Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.65 no.4 Lima Oct./Dec. 2004
Síndrome del túnel del carpo
Correlación clínica y neurofisiológica
Roberto Portillo1,2, María Salazar1,3, Marco-Antonio Huertas1,3
1Servicio de Neurología del Hospital Guillermo Almenara Irigoyen. 2Universidad Nacional Mayor
de San Marcos. 3Universidad San Martín de Porres.
Resumen
Objetivo: Investigar las características clínicas y neurofisiológicas del síndrome del túnel del carpo (STC). Material y Métodos: Se realizó una correlación clínico-electrofisiológica de 381 manos en 308 pacientes del servicio de Neurofisiología del Hospital Nacional Guillermo Almenara Irigoyen (electromiografía del abductor corto del pulgar, velocidad de conducción nerviosa: motora y sensitiva del nervio mediano, conducción nerviosa a nivel del carpo), durante 4 años. Resultados: El 81% de los casos tenía entre 30 y 60 años, el sexo femenino tuvo un discreto predominio (53%); la ocupación manual predominó en 50%. Los síntomas y signos fueron parestesias, dolor y signo de Tinel. La electromiografía fue normal en 80%; 50% de pacientes tuvo una latencia mayor de 6 mseg o fue inexcitable. La velocidad de conducción nerviosa a nivel del carpo tuvo un promedio de 12,5 m/seg. La latencia distal sensitiva estuvo severamente comprometida en 40% de pacientes. Conclusiones: La velocidad de conducción nerviosa motora y sensitiva es un método de diagnóstico del síndrome del túnel del carpo; la correlación clínica electrofisiológica evidencia 3 grados de lesión en este síndrome: leve, moderada y severa; 85% de los pacientes tuvo lesión significativa en la mano derecha, lo que lo relaciona con la actividad, por lo cual consideramos que es una patología ocupacional.
Palabras clave: Síndrome de túnel carpiano; diagnóstico clínico; mano.
Carpal tunnel syndrome. Clinical and neurophysiological correlation
Abstract
Objective: To determine clinical and neurophysiological characteristics of carpal tunnel syndrome Material and Methods: We made a clinical-electrophysiological correlation of 381 hands pertaining to 308 patients, during four years in patients of the Neurophisiological service, Guillermo Almenara Irigoyen National Hospital (electromyography of wrist thumb short abductor, nervous conduction velocity: median nerve motor and sensitivity, nervous conduction to carpal level). Results: About 81% of patients were between 30 an 60 year-old, 53% were female, 50% had manual occupation. Symptoms and signs were parestesia, pain and Tinel syndrome. Electromyography was considered normal in 80% of cases; 50% of patients showed over 6 msec latency or inexcitability. Nervous conduction velocity of carpal level was 12,5 m/sec average. Sensitive distal latency was severely compromised in 40% of patients. Conclusions: Motor and sensitive nervous conduction velocity are diagnosis methods of carpal tunnel syndrome; clinical-electrophysiological correlation evidenced lesions of three degrees: slight, mild and severe; 85% had significant lesion in the right hand, related to occupational activity.
Key Word: Carpal tunnel syndrome; diagnosis clinical; hand.
INTRODUCCIÓN
El síndrome del túnel del carpo es una entidad clínica cuya frecuencia en la población general es alta, variando de 9,2 a 10% a lo largo de la vida (1-3). En estudios realizados en diversas localidades en los Estados Unidos, se ha calculado una prevalencia de esta enfermedad en la población general de 125 a 515 por 10 0000 habitantes (4-6). Pero, recientes estimaciones de la prevalencia del síndrome de tunel del carpo en la población general señala una prevalencia de 0,6% en hombres y 5,8% en mujeres (1). Actualmente, datos reportados de Suecia por Atroshi y col. señalan una prevalencia de 2,1% (7). El costo médico directo asociado es estimado en más de 1000 millones de dólares por año en Estados Unidos (8), constituyéndose como la neuropatía por atrapamiento más común y una de las principales patologías por movimientos y esfuerzos de repetición (9). También es considerada una enfermedad profesional u ocupacional (9). En poblaciones de alto riesgo, como algunos tipos de trabajadores procesadores de carne en Illinois, alcanza cifras de 15% (10). Lamentablemente, en el Perú no contamos con estadísticas y/o registros sobre tal patología. Las profesiones que desarrollan con mayor frecuencia este tipo de patología son las que desarrollan un trabajo manual: Trabajadores de montaje (piezas para gasfitería, electrónica, metalurgia), alimentación (carniceros, charcuteros, matarifes), almacenes agrícolas (envolvedoras, manipuladoras), carpintería y montadores de muebles, cerámica y marmol (disqueros, pulidores), textil (cortadores, máquinas de coser, tricotadoras), calzado (lijadores, montadores, aparadores) (9).
Esta patología deriva de la compresión del nervio mediano a nivel de la muñeca con hipertrofia o edema de la sinovia del flexor. El dolor es secundario a la isquemia más que al daño físico directo del nervio (11).
Es más frecuente en el sexo femenino, con porcentajes de 57% (9) a 80% (12), hasta una relación 7:1 respecto de los varones (1). Se produce fundamentalmente entre la quinta y sexta década de la vida (12-14), pero su presentación no es rara antes de los 40 años, sobretodo cuando es relacionada con la actividad ocupacional (9).
Existen factores de riesgo para el desarrollo del síndrome del túnel del carpo; entre los principales hay que señalar las actividades de flexoextensión de la muñeca (15,16), tales como:
Histerectomía con ooforectomía
Menopausia mayor a 6 meses
Talla baja
Sobrepeso
Terapias para adelgazar
Várices (sólo en hombres)
Edad (mayor de 50 años)
Fumar
Uso de anticonceptivos orales
Historia de alteraciones menstruales
Trastornos digestivos
También podemos observar otras posibles causas de síndrome del túnel del carpo (11), las que señalamos a continuación:
Inflamación de la vaina del tendón flexor por movimientos repetidos de flexión de la muñeca (empaquetamiento, digitadores, intrumentistas musicales)
Edema por traumatismo u otro tipo (fracturas), que pueden comprimir el nervio mediano
Compresión del nervio mediano por edema del embarazo o uso de anticonceptivos orales
Fuerte asociación entre obesidad o sobrepeso y síndrome del túnel del carpo
Acromegalia
Artritis reumatoide
Gota
Tuberculosis
Falla renal y hemodiálisis
Hipotiroidismo
Amiloidosis
Ha sido asociado a diabetes mellitus
Se ha encontrado asociación con artrosis (14%), diabetes mellitus (13%), artritis reumatoide (12%), factores laborales (9%), fracturas (5%), hipotiroidismo (3%), síndrome tóxico (2%), insuficiencia renal crónica (1%) y no asociado en 46% (12). La American Society of Plastic Surgeons (ASPS) indica un riesgo de los trabajadores americanos entre 15 y 20% (17).
El examen anamnésico demuestra síntomas, como disestesias, parestesias tipo hormigueo y la pérdida de la sensibilidad en el territorio del nervio mediano, las disestesias se pueden irradiar en sentido proximal, inclusive hasta el cuello. lo que se conoce como fenómeno de Valleix (18). Los síntomas se presentan inicialmente en la noche, despertando al paciente y obligándolo a sacudir vigorosamente las manos (signo de Flick), mantenerlas colgando fuera de la cama o apoyarlas sobre superficies frías para aliviar sus síntomas. Posteriormente se presentan en el día, relacionados con actividades usuales, como lavar, planchar, sujetarse del bus. Como síntomas tardíos se puede observar pérdida de propiocepción, pérdida de fuerza para la prehensión, atrofia tenar y finalmente pérdida de la discriminación táctil (11,12) En su estudio, Amo y col. encuentran que 95% de los pacientes presentó parestesias, 69% dolor en mano y/o muñeca y 30% pérdida objetiva de fuerza (12), correlacionando las parestesias (sensibilidad 97% y especificidad 60%) con el descenso de la velocidad de conducción sensitiva, el dolor (sensibilidad 79% y especificidad 48%) y la pérdida de fuerza (sensibilidad 39% y especificidad 86%), con un aumento de la latencia motora distal.
El tiempo de evolución medio entre el inicio de los síntomas hasta el diagnóstico es de 22,5 ± 12,6 meses y se relaciona un mayor tiempo de evolución con valores más altos de latencia motora distal y con la pérdida de fuerza (12).
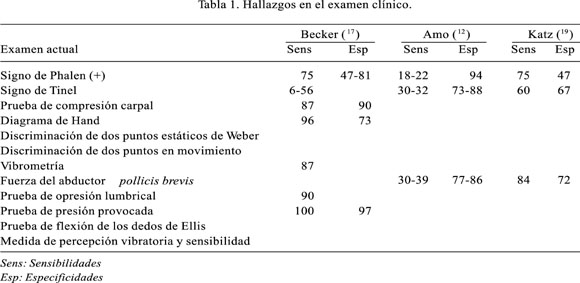
En la Tabla 1 se muestra los signos clínicos que podemos encontrar en el examen, con sus respectivas sensibilidades y especificidades para diversos autores. Podemos objetivar fácilmente la diferencia en lo estadístico que existe entre los autores, para los signos más frecuentemente examinados (12,17,19).
Los métodos de diagnóstico de mayor confiabilidad son fundamentalmente las pruebas electrofisiológicas, entre las que se incluye la electromiografía y los estudios de velocidad de conducción (con un 8% de falsos negativos debido a que es requerida una desmielinización significativa para la anormalidad y las variables dependientes del examinador (17).
Los hallazgos considerados como diagnóstico en base de los anteriores estudios pueden ser cualquiera de los siguientes en forma excluyente (20,21):
1. Latencia sensorial absoluta mayor de 3,7 mseg.
2. Una diferencia > 0,4 mseg entre los valores obtenidos sobre el nervio mediano comparado con el cubital o el radial.
3. Latencia motora mayor de 4 mseg.
4. Un cambio > 0,4 mseg en el estudio de sensibilidad seriado palmar.
Por otro lado, Kimura considera como criterios electrodiagnósticos los siguientes (22,23):
1. Velocidad de conducción nerviosa sensitiva > 41,9 m/s en pacientes menores de 55 años y > 37,3 en pacientes mayores.
2. Latencia sensorial distal > 3,5 mseg.
3. Diferencia de latencia sensitiva distal medioulnar > 0,4 mseg.
4. Latencia motora distal > 4,34 mseg.
En un estudio poblacional, Atroshi y col. usaron como herramienta diagnóstica la diferencia de latencia pico entre el nervio mediano y cubital, el cual era > 0,8 mseg, para definir como mononeuropatía del mediano; de esta manera reducen la posibilidad de falsos positivos y sus hallazgos podrían subestimar la prevalencia de este síndrome (7,24).
Los estudios así descritos no difieren en gran medida y tienen una gran aproximación diagnóstica, por lo que podemos considerarlos en forma independiente uno u otro. En nuestro parecer, utilizaremos los criterios diagnósticos seguidos en primera instancia.
La factibilidad y viabilidad del estudio se da porque se lleva a cabo con los pacientes atendidos en la unidad de neurofisiología del Hospital Guillermo Almenara Irigoyen, realizándose una historia clínica detallada; observando el examen anamnésico del paciente, el examen de la historia social (ocupación), examen de la historia médica social, examen de la historia personal (factores de riesgo), examen de la historia médica anterior (factores asociados o etiológicos), examen de la historia médica actual, examen actual (hipoestesia, atrofia, signo de Tinel, signo de Phalen) y exámenes neurofisiológicos correspondientes.
Por utilidad y conveniencia, se producen con la finalidad de establecer una pauta diagnóstica que sea lo más eficaz posible para que el síndrome del túnel carpal sea reconocido lo más precozmente por el médico y debidamente orientado al especialista, para su correcta confirmación diagnóstica y posterior tratamiento.
El alcance e importancia están en que orientará al médico a una mejor aproximación diagnóstica, que permita un ahorro de tiempo en el estudio de esta patología y un pronto manejo a cargo del especialista. De esta manera disminuirá los costos en el tratamiento al disminuir el tiempo de evolución y la posibilidad de prescindir de técnicas quirúrgicas costosas para la institución y el paciente, así como un rápido retorno a su área ocupacional o reorientando su ocupación, disminuyendo la carga laboral a nivel nacional y personal, al lograr una recuperación lo más pronta posible.
MATERIAL Y MÉTODOS
Se realizó un total de 381 estudios neurofisiológicos en 308 pacientes, así como la historia clínica de cada uno de ellos, de los cuales 73 tenían afección bilateral, tomando como variables: edad de presentación, frecuencia según el sexo, tiempo de evolución, factores de riesgo, factores asociados o etiologías, los síntomas de presentación (dolor, parestesias, déficit motor, disminución de la sensibilidad), los signos hallados (atrofia tenar, hipoestesia, hiperestesia, signo de Tinel, signo de Phalen, paresia), las características neurofisiológicas (latencia motora distal, latencia sensitiva distal, velocidad de conducción motora, características electromiográficas -como la presencia de unidades motoras, fasciculaciones, fibrilaciones y ondas positivas como signos de denervación-), grado de severidad. Las cuales fueron analizados, se obtuvo las medias, la frecuencia absoluta y relativa de cada una de ellas.
El grado de severidad se estableció de acuerdo al grado de excitabilidad o no de las latencias distal motora y sensitiva en leve si ambas estaban presentes, moderado si sólo se obtenía la latencia motora distal y severa si ambos tipos de latencias se encontraban inexcitables.
Asimismo, realizamos el estudio de correlación odds ratio entre las siguientes variables: síntomas de presentación (dolor, parestesia, paresia) vs. patrón de interferencia de unidades motoras, potencial sensitivo antidrómico, latencia motora distal y grado de severidad; signología (normal, signo de Tinel, atrofia) vs. patrón de interferencia de unidades motoras, potencial sensitivo antidrómico, latencia motora distal y grado de severidad; tiempo de evolución vs. patrón de interferencia de unidades motoras, potencial sensitivo antidrómico, latencia motora distal y grado de severidad.
RESULTADOS
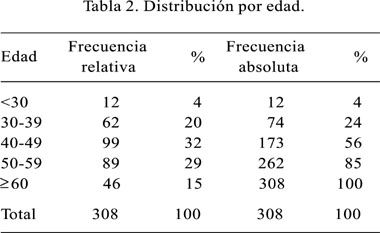
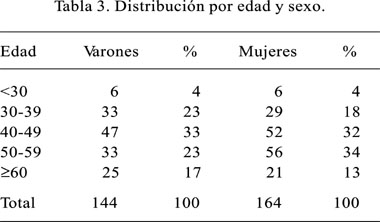
La edad promedio de nuestros pacientes fue de 48,2 años con una desviación estándar de 11,6, encontrándose el 81% en el rango de edad de 30 a 60 años (Tabla 2). El tiempo de enfermedad fue muy variable, desde 10 días a 10 años con un tiempo promedio de 13 meses. Existió un discreto predominio femenino sobre el masculino con un 53%. Al cruzar las variables edad vs. sexo encontramos que a menor edad hay un discreto predominio masculino, lo cual cambia a partir de los 40 años, en donde el predominio es fuertemente femenino; en las postrimerías de la vida esta relación vuelve a igualarse e invertirse (Tabla 3).
Si tenemos en cuenta la ocupación, encontraremos que más del 50% se encuentra relacionado a actividades manuales; siendo las tres primeras y más frecuentes ocupaciones referidas a labores artesanales como textil (19%), obrero (18%) y cuidado del hogar (11%).
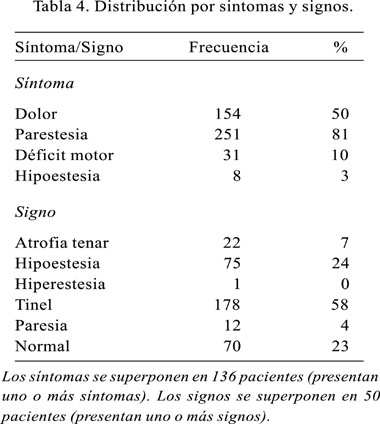
Los antecedentes principales encontrados, y sin necesidad de que exista una relación directamente proporcional a la ocurrencia de síndrome de túnel carpal, se asocian a enfermedades sistémicas, tales como hipertensión arterial y diabetes mellitus, artritis reumatoide y enfermedades neurológicas comunes, como la parálisis facial periférica. Los antecedentes que encontramos fueron: hipertensión arterial, parálisis facial periférica, diabetes mellitus, artritis reumatoide, tumor tenar derecha, traumatismo, reumatismo, obesidad, gestación, discoartrosis y/o cirugía por discoartrosis, traumatismo cervical, tenosinovitis del cuarto dedo, tuberculosis, operación de la muñeca derecha, neurofibromatosis, insuficiencia vascular periférica, infiltración previa, operación previa, impacto de dinamita, hipotiroidea, hepatitis B, túnel carpal derecho operado, hemiatrofia facial, fractura de muñeca, extirpación de hueso semilunar, espondilitis cervical, epicondilitis derecho, colon irritable. Dentro de la sintomatología referida por el paciente cabe resaltar las parestesias y el dolor; y dentro del examen neurológico, el signo de Tinel cobra importancia significativa; no obstante debemos señalar que un 23% de los pacientes presentan el examen normal (Tabla 4).
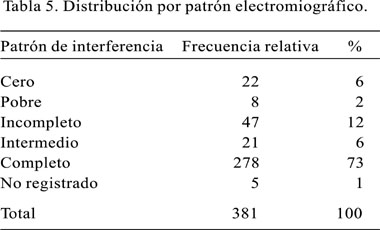
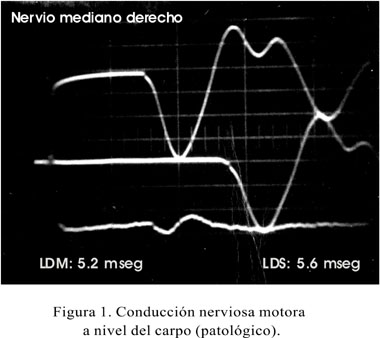
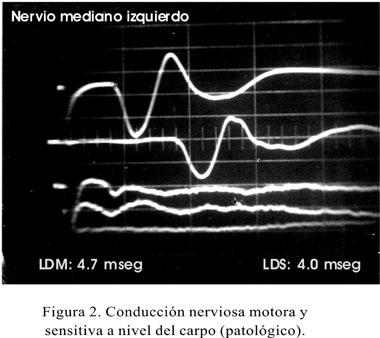
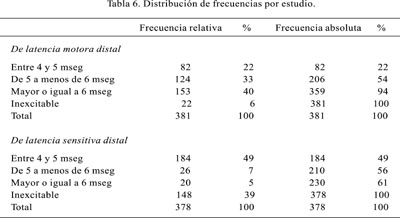
Al revisar los exámenes neurofisiológicos realizados en los pacientes, conviene anotar que el estudio de electromiografía en casi 80% de los pacientes se consideró normal (Tabla 5) y los signos de denervación -en daño severo al nervio- se encontró en menos de 5% de la población, presentando fasciculaciones (2,1%), fibrilaciones (2,1%). Al estudiar la latencia motora distal, todos nuestros pacientes tuvieron de 4 a más milisegundos y cerca de 50% tuvieron la latencia mayor de seis milisegundos o inexcitable. La velocidad de conducción promedio carpal fue de 12,5, con desviación estándar de 3,61. La latencia sensitiva distal, se presentó severamente comprometida en un porcentaje que llegaba al 40% de los pacientes (Figuras 1, 2 y 3) (Tabla 6). El 47% de los pacientes tuvo la mano derecha afectada, en tanto que 15% la mano izquierda, resultando en una afectación bilateral el 38% de los pacientes. El grado de afectación fue de leve (61%), moderada (33%) y severa (6%).
Al comparar la sintomatología (las variables escogidas fueron por su frecuencia las parestesias, el dolor y la paresia) y correlacionarlas con el patrón de interferencia de unidades motoras, el potencial sensitivo antidrómico (latencia sensitiva distal), el grado de afectación y la latencia motora distal, no se encontró correlación entre la severidad de los hallazgos neurofisiológicos y la sintomatología. Lo cual quiere decir que los síntomas no necesariamente expresan la severidad de la lesión del nervio, ya que incluso el patrón de interferencia puede ser normal, pero el paciente ya presenta un grado apreciable clínicamente de paresia. Al comparar la signología con los hallazgos neurofisiológicos, se encontró una correlación fuertemente positiva entre la presencia de atrofia al examen clínico neurológico y la ausencia de unidades motoras, la inexcitabilidad de la latencia motora distal, el potencial sensitivo antidrómico y el grado de severidad (OR = 84,96, 84,96, 28,46, 84,96, respectivamente). No así con el signo de Tinel, que esbozó una baja correlación pero positiva con respecto a las variables antes dichas, sobretodo con el potencial sensitivo antidrómico (OR = 1,92). Además, existe correlación positiva entre la normalidad del examen neurológico y el grado leve de afectación neurofisiológica (OR = 4,66). Por otro lado, el tiempo de enfermedad se correlacionó positivamente con un aumento en la latencia sensitiva distal y la latencia motora distal, aunque en forma débil (OR = 1,92 y 1,94, respectivamente).
DISCUSIÓN
Las personas entre 30 y 60 años son las más frecuentemente afectadas, contrastando con otros estudios (12-14), con un tiempo de evolución al momento de su diagnóstico de 13 meses. Por ello, existe una escasa información acerca de esta patología, que redunda en la demora del establecimiento del diagnóstico por medio de estudios electrofisiológicos.
Existe una mayor incidencia en las mujeres, sobretodo en mayores de 40 años. Podremos suponer que la influencia de la menopausia es determinante para la presentación de este síndrome en las mujeres, lo cual debe ser confirmado en estudios posteriores.
Al igual que en otros estudios indicados anteriormente, la ocupación tiene un rol preponderante en la presentación de este síndrome, por lo que debemos considerarlo una enfermedad ocupacional y dentro de éstas como enfermedad por esfuerzo y repetición de movimientos.
En todo paciente que presenta parestesia en los dedos de la mano y signo de Tinel positivo, debemos tener presente el diagnóstico de síndrome del túnel del carpo, por ser éstos los más frecuentemente encontrados. En nuestro estudio, como en muchos otros, el signo de Tinel es muy frecuente pero no constante en todos los pacientes, corroborando los hallazgos de otros estudios (12,17,19).
Dentro de los estudios neurofisiológicos, la electromiografía aislada no mide la verdadera magnitud del daño, pero la velocidad de conducción motora se convierte en uno de los métodos de diagnóstico relevante, notando además que casi el 50% de nuestros pacientes al momento de ser diagnósticados muestra alteraciones de moderado a severo, siendo un 6% con características de inexcitabilidad, por lo que llamamos la atención para un diagnóstico precoz a partir de los síntomas y signos previamente señalados.
El 85% de nuestra población tuvo lesión significativa en la mano derecha, lo cual demuestra una vez más que esta enfermedad se relaciona con la actividad. Postulamos entonces que en nuestro medio sea considerada una patología ocupacional, la cual actualmente no está considerada como tal y, al respecto, incorporarla como enfermedad ocupacional con la reglamentación y normatividad requerida.
Aunque la sintomatología no guarda relación a la severidad de la afectación del síndrome del túnel del carpo, la presencia de atrofia al examen clínico neurológico demuestra una alta correlación con la ausencia de unidades motoras, la inexcitabilidad de la latencia motora distal, el potencial sensitivo antidrómico y el grado de severidad, no así las otras características clínicas, como el signo de Tinel, que se puede presentar inclusive desde el inicio de la patología.
La correlación clínica electrofisiológica evidencia en nuestra casuística del síndrome del túnel del carpo tres grados de lesión: leve, moderado y severo. El 85% tuvo lesión significativa en la mano derecha, lo que se relaciona con la actividad ocupacional.
REFERENCIAS BIBLIOGRÁFICAS
1. De Krom MCTFM, Knippschild PG, Kester ADM, Thus CT, Boekkoi PF, Spaans F. Carpal tunnel syndrome: prevalence in the general population. J Clin Epidemiol. 1992;45:373-6. [ Links ]
2. Phalen GS. The carpal tunel syndrome: clinical evaluation of 598 hands. Clin Orthop. 1972;83:29-40. [ Links ]
3. White JC, Hansen SR, Jhonson RK. A comparison of EMG procedures in the carpal tunnel syndrome with clinical – EMG correlations. Muscle Nerve. 1988;11:1177-82. [ Links ]
4. Stevens JC, Sun S, Beard CM, OFallon WM, Kurband LT. Carpal tunnel syndrome in Rochester, Minessota, 1961 to 1980. Neurology. 1988;38:134–8. [ Links ]
5. Occupational disease surveillance: carpal tunnel syndrome. MMWR Morb Mortal Wkly Rep. 1989;38:485- 9. [ Links ]
6. Quality Standars Subcommittee of the American Academy of Neurology. Practice parameter for carpal tunnel syndrome. Neurology. 1993;43:2406-9. [ Links ]
7. Atroshi I, Gummesson C, Johnsson R, Omstein E, Ranstam J, Rosén I. Prevalence of carpal tunnel syndrome in a general population. JAMA. 1999;282:153-8. [ Links ]
8. Levine DW, Simmons BP, Kris MJ, Daltroy LH, Hohl GG, Fossel AH, et al. A self-administered questionnaire for the assessment of severity of symptons and funtional status in carpal tunnel syndrome. J Bone Joint Surg Am. 1993;75:1585-92. [ Links ]
9. Roel J. Las patologías por movimientos y esfuerzos de repetición. Informe para un daño anunciado. Estadísticas de enfermedades profesionales 1998. Anuario AT 38. Alicante: Ministerio de Trabajo de España; 1999. [ Links ]
10. Masear VR, Hayes J, Hyde AG. An industrial cause of carpal tunnel syndrome. J Hand Surg (Am). 1986;11:222-7. [ Links ]
11. Steele M. Carpal tunnel syndrome. eMedicine Journal [número en la Internet]. July 5 2001 [citado el 25 noviembre 2003];2(7):[apróximadamente 10 p.]. Disponible en: http://www.emedicine.com [ Links ]
12. Amo C, Fernández-Gil S, Pérez-Fernández S. Sindrome del túnel del carpo. Correlación clínica y neurofisiológica: revisión de 100 casos. Rev Neurol. 1998;27(157):490-3. [ Links ]
13. Kimura J. Electrodiagnosis in diseases of nerves and muscle: principles and practice. Philadelphia: F. A. Davis Company 1989. p. 501-4. [ Links ]
14. DArcy CA, McGee S. Clinical diagnosis of carpal tunnel syndrome. JAMA. 2000;284(15):1924-5. [ Links ]
15. De Krom MC, Kester AD, Knipschild PG, Spaans F. Risk factors for carpal tunnel syndrome. Am J Epidemiol. 1990;132(6):1102-10. [ Links ]
16. Vessey MP, Villard-Mackintosh L, Yeates D. Epidemiology of carpal tunnel syndrome in women of childbearing age. Findings in a large cohort study. Int J Epidemiol. 1990;19(3):655-9. [ Links ]
17. Becker G. Carpal tunnel syndrome. National Guideline Clearinghouse. Illinois: American Society of Plastic and Surgeons; 1998. p. 10. [ Links ]
18. Cracchiolo A. The carpal tunnel syndrome. Seminars Arthritis Rheum. 1971;1:87-95. [ Links ]
19. Katz JN, Larson MG, Sabra A, Krarup C, Stirrat CR, Sethi R, et al. The carpal tunnel syndrome: Diagnostic utility of the history and physical examination findings. Ann Internal Med. 1990;112:321-7. [ Links ]
20. Hamilton ML, Santos-Anzorandia C, Viera C, Coutin G, Cordies L. Neuroconducción motora y sensitiva en pacientes con sindrome del túnel del carpo y polineuropatía diabética. Rev Neurol. 1999;28(12):1147-52. [ Links ]
21. Stevens JC. AAEE minimonograph # 26: The electrodiagnosis of carpal tunnel syndrome. Muscle Nerve. 1987;10:99-113. [ Links ]
22. Kimura J. The carpal tunnel syndrome localization of conduction abnormalities within the distal segment of the median nerve. Brain. 1979;102:619-35. [ Links ]
23. Charles N, Vial C, Chauplannaz G, Bady B. Clinical validation of antidromic stimulation of the ring finger in early electrodiagnosis of mild carpal tunnel syndrome. Electroencephalogy. Clin Neurophysiol. 1990;76:142-7. [ Links ]
24. Franzblau A, Werner R. What is Carpal tunnel syndrome? JAMA. 1999;282:186-7. [ Links ]
Dr. Roberto Portillo Vallenas
Hospital Nacional Guillermo Almenara Irigoyen
Unidad de Neurofisiología
Av. Grau 800. Lima 13, Perú
Correo-e: drrobertoportillo@hotmail.com