Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.66 n.1 Lima ene./mar. 2005
Aspectos histopatológicos y receptores hormonales
en mucosa endometrial de mujeres posmenopáusicas
con terapia hormonal
Victoria Valer 1,2, Rosa Meléndez 2, Luis Rivas 2, Inés León 2
1 Departamento de Cirugía Humana, Facultad de Medicina. Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Instituto de Patología, Facultad de Medicina. Universidad Nacional Mayor de San Marcos. Lima, Perú.
Resumen
Objetivos: Determinar si existe correlación directa entre la terapéutica hormonal administrada en mujeres posmenopaúsicas, el comportamiento de los receptores estrogénicos y progesterónicos en la mucosa endometrial y los cuadros histológicos más frecuentes de patologías endometriales secundarias al tratamiento. Material y Métodos: Estudio prospectivo, longitudinal de 40 mujeres posmenopaúsicas entre los 43 y 60 años con síndrome climatérico, administrándoles 2 mg de 17 beta estradiol y 1 mg de acetato de noretisterona por día, en forma continua y por vía oral. Se realizó una biopsia endometrial basal y otra postratamiento al octavo mes. Las muestras fueron procesadas para estudio histopatológico e inmunohistoquímico para receptores estrogénicos y progesterónicos. Resultados: La menarquia se presentó a una edad promedio de 13,2 años y la menopausia fisiológica entre 42 y 52 años, con una edad promedio de 46,4 años. La sintomatología climatérica mejoró notablemente con la terapia hormonal. El estudio histopatológico de mucosa endometrial basal mostró 10% de hiperplasia simple y 90% de atrofia; postratamiento, todos los casos presentaron atrofia. Los receptores se expresaron en la mucosa endometrial basal: RE (+) 12,5%, RP (++) 12,5%; postratamiento RE (+) 2,5%, RE (+++) 2,5% y RP(+) 2,5%. Conclusiones: La terapia en dosis diarias vía oral de 2 mg de 17 beta estradiol y 1 mg de acetato de noretisterona disminuye la sintomatología climatérica y produce atrofia endometrial en las pacientes con hiperplasia previa. Existe disminución estadísticamente significativa entre la primera muestra basal y la del octavo mes de la expresión de receptores estrogénicos y progesterona.
Palabras clave: Menopausia; terapia de reemplazo de estrógeno; posmenopausia; receptores estrogénicos; receptores de progesterona; hiperplasia endometrial; endometrio, patología.
Endometrial mucosa histopathology and hormonal receptors in postmenopausal women receiving hormone therapy
Abstract
Objectives: To determine correlation between hormone therapy and endometrial mucosa estrogen, progesterone receptors and endometrial histological pathology in postmenopausal women. Material and Methods: Forty postmenopausal women between 43 and 60 years old with climacteric syndrome received oral continuous 2 mg of 17 beta estradiol and 1 mg of noresthisterone acetate. Basal and 8 months post treatment edo metrial biopsies were processed for histopathologic and immune histochemical studies for estrogen and progesterone receptors. Results: Physiologic menopause occurred between 42 and 52 years old, average 46,4 years. Main climacteric symptoms on first consultation were arthralgia 90%, emotional lability 82,5%, dysparenta 75%, hot flashes 27,5% and relative urine incontinence 17,5%. Post treatment emotional lability was 7,5% arthralgia 5%, relative urine incontinence 5%, hot flashes 2,5%, paresthesia 2,5%, and cephalea 2,5%. The histopathologic study of basal endometrial mucosa showed simple hyperplasia in 10% and atrophy in 90%; atrophy was present in every case following treatment. Basal receptors expressed in the endometrial mucosa were ER (+) 12,5%, PR (++) 12,5%, and post-treatment ER(+) 2,5%, ER (+++) 2,5%, and PR (+) 2,5%. Conclusions: Oral daily combined therapy consisting in 2 mg of beta estradiol and 1 mg of norethisterone produced endometrial atrophy in patients with previous hyperplasia and statistical significant drop in the expression of estrogen and progesterone receptors between the basal sample and the 8th month sample.
Key words: Menopause; estrogen replacement therapy; postmenopause; receptors, estrogen; receptors, progesterone; endometrial hyperplasia; endometrium, pathology.
INTRODUCCIÓN
En nuestro país la población ha alcanzado una expectativa de vida de 70 años (1,2) y un gran número de mujeres posmenopaúsicas están viviendo este período de su vida.
La terapéutica hormonal (TH) estrógeno progestágena ha beneficiado a este grupo etáreo y su aplicación está cada vez en aumento; diversos estudios demuestran una mejora en la calidad de vida de estas mujeres (3).
Los efectos más importantes que se obtienen son: prevención de la osteoporosis (4-6), reducción de la enfermedad cardiovascular (7-12) prevención de la enfermedad de Alzheimer (13,14), disminución de los síntomas vasomotores y urogenitales (8,15-22).
Como resultado de la estimulación hormonal del endometrio, se reinician los sangrados uterinos y en ocasiones éstos son abundantes, prolongados, dolorosos e irregulares y su frecuencia depende del esquema terapéutico administrado, constituyendo la principal causa de abandono.
En cada mujer existen variaciones de respuesta clínica que obligan a individualizar la terapéutica, ya sea en relación a la vía de administración, como al tiempo de duración (23). Hay estudios que demuestran que la mayoría de los sangrados considerados anormales en mujeres con TH, se origina por el endometrio funcional, atrofia endometrial o patología benigna, como pólipos endometriales (24).
Sturdee y Al-Azzawi no lograron demostrar la relación entre la histología endometrial y el momento del sangrado en mujeres con TH secuencial, concluyendo que el momento del sangrado no es buen predictor de la patología endometrial (25,26).
El estrógeno y la progesterona producen una retroalimentación positiva y negativa en el hipotálamo y la hipófisis, respectivamente (27). La respuesta del endometrio a la estimulación endógena y exógena de esteroides hormonales es de esperar y ésta es un reflejo del funcionamiento del eje hipotálamo-hipófisis-ovario. El estrógeno causa proliferación de la mucosa endometrial y la progesterona promueve su diferenciación.
En la posmenopausia, el aumento de hormona luteinizante (LH) estimula el estroma ovárico, determinando la producción de testosterona y de hidrostestosterona (28,29), lo cual se convierte en la principal fuente extraglandular de estrona (E1) (30,31) por su aromatización periférica (32,33).
La actividad biológica de los estrógenos depende de su metabolismo en sus fases reversibles e irreversibles (34-37), de su unión proteica y de la concentración de receptores nucleares que permitan su utilización (6,38).
En estudios de endometrio humano se ha observado que los niveles de estradiol (E2) endometrial, de E2 sanguíneo y del receptor de estradiol endometrial (E2R) se incrementan gradualmente, formando un pico en la fase proliferativa tardía, lo que produce una aceleración de la síntesis del ADN nuclear (39).
Los niveles de progesterona (P) endometrial, progesterona sanguínea y receptor progesterónico (RP) endometrial producen picos en la fase secretora temprana y media. La concentración promedio de progesterona (P) forma un pico en la fase proliferativa tardía.
En el endometrio, la integridad vascular está bajo el control de factores de crecimiento angiogénicos específicos (40), con receptores específicos en las células endoteliales. Los factores de crecimiento se encuentran en altas concentraciones en el tejido endometrial y son regulados por los esteroides (41). La progesterona provoca un aumento de la expresión de estos factores, principalmente del factor de crecimiento endotelial, que inhibe la proliferación de células epiteliales de las glándulas endometriales y altera la integridad de la vasculatura, resultando en pérdida de sangre (42).
Existen trabajos (33,36,41) sobre el uso de noretisterona combinada con beta estradiol. Al respecto, es conocido el mecanismo de acción de la noretisterona, la cual actúa provocando a nivel endometrial hiperplasia estromal, con el consiguiente deterioro de la irrigación endometrial y atrofia final en las fases avanzadas del tratamiento. A nivel periférico actúa como sustrato para la acción de las aromatasas, produciendo estrógenos.
Por su parte, el beta estradiol va a disminuir la sintomatología climatérica por su acción periférica, siendo contrarrestada la acción central por la noretisterona.
Por lo expuesto, es necesario determinar si existe correlación directa entre los cuadros histológicos más frecuentes de patología endometrial secundaria, a la TH administrada en mujeres posmenopáusicas y el comportamiento de los receptores estrogénicos y progesterónicos en la mucosa endometrial.
MATERIAL Y MÉTODOS
Estudio prospectivo, longitudinal realizado en el Instituto de Patología de la Facultad de Medicina Humana de la Universidad Nacional Mayor de San Marcos, Sede Hospital Arzobispo Loayza, Lima – Perú, entre enero de 2001 y junio de 2002.
Se confeccionó historias clínicas ad hoc y se examinó 80 mujeres posmenopáusicas con sintomatología climatérica. Se realizó examen físico y ginecológico con toma de secreción cervicovaginal para Papanicolaou, exámenes de laboratorio en sangre -hemograma completo, dosaje de glucosa, urea, creatinina, reacciones serológicas, HIV, pruebas de función hepática, fosfatasa alcalina, fósforo, calcio-, examen completo de orina y examen parasitológico en heces. Exámenes ecográficos de abdomen completo y de mamas, radiológicos como mamografía, densitometría ósea completa.
Ingresaron al estudio 50 mujeres posmenopáusicas con síndrome climatérico, 10 de las cuales abandonaron el tratamiento al tercer mes y en 40 se completó su estudio en el octavo mes.
Los criterios de inclusión utilizados fueron edad entre 40 a 60 años, última menstruación como mínimo un año; examen clínico de mamas y ginecológico normales y PAP cervicovaginal negativo.
Los criterios de exclusión fueron presencia de tumoración pélvica o mamaria, antecedente o presencia de patología benigna o maligna de mama, antecedente de haber recibido TH reciente tipo estrógeno progestágeno, enfermedad hepática, sinequia parcial o total del canal endocervical.
Las pacientes seleccionadas firmaron el consentimiento como aceptación para participar en el estudio. Seguidamente se realizó la toma de muestra basal de mucosa endometrial por aspiración con cánula para biopsia endometrial, con diámetro externo de 3,1 mm, y diámetro interno de 2,6 mm (Medscand C EndoreteTM) antes de recibir terapia hormonal y a los 8 meses postratamiento.
Las muestras fueron fijadas en formol neutro por 24 horas y embebidas en parafina para su estudio histopatológico con coloración de hematoxilina-eosina y de inmunohistoquímica con el método LSAB@2 inmunoperoxidasa y los anticuerpos monoclonales para receptores estrogénicos (RE) Ab-11 (1D5) y receptores de progesterona RP Ab8 (cocktail), de Lab-Vision.
La positividad fue evaluada por el método semicuantitativo en cruces, de acuerdo a la siguiente valoración:
+ : sólo células individuales positivas en campos ocasionales.
++ : grupos de células positivas en aproximadamente el 50% de los campos.
+++: positividad de todas las células en todos los campos.
Se consideró positiva la tinción nuclear de células glandulares y estromales.
La terapia hormonal fue suministrada por vía oral, con la ingesta de 2 mg de 17 beta estradiol y 1 mg de acetato de noretisterona por día durante 8 meses. Los controles clínicos fueron realizados el 1º, 2º mes y después cada 2 meses.
La evaluación de los resultados se hizo aplicando indicadores estadísticos de tendencia central (media aritmética), frecuencias absolutas y porcentajes y se utilizó la prueba de Mac Nemar y la de chi cuadrado con un nivel de significancia <0,05.
RESULTADOS
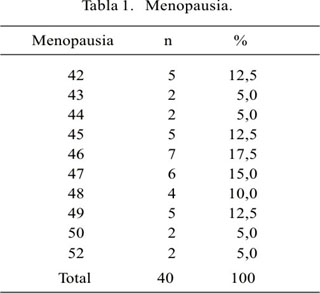
En el período comprendido de enero de 2001 a junio de 2002 se estudió 40 mujeres posmenopáusicas con síndrome climatérico en el Instituto de Patología de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos, Sede Hospital Arzobispo Loayza. Las edades fluctuaron entre 43 y 60 años, con una edad promedio de 48,8 años. La menarquia se produjo entre los 10 y 17 años de edad, con una edad promedio de 13,2 años. En cuanto a la paridad, fueron: (n=2) 5% nulíparas, (n=2) 5% primíparas, (n=6) 15% secundíparas y (n=30) 75% multíparas. La menopausia fisiológica se produjo entre los 42 y 52 años de edad, con una edad promedio de 46,4 años (Tabla 1). De acuerdo a su procedencia, correspondió a Comas (n=4) 10%, San Martín de Porras (n=5) 12,5%, Santa Anita (n=5) 12,5%, Independencia (n=6) 15%, Breña (n=6) 15%, Villa María del Triunfo (n=6) 15% y otros distritos (n=8) 20%. Los síntomas predominantes en la primera consulta pretratamiento fueron: (n=36) 90% artralgias, (n=33) 82,5% labilidad emocional, (n=30) 75% coitalgias, sofocaciones (n=11) 27,5% y (n=7) 17,5% incontinencia urinaria relativa. Postratamiento, la sintomatología se caracterizó por la presencia de: labilidad emocional (n=3) 7,5%, artralgias (n=2) 5%, incontinencia urinaria relativa (n=2) 5%, sofocaciones (n=1) 2,5%, parestesias (n=1) 2,5% y cefaleas (n=1) 2,5%.
Después de la administración de la terapéutica hormonal, el (n=36) 90% de mujeres posmenopáusicas reinició sangrado menstrual irregular en escasa cantidad hasta el cuarto mes, para después no presentarlo más.
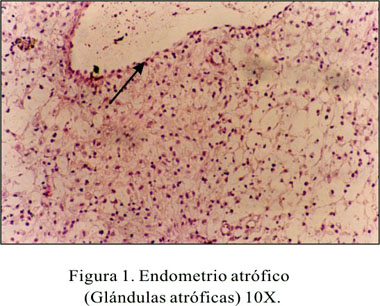
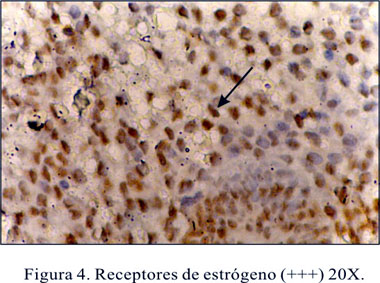
En el estudio histopatológico basal de mucosa endometrial, se obtuvo (n=4) 10% de casos con hiperplasia simple y (n=36) 90% con atrofia severa. En el estudio postratamiento al octavo mes, se encontró atrofia en el 100% de los casos (Figuras 1 y 2).
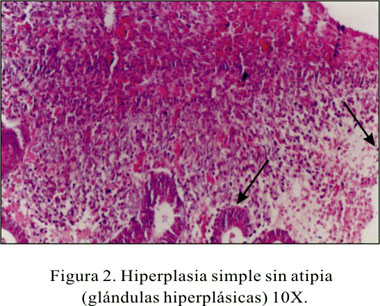
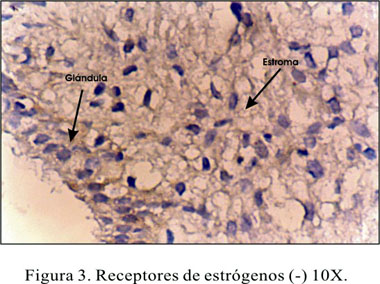
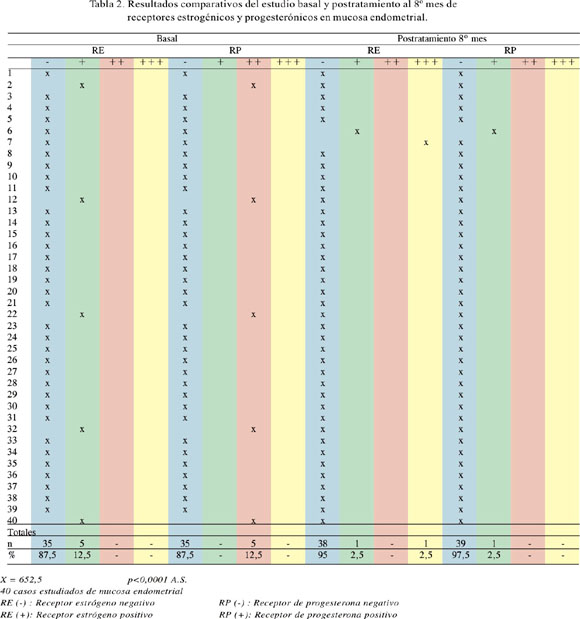
Los receptores estrogénicos en el estudio basal fueron (n=35) 87,5% de RE (-) y (n=5) 12,5% de RE (+), y los receptores progesterónicos (n=35) 87,5% RP (-) y (n=5) 12,5% RP (++). Después del tratamiento al octavo mes, los receptores fueron (n=38) 95% de RE (-), (n=1) 2,5% RE (+) y (n=1) 2,5% RE (+++) (Figuras 3 y 4); los receptores progesterónicos (n=39) 97,5% RP (-) y (n=1) 2,5% RP (+), existiendo disminución estadísticamente significativa entre la primera muestra basal y la del octavo mes de la expresión de receptores de estrógenos y progesterona en la población estudiada (Tabla 2).
DISCUSIÓN
En estudios previos realizados en la misma Institución (43) en mujeres posmenopaúsicas se observa semejanzas en cuanto a la edad promedio de la menarquia y la multiparidad. En cuanto a su procedencia, se observa que provienen de distritos populosos jóvenes y manifiestan tener conocimiento acerca de la TH, por lo que han acudido a pedir información y tratamiento. La sintomatología climatérica disminuyó en más del 50% en intensidad y frecuencia en el postratamiento, como está descrito en otros estudios de investigación (4,7,13,17,22).
En 90% de pacientes se halló, antes del inicio de la terapia, endometrio atrófico en relación al estado hormonal posmenopáusico, en el que se presentan cambios cíclicos producidos por la disminución del estrógeno y progesterona descrito en la literatura. El 10% mostró hiperplasia, lo cual podría estar en relación a la acción estrogénica periférica.
En general, las muestras obtenidas como en otros estudios (44) fueron escasas, pues el endometrio de la mujer posmenopáusica es muy delgado. Todas las pacientes que en el control basal fueron reportadas como endometrio atrófico, presentaron también al octavo mes postratamiento endometrio atrófico, lo cual obedecería al efecto del tratamiento con la noretisterona, que inhibiría la acción del beta estradiol, produciendo atrofia endometrial después de seis meses (44-46). Las pacientes que presentaron hiperplasia simple previa al tratamiento, el 100% mostró atrofia endometrial.
El 12,5% de las pacientes expresó positividad para receptores estrógenicos RE (+) y 12,5% para progesterona RP (++) en la muestra basal; en el postratamiento, al octavo mes 2,5% presentó positividad para RE (+) y 2,5% para RE (+++), y 2,5% para receptor de progesterona RP (+), observándose una disminución del 10%. Teniendo en cuenta la población estudiada, este resultado es estadísticamente significativo con una p<0,0001. Sólo un caso mostró negatividad de inicio y positividad (+++) en el control postratamiento, sin causa aparente, necesitando mayor investigación al respecto.
La terapia hormonal combinada y administrada en dosis diaria por vía oral de 2 mg de 17 beta estradiol y 1 mg de acetato de noretisterona, disminuye la sintomatología climatérica y se observa una disminución estadísticamente significativa de la expresión de receptores de estrógeno y progesterona en la población estudiada a los 8 meses de tratamiento.
En relación a los resultados obtenidos en nuestro estudio, se sugiere la creación de un Centro Nacional de Investigación, que monitorice los estudios con administración de terapia hormonal por un lapso de 5 años, de manera que este grupo de mujeres puedan recibir dosis sin efectos colaterales (47).
REFERENCIAS BIBLIOGRÁFÍCAS
1. Instituto Nacional de Estadística e Informática Perú. Compendio Estadístico 2001. Lima: INEI; 2002. [ Links ]
2. Evans WL, Evans ML, Lajj SN. The aging population clinical post reproductive gynecology. East Norwalk Connecticut: Appleton and Lange; 1993. [ Links ]
3. Zubialde JP, Lawier F, Clemenson N. Estimated gain in life expectancy with use of postmenopausal estrogen therapy: a decision analysis. J Farm Pract. 1993;36:271-80. [ Links ]
4. Monitor Médico. La osteoporosis y el ginecólogo: una llamada a la acción. Revista de Revistas. 1998;1:25-30. [ Links ]
5. Consensus Development Conference. Diagnosis, prophylaxis and treatment of osteoporosis. Am J Obst Gynecol. 1993;94:646-50. [ Links ]
6. Katzenellenbogen JA, OMalley BW, Katzenellenbogen BS. Tripartite steroid hormone receptor pharmacology: interaction with multiple effector sites as a basis for the cell and promoter- specific action of these hormones. Mol Endocrinol. 1996;10:119-31. [ Links ]
7. Collins P, Beale CN. El papel cardioprotector de la TRH. Actualización clínica. New York: The Partenon Pub; 1997. [ Links ]
8. Ainmelk Y. Comparison of two continuous combined estrogen progestagen regimens in postmenopausal women: a randomized trial. Fertil Steril. 1996;66:962-8. [ Links ]
9. Mashchak CA, Lobo RA, Dozono-Takano R, Eggena P, Nakamura RM, Brenner PF, et al. Comparison of pharmacodynamic properties of various estrogen formulations. Am J Obstet Gynecol. 1982;144:511-8. [ Links ]
10. Adami S, Rossini M, Zamberlan N, Bertoldo F, Dorizzi R, Lo Cascio V. Long-term effects of transdermal and oral estrogens of serum lipids and lipoprotein in postmenopausal women. Atheroesclerosis. 1997;135;73-81. [ Links ]
11. Mc Manus J, Mc Eneny J, Thompson W, Young IS. The effect of hormone replacement therapy of the oxidation of low density lipoprotein in postmenopausal women. Atherosclerosis. 1997;5:157-62. [ Links ]
12. Shwaery GT, Vita JA, Keaney JF Jr. Antioxidant protection of LDL by physiologic concentrations of estrogens is specific for 17-beta-estradiol. Atherosclerosis. 1998;138:255-62. [ Links ]
13. Paganini-Hill A, Henderson VW. Estrogen replacement therapy and risk of Alzheimer disease. Arch Intern Med. 1996;156:2213-7. [ Links ]
14. Kawas C, Resnick S, Morrison A, Brookmeyer R, Corrada M, Zonderman A, et al. A prospective study of estrogen replacement therapy and the risk of developing Alzheimers disease. The Baltimore Longitudinal study of aging. Neurology. 1997;48:1517-21. [ Links ]
15. Bhavnani BR. Pharmaco kinetics and pharmaco dynamics of conjugated equine estrogens: Chemistry and metabolism. Proc Soc Exp Biol Med. 1998;217:6-16. [ Links ]
16. Dorfman RI, Dorfman AS. Estrogen assays using the rat uterus. Endocrinology. 1954;55:65-9. [ Links ]
17. Persson I, Adami HO, Bergkvist L, Lindgren A, Pettersson B, Hoover R, et al. Risk of endometrial cancer after treatment with estrogens alone or in conjunction with progestagens: results of a prospective study. Br Med J. 1989;298:147-51. [ Links ]
18. Pickar JH, Thorneycroft I, Whitehead M. Effects of hormone replacement therapy on the endometrium and lipid parameters; a review of randomized clinical trials, 1985 to 1995. Am J Obstet Gynecol Clinical. 1998;178:1087-99. [ Links ]
19. Gomes AM, Baracat EC, Simoes MJ, Haidar MA, Focchi GR, Evencio-Neto J, et al. Morphologic and morphometric aspects of the endometrium of postmenopausal women before and after cyclic oestrogen replacement treatment. Eur J Obstet Gynecol Reprod Biol. 1997;78:79-82. [ Links ]
20. Nacktigall LE. Clinical trial of the estradiol vaginal ring in the U.S. Maturitas. 1995;22 Suppl 1:543-7. [ Links ]
21. Bhavnani BR. The saga of the ring B unsaturated equine estrogens. Endocr Rev. 1988;9:346-416. [ Links ]
22. Pornel B. Efficacy and safety of Menorest in two positive- controls studies. Eur J Obstet Gynecol. Reprod Biol. 1996;64 Suppl 1:S35-7. [ Links ]
23. Bellido PB. Concentración plasmática de estrógenos en mujeres posmenopáusicas que reciben terapia estrogénica oral y transdérmica, Rev Per Ginecol Obstet. 1999;45(1):27. [ Links ]
24. Nagele F, OConnor H, Baskett TF, Davies A, Mohammed H, Magos AL Hysteroscopy in women with abnormal uterine bleeding on hormone replacement therapy a comparison with postmenopausal bleeding. Fertil Steril. 1996;65(6):145-50. [ Links ]
25. Sturdee DW, Barlow DH, Ulrich LG, Wells M, Gydesen H, Campbell M, et al. Is the timing of withdrawal bleeding a guide to endometrial safety during sequential oestrogren- progestagen replacement therapy. Lancet. 1994;344:979-82. [ Links ]
26. Al-Azzawi F, Habiba M: Regular bleeding on hormone replacement therapy a myth? Br J Obstet Gynecol. 1994;101:661-2. [ Links ]
27. Hernandez E, Atkinson B. Clinical Gynecologic Pathology. 1a Ed. Philadelphia: WB Saunders; 1996. p. 226-37. [ Links ]
28. Ganong W. Fisiologia Médica. 13va Ed. México DF: OPS; 1998. p. 364-415. [ Links ]
29. Suchaneck E. Biosynthesis of steroids in the ovaries. Lijec Viesn. 1996;118 Suppl 1:11-2. [ Links ]
30. Pritchard J, McDonald P, Gant N, Williams: Obstetricia. 3 ed. México DF: Salvat; 1993. p. 29-59. [ Links ]
31. Jones H, Wentz AC, Nurnett L. Tratado de Ginecología de Novak. México DF: Interamericana de México; 1991. [ Links ]
32. Barry R. Witt M. Thorneycroft J. Hormonas esteroides en la reproducción; generación, desintegración, recepción, acción. Clin Obst Ginecol. 1991;3:549-74. [ Links ]
33. Okada M, Yoden T, Kawamani E, Shimada Y, Kudoh M, Ysonura Y, et al. Studies on aromatase inhibitors. Synthesis and biological evaluation of 4- amino 4H-1,2,4 triazoles derivates, Chem Pharm Bull (Tokio). 1996;44(10):1871-9. [ Links ]
34. Palacios S. Farmocología de los estrógenos. En: S. Palacios (eds). Climaterio y Menopausia. Madrid: Mripla; 1992. p. 204-18. [ Links ]
35. Goodman G. Las bases farmacológicas de la terapéutica. 7ma Ed. México DF: Panamericana; 1991. p. 1340-66. [ Links ]
36. Lievertz RW. Pharmacology and pharmacokinetics of estrogen. Am J Obstet Gynecol. 1987;156:1289-93. [ Links ]
37. OConnell MB. Pharmacokinetic and pharmacologic variation between different estrogen products. J Clin Pharmacol. 1995;35 Suppl 1:18s-24s. [ Links ]
38. Katzenellenbogen BS, Korach KS. Editorial: A new actor in the estrogen receptor drama-enter ER-beta. Endocrinology. 1997;138:861-2. [ Links ]
39. Kanki S. Cambios cíclicos en la concentración de esteroides hormonales y receptores hormonales en el endometrio humano. Nippon Sanka Fujinka Gakkai Zasshi. 1982;34(12):2177-84. [ Links ]
40. Sturdee W. Bleeding patterns and endometrial histology with sequential HTR (abstract). Satellite Symposium 8th International Congress of the menopause. Understanding Endometrial Histology, New Data, New Insights; 1996. p. 9-11. [ Links ]
41. Silfen SL, Ciaccia AV, Bryant HU. Selective estrogen receptor modulators: Tissue selectivity and differential uterine effects. Climacteric. 1999;2(4):268-83. [ Links ]
42. Henriet P, Cornet PB, Lemoine P, Galant C, Singer CF, Courtoy PJ, et al. Circulating ovarian steroids and endometrial matrix metalloproteinases (MMPs). Brussels: Universite Catholique de Louvain; 1997. [ Links ]
43. Valer V, Valderrama C, Rivas L. Terapia de Reemplazo Hormonal en mujeres posmenopáusicas. Patología mamaria. Lima: UNMSM; 1998. [ Links ]
44. Hernández E, Atkinson B. Clínical Gynecologic Pathology. Philadelphia: W.B. Saunders, 1996. [ Links ]
45. Wunstein L. Efficacy of the continuous estrogen progestin regimen in the menopausal patient. Obstet Gynecol. 1987;69:929-32. [ Links ]
46. Magos DL, Buncat M, Studd JW, Wardle Schelesanger P, O´Dowd T. Amenorrhea and endometrial atrophy with continuous oral estrogen and progestogen therapy in postmenopausal women. Obstet Gynecol. 1985;65:496-9. [ Links ]
47. Womens Health Initiative (WHI). Actualización sobre el Programa de Hormonas de WHI. [homepage on the Internet]. Washington: The Association; c2004 [updated 1993 september; cited 2004 Jan 12]. Available from: http://www.whi.org/updates/update_hrt2004_sp.php[ [ Links ]STANDARDIZEDENDPARAG]
Manuscrito recibido el 05 de enero de 2005 y aceptado para publicación el 15 marzo 2005.
Correspondencia:
Dra. Victoria Eugenia Valer Tito
Av. Uruguay 126 Dpto. 201
Lima 1, Perú
Correo-e: mirandavaler@yahoo.com