Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.66 no.3 Lima Sept. 2005
Manejo de quilotórax posquirúrgico: Clipaje del conducto torácico y derivación pleuroperitoneal por toracoscopia
Youry Riveros1, Petro Shevchuk1, Felicia Lazo2
1Departamento de Cirugía, Hospital Departamental de Huancavelica. Minsa. Huancavelica, Perú.
2Departamento de Pediatría, Hospital Sergio E. Bernales. Minsa. Lima, Perú.
Resumen
El quilotórax por lesión del conducto torácico es una complicación catastrófica y rara, que se produce posterior a cirugías cardiotorácicas y a disecciones extensas en cuello. La pérdida diaria de quilo provoca déficit nutricional, metabólico e inmunodepresión, siendo incluso mortal si no es tratado. Actualmente, se recomienda el tratamiento quirúrgico temprano con apoyo de la cirugía torácica vídeoasistida (VATS), aplicando clips, endostapler o coagulador ultrasónico sobre el conducto torácico. El manejo conservador tiene alto porcentaje de falla, sobre todo en fístulas quilosas de gasto alto. Reportamos el manejo exitoso de una paciente con quilotórax poscirugía torácica por hidatidosis pulmonar gigante, mediante clipaje del conducto torácico y la realización de una derivación pleuroperitoneal.
Palabras clave: Quilotórax; conducto torácico; toracoscopia; cirugía torácica; enfermedades linfáticas.
Thoracoscopic management of post-operative chylothorax: Clipping of the thoracic duct and pleuroperitoneal shunt
Abstract
Chylothorax by thoracic duct injury is a catastrophic and rare complication that takes place following cardiac operations, chest surgery and extensive neck dissection. The chyle daily loss may lead to nutritional, metabolic and immunologic deficiencies, and even death if not treated. Currently, early surgical treatment is recommended with support of video-assisted thoracic surgery (VATS) applying clips, endostapler or ultrasonic coagulator over the thoracic duct. Conservative management has a great percentage of failures mainly due to high output chylous fistulae. We report the successful treatment of a patient with chylothorax following chest surgery for a lung giant hydatidic cyst, by clipping of the thoracic duct and pleuroperitoneal shunt.
Keywords: Chylothorax; thoracic duct; thoracoscopy; thoracic surgery; lymphatic diseases.
INTRODUCCIÓN
La lesión del conducto torácico es una complicación poco común y sin tratamiento que tiene una alta morbimortalidad. Se produce posterior a cirugías torácicas complejas (como la excisión de tumores mediastinales posteriores, neumonectomías, esofaguec-tomías, simpatectomías), a cirugías cardiovasculares (derivación aortocoronaria, aneurisma de aorta toráxica), a traumatismo de columna vertebral, cirugías espinales y disecciones extensas del cuello (1-5). Se manifiesta clínicamente como quilotórax, quilopericardio o fístula quilosa.
El quilotórax es una complicación catastrófica para el paciente, que aún desafía en su manejo al cirujano. Tradicionalmente, se ligaba el conducto torácico por toracotomía derecha. Actualmente, según el gasto diario de quilo por el drenaje torácico, se maneja conservadoramente o sometiendo a una intervención quirúrgica temprana con la cirugía torácica vídeoasistida, conocida como VATS (video-assisted thoracic surgery), ligando o clipando el conducto torácico (1). La VATS permite una visión magnificada de las estructuras torácicas, es mínimamente invasivo, de rápida recuperación posquirúrgica y alta temprana (1,6-8). Respaldado por nuestra revisión en la literatura médica, comunicamos el primer caso de quilotórax posquirúrgico de una cirugía torácica por hidatidosis pulmonar gigante, que fue tratada exitosamente mediante el clipaje del conducto torácico y una derivación pleuroperitoneal (9) por VATS.
CASO CLÍNICO
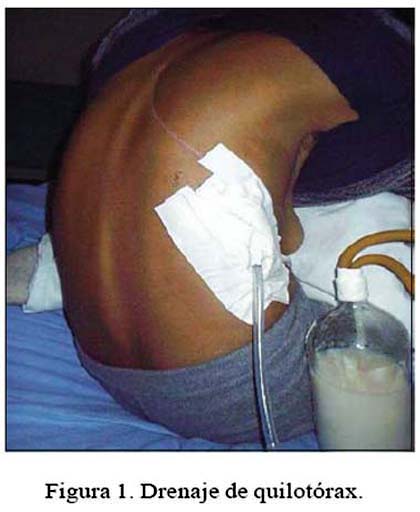
Paciente mujer de 27 años de edad, madre soltera, natural y procedente de Huancavelica, ingresa por emergencia en julio de 2005 presentando fiebre de 39ºC, dolor torácico intenso a predominio derecho, disnea. Al examen clínico, adelgazada y pálida, cicatriz de toracotomía posterolateral a nivel del 6º espacio intercostal (EIC) derecho; operada hacía 4 meses por hidatidosis pulmonar derecha gigante. Presentaba murmullo vesicular y vibraciones vocales abolidas, así como matidez en los dos tercios inferiores de hemitórax derecho (HTD). Luego de una radiografía de tórax y de apreciar radiopacidad del lado comprometido, se colocó un dren torácico visualizándose inmediatamente en el frasco un fluido blanco lechoso al que posteriormente confirmamos como quilotórax, por su alto contenido de triglicéridos (TGC) y quilomicrones (Figura 1). Se trató conservadoramente con antibióticos y dieta baja en grasas sin triglicéridos de cadena larga. No contamos con Unidad de Soporte Nutricional. El gasto diario de quilo era de 1075 a 2200 mL, en promedio 1520 mL/día. Los exámenes auxiliares mostraton: hemoglobina 9,96 mg%, leucocitos 11 600, abastonados 0; líquido pleural lechoso, quilomicrones, proteínas 3,47 g%, triglicéridos 675 mg%), albúmina sérica 2,29 g%.
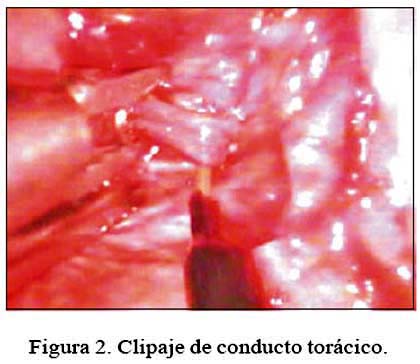
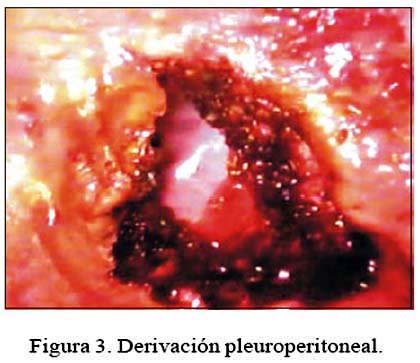
Bajo anestesia general con intubación de doble lumen, se colocó a la paciente en decúbito lateral izquierdo. Dos horas antes del inicio de la cirugía, por la sonda nasogástrica se instiló una mezcla licuada de 300 mL de leche y mantequilla para facilitarnos la localización de la fuga quilosa. Se utilizó tres puertos de trabajo, dos de 10 mm a nivel de 7º espacio intercostal y líneas axilar anterior y media, respectivamente. Utilizamos óptica de 30º, un puerto de 5 mm a nivel del 5º espacion intercostal y línea axilar media. Ya en la cavidad torácica, los 2/3 inferiores del hemitórax derecho lo encontramos anatómicamente irreconocible, con abundante colección de quilo y tejido tipo requesón que nos impedía trabajar, empañando constantemente la óptica. Ello nos obligó a realizar una minitoracotomía, con una incisión de 5 a 7 cm sobre la cicatriz anterior para evacuar con mayor rapidez el contenido y realizar una exhaustiva limpieza bajo visión endoscópica. Logramos así identificar una fístula quilosa de aproximadamente 3 mm de diámetro y varias otras de secreción serosa con tendencia a coagular. A nivel supradiafragmático, luego de abrir 10 mm de pleura engrosada, identificamos vena ácigos, esófago y aorta. El contenido en sentido cefalocaudal entre estas tres estructuras fue clipado en masa, proximal y distalmente (Figura 2), apreciándose inmediatamente cese del flujo lechoso de la fístula mayor pero aún continuaba el flujo seroso de las otras fístulas pleurales. Esto nos motivó a realizar una ventana en el diafragma (derivación pleuroperitoneal) de aproxima-damente 3 cm de diámetro (Figura 3). Se colocó un dren torácico que salió por uno de los orificios de los puertos de trabajo y se cerró las heridas finalmente. Se retiró el dren a las 2 semanas, cuando el gasto serohemático fue menos de 50 mL/día, indicando el alta a los 18 días postoperatorio, asintomática. En nuestro seguimiento de dos meses, no hubo recurrencia del quilotórax ni otra complicación.
DISCUSIÓN
La incidencia de quilotórax poscirugía por hidatidosis pulmonar es desconocida y luego de revisar la literatura, creemos que se trata del primer caso reportado como complicación de esta patología y solucionado exitosamente por VATS. La incidencia de lesión del conducto torácico luego de cirugías cardiotorácicas va de 0,5 a 2%, luego de disecciones mayores del cuello de 1 a 3% (7,10) y de esofaguectomías de 0,9% (11). La injuria del ducto torácico es una complicación catastrófica y rara que puede llevar a una deficiencia nutricional, disfunción respiratoria e inmunodepresión, con una mortalidad superior al 50% si no se ofrece tratamiento (12-16). Bonavina y col refieren que con la pérdida de quilo se depletan los linfocitos T, aumentando el riesgo de septicemia (11). Según Romero (9), se sospecha quilotórax por su apariencia lechosa y se le diagnostica con los siguientes criterios en líquido pleural: a) triglicéridos mayor de 110 mg/dL; b) la relación de TGC de líquido pleural sobre TGC sérico mayor que uno; y, c) la relación de colesterol en líquido pleural sobre colesterol sérico menor de uno. El líquido pleural de nuestra paciente tenía 675,6 mg/dL de TGC, abundante quilomicrones y proteínas. A pesar de las grandes ventajas que ofrece la cirugía toracoscópica actual, muchos autores defienden un manejo conservador e inicial del quilotórax de dos semanas (11,17-19) o de una semana (20,21), que consiste en nutrición parenteral total o dieta baja en grasas, evitando TGC de cadena larga, corrección de líquidos - electrólitos y drenaje torácico (22,23). Collard y col describen un manejo conservador exitoso con infusión continua de somatostatina-14. Últimamente, se describe el uso de etilefrina. Se cree que ambos son agentes adrenérgicos que contraen la musculatura lisa del conducto torácico (21). Otros autores consideran que el manejo conservador tiene una falla superior al 50%, sobre todo en aquellas fístulas quilosas de alto gasto (24,25). Por ello, Gunnlaugsson y col, en el 2004, recomendaron para el quilotórax una intervención quirúrgica temprana o primaria en los siguientes casos: a) gasto alto de quilo mayor de 500 mL/día; b) complicación metabólica y nutricional severa; c) cuando existe compromiso respiratorio; y, d) fístulas de gasto bajo menor de 500 mL/día, que duran más de 14 días a pesar de manejo conservador (25). Kumar y col sugieren cirugía temprana por VATS (1,21,26) si el gasto de quilo es mayor de 1000 mL/día y manejo conservador por una semana si el gasto es menos de este volumen. Si a pesar de este manejo el gasto es mayor de 200 mL diarios, someter a cirugía (1). Nuestra paciente tuvo un gasto promedio diario de 1520 mL, cuadro clínico venido a menos y casi dos semanas de manejo conservador, indicación suficiente para someterla a cirugía por VATS. El tratamiento definitivo del quilotórax es detener el tránsito del quilo por el conducto torácico a nivel supradiafragmático. De esta manera, se cierra el tronco principal que alimenta la fístula quilosa. Retrógradamente, gracias a la existencia de las comunicaciones linfaticovenosas (27), el quilo llega a su destino. La VATS, introducida en los 90s, gracias a sus ventajas para el manejo con éxito de la lesión del conducto torácico en cualquiera de sus presentaciones clínicas, se ha convertido en la técnica ideal. Desde entonces hasta la actualidad, muchos autores comunican éxito utilizando para este fin instrumental laparoendoscópico cada vez más sofisticado, reduciendo de esta manera la morbilidad, el tiempo quirúrgico, menos dolor postoperatorio, menos complicación posquirúrgica, menos días de drejane torácico, reinicio temprano de la ingesta oral y menos estancia hospitalaria. Diversos métodos han sido aplicados para cerrar la fístula quilosa, que muchas veces no se logra ubicar o son varias. Entonces, se inició aplicando directamente fibrin glue (24,28). Otra manera es cerrar la fuente de alimentación de la fístula directamente en el tronco principal, que es el conducto torácico. Así, Lampson (2), en 1948, informó sobre la primera ligadura del conducto torácico por toracotomía y, desde 1993, varios autores comunicaron de la ligadura del ducto por VATS (29-31). En 1994, Janssen describió clipaje directo, método que nosotros utilizamos en nuestra paciente (3,16,20,32). En 2001, Bonavina y col publicaron el manejo del quilotórax aplicando endostapler al conducto torácico, tejido periaórtico y la vena ácigos en bloque (11). En 2002, Takeo y col informaron del manejo del conducto torácico sin clips utilizando por toracoscopia coagulador ultrasónico de alta frecuencia (15,18). En nuestra paciente realizamos clipaje directo. Lo esencial para el éxito de la cirugía es encontrar el conducto torácico localizado justo encima del diafragma. Hay mayor probabilidad de no encontrarlo cuanto nos alejamos de éste (1,3,5). Otros autores informan el abordaje transabdominal, a nivel del hiato (33,34). En lo posible, debe evitarse la disección del conducto torácico, procurando rodear todo el tejido entre la ácigos y la aorta y proceder a clipar o ligar en masa; algunas veces, hasta puede incluirse la vena ácigos (3,5,11). En los quilotórax unilaterales, realizar el abordaje quirúrgico del lado torácico de la efusión. Se prefiere el abordaje derecho en caso de quilotórax bilateral o cuando el origen de la fístula quilosa es desconocida (5). Tener en cuenta que el conducto torácico tiene un diámetro de 2 a 4 mm y variantes anatómicas que pudieran alimentar una fístula quilosa a pesar de haber clipado el tronco principal, y hacer de la cirugía un fracaso o un quilotórax recurrente o intratable (3,27,35). Para ayudar a identificar la fuga quilosa o el conducto, se puede administrar vía oral 2 horas antes de la cirugía una solución con alto contenido graso, azul de metileno o sudan black, pero estos mecanismos podrían hacer más difícil la identificación de nuestro objetivo, ya que los tejidos se tiñen y absorben la luz durante la toracoscopia (6,30,32,36). Nosotros administramos a través de la sonda nasogástrica una mezcla licuada de leche de vaca y mantequilla, en una relación de uno a tres en un volumen total de 300 mL, permitiendo identificar la fístula quilosa y hacer más turgente el conducto torácico; no tuvimos complicación alguna y nos permitimos recomendarlo. Se describe como alternativa de solución al quilotórax, la derivación pleuroperitoneal, en la que se comunica tórax y abdomen realizando una ventana en el diafragma, permitiendo el pasaje del contenido torácico al abdomen y aprovechando de esta manera la capacidad de absorción del peritoneo. La única condición es que no haya ascitis quilosa (9,35). Finalmente, otra alternativa de solución es la pleurodesis, ya sea mecánica -mediante la pleurectomía parietal- o química, utilizando talco, doxiciclina o actualmente la bleomicina (14).
Se concluye que el quilotórax es una complicación muy seria, pero solucionable con un adecuado tratamiento. La VATS es una excelente técnica de abordaje quirúrgico que permite llegar con visión amplificada al conducto torácico y, según la disponibilidad de recursos de cada institución, llegar a ligar, clipar o a coagularlo por ultrasonido. Hemos visto que, a través del tiempo, el manejo conservador se ha convertido en una terapia de segunda línea, es caro y tiene alta probabilidad de falla en fístulas de alto gasto. Recomendamos la intervención quirúrgica temprana por VATS, evitando de esta manera el compromiso nutricional e inmunológico del paciente. Se deja como alternativa de solución al manejo conservador, pero no como terapia inicial y obligatoria, procurando así menos estancia hospitalaria y pronta recuperación. La derivación pleuroperitoneal es también una buena alternativa, eficaz y realizable en el mismo acto quirúrgico para tratar las fístulas pleurales remanentes, reduciendo el costo si se aplicara cola de fibrina.
AGRADECIMIENTO
A mi madre Sra. Julia Ramos de Riveros, mujer amorosa, luchadora y tenaz, que dios la bendiga.
A mi esposa y a mi hijo Sebastián por su invalorable colaboración.
A mis maestros cirujanos del Hospital Guillermo Almenara Irigoyen por brindarme su arte y sabiduría.
Al Hospital Departamental de Huancavelica por la oportunidad de acogerme en su seno.
REFERENCIAS BIBLIOGRÁFICAS
1. Kumar S, Kumar A, Pawar DK. Thoracoscopic management of thoracic duct injury: Is there a place for conservatism? J Post Grad Med. 2004;50:57-9. [ Links ]
2. Lampson RS. Traumatic chylosthorax, a review of literature and report of a case treated by mediastinal ligation of the thoracic duct. J Thorac Surg. 1948;17:778-91. [ Links ]
3. Wurnig PN, Hollaus PH, Ohtsuka T, Flege JB, Wolf RK. Thoracoscopic direct clipping of the thoracic duct for chylopericardium and chylothorax. Ann Thorac Surg. 2000;70:1662-5. [ Links ]
4. Fahimi H, Casselman FP, Mariani MA, van Boven WJ, Knaepen PJ,van Swieten HA. Current management of postoperative chylothorax. Ann Thorac Surg. 2001;71:448-51. [ Links ]
5. Gao X. Surgical management of chylothorax: a report of 65 cases. Zhonghua Waikeza Zhi. 1989;27(3):164-5. [ Links ]
6. Crostwaite GL, Joypaul BV, Cushieri A. Thoracoscopic management of thoracic duct injury. J R Coll Surg Edinb. 1995;40:303-4. [ Links ]
7. Lapp GC, Brown DH, Guyllane PJ, McKneally M. Thoracoscopic management of chylous fistula. Am J Otolaryngol. 1998;19:257-62. [ Links ]
8. Linder A, Friedel G, Toomes H. Prerequisites, indications, and techniques of video-assisted thoracoscopic surgery. Thorac Cardiovasc Surg. 1993;41:140-6. [ Links ]
9. Romero S. Nontraumatic chylothorax. Curr Opin Pulm Med. 2000;6:287-91. [ Links ]
10. Furrer M, Hopf M, Ris HB. Isolated primary chylopericardium: treatment by thoracoscopic thoracic duct ligation and pericardial fenestration. J Thorac Cardiovasc Surg. 1996;112:1120-1. [ Links ]
11. Bonavina L, Saino G, Bona D, Abraham M, Peracchia A. Thoracoscopic management of chylothorax complicating esophagectomy. J Laparoendosc Adv Surg Tech. 2001;11:367-9. [ Links ]
12. Sakata S, Yoshida I, Otani Y, Ishikawa S, Morishita Y. Thoracoscopic treatment of primary chylopericardium. Ann Thorac Surg. 2000;69:1581-2. [ Links ]
13. Graham DD, McGahren ED, Tribble CG, Daniel TM, Rodgers BM. Use of video-assisted thoracic surgery in the treatment of chylothorax. Ann Thorac Surg. 1994;57:1507-12. [ Links ]
14. Nadesan S, Ming TC, Thangaveloo G, Jasmi AY. Treatment of delayed chylothorax complicating oesophagectomy. Asian J Surg. 2005;28:142-4. [ Links ]
15. Ohtsuka T, Ninomiva M, Kobayashi J, Kaneko Y. VATS thoracic-duct division for aortic surgery-related chylous leakage. Eur J Cardiothorac Surg. 2005;27:153-5. [ Links ]
16. Willemsen HW, Girbes AR, Borgstein PJ, Wisselink W. Thoracic clipping of thoracic duct in a woman with persisting chylothorax. Ned Tijdschr Geneeskd. 2000;144:2564-7. [ Links ]
17. Shiraisi Y. Chylothorax. Kyobu Geka. 2004;57:757-61. [ Links ]
18. Takeo S, Yamasaki K, Takagi M, Nakashima A. Thoracoscopic ultrasonic coagulation of thoracic duct in management of postoperative chylothorax. Ann Thorac Surg. 2002;74:263-5. [ Links ]
19. Fogli L, Gorini P, Belcastro S. Conservative management of traumatic chylothorax: a case report. Intensive Care Med. 1993;19:176-7. [ Links ]
20. Tojo T, Nezu K, Kushibe K, Takahama M, Kitamura S. Clipping of the thoracic duct with video-assisted thoracic surgery in treatment of chylothorax after pulmonary resection. Nippon Kyobu Geka Gakkai Zasshi. 1997;45:102-6. [ Links ]
21. Hirata N, Ueno T, Amemiya A, Shiguemura N, Akashi A, Kido T. Advantage of earlier thoracoscopic clipping of thoracic duct for post-operation chylothorax following thoracic aneurysm surgery. Jpn J Thorac Cardiovasc Surg. 2003;51:378-80. [ Links ]
22. Merrigan BA, Winter DC, O´Sullivan GC. Chylothorax. Br J Surg. 1997;84:15-20. [ Links ]
23. Collard JM, Laterre PF, Boemer F, Reinaert M, Ponlot R. Conservative treatment of postsurgical lymphatic leaks with somatostatin-14. Chest. 2000;117:902-5. [ Links ]
24. Inderbitzi RG, Krebs T, Stirnemann P, Althaus U. Treatment of postoperative chylothorax by fibrin glue application under thoracoscopic view with use of local anaesthesia. J Thorac Cardiovasc Surg. 1992;104:209-10. [ Links ]
25. Gunnlaugsson CB, Iannettoni MD, Yu B, Chepeha DB, Teknos TN. Management of chyle fistula utilizing thoracoscopic ligation of the thoracic duct. J Otorhinolaryngol Relat Spec. 2004;66:148-54. [ Links ]
26. Kansaki M, Sasano S, Murasugi M, Oyama K. Early endoscopic treatment of chylothorax develops after surgical treatment of lung cancer patients. Jpn J Thorac Cardiovasc Surg. 2003;51:506-10. [ Links ]
27. Flondrin, et al. Lymphaticovenous communications. Anat Clin. 1985;7:83-91. [ Links ]
28. Shirai T, Amano J, Takabe K. Thoracoscopic diagnosis and treatment of chylothorax after pneumonectomy. Ann Thorac Surg. 1991;52:306-7. [ Links ]
29. Kent RB 3rd, Pinson TW. Thoracoscopic ligation of the thoracic duct. Surg Endosc. 1993;7:52-3. [ Links ]
30. Zoetmulder F, Rutgers E, Baas P. Thoracoscopic ligation of a thoracic duct leakage. Chest. 1994;106:1233-4. [ Links ]
31. Stringel G, Texeira JA. Thoracoscopic ligation of the thoracic duct. JSLS. 2000;4:239-42. [ Links ]
32. Janssen JP, Joosten HJ, Postmus PE. Thoracoscopic treatment of postoperative chylothorax after coronary bypass surgery. Thorax. 1994;49:1273. [ Links ]
33. Terashima H, Sugawara F, Hirayama K. The optimal procedure for chylothorax alter operation for thoracic esophageal cancer; reasonable approaches to the thoracic duct from the point of view of routes for esophageal replacement. Kyobu Geka. 2003;56:465-8. [ Links ]
34. Miyamura H, Watanabe E. Ligation of the thoracic duct through transabdominal phrenotomy for chylothorax after heart operations. Thor Cardiovasc Surg. 1994;107:316. [ Links ]
35. Demetriades D, AsensioJ, Velmaho G. Complex problems in penetrating neck trauma. Surg Clin North Am. 1996;76:661-81. [ Links ]
36. Buchan KG, Hosseinpour AR, Ritchie AJ. Thoracoscopic thoracic duct ligation for traumatic chylothorax. Ann Thorac Surg. 2001;72:1366-7. [ Links ]
Manuscrito recibido el 02 de setiembre de 2005 y aceptado para publicación el 30 setiembre de 2005.
Correspondencia: Dr. Youry Dowell Riveros Ramos
Jr. Bolognesi 831
Lima 32, Perú.
Correo-e: yriveros3@yahoo.com