Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.67 no.2 Lima abr.-jun. 2006
Un caso de duplicación gástrica quística del adulto manejado por laparoscopia
José De Vinatea 1, Luis Villanueva 1, Édgar Gonzales 1, Carmen Asato 1, Julia Sumire 1, Karina Castro 1
1 EsSalud. Hospital Nacional Guillermo Almenara Irigoyen, Departamento de Cirugía General. Lima, Perú.
Resumen
El objetivo de este estudio fue evaluar las dificultades diagnósticas y las alternativas terapéuticas de esta rara enfermedad. Describimos un caso de duplicación gástrica en una paciente de 42 años de edad, que acudió por dolor abdominal inespecífico y que las imágenes mostraron una masa quística retrogástrica. Con el diagnóstico presuntivo de cistoadenoma o hidatidosis pancreática, la paciente fue sometida a exploración y manejo laparoscópico. Se extirpó una tumoración quística dependiente de la pared posterior gástrica, sin comunicación con su luz, la cual fue extraída completamente en una bolsa. El contenido fue verdoso y el informe de anatomía patológica fue duplicación gástrica. Concluimos que la duplicación gástrica debe ser resecada completamente y que la vía laparoscópica es una alternativa viable.
Palabras clave: Laparoscopia; duplicacion gástrica.
A case of adult cystic gastric duplication treated by laparoscopy
Abstract
The aim of the study was to evaluate the diagnosis difficulties and surgical treatment of this rare congenital disease. We describe a cystic gastric duplication case in a 42 year-old female patient who presented abdominal pain. Computed tomography and ultrasound revealed a cystic retrogastric mass. With the preoperative diagnosis of pancreatic cystoadenoma or pancreatic hydatid cyst the patient underwent laparoscopic surgery. A non-connected posterior wall stomach cyst was mobilized and resected. Histopathology examination revealed gastric duplication. In summary, treatment of this disease is surgical total excision and the laparoscopic approach is feasible.
Key words: Laparoscopy; gastric duplication.
INTRODUCCIÓN
Reportamos un caso de duplicación gástrica en un adulto. Se trata de una enfermedad congénita rara. La duplicación digestiva más frecuente es la ileal. La duplicación gástrica es una de las más raras. Puede tener o no comunicación con el estómago, pero siempre está íntimamente unida a él.
Se define la duplicación gástrica como una estructura esférica recubierta con musculatura lisa y tapizada de epitelio digestivo, unida a cualquier nivel del estómago.
En la literatura, puede ser encontrada con estos nombres: quiste de duplicación o quiste entérico.
La sintomatología es usualmente inespecífica y frecuentemente es un hallazgo quirúrgico. El diagnóstico topográfico se hace con imágenes (ecografía y tomografía). El diagnóstico clínico exige un alto índice de sospecha y el diagnóstico definitivo es solo por anatomía patológica.
El tratamiento es quirúrgico.
CASO CLÍNICO
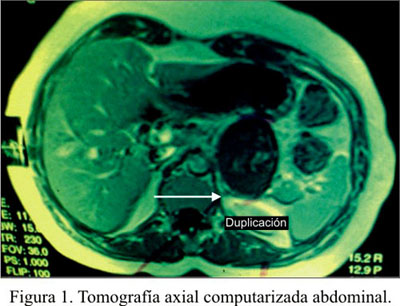
Mujer de 42 años que ingresó con una historia de 10 meses de dolor abdominal en cuadrante superior izquierdo, de moderada intensidad, tipo opresivo, que cedía parcialmente con antiespasmódicos. No había vómitos, fiebre, ictericia ni pérdida ponderal. Antecedente de miomectomía 5 años antes y traumatismo abdominal cerrado, a los 7 años. Examen clínico sin importancia. Los análisis de laboratorio mostraron una leve anemia (11,2 g/dL) y el resto dentro de límites normales, incluyendo una prueba de Elisa anti equinococcus negativa y marcadores tumorales negativos. La ultrasonografía mostró tumoración quística de 70x56 mm, dependiente de la glándula suprarrenal izquierda. La tomografía axial computarizada, una tumoración ovoidea de 50x68 mm, que desplazaba caudalmente el páncreas, manteniendo interfase adecuada con el mismo. La conclusión fue: tumoración adrenal vs. cola de páncreas (Figura 1).
La gammagrafía de adrenales (MIGB-I-131) fue negativa a patología.
La resonancia magnética nuclear mostró glándula suprarrenal izquierda normal; tumoración quística en la porción anterior y superior del páncreas, en la unión del cuerpo con la cola, de 61x55 mm.
La paciente fue programada para una resección laparoscópica, con la impresión diagnóstica de cistoadenoma de páncreas, sin descartar completamente una hidatidosis pancreática.
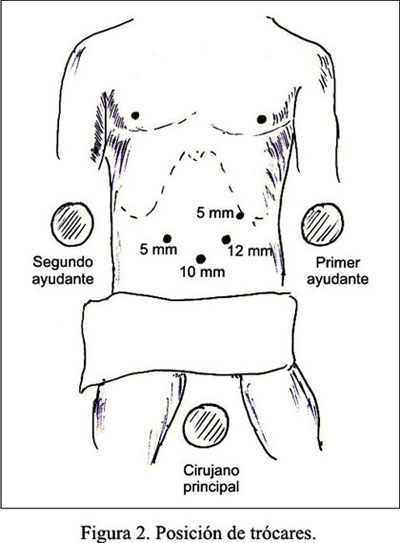
La paciente fue colocada en decúbito dorsal y el cirujano se situó entre los miembros inferiores de la paciente. Los trócares fueron colocados según la Figura 2.
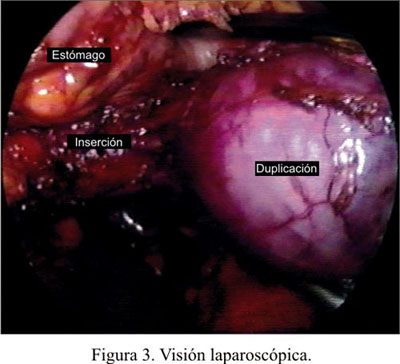
Al abrir el epiplón mayor e ingresar a la transcavidad de los epiplones, se encontró una tumoración quística ovalada de 70x90 mm, independiente del páncreas. Se liberó completamente la curvatura mayor del estómago y se observó que dicha tumoración hacía cuerpo con la pared posterior y superior del estómago, hacia la curvatura menor (Figura 3). Se abrió el epiplón menor, con la intención de voltear el estómago para anteriorizar la tumoración, pero debido a su gran tamaño no fue posible lograrlo. Se decidió clipar y seccionar los vasos gástricos izquierdos, con lo cual se creó una adecuada ventana, por donde ahora sí se logró pasar la tumoración y voltear el estómago. Con el quiste completamente visible y delimitado, se procedió a colocar unos puntos de reparo: uno fue colocado en la parte inferior del quiste y otro en la parte superior, cercano a la unión esófago-gástrica.
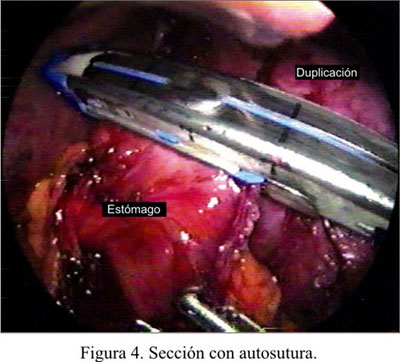
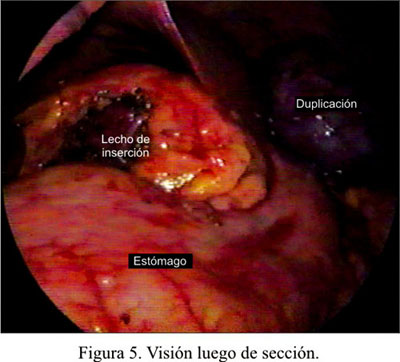
Al suspender el quiste y traccionar ambos reparos, se creó el trayecto adecuado para proceder a los disparos con la endograpadora lineal cortante de 30 mm (Figura 4). Luego de usar 4 cargas en un trayecto semicurvo, se completó la separación del quiste y el estómago sin ningún tipo de contaminación (Figura 5). Luego de verificar el cierre adecuado, con instilación de azul de metileno, se seccionó los puntos de reparo e inmediatamente el estómago regresó a su posición original, dejando la línea de grapas en la cara posterior. Se dejó una sonda nasogástrica.
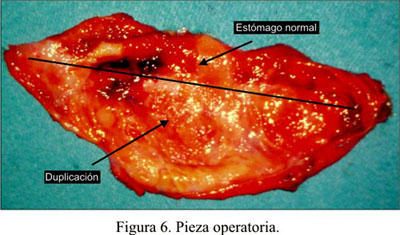
El quiste fue introducido dentro de una bolsa de plástico y se lo extrajo ampliando la incisión del trócar por donde se introdujo la endograpadora. El quiste fue punzado y aspirado dentro de la bolsa, para conseguir su colapso y facilitar la extracción (Figura 6). El líquido fue de color verde y de consistencia algo pastosa, enviándosele al laboratorio para su estudio.
Durante el acto quirúrgico, fuimos cambiando progresivamente nuestras presunciones diagnósticas, de quiste mesentérico, divertículo gástrico, leiomioma gástrico necrosado.
Al observar el tipo de contenido del quiste, propusimos como una alternativa el diagnóstico de duplicación gástrica.
El tiempo operatorio fue de 3 horas, la paciente no hizo complicación alguna y salió de alta al 4º día postoperatorio.
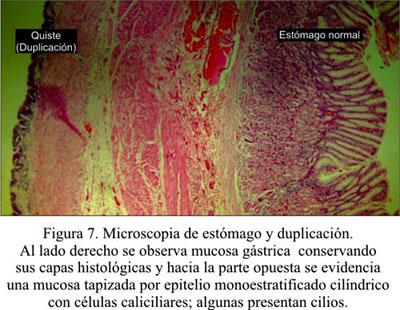
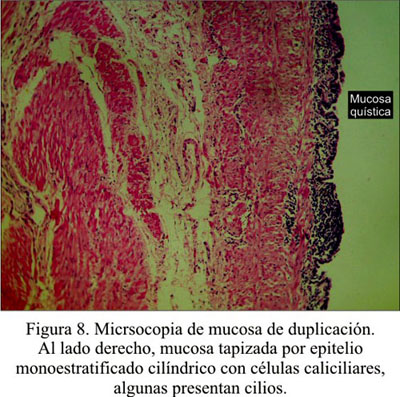
El informe anátomo-patológico fue duplicación gástrica (Figura 7 y 8 ).
El Gram y cultivo de la muestra del líquido intraquístico fueron negativos para gérmenes aeróbicos y anaeróbicos. Las bilirrubinas, 3,9 mg/dL, y las amilasas, 416 U/L.
Se le tomó una radiografía de control con contraste hidrosoluble (Figura 9), observándose adecuado pasaje de la sustancia de contraste.
DISCUSIÓN
Las duplicaciones digestivas son de origen congénito y pueden encontrarse a cualquier nivel. La más frecuente es la duplicación ileal (1). De todas las duplicaciones digestivas, la duplicación gástrica es una de las más infrecuentes, 3 a 4% (2).
La primera descripción de una duplicación digestiva fue en 1 711 (duplicación esofágica) (3). La primera extirpación quirúrgica fue realizada en 1900 (quiste ileal) (4). Es muy rara en el adulto; la mayoría ocurre en niños (80%) (5), Se ha comunicado hasta en personas de 83 años de edad (6).
Es más frecuente en mujeres (7), aunque hay autores que refieren que la incidencia es semejante (8). La confusión podría estar en el análisis de las series: en adultos la frecuencia sería mayor en mujeres jóvenes. En forma global o en las series pediátricas, la incidencia sería igual.
Se la define como una estructura quística entérica en contacto con el estómago, compartiendo sus capas musculares y vasculatura (9).
En 1959, se propuso los siguientes criterios diagnósticos esenciales (10):
- Continuidad del quiste con la pared gástrica.
- El quiste debe estar rodeado por músculo liso, que se continúa con musculatura lisa gástrica.
- El quiste debe estar tapizado por epitelio digestivo.
En la histología, lo más frecuente es encontrar mucosa gástrica, pero también epitelio escamoso (11), a veces tejido colónico, pancreático o bronquial (10,12,13). El contenido del quiste dependerá del tipo de epitelio. Si es mucosa gástrica, el pH será ácido; si es intestinal, será alcalino. A veces, puede haber un contenido hemorrágico o necrótico (5). Woolfolk describe contenido sebáceo en un caso reportado por él (14). Un mismo quiste puede presentar diferentes epitelios, en forma parcelar: intestinal, ciliado y escamoso (2,7).
Siendo el tipo de epitelio el elemento más importante para determinar sus eventuales complicaciones, es imperativo el estudio minucioso de toda la mucosa del quiste, lo cual solo se logra con la extirpación completa del mismo.
Se describe su transformación maligna, a adenocarcinoma (más frecuente) y carcinoma epidermoide (15). Horie describe un foco de carcinoide encontrado en la capa muscular de una duplicación gástrica, recomendando un minucioso estudio del quiste (16). La posibilidad de malignización es el aspecto más contundente para concluir que el manejo de esta patología debe ser la resección completa del quiste.
El origen embriológico de la duplicación gástrica es controversial, existiendo varias teorías: invaginación de los pliegues longitudinales durante la organogénesis fetal (17,18), separación diverticular de nidos celulares (19), gemelo frustro (20), error de recanalización del tracto intestinal (17).
La duplicación gástrica puede ser de dos tipos: tubular y quístico. El tipo tubular se comunica con el estómago y el quístico no (11,21). La mayoría no se comunica con el estómago (80%) (22).
Según su ubicación, los quistes pueden ser: submucosos, intermusculares, subserosos o intermesentéricos (23). Quiere decir que, pueden presentarse hacia la luz gástrica o hacia la serosa. La localización más frecuente es en la curvatura mayor y el antro (21).
Los quistes más frecuentemente descritos son únicos. Sin embargo, Koltun describe una duplicación gástrica en un adulto, compuesta por dos quistes (9), solo uno de ellos comunicado con la luz del estómago. Koumanidou describe un caso de duplicación gástrica quística múltiple, que se presentó con cuadro abdominal agudo, por perforación de uno de los quistes (24).
La sintomatología es variable. Algunos pacientes son asintomáticos, haciéndose el diagnóstico en forma accidental, otros cursan con sintomatología vaga e inespecífica. Los síndromes clínicos más frecuentes podrían resumirse en síndrome doloroso, tumoral, obstructivo, hemorrágico-anémico. El dolor puede ser producido por varios mecanismos, como aumento de tensión intraquística, ulceración de la mucosa gástrica, pancreatitis, compromiso vascular, etc. La hemorragia puede deberse a ulceración péptica de la mucosa o erosión de algún vaso sanguíneo.
Los diagnósticos diferenciales más frecuentes son: divertículo gástrico, leiomioma gástrico, seudoquiste de páncreas, quiste mesentérico, cistoadenoma de páncreas, hidatidosis pancreática (diagnóstico diferencial, en el presente caso), tumor adrenal izquierdo.
El quiste mesentérico tiene paredes delgadas y se separa con facilidad de las vísceras vecinas. Al resecarse una duplicación digestiva, usualmente hay que extirpar una porción de tubo digestivo.
El seudoquiste de páncreas debe tener una historia documentada o compatible con pancreatitis, incluyendo la producida por traumatismo pancreático. Además, en el acto quirúrgico se constata la obvia relación con el páncreas.
El divertículo gástrico no cuenta con la capa muscular.
Cougard describe un caso poco frecuente de una duplicación gástrica en forma de reloj de arena, que fue diagnosticada como tumoración torácica (25).
El diagnóstico es básicamente por imágenes: ecografía (incluyendo la ecografía endoscópica), tomografía y resonancia. Puede ser útil el estudio contrastado del estómago y la endoscopia gástrica. Un dato útil en presencia de una tumoración de aspecto quístico sospechosa de duplicación gástrica es la asociación con otras malformaciones congénitas (vertebrales). Estlein informa que hasta 50% está asociado con otras anomalías congénitas (26).
Se describe la utilidad del scanning con tecnecio, para mucosa gástrica ectópica (27,28).
Rullier describe que, una buena ultrasonografía que demuestre una estructura quística adyacente al estómago y que presente movimientos peristálticos hace el diagnóstico de duplicación gástrica (29).
Se describe el diagnóstico prenatal de duplicación gástrica con ecografía que muestra quiste abdominal con movimiento peristáltico (30).
Steiner reporta una duplicación digestiva a la semana 25 de gestación (31). Ford describe otro caso diagnosticado a las 20 semanas de gestación (32).
Existen varias propuestas terapéuticas. Rullier propone que solo debe resecarse los casos sintomáticos (29). Ferrari describe la punción –aspiración endoscópica del quiste (33). La resección parcial del quiste con stripping de la mucosa sin ingresar a cavidad gástrica es una alternativa reportada (8,34). Woolfolk describe un manejo endoscópico con ayuda ecográfica, que consiste en establecer una ventana entre el quiste y la luz gástrica, con biopsias múltiples de la mucosa del quiste (14). Pequeños quistes submucosos pueden ser extirpados endoscópicamente (35).
En países donde la enfermedad hidatídica es endémica, todo abordaje por punción (percutánea o endoscópica) de cualquier formación quística, debe ser considerado con mucha precaución, por el riesgo de diseminación o anafilaxia.
El tratamiento ideal es la resección completa de la lesión. Se confirma el diagnóstico por anatomía patológica y se debe descartar la presencia de neoplasia maligna (10). En algunos casos, puede ser necesaria una gastrectomía parcial (36,37) o total (6).
Hemos encontrado 5 casos comunicados en la literatura, sobre el manejo laparoscópico de la duplicación gástrica. Dos casos tratados en niños (32,38) y tres en adultos (39,40,41). El presente caso sería el cuarto sobre resección laparoscópica en un adulto. Como todo procedimiento laparoscópico, propone una menor agresión, con todas sus ventajas colaterales. El procedimiento ideal es aquel que resuelve el problema (resección completa del quiste) y además lo hace agrediendo menos al paciente (endoscópico o laparoscópico). La importancia del desarrollo de una alternativa quirúrgica laparoscópica para cualquier patología congénita capaz de ser diagnosticada prenatalmente, consiste en viabilizar la posibilidad que ésta pueda ser resuelta en estadio fetal por esta misma vía.
RERFERENCIAS BIBLIOGRÁFICAS
1. Lewis PL, Holder T, Feldman M. Duplication of the stomach. Arch Surg. 1961;82:180-5. [ Links ]
2. Faerber EN, Balsara R, Vinocur CD, de Chadarevian JP. Gastric duplication with hemoptysis: CT findings. AJR Am J Roentgenol. 1993;161:1245-6. [ Links ]
3. Blaes G. Observationae medicae anatomicae rariores. Amstelodami: Lugduni Batavorum; 1711. [ Links ]
4. Sprengel C. Eine angeborene cyste der darmwand als ursache der invagination. Verh Dtsch Chir. 1900;29:537-52. [ Links ]
5. Pediatric diseases of the stomach and duodenum. En: Harkins HN, Nyhus LM, eds. Surgery of the stomach and duodenum. 2nd Ed. London: J and A Churchill; 1969. [ Links ]
6. Marcote-Valdivieso E, Arlandis-Felix F, Baltasar A, Roca-Villanueva B, Vierna-García J. Gastric duplication in an adult. Rev Esp Enferm Dig. 1993;84:195-6. [ Links ]
7. Glaser C, Kuzinkovas V, Maurer C, Glattli A, Mouton WG, Baer HU. A large duplication cyst of the stomach in an adult presenting as pancreatic pseudocyst. Dig Surg. 1998;15:703-6. [ Links ]
8. Perek A, Perek S, Kapan M, Goksoy E. Gastric duplication cyst. Dig Surg. 2000;17:634-6. [ Links ]
9. Koltun WA. Gastric duplication cyst: endoscopic presentation as an ulcerated antral mass. Am Surg. 1991;57:468-73. [ Links ]
10. Rowling JT. Some observations on gastric cysts. Br J Surg. 1959;46:441-5. [ Links ]
11. Chen YM, Teague RS, Ott DJ, Butler RFI, Sanzenbacher LJ. Gastric duplication cyst simulating leiomyoma. Gastro Endosc. 1987;33:250-2. [ Links ]
12. Nissan S. Duplications of the stomach. Am J Surg. 1960;100:59-63. [ Links ]
13. Steyaert H, Voigt JJ, Brouet P, Vaysse P. Uncommon complication of gastric duplication in a three-year-old child. Eur J Pediatr Surg. 1997;7:243-4. [ Links ]
14. Woolfolk GM, McClave SA, Jones WF, Oukrop RB, Mark MD. Use of endoscopic ultrasound to guide the diagnosis and endoscopic management of a large gastric duplication cyst. Gastrointest Endosc. 1998;47:1-5. [ Links ]
15. Colt DG, Mies C. Adenocarcinoma arising within a gastric duplication. Cyst J Surg Oncol. 1992;50:274-7. [ Links ]
16. Horie H, Iwasaki I, Takahashi H. Carcinoid in a gastrointestinal duplication. J Pediatr Surg. 1986;21:902-4. [ Links ]
17. Bremer JL. Diverticulae and duplications of the intestinal tract. Arch Pathol Lab Med. 1944;38:1168-71. [ Links ]
18. Taft DA, Hairston JT. Duplication of the alimentary tract. Am Surg. 1976;42:455-62. [ Links ]
19. Lewis FT, Thyng FW. Regular occurrence of intestinal diverticulae in embryos of pig, rabbit and man. J Anat. 1908;7:505. [ Links ]
20. Edwards H. Congenital diverticulae of the intestine. Report of a case exhibiting heterotopia. Br J Surg. 1929;17:7. [ Links ]
21. Wieczorec RL, Seidman I, Ranson JHC, Ruoff M. Congenital duplication of the stomach: Case report and review of the English literature. Am J Gastroenterol. 1984;79:597-601. [ Links ]
22. Spivak H, Pascal RR, Wood WC, Hunter JG. Enteric duplication presenting as cystic tumors of the pancreas. Surgery. 1997;121:597-600. [ Links ]
23. Minkari T, Unal G: Midenin selim tumorleri. Mide Tumorleri ve Cerrahisi. Istanbul, ed Tank Minkari, Gurcan Unal: Kagit ve Basim Isleri AS; 1976. p. 116. [ Links ]
24. Koumanidou C, Montemarano H, Vakaki M, Pitsoulakis G, Savvidou D, Kakavakis K. Perforation of multiple gastric duplication cysts: diagnosis by sonography. Eur Radiol. 1999;9:1675-7. [ Links ]
25. Cougard P, Bernard A, Melnick W, Guerin JC, Viard H. Cystic tumor of the mediastinum of digestive origin. Apropos of a new case. Diagnostic and pathogenic hypotheses. Ann Chir. 1992;46:774-7. [ Links ]
26. Estlein D, Wolloch Y. Gastric duplication cyst in an adult. Harefuah. 1997;132:634-5. [ Links ]
27. Curran JP, Behbahani M, Kim BH, Parlamis N. Ectopic gastric duplication cyst in an infant. Clin Pediatr. 1984;23:50-2. [ Links ]
28. Dittrich JR, Spottswood SE, Jolles PR. Gastric duplication cyst. Scintigraphy and correlative imaging. Clin Nucl Med. 1997;22:93-6. [ Links ]
29. Rullier E, Carles J, Zerbib F, Chaussende C, Saric J. Gastric duplication or pancreatic pseudocyst. Diagnostic difficulties apropos of a case. Gastroenterol Clin Biol. 1996;20:200-3. [ Links ]
30. Bidwell JK, Nelson A. Prenatal ultrasonic diagnosis of congenital duplication of the stomach. J Ultrasound Med. 1986;5:589-91. [ Links ]
31. Steiner Z, Mogilner J. A rare case of completely isolated duplication cyst of the alimentary tract. J Pediatr Surg. 1999;34:1284-6. [ Links ]
32. Ford WDA, Guelfand M, López PJ, Furness ME. Laparoscopic excision of a gastric duplication cyst detected on antenatal ultrasound scan. J Pediatr Surg. 2004;39:E38-40. [ Links ]
33. Ferrari AP, Van Dam J, Carr-Locke DL. Endoscopic needle aspiration of a gastric duplication cyst. Endoscopy. 1995;27:270-2. [ Links ]
34. Wang JY, Huang TJ, Hsieh JS, Huang YS, Huang CJ, Hou MF, et al. Gastric duplication cyst: report of a case. Kaohsiung J Med Sci. 1998;14:121-5. [ Links ]
35. Yu IP, Luo HS, Wang XZ. Endoscopic treatment of submucosal lesions of the gastrointestinal tract. Endoscopy. 1992;24:190-3. [ Links ]
36. Pacher K, Fluckiger R, Schaub N, Wegmann W, Huber A. Duplication cyst of the stomach antrum as the cause of an acute gastric emptying disorder in an adult. Dtsch Med Wochenschr. 1998;123:621-5. [ Links ]
37. Gupta S, Sleeman D, Alsumait B, Abrams L. Duplication cyst of the antrum: a case report. Can J Surg. 1998;41:248-50. [ Links ]
38. Martinez Ferro M, Scheri H, Bailez M. Resolución laparoscópica de una duplicación gástrica. Revista de Cirugía Infantil. 1999;9:2. [ Links ]
39. Machado MA, Santos VR, Martino RB. Laparoscopic resection of gastric duplication: successful treatment of a rare entity. Surg Laparosc Endosc Percutan Tech. 2003;13:268-70. [ Links ]
40. Sasaki T, Shimura H, Ryu S. Laparoscopic treatment of a gastric duplication cyst: report of a case. Int Surg. 2003;88:68-71. [ Links ]
41. Tayar C, Brunetti F, Tantawi B. Laparoscopic treatment of an adult gastric duplication cyst. Ann Chir. 2003;128:105-8. [ Links ]
Manuscrito recibido el 7 de junio de 2006 y aceptado para publicación el 28 junio de 2006.
Correspondencia:
Dr. José De Vinatea De Cárdenas
San Ignacio de Loyola 476, Dpto 302
Lima 18, Perú
Correo-e: jomal@terra.com.pe