Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.67 n.3 Lima jul.- sep. 2006
Capacidad antioxidante de la sangre de grado (Croton palanostigma) sobre la mucosa gástrica, en animales de experimentación
Miguel Sandoval 1, Salomón Ayala 1, Raquel Oré 1, Amalia Loli 2, Óscar Huamán 3, Rubén Valdivieso 1, Elsa Béjar 4
1 Centro de Investigación de Bioquímica y Nutrición Alberto Guzmán Barrón. Facultad de Medicina, UNMSM. Lima, Perú.
2 Departamento Académico de Enfermería. Facultad de Medicina, UNMSM. Lima, Perú.
3 Departamento Académico de Ciencias Dinámicas, Sección Bioquímica. Facultad de Medicina, UNMSM. Lima, Perú.
4 Colaboradora. Facultad de Medicina, UNMSM. Lima, Perú.
Resumen
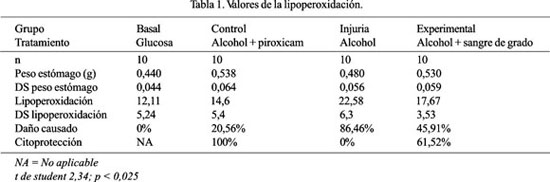
Introducción: El uso de la sangre de grado para el tratamiento de la gastritis y úlceras gástricas se realiza de manera empírica. En investigaciones anteriores hemos observado su capacidad cicatrizante y protectora de la mucosa gástrica, por la estimulación de la secreción de moco, secreción del jugo gástrico sin alterar el pH e incremento de la actividad péptica; por sus componentes, podría además tener capacidad antioxidante, lo que potenciaría su actividad citoprotectora. Objetivo: Determinar la capacidad antioxidante de la sangre de grado (Croton palanostigma) sobre la mucosa gástrica en animales de experimentación, por la prueba de TBARS. Diseño: Estudio prospectivo, analítico-experimental y longitudinal. Lugar: Centro de Investigación de Bioquímica y Nutrición Facultad de Medicina UNMSM. Material biológico: Cuarenta ratas albinas machos, entre 220 a 250 g de peso, distribuidas en 4 grupos. Intervenciones: Previo ayuno sólido de 24 h, se administró a las ratas por canulación orogástrica, en dosis única, del modo siguiente: Grupo basal: glucosa 37,5 kcal/kg de peso. Grupo injuria: alcohol 37,7 kcal/kg en glucosa. Grupo control: alcohol 37,7 kcal/kg con piroxicam 10 mg/kg en glucosa. Grupo experimental: alcohol 37,7 kcal/kg con sangre de grado 0,8 mL/kg, en solución de glucosa. Los animales tuvieron agua para consumo ad libitum. Seis horas después, bajo anestesia con éter vaporizado, se practicó una cirugía abdominal, se extrajo el estómago y se obtuvo la porción glandular, se separó una porción representativa de aproximadamente 0,5 g. El tejido gástrico fue homogenizado con buffer fosfato de sodio 50 mmol/L, a pH 7,4. Se determinó la lipoperoxidación midiendo sustancias reactivas al ácido tiobarbitùrico (TBARS), por método espectrofotométrico a 535 nm y se expresó en nmol/gramo de tejido gástrico. Principales medidas de resultados: Capacidad antioxidante de la sangre de grado (Croton palanostigma) sobre la mucosa gástrica, en animales de experimentación. Resultados: La lipoperoxidación en el grupo basal fue 12,11 + 5,24; grupo injuria 22,58 + 6,3; del grupo control 14,60 + 5,4; grupo experimental 17,67 + 3,53. La t de student 2,34 con p<0,025 muestra diferencia significativa. Conclusiones: En nuestras condiciones experimentales, la admnistración de sangre de grado por vía orogástrica, tiene efecto antioxidante sobre la mucosa gástrica, pues se observa menor lipoperoxidación, respecto al grupo de injuria, por administración de alcohol, lo que potencia su acción citoprotectora.
Palabras clave: Sangre de grado; Croton palanostigma; mucosa gástrica; antioxidante; gastritis.
Antioxidant capacity of sangre de grado (Croton palanostigma) on gastric mucosa in experimentation animals
Abstract
Introduction: Sangre de grado use in gastritis and gastric ulcer treatment is done empirically. In previous investigations we have observed sangre de grado both gastric mucosa healing and protection capacity by stimulating mucous secretion, gastric juice secretion without pH change, and increase in peptic activity; due to its components it may have also antioxidant capacity, thus strengthening its citoprotector activity. Objective: To determine sangre de grado (Croton palanostigma) antioxidant capacity on gastric mucosa in experimentation animals by using TBARS test. Design: Prospective, analytic-experimental and longitudinal study. Setting: Biochemistry and Nutrition Research Center, Faculty of Medicine, UNMSM. Biologic material: Forty male albino rats between 200 and 250 g. Interventions: Following 24 hours solid food fasting, the rats received by orogastric cannulation and in unique dose the following: Basal group: glucose 37,5 kcal/kg. Alcohol supplied group: alcohol 37,7 kcal/kg in glucose solution. Control group: alcohol 37,7 kcal/kg with piroxicam 10 mg/kg in glucose solution. Experimental group: alcohol 37,7 kcal/kg plus sangre de grado 0,8 mL/kg in glucose solution. All animals received water ad libitum. Six hours afterwards, abdominal surgery was practiced under vaporized ether anesthesia, the stomachs were extracted and a representative portion of approximately 0,5 g of their glandular portions was obtained. The gastric tissue was homogenized with buffer sodium phosphate 50 mmol/L, at 7,4 pH. Lipoperoxidation was determined by measuring substances reactive to thiobarbituric acid (TBARS), via espectrofotometry at 535 mm, finally expressed by gastric tissue gram. Main outcome measures: Sangre de grado (Croton palanostigma) antioxidant capacity on gastric mucosa in experimental animals. Results: Lipoperoxidation was as follows: basal group 12,11 + 5,24, alcohol supplied group 22,58 + 6,3, control group 14,60 + 5,4, experimental group 17,67 + 3,53. Student t was 2,34, with p<0,025 showing significative difference. Conclusions: In experimental conditions, the orogastric administration of sangre de grado had antioxidants effects on gastric mucosa; lower lipoperoxidation in the alcohol supplied group indicated cytoprotective action.
Key words: Sangre de grado; Croton palanostigma; gastric mucose; antioxidants; gastritis.
INTRODUCCIÓN
La sangre de grado, látex del Croton palanostigma, es un producto de nuestra amazonía usado por etnias nativas y difundido en diversas regiones del Perú, así como en otras latitudes, pues es un producto natural que ha traspasado las fronteras como una medicina natural efectiva. Se le conoce de diferentes maneras, como sangre de grado, sangre de drago o sangre de dragón; se le usa de manera curativa como cicatrizante, aplicándolo directamente sobre la herida en la piel, en mordeduras de arañas, en abrasiones y ampollas. Se ha observado, en la medicina tradicional, su efecto sobre la inflamación y edema. Su mayor utilidad está muy difundida, usándolo en las gastritis y úlceras gástricas, así como un coadyuvante en el tratamiento de las infecciones intestinales.
La sangre de grado, o sangre de dracón u otros nombres populares como se le conoce a la savia del árbol del Croton palanostigma, es un líquido de color y densidad parecido con la sangre, existiendo además látex de otras plantas, variedades como Croton lechleri, Croton urucurama, Croton echinocarpus y Croton draconico, cuyas propiedades medicinales son semejantes (1,2). El croton es un árbol de tallo elevado, sin ramificaciones a media altura, únicamente en copa. El nombre de la savia se debe al parecido con la sangre humana. Para obtenerla, se practica incisiones transversales sobre la corteza, por donde fluye y se recolecta en recipientes en el extremo terminal del corte (1-3). La sangre de grado es una resina de sabor astringente, está compuesta por sustancias diversas como heterósidos, tanino, ácido benzoico, celulosa, resina dragocoresina -compuesta por ésteres de alcohol resínicos y ácido benzilacético y alcaloides, entre los que resalta la taspina (1).
Se conoce de sus propiedades protectoras frente a la injuria aguda de la mucosa gástrica (4-6), así como su poder cicatrizante, habiéndose estudiado principalmente C. lecleri (7,8). En la actualidad, existe la tendencia a rescatar las bondades de los productos naturales en el tratamiento de diversas enfermedades y entre ellas las del aparato digestivo, que se encuentran entre los cinco principales registros de defunciones en el Perú (9).
Existen estudios de otras plantas como las de Musa spientum (el plátano) o como de Brassicca oleracea (la col) (10,11) la cual es usada actualmente como anti-ulceroso (gafarnate) (12), así como el efecto protector de la mucosa gástrica de la sangre de grado (6).
Por nuestras investigaciones, sabemos que el efecto protector de la sangre de grado del árbol Croton palanostigma, se debe en gran medida a la estimulación de la formación de moco que produce, cuando se le aplica directamente sobre la mucosa gástrica (13), con la característica de la presencia de grupos SH-no proteicos en el moco, que le confieren mayor capacidad protectora (14). De la misma manera, hemos estudiado las características del jugo gástrico tras la aplicación de la sangre de grado en la mucosa gástrica, habiéndose observado estimulación de su secreción, así como mayor actividad péptica, sin alteración del pH del medio (15).
Se ha descrito también el mecanismo de acción cicatrizante de la sangre de grado mediante la purificación de su principio activo denominado taspina (16), la cual tiene un efecto directo sobre la migración celular y la síntesis de colágeno, lo que activa la cicatrización (17), así como su actividad anti inflamatoria (18).
Entre otros compuestos presentes en la sangre de grado, encontramos antivirales como el SP-303, el cual es un oligómero de proantocianidina, que tiene una actividad contra una variedad de cepas de laboratorio de virus ADN y ARN entre ellos el virus sincitial respiratorio (RSV) y el virus de la influenza; tiene además actividad inhibitoria contra los tipos 1 y 2 del virus del herpes (HSV) y los virus de la hepatitis A y B. Además, la sangre de grado, contiene otras proantocianidinas que contiene como el 3-O-metilcedrusina (neolignano), procianidina B-1, procianidina B-4, catequiza, epicatequina y galocatequina, que le confieren su rol de prevención en enfermedades (19,20).
Por sus componentes, pensamos que la sangre de grado puede también tener actividad protectora contra los radicales libres y otros agentes antioxidantes, lo que genera esta investigación.
MATERIALES Y MÉTODOS
Por sus características, se desarrolló el estudio bajo un diseño de investigación básica, prospectiva, analítica-experimental y longitudinal.
Para determinar la capacidad antioxidante de la sangre de grado (Croton palanostigma) por la prueba de TBARS, sobre la mucosa gástrica en animales de experimentación, se usó 40 ratas albinas machos, de 220 a 250 g de peso. Los animales fueron divididos aleatoriamente en cuatro grupos, como se muestra a continuación:
- Grupo basal: glucosa 37,5 kcal/kg de peso.
- Grupo injuria: alcohol 37,7 kcal/kg en glucosa.
- Grupo control: alcohol 37,7 kcal/kg con piroxicam 10 mg/kg en glucosa.
- Grupo experimental: alcohol 37,7 kcal/kg con sangre de grado 0,8 mL/kg, en solución de glucosa.
Todos los productos químicos usados fueron de grado reactivo, químicamente puros, de marca comercial. Entre otros, se utilizó ácido clorhídrico, ácido tricloroacético, ácido tiobarbitúrico, éter dietílico, glucosa, cloruro de sodio, alcohol, piroxicam. Se usó agua destilada, para todas las diluciones.
Los animales fueron distribuidos en número de 10 para cada grupo. A todos ellos se les colocó en ayuno sólido por 24 horas, con abastecimiento de agua ad libitum, para mentener la vía digestiva libre de interferencias. Todos fueron pesados y se calculó la cantidad de glucosa, a partir de una solución preparada al 50% en agua, para una dosis de glucosa 37,5 kcal/kg de peso, y se aplicó por vía orogástrica por canulación.
Para los animales del grupo injuria, ésta se realizó con alcohol etílico, en cantidad equivalente a 37,7 kcal/kg, administrada por canulación orogástrica.
Al grupo control se les administró alcohol etílico equivalente a 37,7 kcal/kg con piroxicam 10 mg/kg, por vía orogástrica, para establecer el patrón de comparación de protección.
Para el grupo experimental, se seleccionó 10 animales de manera aleatoria y se les administró por canulación orogástrica alcohol etílico 37,7 kcal/kg de peso con sangre de grado 0,8 ml/kg, en solución de glucosa.
Todos los animales, 6 horas después del tratamiento de la canulación fueron sometidos a una cirugía abdominal, para lo cual fueron anestesiados con éter vaporizado en una campana hermética de vidrio; se localizó el estómago y se le extrajo. Se procedió a abrir el órgano por la curvatura mayor y se lavó dos a tres veces en solución de cloruro de sodio al 0,9 g%o ; se obtuvo una porción a partir de la zona glandular y se pesó, recortando hasta obtener un peso aproximado de 0,5 g.
El tejido fue llevado a un homogenizador de teflón, con cantidad suficiente para 5 mL de solución buffer fosfato de sodio a pH 7,4, a concentración 50 mmol/L; para su homogenización, se utilizó una velocidad de 300 rpm. El tejido homogenizado fue separado en tubos de ensayo, para la determinación de las especies reactivas del ácido tiobarbitúrico.
La lipoperoxidación fue medida a través de las especies reactivas del ácido tiobarbitúrico (TBARS). Las TBARS fueron cuantificadas por el método de Buege y Aust, (21) usando un coeficiente de extinción molar de 1,56 x 105 mol-1 cm-1, que representa los niveles de malondialdehido, un producto final de lipoperoxidación (22). Se procedió de acuerdo al método espectrofotométrico descrito por Schemedes y col (23), basado en la reacción del ácido tiobarbitúrico (TBA) con el grupo aldehido del compuesto malonaldehido, formando un producto (TBA-MDA) cromóforo rosado, con un máximo de absorción a 535 nm (23).
Para el cálculo del daño causado, se estimó como 100% el valor de la lipopero-xidación del grupo basal y se calculó el daño encontrando el porcentaje de la diferencia del valor de lipoperoxidación caso menos lipoperoxidación basal.
Para el cálculo de citoprotección, se realizó las siguientes operaciones: ((lipope-roxidación sangre grado – lipoperoxidación máxima)/lipoperoxidación basal)*100 y a lo encontrado se le sumó 100. Se tomó arbitrariamente la citoprotección del grupo control (con piroxicam), como el grupo con citoprotección total.
La diferencia observada entre la lipope-roxidación del grupo injuria (con alcohol) y el grupo experimental (alcohol con sangre de grado) fue sometida a la prueba de t de student, para un nivel de significancia del 95% y un p 0,05.
RESULTADOS
Los resultados de los valores de la lipoperoxidación fueron expresados como resultados de la prueba de TBARS por gramo de tejido tratado (Tabla 1).
DISCUSIÓN
En la actualidad, dadas las bajas condiciones económicas y la poca accesibilidad de la población de escasos recursos a las instituciones de salud, surge como una opción la medicina natural y alternativa, las cuales revaloran el uso de plantas medicinales con acciones paliativas, preventivas o curativas sobre algunas afecciones o síntomas. En muchos de estos casos, los tratamientos son empíricos y carecen de fundamentación científica. Dentro de estos productos se encuentra la sangre de grado, producto natural de nuestra amazonía, que, dadas sus bondades desinflamantes, cicatrizantes y antiulcerosas, lo convierten en un producto industrializable y exportable, lo cual generaría una actividad económica alternativa que beneficiaría especialmente a los pobladores de la región amazónica.
Hemos citado las bondades de la sangre de grado y los indígenas de las comunidades amazónicas, donde nunca existió una universidad, instituto, laboratorio o bibliotecas, supieron usar durante siglos este látex para curarse de diversas enfermedades, usándolo como desinfectante para curar males de la garganta (solución acuosa del látex), diarreas, herpes viral, úlceras internas y heridas en general, pero sobre todo como cicatrizante en heridas y úlceras y también como anticonceptivo; uso que aún utilizan las mujeres en edad fértil en las zonas urbano-marginales de Iquitos.
En la actualidad, existe evidencia contundente que indica que los radicales libres causan daño oxidativo a los lípidos, proteínas y ácidos nucleicos. Los radicales libres se encuentran naturalmente en el cuerpo humano como un subproducto del metabolismo y pueden ser generados por los macrófagos como parte del proceso de fagocitosis. También, se pueden formar por exposición a radiación, humo del tabaco, ciertos contaminantes, disolventes orgánicos, pesticidas e inclusive durante el ejercicio intenso. Los radicales libres tienen que ver con la etiología o historia natural de muchos padecimientos, como el cáncer y enfermedades cardiacas, vasculares y neuro-degenerativas. Por lo tanto, los antioxidantes, que pueden neutralizar a los radicales libres, pueden ser de vital importancia en la prevención de estas enfermedades.
La capacidad antioxidante de muchos compuestos fenólicos ha sido estudiada recientemente con un gran interés. Muchos investigadores han investigado la actividad antioxidante de los flavonoides y han tratado de relacionar esta actividad con su estructura. Los flavonoides son compuestos polifenólicos, con un esqueleto de 15 átomos de carbono, con un anillo bencénico fusionado a un anillo cromano (C), que está unido a su vez a un segundo anillo aromático (B) en la posición 2, 3 ó 4.
La presencia de grupos o-dihidroxi en el anillo B, de un doble enlace entre los carbonos 2 y 3, junto con un 4-oxo en el anillo C, y de grupos hidroxilo en los carbonos 3 y 5, junto con el 4-oxo en los anillos A y C, ha sido asociada con actividad antioxidante. Parece que los ácidos fenólicos, como el cafeico, clorogénico, ferúlico, sinápico y p-cumárico, son antioxidantes más activos que los derivados hidroxilados del ácido benzoico, como el p-hidroxibenzoico, vanílico y siríngico. Muchos de los flavonoides presentan una gama de efectos biológicos, como actividades antibacterianas, antivirales, anti-inflamatorias, antialérgicas, antitrombóticas y vasodilatadoras. La actividad antioxidante es una propiedad importante para la vida. Muchas de las funciones biológicas, como la antimutagenicidad, anticarcinogenicidad y retraso del envejecimiento, derivan de la capacidad antioxidante.
Como señalan Rozowski y cols. (24), otro aspecto que puede afectar los valores de TBARS es el consumo de alcohol. En su trabajo de investigación, la información se obtuvo durante la encuesta, pero no hubo un énfasis especial en esta pregunta. Ha sido informado que el consumo de alcohol se relaciona positivamente con los niveles de TBARS (24). Es por ello que, los valores de la prueba TBARS es un reflejo de la lipoperoxidación, agresión del alcohol. Tal como se observa en nuestros resultados, la lipoperoxidación fue mayor en el grupo de animales a los que se administró alcohol solo, que en el grupo a los que, además de alcohol, se le administró simultáneamente sangre de grado. El alcohol en ratas se usa para lograr efectos controlados (25,26).
La citoprotección que confiere la sangre de grado lo realiza también mediante la formación de una capa de protección física a la mucosa, como lo hacen algunos fármacos, como el sucralfato (27,28), y la presencia de grupos sulfhidrilos en la mucosa (29).
El piroxicam es un fármaco que actúa impidiendo la formación de prostaglandinas en el organismo, ya que inhibe a la enzima ciclooxigenasa. Las prostaglandinas se producen en respuesta a una lesión o a ciertas enfermedades y provocan inflamación y dolor. El piroxicam reduce la inflamación y el dolor y su mecanismo de acción se asocia a la inhibición que logran los anti-inflamatorios no esteroideos (Aines) sobre la enxima COX II, y como consecuencia inhibe la síntesis de prostaglandinas, como PgE2 y PgI2, responsables de las respuestas inflamatorias en los tejidos. Los estudios realizados con diversos Aines en ratas muestran que el piroxicam fue el que obtuvo mejores resultados observables en un tiempo de 6 horas, esquema que nosotros hemos seguido, así como la demostración in vitro de la capacidad antioxidante a radicales libres del oxígeno, peroxido e hidroxilo (30).
Entonces, encontramos congruencia en nuestros resultados, al observar que el grupo control (alcohol con piroxicam) fue el que observó niveles menores de TBARS, de tal manera que nos permite comparar los resultados entre el grupo al que se le administró alcohol solo con el grupo al que el alcohol fue administrado con sangre de grado, denotando que el nivel de citoprotección fue de 61,52% y, si bien hubo efecto del alcohol provocando un daño de 86,46% en el tejido, medido por la prueba TBARS, fue menor en el grupo al que se les administró alcohol y sangre de grado, en el que fue 45,91%. Esto nos muestra la actividad antioxidante que generó la sangre de grado en la mucosa gástrica de los animales de experimentación, por estas razones además de otras y expuestas, el látex del árbol de croton, conocido como sangre de grado, parte de nuestra riqueza de la biodiversidad peruana, es potencialmente fuente de recurso económico para la zona amazónica (31).
En nuestras condiciones experimentales, podemos concluir que la admnistración de sangre de grado por vía orogástrica, tiene efecto antioxidante sobre la mucosa gástrica, al observar menor lipoperoxidación, respecto al grupo de injuria, por administración de alcohol, lo que potencia su acción citoprotectora.
AGRADECIMIENTOS
Al Consejo Superior de Investigaciones de la UNMSM, por la financiación del proyecto de investigación.
A Katia Sandoval Pajuelo, por la elaboración del abstract.
REFERENCIAS BIBLIOGRÁFICAS
1. Arellano P. El libro verde. Guia de recursos terapeuticos vegetales. Lima: Ministerio de Salud; 1992. p. 33,46,53. [ Links ]
2. Estrella E. Planta medicinales amazónicas. Tratado de Cooperación amazónica. Lima: Cooperación amazónica; 1995. p. 210,212. [ Links ]
3. Barriga R. Plantas útiles de la Amazonía peruana. Lima: CONCYTEC; 1994. [ Links ]
4. Tapia SB, Principe H, Rachumi M. Estudio controlado del efecto preventivo y terapéutico de Croton palanostigma, Aloe vera y Omepraszol, sobre lesiones gástricas inducidas por etanol en ratas albinas. Congreso Peruano de Gastroenterología; 1996 julio. Lima: Sociedad Peruana de Gastroenterología; 1996. [ Links ]
5. Málaga E. Efecto del clorhidrato de taspina sobre la curación de úlcera gástrica inducida en ratas [Tesis de Bachiller en Biología]. Lima: Universidad Peruana Cayetano Heredia; 1991. [ Links ]
6. Ayala S, Díaz D, Palomino M, Armas S, Paz J. Efecto protector de Croton palanostigma y Aloe vera frente a la injuria aguda de mucosa gástrica inducida por etanol en ratas. An Fac Med Lima. 1999;60(1):22-9. [ Links ]
7. López-Neira L. Elaboración de una farmacéutica de aplicación tópica con efecto cicatrizante a partir del extracto atomizado del látex de sangre de drago [Tesis Químico Farmacéutico]. Lima: Universidad Nacional Mayor de San Marcos; 1999. [ Links ]
8. Lapa A, Badilla B, Mora G. Anti-inflammatory activity of Urera baccifera (Urticaceae) in Sprague-Dawley rats. Rev biol trop. 1999;47(3):365-71. [ Links ]
9. Instituto Nacional de Estadística e Informática (INEI). Perú compendio estadístico 2005. Sistema Nacional de Estadística. Lima: INEI; 2005. [ Links ]
10. Sanyal AK, Das PK, Sinha S, Sinha YH. Banana and gastric secretion. J Pharmacology. 1961;13:318-9. [ Links ]
11. Sanyal AK, Burnerjee CR, Das PK. Studies on peptic ulceratrion – Part II. Role of banana in restraint and pregnisolone induced ulcer in albino rats. Arch Intern Pharmacodynamie ther. 1965;155:244-8. [ Links ]
12. Adami E, Marzzi-Uberti E, Turba C. Pharmacological reserch on gafarmate, a new synthetic isopenoid with an antiulcer actino. Arch Intern Phasmacodynamie ther. 1964;147:113-45. [ Links ]
13. Sandoval M, Ayala S, Oré R, Arroyo J. Inducción de la formación de moco gástrico por sangre de grado Croton palanostigma. An Fac Med Lima. 2002;63(4):251-6. [ Links ]
14. Sandoval M, Ayala S, Oré R, Ricra V, Ugarte G. Incremento del moco gástrico y reducción de grupos sulfidrilo no proteicos por estimulación con sangre de grado de Croton palanostigma. An Fac Med Lima. 2004;65(Suppl 1):21. [ Links ]
15. Sandoval M, Ayala S, Oré R, Ricra V, Durand J, Ugarte G. Estimulación de la actividad péptica del jugo gástrico, inducida por látex de Croton palanostigma (sangre de grado). An Fac Med Lima. 2003;64(Suppl 1):24. [ Links ]
16. Milla ME. Estudio sobre el mecanismo de acción del principio activo taspina de sangre de grado [Tesis Bachiller en Biología]. Lima: Universidad Peruana Cayetano Heredia; 1985. [ Links ]
17. Goñi-Morgan MA. Efecto del alcaloide taspina de la sangre de grado sobre la migración celular y síntesis de colágeno en células 3T3 [Tesis de Bachiller en Biología]. Lima: Universidad Peruana Cayetano Heredia; 1987. [ Links ]
18. Pieters L, De Bruyne T, Claeys M, Vlietinck A, Calomme M, Vanden Berghe D. Isolation of a dihidrobenzofuran lignan from south American dragons blood (croton ssp) as an inhibitor of cell proliferation. University of Antwerp, Belgium, J Natural Products. 1993;56(6):899-906. [ Links ]
19. Ubillas R, Jolad SA, Bruening RC, Kernan MR, King SR, Sesin DF, et al. SP-303, an antiviral oligomeric proanthocyanidin from the latex of Croton lechleri (sangre de drago). Phytomedicine. 1994;1:77-106. [ Links ]
20. Sandoval M, Okuhama N, Lao J, Angeles F, Miller M. Plantas Medicinales como fuente de antioxidantes naturales. Rol en la prevención de enfermedades y salud humana. 1º Congreso Internacional FITO 2000. 2000-09-27. Lima, Perú; 2000. [ Links ]
21. Buege JA, Aust SD. Microsomal lipid peroxidation. Methods Enzymol. 1978;52:302-10. [ Links ]
22. Schuh J, Faitclough CF, Haschemeyer RH. Oxigen mediated heterogeneity of apoprotein low density lipoprotein. Proc Natl Acad Sci USA. 1975;volumen:3173-7. [ Links ]
23. Schemedes A, Holmer G. A new TBA method for determining free MDA and hydroperoxides selectively as a measure of lipid peroxidation. JAOCS. 1987;66:813-7. [ Links ]
24. Rozowski J, Cuevas A, Castillo O y col. Diferencias en antioxidantes plasmáticos según nivel socioeconómico en mujeres chilenas. Rev Méd Chile. 2001;129(1):43-50. [ Links ]
25. Gutierrez C, Raynal A. Gastroprotective effect of intragastric clarithromtycin against damage induced by etanol in rats. Digestive Diseases and Sciences. 1999;44(8):1721-31. [ Links ]
26. Ndoh K, Baker M, Leung FW. Mechanism of untragastric nicotine protection against ethanol-induced gastric injury. Digestive Diseases and Sciences. 1991;36(1):39-46. [ Links ]
27. Harrington SJ, Schelegel JF, Code CF. The proctective effect os sucraltate on the gastric mucosa of rats. J Clin Gastroenterol. 1981;3:129-34. [ Links ]
28. Nagashima R, Hashino E, Hinohara Y, Sakai K, Haa S, Nakano H. Effect of sucralfate on etanol induced gastric munosal damage in the rat. Scand J Gastroenterol. 1983;3(suppl 83):17-20. [ Links ]
29. Szabo S, Trier JS, Frankel JW. Sulfhydryl compounds may mediate gastric cytoprotection. Science. 1981;214(9):200-2. [ Links ]
30. Desmarchelier C, Schaus W, Coussio J, Cicca G. Efects of sangre de drago from Croton Lechleri Muller-Arg. On the production of active oxygen radicals. Journal of Enthnopharmacology. 1997;58:103-8. [ Links ]
31. Álvaro MR. Meza E. Desarrollando nuestra diversidad biocultural: Sangre de grado y el reto de su producción sustentable en el Perú. Lima: Universidad Nacional Mayor de San Marcos; 1999. [ Links ]
Manuscrito recibido el 08 de setiembre de 2006 y aceptado para publicación el 29 setiembre de 2006.
Correspondencia:
Miguel Sandoval Vegas
Centro de Investigación de Bioquímica y Nutrición,
Facultad de Medicina UNMSM.
Av.Grau 755. Lima 1, Perú.
Correo-e: mhsave@gmail.com