Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.68 n.3 Lima sep. 2007
Comunicaciones Cortas
Evaluación de la actividad larvicida del metopreno (Altosid)® sobre mosquitos vectores, en un área de alta transmisión
Methoprene (Altosid)® larvicide's activity determination on vector mosquitoes in a high transmission area
Julia Castro 1, Duber Díaz 1, Germán Correa 2, Fátima Medina 3
1 Instituto de Investigación de Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas - Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Sub-Región de Salud de Madre de Dios, Centro de Investigación Biológica para el Desarrollo Amazónico (CIBDA). Lima, Perú.
3 Facultad de Ciencias Matemáticas - Universidad Nacional Mayor de San Marcos. Lima, Perú.
Resumen
Objetivos: Determinar la actividad larvicida de la hormona reguladora de crecimiento metopreno. Diseño: Estudio experimental. Lugares: Instituto de Investigación de Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Sub-Región de Salud de Madre de Dios. Centro de Investigación Biológica para el Desarrollo Amazónico. Material biológico: Larvas de Aedes aegypti en estadios III y IV. Intervenciones: Se realizó 3 bioensayos de laboratorio para evaluar la actividad larvicida de la hormona reguladora de crecimiento metopreno (Altosid)® sobre 7 000 larvas de Aedes aegypti, en los estadios III y IV, a nivel de laboratorio y sobre criaderos naturales de Anopheles benarrochi. La población larval se obtuvo de los criaderos ubicados en las comunidades de La Cachuela, La Joya y Las Piedras, situadas en la provincia de Tambopata (Puerto Maldonado), departamento de Madre de Dios. La actividad larvicida se determinó con 2 dosis del metopreno, 0,004 y 0,008 g/L. Se realizó los bioensayos por triplicado, utilizando agua de criadero. Para determinar la eficacia y susceptibilidad, se hizo lecturas a las 24, 48, 72 y 96 horas después del tratamiento. Principales medidas de resultados: Actividad larvicida del metopreno. Resultados: Se obtuvo una mortalidad de 85,2% y 92%, para las diluciones de 0,004 y 0,008 g/L, en el laboratorio y en los criaderos naturales, respectivamente. La dosis letal media (DL50) fue 0,0018, 0,0014, 0,0017 y 0,0012 g/L, a las 24, 48, 72 y 96 horas, respectivamente. La aplicación sobre los criaderos se realizó con la dosis de 0,008 g/L de metopreno, obteniéndose una DL50 de 0,0056, 0,0048, 0,0034 y 0,0025 g/L a las 24, 48, 72 y 96 horas, respectivamente. La DL90 fue de 0,0098, 0,0086 g/L, 0,008 g/L y 0,0070 g/L, a las 24, 48, 72 y 96 horas, respectivamente, obteniéndose a las 96 horas 100% de mortalidad. Conclusiones: La máxima efectividad del metopreno fue con la dosis 0,008 g/L y a las 96 horas.
Palabras clave: Aedes; anopheles; metopreno; culicidae; hormona del crecimiento.
Abstract
Objectives: To determine growth regulating hormone methoprene larvicide's activity. Design: Experimental study. Setting: Instituto de Investigacion de Ciencias Biologicas Antonio Raimondi, Facultad de Ciencias Biologicas, Universidad Nacional Mayor de San Marcos. Sub-Region de Salud de Madre de Dios. Centro de Investigacion Biologica para el Desarrollo Amazonico. Biologic material: Stages III and IV Aedes aegypti larves. Interventions: Three laboratory bioessays were done to determine regulating hormone methoprene (Altosid)® on 7 000 stages III and IV Aedes aegypti larves, in the laboratory and in Anopheles benarrochi natural breeding places. Larval population was obtained from breeding places located in La Cachuela, La Joya and Las Piedras communities, Tambopata province (Puerto Maldonado), Madre de Dios department. Larvicide activity was determined by 2 methoprene doses, 0,004 and 0,008 g/L. Bioessays were done by triplicate using breeding places water. Readings at 24, 48, 72 and 96 hours following treatment were done to determine both efficacy and susceptibility. Main outcome measures: Methoprene larvicide activity. Results: Mortality of 85,2% and 92% was obtained for 0,004 and 0,008 g/L dilutions, both at the laboratory and natural breeding places. Median lethal doses (LD50) were 0,0018, 0,0014, 0,0017 and 0,0012 g/L, at 24, 48, 72 y 96 hours respectively. Application on breeding places was done with 0,008 g/L methoprene dosis obtaining 0,0056, 0,0048, 0,0034 and 0,0025 g/L LD50 at 24, 48, 72 y 96 hours, respectively. LD90 was 0,0098, 0,0086 g/L, 0,008 g/L and 0,0070 g/L, at 24, 48, 72 and 96 hours respectively, obtaining 100% mortality at 96 hours. Conclusions: Maximum effectiveness was obtained with methoprene 0,008 g/L dose at 96 hours.
Key words: Aedes; anopheles; methoprene; culicidae; growth hormone.
INTRODUCCIÓN
En el Perú, el patrón de transmisión de las enfermedades metaxénicas ha cambiado, se ha vuelto inestable, estacional e hipoendémico, y se extiende hasta el 75% de la superficie del territorio, donde habitan cerca de 10 millones de peruanos. Con los programas de control de mosquitos vectores de enfermedades metaxénicas, basados solo en el uso de insecticidas residuales, la reemergencia de la malaria producida por P. falciparum alcanzó el 43,3% de todos los casos de la enfermedad, concentrándose más del 80% de casos en Tumbes, Piura, Loreto, Madre de Dios y Ayacucho ( 1 ).
La tendencia histórica de la malaria en el país muestra un sostenido incremento desde 1990. En 1998, durante el Fenómeno del Niño, se llegó a registrar la tasa más alta de los últimos 60 años y, desde 1993 hasta la actualidad, se observa un aumento marcado de casos de malaria por Plasmodium falciparum en la selva y costa norte del país, así como en los valles de la costa comprendidos entre 0 y 2 000 msnm y en los valles interandinos, por debajo de los 2 300 msnm ( 2 ).
La reemergencia del dengue y de la fiebre amarilla está directamente relacionada con la dispersión de los mosquitos Aedes aegypti y su resistencia frente al uso irracional de los insecticidas químicos. La emergencia del dengue hemorrágico en las Américas ocurrió en 1981, casi 30 años después de su aparición en Asia, y su incidencia está en aumento en los últimos años ( 3 ). La transmisión del dengue involucra a los mosquitos hembras del género Aedes, los que se infectan luego de picar a individuos virémicos, transmitiendo el virus por el resto de su vida ( 3 ).
En la última década, ha crecido el interés por utilizar estrategias creativas de control para afrontar el problema de las enfermedades metaxénicas, aplicando medidas adecuadas que provoquen menor impacto en el ambiente, sean sostenibles por su bajo costo, efectivas y de fácil ejecución, se adapten a la situación local y que permanezcan en el medio por largos periodos de tiempo ( 4 ).
Entre los métodos de control no tradicionales, se encuentran aquellos que utilizan imitadores de la hormona juvenil de crecimiento, que actúan sobre el desarrollo de algunos artrópodos. Dos insecticidas imitadores de la hormona juvenil son el metopreno -el cual presenta un estrecho parecido en su estructura con las hormonas juveniles- y el fenoxicarb ( 5 ). El primero actúa sobre la muda, permitiendo que la larva aumente de tamaño, pero sin evolucionar a crisálida ( 6 ), y además el metopreno altera la fisiología reproductiva normal, actuando como un método de control de la natalidad.
Se ha realizado estudios con metopreno en mosquitos australianos Aedes vigilax y Culex sitiens, obteniéndose una reducción significativa de su población ( 5 ). En Honduras, se ha estudiado como un larvicida biorracional en el control del Anopheles albimanus, vector de la malaria, demostrando una eficaz acción larvicida ( 7 ).
En 1996, Sithiprasasna et al. ( 8 ) determinaron que la exposición subletal del metopreno sobre larvas de IV estadio de Anopheles dirus afectó su fecundidad. Así mismo, se evaluó la influencia de hormonas inhibidoras en Musca domestica ( 9 ) y la resistencia a altas dosis de metopreno por Ochlerotatus nigromaculis ( 10 ).
La provincia de Tambopata es un área endémica de alta transmisión, que por su temperatura, latitud y humedad relativa favorecen el incremento de la densidad larvaria, facilitando la transmisión de las enfermedades metaxénicas ( 1 ). Es por eso que el presente estudio evalúa la actividad larvicida de un análogo de la hormona reguladora del crecimiento (metopreno), como un método alternativo de control de mosquitos vectores, tanto en criaderos naturales de Tambopata, como en bioensayos de laboratorio.
MÉTODOS
Se realizó la búsqueda de criaderos naturales permanentes de anofelinos y de aedinos, tanto en áreas urbana como en rurales, de las comunidades de La Cachuela, La Joya y Las Piedras, provincia de Tambopata (Puerto Maldonado), que se encuentran bajo la jurisdicción de la DISA Madre de Dios. Se anotó las características ecológicas del criadero, fauna y flora, tipo de criadero, dimensiones, densidad larvaria, polución del criadero y horario de evaluación (Tabla 1).
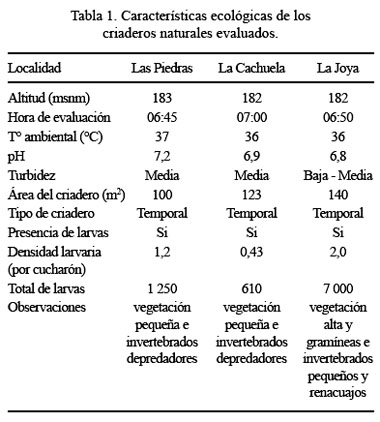
La temperatura ambiental fue 34 a 36 ºC, la precipitación pluvial varió entre 1,5 y 20,5 L/h, en áreas de 100 m2.
En cada criadero se determinó la densidad larvaria, por el método del cucharón (OMS, 1994) y se tomó muestras de agua, para el análisis físico-químico y bacteriológico. Para el establecimiento de la colonia de Aedes aegypti, la población blanco fue colectada entre las 06:30 - 07:00 horas en bandejas de plástico de 1 L, y las larvas fueron separadas por estadio evolutivo y mantenidas en agua de criadero a 26°C, con humedad relativa de 98%. Se alimentó las larvas cada 24 horas, con 1,5 g de harina de pescado, hasta que alcanzaron el estadio de pupa, donde fueron trasladados a los insectarios, para la obtención de adultos.
En la identificación taxonómica de los mosquitos, se utilizó las larvas de IV estadio y se siguió las claves entomológicas para adultos y estadios larvarios de Ghorham et al. ( 11 ), Consoli y De Olivera ( 12 ) y Calderón et al. ( 13 ).
El metopreno (Altosid) ® es una hormona juvenil sintética (C19H34O3) perteneciente a los larvicidas llamados reguladores de crecimiento, de toxicidad baja (LD-50 39 000 mg/kg de peso, vía oral), de solubilidad en agua de 1,39 ppm y soluble en solventes orgánicos.
Para la obtención del inóculo, se siguió la metodología de Sawby et al. ( 6 ), obteniéndose una solución stock con 0,1 g de metopreno diluido con 10 mL de acetona, que se homogenizó en un mortero. Se tomó 0,1 mL de esta solución y se diluyó en 9,9 mL de agua destilada, para obtener una concentración de 10-4 (0,01 µg).
Las dos dosis que se utilizó en los bioensayos de laboratorio fueron 0,004 g/L y 0,008 g/L. En los bioensayos se utilizó un inóculo de 1 mL por cada dosis y fue probado por triplicado, contra larvas de Aedes aegypti, según metodología descrita por Díaz et al. ( 14 ).
Se obtuvo un total de 7 000 larvas, que se dividió de la siguiente manera: 400 de estadio I; 800 larvas de estadio II; 3 450 de estadio III; y, 2 350 larvas de IV estadio. Se realizó los bioensayos en vasos de plástico, utilizando 4 vasos por dosis: 3 para la hormona y uno para el control de la prueba. A cada vaso se le agregó 30 mL de agua de criadero y lotes de 25 larvas de A. aegypti de I, II, III y IV estadios, completando un volumen total de 150 mL.
Para determinar la mortalidad larvaria, se realizó la cuantificación de la densidad larvaria inicial y se verificó diariamente los cambios ocurridos en la población estudiada. Las dosis letales media (DL50) y noventa (DL90) fueron determinadas según el método de Reed y Muench ( 15 ).
En los criaderos naturales, se determinó el área de cada criadero y se hizo el cálculo de la dosis para el número total de larvas de Anopheles benarrochi (7 000 larvas), teniendo en cuenta el área, profundidad y volumen total de cada criadero. Se utilizó 1120 mL de la dosis de 0,008 g/L de metopreno, de acuerdo con las observaciones de los bioensayos de laboratorio. Los recuentos de la mortalidad larvaria postratamiento se hizo cada 24 horas durante 5 días.
RESULTADOS
En el laboratorio se obtuvo una mortalidad de 85,2% de larvas de A. aegypti, por la actividad del metopreno, después de 96 horas de aplicación (Tabla 2).
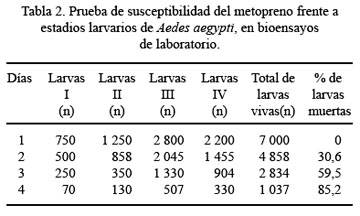
La mortalidad larvaria de A. benarrochi fue 92%, a las 96 horas de la aplicación (Tabla 3). Se observó que la flora y la fauna acompañante de los criaderos no sufrieron alteración durante la aplicación del metopreno.
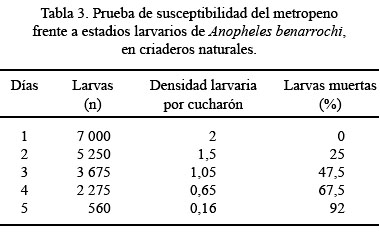
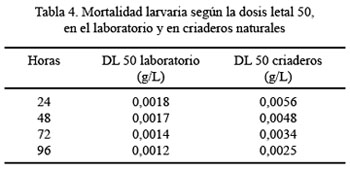
La dosis letal cincuenta (DL50), a las 24, 48, 72 y 96 horas postaplicación, en ambos tratamientos, se muestra en la Tabla 4. En condiciones de campo, la dosis letal noventa (DL90) fue 0,0098, 0,0086, 0,0080 y 0,0070 g/L, a las 24, 48, 72 y 96 horas, respectivamente.
DISCUSIÓN
La presencia de criaderos naturales de mosquitos vectores de malaria y dengue en Tambopata está relacionada con la presencia de factores ambientales que favorecen su permanencia, lo que constituye un factor de riesgo para la población. Además, en el país se viene utilizando los piretroides, desde 1994, evidenciándose que los vectores han desarrollado resistencia a estos compuestos ( 16 ).
El método larvicida de control alternativo utilizado en el presente estudio, con exposición de los vectores al metopreno, resultó en una mortalidad mayor al 85%, en larvas de Aedes aegypti, a las 96 horas postaplicación, con una dilución de 0,008 g/L, dilución por debajo que la usada por Ritchie y col. ( 5 ), que obtuvieron una mortalidad de 90% en Aedes vigilax, después de 192 horas de aplicación.
La susceptibilidad del metopreno en los criaderos de A. benarrochi alcanzó el 92% en 4 días y en el laboratorio se alcanzó el 85% sobre larvas de Aedes aegypti, a los 4 días postaplicación, mientras que Dave ( 17 ) reportó 70% a los 6 días de la aplicación del metopreno, a pesar de trabajar únicamente con la especie Aedes aegypti.
Sawby y col. ( 6 ) lograron determinar una mortalidad de 50% a los 6 días postaplicación en estadios larvales y pupales, en tanto que en el presente estudio se alcanzó una mortalidad mayor del 50%, a las 3 días de aplicación del metopreno. Los resultados obtenidos en este estudio permiten apreciar que con el metopreno se alcanza mortalidades larvarias mayores del 85%, a las 96 horas postratamiento.
En conclusión, se demuestra la eficacia del metopreno para controlar larvas de Aedes aegypti en el laboratorio y larvas de Anopheles benarrochi en criaderos naturales. La dosis de 0,008 g/L tuvo una mayor eficacia en ambos tratamientos, con mortalidades mayores del 85%, después de 96 horas de exposición. La DL50 y la DL90 del metopreno fueron efectivas, al demostrarse su alta sensibilidad y eficacia en los 4 días de tratamiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de Salud del Perú, Oficina General de Epidemiología. Semana Epidemiológica. Boletín Epidemiológico. 2005;(39):1-20. [ Links ]
2. Celis J, Montenegro R, Castillo O, Ché E, Baquerizo C, Mendoza M. Evolución de la malaria en la región Loreto. Rev Soc Per Med Int. 2003;16(2):58-63. [ Links ]
3. Organización Panamericana de la Salud. Dengue y dengue hemorrágico en las Américas. Guías para su prevención y control. Publicación Científica N° 548. Washington D.C.: OPS; 1991. p. 109. [ Links ]
4. Patz JA, Daszak P, Tabor GM, Aguirre AA, Pearl M, Epstein J, Wolfe ND, Kilpatrick AM, Foufopoulos J, Molyneux D, Bradley DJ; Working Group on Land Use Change and Disease Emergence.Unhealthy landscapes: policy recommendations on land use change and infectious disease emergence. Environmental Health Perspectives 2004 ;112: 1092-1098. [ Links ]
5. Ritchie SA, Asnicar M, Kay BH. Acute and sublethal effects of (S)-methoprene on some Australian mosquitoes. J Am Mosq Control Assoc. 1997;13(2):153-5. [ Links ]
6. Sawby R, Klowden M, Sjogren R. Sublethal effects of larval methoprene exposure on adult mosquito longevity. J Am Mosq Control Assoc. 1992;8(3):290-2. [ Links ]
7. Perich MJ, Boobar LR, Stivers JC, Rivera LA. Field evaluation of four biorational larvicide formulations against Anopheles albimanus in Honduras. Med Vet Entomol. 1990;4(4):393-6. [ Links ]
8. Sithiprasasna R, Luepromchai E, Linthicum KJ. Effects of sublethal dosages of methoprene on Anopheles dirus species A and B. J Am Mosq Control Assoc. 1996;12(3):483-6. [ Links ]
9. Ambros C, Montada D. Influencia de inhibidores de desarrollo sobre la reproducción de Musca domestica. Rev Cubana Med Trop. 1996;48(1):21-5. [ Links ]
10. Cornel A, Stanich M. High level methoprene resistence in the mosquito Ochleratus nigromaculis in Central California. Pest Manag Sci. 2002;58:791-8. [ Links ]
11. Ghorham J, Stojanovich C, Scott H. Clave ilustrada para los mosquitos anophelinos de Sudamérica Occidental. Mosq System. 1973;5(2):97-154. [ Links ]
12. Consoli R, De Olivera R. Principias mosquitoes de importancia sanitaria no Brasil. Rio de Janeiro: Ed. Fiocruz; 1994. p. 225. [ Links ]
13. Calderón F, Fernández L, Valle J. Especies de la fauna anophelina en su distribución y algunas consideraciones sobre su abundancia, infectividad e importancia en la transmisión de la Malaria en el Perú. Rev Per Epid. 1885;8(1):5-53. [ Links ]
14. Diaz D, Ibáñez Z, Gandolfo G, Castro S, Castro J. Evaluación de la actividad del metopreno como controlador de larvas de Aedes aegypti. Resúmenes XLVI Convención Nacional de Entomología. Arequipa, Perú. 2004. p. 136. [ Links ]
15. Reed LJ, Muench H. A simple method of estimating fifty percent endpoints. Am J Hyg. 1938;27:493-7. [ Links ]
16. Ministerio de Salud, Proyecto Vigía. Susceptibilidad de los vectores de malaria a los insecticidas en el Perú. Lima: MINSA; 2000. p.22. [ Links ]
17. Dave C. An evaluation of themephos in water drums in Trinidad, W.I. Mosquito News. 1984;44:51-3. [ Links ]
Manuscrito recibido el 08 de agosto de 2007 y aceptado para publicación el 21 de setiembre de 2007.
Correspondencia:
Dra. Julia Castro
Instituto de Investigación de Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas - Universidad Nacional Mayor de San Marcos
Ciudad Universitaria, Av. Venezuela s/n. Cercado de Lima
Lima 1, Perú
Correo-e: julia_c1@hotmail.com














