Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.69 no.2 Lima June 2008
Síndrome de Doege Potter y derrame pericárdico, como manifestaciones iniciales de neoplasia pulmonar
Doege-Potter syndrome and pericardic effusion as lung carcinoma early manifestations
Leonidas Carrillo1,2, Iván Camacho3, Jaime Flores4
1 Profesor Auxiliar de la Facultad de Medicina de San Fernando, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Servicio de Medicina Interna del Hospital Nacional Arzobispo Loayza, Ministerio de Salud. Lima, Perú.
3 Residente de Medicina Interna de la Facultad de Medicina de San Fernando, Universidad Nacional Mayor de San Marcos. Lima, Perú.
4 Estudiante de Medicina Humana de la Facultad de Medicina de San Fernando, Universidad Nacional Mayor de San Marcos. Lima, Perú.
Resumen
Comunicamos el caso de un paciente de 52 años que ingresa a nuestro hospital por presentar derrame pericárdico masivo y manifestaciones de hipoglicemia de manera repetitiva, sin antecedentes de tabaquismo, diabetes mellitus, ni consumo de fármacos. Fue sometido a pericardiocentesis, obteniéndose 1 430 mL de líquido de aspecto serosanguinolento, el mismo que se remitió para estudio, demostrándose un exudado polimorfonuclear, adenosina deaminasa (ADA) positivo y presencia de células compatibles con adenocarcinoma metastático. Se observó en la radiografía de tórax y tomografía axial computarizada pulmonar la presencia de una masa en la región parahiliar izquierda compatible con una neoplasia maligna, con derrame pleural y pericárdico. Se trató de una presentación poco frecuente de neoplasia maligna pulmonar, con metástasis pericárdica, derrame pleural izquierdo y un síndrome paraneoplásico endocrino, caracterizado por hipoglicemia a repetición, como manifestación inicial.
Palabras clave: Enfermedades pulmonares; neoplasias; metástasis de la neoplasia; derrame pleural; síndromes paraneoplásicos endocrinos.
Abstract
A 52 year-old man was admitted to our hospital because of large pericardial effusion and symptoms of recurrent hypoglycaemia. He had no history of smoking or diabetes mellitus and was taking no medication. Diagnostic pericardiocentesis was performed and 1 430 mL of bloody-stained fluid was obtained. The exudate showed neutrophils positive to adenosin deaminase (ADA) test. Chest X-ray and computed tomography showed a left lung hilar mass resembling a lung neoplasm, with pleural and pericardial effusion. It was a lung cancer of unusual presentation, with pleural and pericardial metastasis and a paraneoplastic syndrome characterized by recurrent hypoglycaemia as initial manifestation.
Key words: Lung diseases; neoplasms; neoplasm metastasis; pleural effusion; paraneoplastic endocrine syndromes.
INTRODUCCIÓN
En los inicios del siglo XX, el cáncer pulmonar era poco frecuente; en la actualidad, alcanza proporciones casi epidémicas en el mundo, siendo la causa de muerte por cáncer más frecuente a nivel mundial (1). Tiene una elevada mortalidad, que suele ser diagnosticado en estadios avanzados (2). Se estima que 80 a 90% de las neoplasias pulmonares están relacionadas con el tabaquismo (3).
Los síntomas del cáncer son consecuencia de las alteraciones broncopulmonares: efecto local, extensión del tumor a estructuras circundantes, efectos sistémicos inespecíficos, metástasis a distancia y síndromes paraneoplásicos (4,5). Entre 6% y 10% de pacientes con cáncer pulmonar son asintomáticos (6,7). El adenocarcinoma es el tipo más común de cáncer pulmonar, ocurre en 30 a 35% de los casos (8). Los lugares frecuentes de metástasis son hígado, hueso, cerebro, ganglios y glándulas suprarrenales (6,9,10). La metástasis pericárdica no es una manifestación frecuente, pero cuando el pericardio es infiltrado por una neoplasia maligna, esta procede principalmente de una neoplasia pulmonar (11). Los tumores con potencial metastático que infiltran pericardio son los del pulmón, mama, esófago, linfomas, leucemia, melanoma maligno. Se considera que las células malignas llegan al pericardio por vía linfática, hematógena, directa o extensión transvenosa (12). La sintomatología depende mas del tipo histológico, que de la localización de la metástasis, cuando el pericardio esta comprometido puede ser pericarditis con derrame y taponamiento pericárdico, en los casos que el derrame se ha producido de manera rápida (8,13).
Las manifestaciones paraneoplásicas dependen de la secreción de péptidos hormonales o sus precursores, de citoquinas y, más raramente, de hormonas tiroideas y otras, que actúan de forma endocrina, paracrina o autocrina (6,9,10). En ocasiones, los síndromes paraneoplásicos pueden ser más graves que las consecuencias del propio tumor primario y pueden preceder, ir en paralelo o seguir a las manifestaciones clínicas de dicho tumor (14). Si bien la hipoglicemia no es la más frecuente manifestación paraneoplásica en neoplasia maligna (NM) pulmonar, la hipoglicemia asociada con tumor de células no beta del páncreas fue descrito por primera vez en 1930; desde entonces, más de 200 casos de hipoglicemia asociadas a tumores extrapancreáticos han sido publicados (15,16). Sus manifestaciones son consecuencia del bloqueo de la producción hepática, por inhibición de la glucogenolisis, gluconeogénesis, inhibición de la lipólisis e incremento del consumo periférico de glucosa (17-19). El caso clínico presentado a continuación tiene como finalidad permitir un diagnóstico diferencial amplio, dado que el paciente presentó como primera manifestación de una neaoplasia pulmonar maligna un síndrome paraneoplásico endocrino y derrame pericárdico masivo, considerando entre los antecedentes la ausencia de diabetes mellitus y de enfermedades infecciosas, como la tuberculosis.
CASO CLÍNICO
Paciente varón de 52 años, procedente de Lima, obrero eventual, que inició la enfermedad dos semanas antes de su ingreso, con disnea a moderados esfuerzos, que progresivamente aumentó hasta presentarse en el reposo y con predominio nocturno. Asimismo, refirió más de un episodio de alteración del comportamiento y dificultad para articular el pensamiento, que duraba varios minutos, llegando a presentar pérdida de la conciencia, por lo cual fue traído a la emergencia del Hospital Nacional Arzobispo Loayza, Lima. Refirió tres días antes del ingreso, tos con expectoración amarillenta, asociada a sensación de alza térmica no cuantificada, a predominio nocturno. Dos días antes del ingreso, presentó dolor tipo hincada en región precordial y dorsal, acompañado de sensación de falta de aire al reposo, por lo que bajo sospecha de pericarditis se le realizó un ecocardiograma, encontrándose derrame pericárdico severo. Se realizó pericardiocentesis, drenándose 1 430 mL de líquido serohemático, luego de lo cual fue hospitalizado en el pabellón de Medicina 2-I. Entre las funciones biológicas, el sueño estaba alterado por el dolor precordial y de espalda, desde hacía dos días. Había bajado 4 kilos de peso desde el inicio de la enfermedad.
Negó hábitos nocivos, diabetes, consumo de fármacos, antecedentes de tuberculosis, tabaquismo, antecedentes familiares de neoplasia, antecedentes patológicos de importancia.
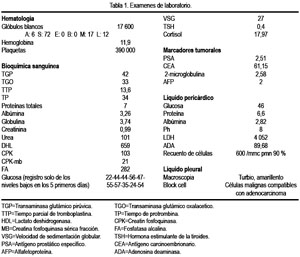
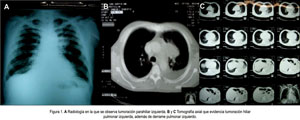
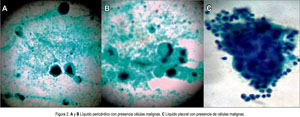
En el examen físico, se encontró presión arterial 110/60 mmHg, frecuencia cardiaca 106 por minuto, frecuencia respiratoria 18 por minuto, temperatura 36,4 °C, paciente despierto en decúbito dorsal activo, en regular estado general, de nutrición e hidratación, con vía endovenosa. La piel era tibia, elástica, hidratada. No había palidez ni ictericia. El llenado capilar era < 2 segundos. No había edemas. En el cuello se evidenció ingurgutación yugular (IY). En aparato respiratorio, la mplexación era conservada, vibraciones vocales disminuidas en base de hemitórax izquierdo; el murmullo vesicular estaba disminuido en ambas bases pulmonares. En el aparato cardiovascular, los ruidos cardiacos eran rítmicos, de baja intensidad, sin soplos; IY (+), reflujo hepato yugular (+). Los pulsos periféricos estaban presentes y eran simétricos. En el abdomen, los ruidos hidroaéreos estaban presentes; el abdomen era blando, depresible, no doloroso, sin tumoraciones ni visceromegalia. El sistema genitourinario no mostraba alteraciones. Al examen del sistema nervioso, el paciente estaba despierto, orientado en persona y espacio, parcialmente en tiempo, con bradipsiquia, sin alteración sensitiva ni de equilibrio, sin signos meníngeos ni focalización. Se realizó exámenes auxiliares, los cuales están consignados en la Tabla 1 y en las Figuras 1 y 2.
No se realizó fibrobroncoscopia ni la biopsia del tumor, por motivos económicos.
En la evolución, la hipoglicemia fue tratada con infusión de dextrosa al 10% y aplicación en bolos de dextrosa al 33%; asimismo, recibió glicocorticoides. El registro de niveles bajos de glicemia correspondió sobre todo a los primeros días de hospitalización. Las manifestaciones clínicas variaron desde una forma oligosintomática hasta un episodio severo de neuroglucopenia, que se manifestó con severo trastorno de conciencia y rigidez de descerebración.
El paciente fue evaluado por el Servicio de Oncología, que programó quimioterapia (carboplatino + paclitaxel). La evolución fue favorable y se le dio de alta para manejo ambulatorio.
DISCUSIÓN
El cáncer de pulmón es uno de los tumores sólidos más frecuentes en el mundo; representa 22% de los cánceres en hombres y 8% en mujeres. Su incidencia está incrementándose trágicamente, debido al incremento del tabaquismo (2,3).
El cáncer de pulmón permanece como un desafío para la medicina, porque a pesar de los avances en técnicas diagnósticas y en recursos terapéuticos, los resultados continúan siendo magros, evidenciándose tasa baja de curaciones y pequeño tiempo de vida posdiagnóstico (2).
La diseminación en el momento del diagnóstico es de 40% en los casos de cáncer de células no pequeñas y de 70% en el cáncer de células pequeñas, siendo el compromiso metastático a ganglios, hueso, médula ósea, cerebro, hígado y suprarrenal. En 10% de casos, los pacientes con neoplasia maligna pulmonar son asintomáticos (7).
La frecuencia de metástasis a corazón (pericardio) es poca; ocurre en neoplasias con diseminación extensa. Abraham y col. (20), en un periodo de 14 años, revisaron 3 314 autopsias; 806 (24,3%) correspondieron a neoplasia maligna y de estos, 95 (11,8%) tuvieron metástasis al corazón. Más de 50% de los tumores que dan metástasis a pericardio lo constituyen los cánceres pulmonar y de mama, linfomas, melanoma maligno. La incidencia de metástasis pericárdica en la neoplasia pulmonar maligna puede alcanzar el 31%, que suele acompañarse de metástasis a otros órganos, sobre todo si el carcinoma es indiferenciado; en general, se manifiesta tardíamente.
El presente caso trata de un paciente con historia de enfermedad breve, cuyas primeras manifestaciones fueron derrame pericárdico masivo. Entre 15 a 20% de casos de derrame pericárdico ocurren en neoplasias malignas, teniendo el estudio de liquido pericárdico un alcance diagnostico de 85%; en el presente caso, el líquido pericárdico tuvo un examen de ADA de 89,68 que, dada la evidencia de una adenocarcinoma metastático, fue considerado como falso positivo, tal como algunos trabajos lo mencionan (21). Así mismo, estuvo acompañado de episodios de hipoglicemia repetidos, sin presentar antecedentes de diabetes mellitus o uso indebido de hipoglicemiantes orales o insulina; tampoco era portador de insuficiencia renal crónica o de enfermedad hepática terminal, ni había evidencia de insuficiencia suprarrenal o hipofisiaria. Al momento de su internamiento, no había evidencia de infecciones. Se hizo el diagnóstico de neoplasia pulmonar maligna con metástasis pericárdica, metástasis pleural e hipoglicemia, como manifestación paraneoplásica, siendo éstas las primeras manifestaciones de neoplasia pulmonar maligna.
Aunque la hipoglicemia es relativamente común en la comunidad, muy pocos pacientes pueden ser dados de alta después del tratamiento de emergencia. Más bien, requieren hospitalización, para investigar la causa cuando no es evidente y para manejo de la morbilidad en episodios agudos (14,22). La hipoglicemia asociada a tumores de células no beta fue descrito por primera vez en 1930; desde entonces, algo más de 200 casos de hipoglicemia asociado con tumores extrapancreáticos han sido publicados. La mayoría de estos pacientes presentó tumores intratorácicos e incluyeron rabdomiosarcoma, fibrosarcoma, neurofibromas y carcinomas broncogénicos (15,16). Si bien la hipoglicemia es una emergencia que genera importante morbilidad y mortalidad, si ésta no es atendida, se requiere hospitalizar al paciente, como el nuestro, no solo para compensarlo sino para un mejor estudio, dado que la causa de la hipoglicemia aún no se encontraba establecida. La hipoglicemia asociada a neoplasia maligna ha sido reconocida como síndrome de Doege Potter (18). Esta puede ocurrir en ayunas, como en estado posprandial, como ocurrió en nuestro paciente. En el caso que presentamos, se tuvo que administrar dextrosa e infusión de dextrosa con glicocorticoides, tal como recomienda la literatura médica, donde además se sugiere otros fármacos como diazóxido, octeotrida (23).
Diferentes son los mecanismos que generan hipoglicemia, aunque no están completamente conocidos: bloqueo de la producción hepática de glucosa debido a inhibición de la glucogenólisis, gluconeogénesis, bloqueo de la lipólisis en el tejido adiposo, lo que conlleva a niveles bajos de ácidos grasos libres y a aumento del consumo periférico de glucosa, debido tanto a un aumento de consumo de glucosa por el tumor, como a un incremento de la captación periférica por el músculo esquelético.
En los pacientes con hipoglicemia paraneoplásica se ha encontrado niveles plasmáticos de insulina baja, niveles elevados de big IGF-II ( factor incompleto de crecimiento similar a la insulina tipo II), producto de un error en el procesamiento del IGF II, y aumento de su biodisponibilidad por una distribución alterada entre sus proteínas transportadoras (24-26).
El diagnóstico de hipoglicemia paraneoplásica se vio facilitado por los antecedentes negativos de diabetes mellitus, el no uso de fármacos o drogas (hipoglicemiantes orales, insulina, ácido acetil salicílico, alcohol, entre otros), ausencia de infecciones u otras enfermedades metabólicas, nutricionales, y por la presencia de derrame pericárdico masivo. Al ser sometido a pericardiocentesis y estudiado el líquido, se obtuvo células malignas compatibles con adenocarcinoma. Con esta evidencia y con una radiografía de pulmones, en donde se observó una imagen parahiliar izquierda, se solicitó una tomografía axial computarizada pulmonar para mejor evaluación y se demostró lesión tumoral en pulmón izquierdo, de bordes lobulados, 52 x 32 mm, en segmento izquierdo, adherida a pleura mediastinal, con captación heterogénea del contraste, adenopatías pre-traqueales, efusión pleural y pericárdica. Se procedió a realizar una toracocentesis y el líquido evidenció presencia de células malignas, compatibles con adenocarcinoma.
En otras circunstancias, cuando la hipoglicemia paraneoplásica anticipa significativamente al diagnóstico de la neoplasia primaria, existe mucha dificultad para su diagnóstico. Son necesarios estudios de laboratorio complejos, como: HGH( hormona de crecimiento humana), dosaje de insulina plasmática, péptido C, IGF I, IGF II, big IGFII, pro-insulina (27). En el caso que presentamos, el paciente recibió su segunda quimioterapia con carboplatino y paclitaxel; no hubo complicaciones durante el procedimiento y se obtuvo un control de la hipoglicemia.
En conclusión, en aquellas situaciones en que ocurren hipoglicemias sintomáticas, repetidas y en las que no hay evidencia clara de su origen, sobre todo relacionadas a causas frecuentes como diabetes mellitus, otras endocrinopatías que cursen con hipoglicemias, no consumo de hipoglicemiantes, alcohol, entre otros, se debe hospitalizar al paciente, para investigar la posibilidad de un síndrome paraneoplásico endocrino, como el que resultó ser el presente caso clínico.
REFERENCIAS BIBLIOGRÁFICAS
1. Travis Wd, Lubin J, Rias L, Devesa. S. United States lung cancer incidence trends. Cancer. 1996;77: 2464-70. [ Links ]
2. Fernandez V, Alonso JL, Munuera L, Moya JL, Lasa B, Suárez A, et al. Analysis of lung cancer cases diagnosed in an Internal Medicine Department: from January 2001 to September 2006. Anales Sis San Navarra. [serial on the Internet]. 2007 Dec [cited 2008 July 07] ; 30(3): 353-362. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1137-66272007000500004&lng=en&nrm=iso.
3. Ahsan H, Thomas DC. Medical biology: on the etiology of lung cancer. J Am Med Assoc. 2004;292:2026.
4. Gnippi MA. Clinical aspects of lung cancer. Semen Roentgenol. 1990;25:12-24.
5. Fraser RG, Pare JAP, Pare PD, Fraser RS, Genereux G P. Neoplastic disease of the lung. En: Fraser RG. Pare JAP, Pare PD. Fraser RS, Genereux GP, eds. Diagnosis of diseases of the chest. 3rd ed. Philadelphia, Pa: Saunders; 1989:1327-699.
6. Scagliotti GV. Symptoms, signs and staging of lung cancer. Eur Respir Mon. 2001;17(2):86-119.
7. Beckles MA, Spiro SG, Colice GL, Rudd RM. Initial evaluation of the patient with lung cancer. Chest. 2003;123:975-1045.
8. Vincent RG, Pickren JW, Lane WW, Bross I, Takita H, Houten L, et al. The changing histopathology of lung cancer. A review of 1 682 cases. Cancer. l977;39:1647-55.
9. Zamboni M, Carvalho WR. Câncer de pulmão. Rio de Janeiro: Atheneu; 2005.
10.Naime FF, Younes RN, Kersten BG, Anelli A, Beato CA, Andrade RM, et al. Metastatic non-small cell lung cancer in Brazil: treatment heterogeneity in routine clinical practice. Clinics. 2007;62(4):397-404.
11. Quraishi MA, Constanzi J, Hokanson J. The natural history of lung cancer with pericardial metastases. Cancer. 1983;51:740-2.
12. Weiss L. An analysis of the incidence of myocardial metastasis from solid cancers. Br Heart J. 1992;68:501-4.
13. Mateos L, Nogales JM, González RA, Garrido JJ, González R, Pérez AM. Pericarditis constrictiva como primera manifestación de un carcinoma pulmonar. Arch Bronconeumol. 2006;42:608-10.
14. Onuigbo WI. The spread of lung cancer to the heart, pericardium and great vessels. Jpn Heart J. 1974;15(3):234-8.
15. Touyz R, Plitt M, Rumbak M. Hypoglycemia associated with a lung mass. American College of Chest Physicians. Chest. 1986;89;289-90.
16. Ahn JE, Byun JH, Ko MS, Park SH, Lee MG. Neuroendocrine carcinoma of the gallbladder causing hyperinsulinaemic hypoglycaemia. Clin Radiol. 2007;62:391-4.
17. Adhami N, Ahmed R, Lento PA, Shimshi M, Herman SD, Teirstein AS. Fibrous pleural tumor with hypoglycemia: Case study. Mount Sinai J Med. 2004;71(5):344-6.
18. Balduyck P, Lauwers P, Govaert K, Hendriks J, de Maeseneer M, van Schil P. Solitary fibrous tumor of the pleura with associated hypoglycemia: Doege-Potter syndrome: a case report. J Thoracic Oncol. 2006;1(6):588-90.
19. Nauck MA, Reinecke M, Perren A, Frystyk J, Berishvili G, Zwimpfer C, et al. Hypoglycemia due to paraneoplastic secretion of insulin-like growth factor-I in a patient with metastasizing large-cell carcinoma of the lung. J Clin Endocrinol Metab. 2007;92(5):1600-5.
20. Abraham KP, Reddy V, Gattuso P. Neoplasms metastatic to the heart: review of 3314 consecutive autopsies. Am J Cardiovasc Pathol. 1990;3(3):195-8.
21. Jimenez Castro D, Diaz Nuevo G, Perez-Rodriguez E, Light RW. Diagnostic value of adenosine deaminase in nontuberculous lymphocytic pleural effusions. Eur Respir J. 2003;21:220-4.
22. Zapf J. IGFs: functions and clinical important role of insulin-like growth factor (IGF II) and IGF binding proteins in extrapancreatic tumor hypoglycemia. J Int Med. 1993;234:453-552.
23. Berman J, Harland S. Hypoglycaemia caused by secretion of insulin-like growth factor 2 in a primary renal cell carcinoma. Clin Oncol. 2001;13:367-9.
24. Morbois-Trabut L, Maillot F, De Widerspach-Thor A, Lamisse F, Couet C. Big IGF-II-induced hypoglycemia secondary to gastric adenocarcinoma. Diabetes Metab. 2004;30:276-8.
25. Hirai A, Nakanishi R. Solitary fibrous tumor of the pleura with hypoglycemia associated with serum insulin-like growth factor II. J Thorac Cardiovasc Surg. 2006;132:713-4.
26. Davda R, Seddon BM. Mechanisms and management of non-islet cell tumour hypoglycaemia in gastrointestinal stromal tumour: case report and a review of published studies. Clin Oncol. 2007;19:265-8.
27. Miraki-Moud F, Grossman AB, Besser M, Monson JP, Camacho-Hubner C. A rapid method for analyzing serum pro-insulin-like growth factor-II in patients with non-islet cell tumor hypoglycemia. J Clin Endocrinol Metab. 2005;90(7):3819-23.
Manuscrito recibido el 3 de marzo de 2008 y aceptado para publicación el 22 de abril de 2008.
Correspondencia:
Leonidas Carrillo Ñáñez
Calle Los Ficus 136 Urb. Jardines Virú
Callao 02, Perú
Correo-e: lchcarn@yahoo.es