Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.70 n.2 Lima jun. 2009
Efecto citoprotector y antisecretor del aceite de Copaifera officinalis en lesiones gástricas inducidas en ratas
Copaifera officinalis oil cytoprotector and antisecretory effects in induced gastric lesions in rats
Jorge Arroyo1,2, Yuan Almora3, Mariano Quino1,4, Jaime Martínez5, Martín Condorhuamán6, Marlene Flores7, Pablo Bonilla8
1 Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Laboratorio de Farmacología, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Departamento de Farmacia, Hospital Nacional Hipólito Unanue. Lima, Perú.
4 Servicio de Gastroenterología, Hospital Nacional Dos de Mayo. Lima, Perú.
5 Médico Asistente del Seguro Social de Salud (EsSALUD). Lima, Perú.
6 Médico residente del Hospital Docente Materno Infantil San Bartolomé. Lima, Perú.
7 Departamento de Anatomía Patológica, Hospital nacional Hipólito Unanue. Lima, Perú.
8 Instituto de Ciencias Farmacéuticas y Recursos Naturales, Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos. Lima, Perú.
Resumen
Objetivos: Demostrar el efecto gastroprotector del aceite de Copaifera officinalis usando indometacina y ligadura de píloro en ratas. Diseño: Estudio preclínico. Lugar: Facultades de Medicina, de Farmacia y Bioquímica. Universidad Nacional Mayor de San Marcos, Lima, Perú. Material biológico: Ratas y aceite de copaiba. Intervenciones: Se colectó el aceite de copaiba en Ucayali, Pucallpa. La citoproteccción fue evaluada con indometacina, considerando un grupo control normal, indometacina, grupos de aceite de copaiba y omeprazol. Las lesiones de la mucosa gástrica fueron calificadas como las compatibles con necrosis local (tejido no viable), hiperemia, enrojecimiento presente y hemorragia, empleando la escala de puntaje observacional; y la úlcera, según la escala de Macallister modificado. El ensayo de antisecreción fue realizado por el modelo de ligadura del píloro, en el que 24 ratas albinas fueron divididas al azar en 3 grupos; un control, otro de aceite de copaiba 40mg/kg y un tercero de omeprazol 10 mg/kg. Después de 4 horas de ligazón, fueron sacrificados, extrayéndose los estómagos; con mucho cuidado se midió el volumen y se determinó el pH de la secreción gástrica, por potenciometría. Se realizó evaluación histopatológica según Devi. Principales medidas de resultados: Lesiones ulcerosas. Resultados: Los resultados indicaron 100% de efecto citoprotector con el aceite de copaiba y de 97,8% para el omeprazol (p<0,0001), ratificado con los hallazgos histopatológicos; la disminución del volumen de secreción fue 79,4% para omeprazol y 42,8% para el aceite de copaiba (p<0,001), con incremento del pH. Conclusiones: En condiciones experimentales, el aceite de copaiba fue efectivo como agente gastroprotector en ratas con inducción de úlcera gástrica.
Palabras clave: Úlcera gástrica; copaiba; agentes gastrointestinales.
Abstract
Objetives: To determine the gastroprotector effect of Copaifera officinalis oil using indomethacin and pyloric ligature in rats. Design: Preclinical study. Setting: Faculties of Medicine, Pharmacy and Biochemistry, National University of San Marcos, Lima, Peru. Biological material: Rats and copaiba oil. Interventions: Copaiba oil was collected in Ucayali, Pucallpa. Cytoprotection was tested with indomethacin considering a normal control group, and indomethacin, copaiba and omeprazole groups. Using visual analogue scale mucosa gastric injuries were referred as those compatible with local necrosis (unviable tissue), hyperemia, flushing, and hemorrhage, and ulcers according to the modified Macallisters scale. The anti-secretion trial used the pyloric ligature model. Twenty-four albino rats were randomized in three groups: control, copaiba oil 40 mg/kg and omeprazole 10 mg/kg, respectively. After 4 hours of linkage, they were sacrificed. Stomachs were removed, their volume measured carefully and gastric secretion pH determined by potentiometry. Deviss histopathological evaluation was used. Main outcome measures: Ulcerous injuries. Results: There was 100% cytoprotection with copaiba oil and 97,8% with omeprazole (p<0,0001), ratified by histological findings. Decrease in secretion volume was 79,4% for omeprazole and 42,8% for copaiba oil (p<0,0001) with pH increment. Conclusions: In experimental conditions copaiba oil was effective as gastroprotective agent in gastric ulcers-induced rats.
Key words: Stomach ulcer; copaiva; gastrointestinal agents.
INTRODUCCIÓN
La enfermedad de úlcera péptica (EUP) es un problema gastrointestinal caracterizado por daño de la mucosa, secundario a la secreción de ácido gástrico y pepsina, la cual usualmente ocurre en el estomago y duodeno proximal; es menos común en el esófago bajo, duodeno distal o el yeyuno. En los Estados Unidos de América del Norte, aproximadamente 500 000 personas desarrollan esta enfermedad cada año, de las cuales 70% oscilan entre los 25 y 64 años, lo que constituye un costo anual estimado en 10 mil millones de dólares, en servicios de salud (1,2).
En nuestro país, en un estudio realizado en el período 2000-2005, se comunicó una prevalencia de EUP de 83,09 por 1 000 pacientes sintomáticos, a los cuales se les realizó una endoscopia, siendo la úlcera duodenal la más común. Sin embargo, en los últimos años, la úlcera gástrica se ha ido incrementando, caracterizándose por presencia de hemorragia digestiva alta y dispepsia; además, la frecuencia de infección por Helicobacter pylori fue 65,3% en todas las úlceras pépticas, 74,3% en úlcera duodenal y 55,4% en úlcera gástrica (2). Cabe agregar que el descubrimiento del Helicobacter pylori ha esclarecido muchos de los misterios que habían nublado la epidemiología clínica de la EUP (3-5).
El aceite de copaiba es producido por exudación del tronco de los árboles pertenecientes al género copaifera. El material exudado es un líquido que va desde transparente, amarillo a marrón claro. Las propiedades medicinales del aceite de copaiba fueron conocidas por los indios americanos, quienes lo empleaban para el tratamiento de varias afecciones (6).
Los efectos atribuidos al aceite de copaiba en medicina folclórica son antiiflamatorio, antitumor, antiséptico urinario, enfermedades de la piel, úlceras, cicatrizantes de heridas. Varias efectos del aceite de copaiba han sido estudiados como antitumoral contra sarcoma Walker (6), en la línea celular del melanoma (7), antiulcerogénico, antioxidante y antiliperoxidativo (8), antimicrobiano (9), cicatrizante, analgésico (10) y antiinflamatorio (11,12).
En los últimos años, las investigaciones realizadas han permitido validar diversos usos tradicionales atribuidos al aceite de Copaifera officinalis. El objetivo nuestro ha sido corroborar mediante estudios preclínicos su empleo como agente antiulceroso en un modelo animal, empleando como agente inductor indometacina, y evaluar su actividad antisecretora mediante ligadura del píloro en animales de experimentación.
MÉTODOS
Se extrajo el aceite de copaiba del árbol Copaifera officinalis, procedente de la zona de Ucayali, Pucallpa. La planta fue identificada taxonómicamente en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos.
Con relación a la marcha fitoquímica, cada reacción de identificación de metabolitos secundarios presentes en el aceite de copaiba se realizó con los reactivos específicos, comunicando los resultados como presencia o ausencia de metabolitos: 5 mL de extracto problema con 5 gotas de reactivos (13).
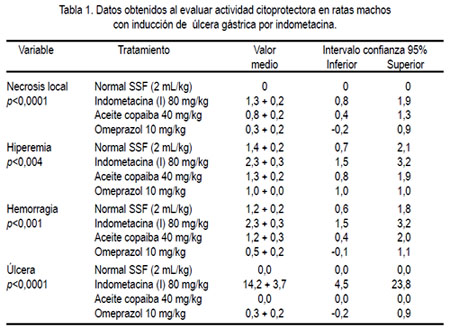
Se hizo la determinación de la actividad citoprotectora en ratas, según OBrien, 1990 (14), con modificación en la dosis de indometacina. Se utilizó 32 ratas Holtzmann procedentes del Instituto Nacional de Salud, machos de 180 ± 20 g. Los animales fueron aclimatados previamente al ambiente de experimentación, durante 5 días; se les mantuvo en un ambiente a temperatura de 21°C, con dieta y agua a libertad. Veinticuatro horas antes del ensayo, se les sometió a ayuno, recibiendo agua a libertad. Se dividió los animales en cuatro grupos de ocho cada uno, según el siguiente diseño experimental: 1) Normal con solución salina fisiológica (SSF) 2 mL/kg; 2) Control indometacina (I) 80 mg/kg vía intraperitoneal; 3) I + aceite de copaiba 40 mg/kg vía oral; 4) I + omeprazol 10 mg/kg. El procedimiento fue el siguiente. Mediante sonda metálica de acero inoxidable, se administró por vía oral el suero fisiológico, el aceite de copaiba y una suspensión de omeprazol/bicarbonato de sodio 2 mg/mL (cada mL de suspensión contiene 2 mg de omeprazol en 84 mg de bicarbonato de sodio), en las dosis indicadas, esto con la finalidad de elevar el pH gástrico y evitar la degradación ácida del omeprazol (15). Luego de 60 minutos, se administró la indometacina por vía intraperitoneal, a todos los grupos, excepto al grupo normal; esto se repitió a las doce horas; y, luego de seis horas de la última administración, los animales fueron sacrificados, administrándoseles por vía intraperitoneal pentobarbital 100 mg/kg. Mediante laparotomía, se extrajo el estómago, que fue abierto por la curvatura mayor, observándose la presencia de lesiones. Se consideró hiperemia, hemorragia, úlceras y lesiones compatibles a necrosis. Finalmente, los estómagos fueron conservados en una solución de formol tamponado (formol 40% (100 mL) + sodio fosfato monobásico monohidratado (4 g) + sodio fosfato dibásico anhidro (6,5 g) + agua destilada csp un litro). Para calificar las lesiones de la mucosa gástrica, se observó aquellas compatibles con necrosis local (tejido no viable), siendo calificado según la magnitud de la lesión observada. La hiperemia fue calificada según la magnitud del enrojecimiento presente y la hemorragia, según la magnitud del sangrado, dependiente de la cantidad de vasos comprometidos. Los parámetros antes mencionados fueron medidos empleando la escala de puntaje observacional: ausente = 0; leve = 1; moderado = 2; severo = 3.
Para calificar la úlcera, se tuvo en cuenta la magnitud de la lesión observada en la mucosa gástrica (pérdida de continuidad o rotura de la misma), siendo calificada según la escala de Alada y col, 2008 modificada (16), en: normal = 0; leve (úlceras puntiformes <1 mm o microhemorragias) = 1; moderada (2 o más ulceras hemorrágicas pequeñas) = 2; severa (úlceras grandes >2 mm de diámetro) = 3.
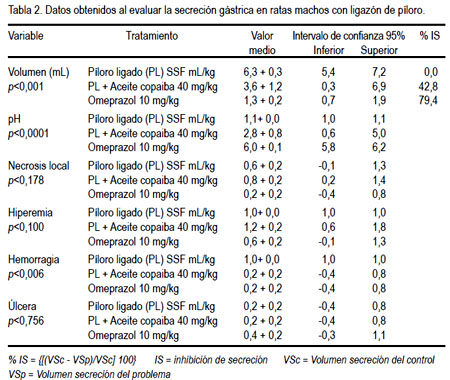
Se determinó la actividad antisecretoria en ratas según Shay y col., 1945 (17), con modificaciones de Long y col., 1983 (18). Veinticuatro ratas albinas fueron separadas al azar en tres grupos de 8 cada uno; un grupo fue control y solo recibió el vehículo que redisolvió al aceite de copaiba (solución de polisorbato 80 o tween 80 al 1%, a la dosis de 2 mL/kg); el segundo recibió aceite de copaiba 40 mg/kg; y al tercero se le administró omeprazol en dosis de 10 mg/kg. Los animales fueron anestesiados con éter, se les hizo una laparotomía abdominal, exponiéndose el píloro, el que fue ligado; seguidamente, se administró las sustancias vía intraduodenal, se suturó el peritoneo por planos y finalmente a todos los animales se les administró histamina en dosis de 50 mg/kg. Luego de cuatro horas, los animales fueron sacrificados por administración de pentobarbital 100 mg/kg. Posteriormente, se extrajo los estómagos, ligándose el cardias, con cuidado se midió el volumen y se determinó el pH de la secreción gástrica, por medio de un potenciómetro. Se determinó el porcentaje de inhibición de secreción (% IS), teniendo en cuenta el volumen de secreción del control (VSc) y el volumen de secreción del problema (Vsp). % IS = {[(VSc - VSp)/VSc] 100}
Para la evaluación histopatológica según Devi y col., 1998 (19), los estómagos fueron extirpados y lavados suavemente con solución salina, para remover la sangre y los detritos adheridos al tejido. Se los fijó en solución de formol al 10% tamponado, por 7 días, y luego se seleccionó las zonas donde de acuerdo al examen macroscópico se evidenciaba lesión aparente. Trascurrido este tiempo, se les procesó en un autotecnicón por 18 horas, en soluciones de alcoholes para deshidratación, hidratación con xilol, y embebido en parafina. El procesamiento de los tacos de parafina se realizó empleando un dispensador de parafina. Los tacos obtenidos fueron llevados a congelamiento a <0°C, por un lapso de 3 horas, para luego proceder al corte de 3µ de espesor con ayuda de un micrótomo. Luego, se retiró la parafina en una estufa, para proceder a la coloración con hematoxilina y eosina. Después de la deshidratación y limpieza de las láminas, fueron llevados para observación microscópica.
Los datos fueron procesados utilizando el paquete estadístico SPSS (stadistical package for social sciences), versión 15,0, año 2006. Se consideró significativa una p<0,05, con intervalo de confianza del 95%. Se aplicó el análisis de varianza (Anova) a los valores obtenidos al administrar los diferentes tratamientos. Se determinó la media y error estándar de los valores individuales obtenidos para los animales de cada grupo.
RESULTADOS
Al realizar el análisis fitoquímico de Copaifera officinalis, se identificó los metabolitos presentes en mayor cantidad. Dichos metabolitos fueron esteroiodes y/o terpenoides, hallados mediante reacción de Lieberman-Burchard, estando ausentes otros metabolitos secundarios.
Para el efecto citoprotector, se midió el daño de la mucosa gástrica inducida por indometacina en ratas, a los cuales se les administró el aceite de copaiba. En la tabla 1 se observa los valores medios numéricos para cuantificar las lesiones. Los resultados de protección de úlceras indicaron 100% de efecto citoprotector (EC) con el aceite de copaiba y de 97,8% para el omeprazol, obtenidos según la fórmula EC = ((indometacina – tratamiento/indometacina) x 100).
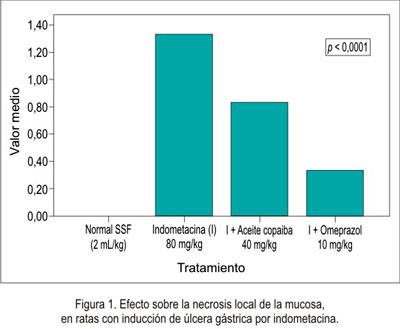
En relación a la disminución de la necrosis local sobre la mucosa gástrica del estómago se obtuvo que el grupo que recibió omeprazol presentó mejor efecto citoprotector, seguido del grupo de aceite de copaiba (figura 1), siendo igual comportamiento en la hiperemia (figura 2) y la hemorragia (figura 3). Al evaluar la presencia de úlceras sobre la mucosa gástrica (figura 4), el aceite de copaiba mostró un efecto ligeramente superior al grupo que recibió omeprazol.
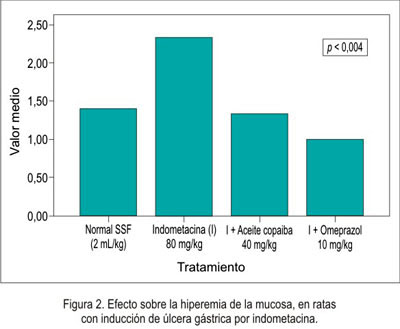
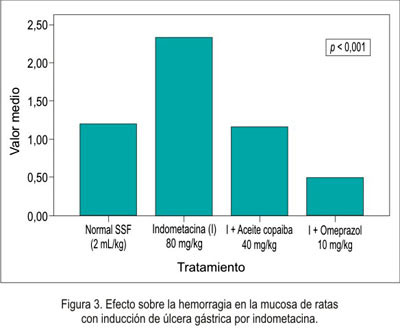
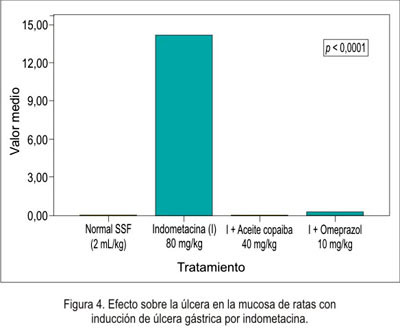
El efecto antisecretorio del aceite de copaiba frente al modelo experimental de ligazón pilórica en ratas se muestra en la tabla 2 y figuras 5, 6, 7 y 8.
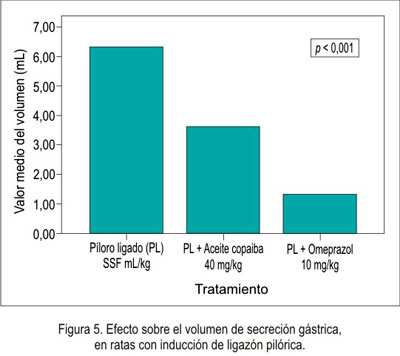
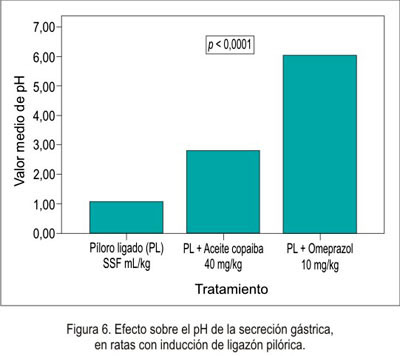
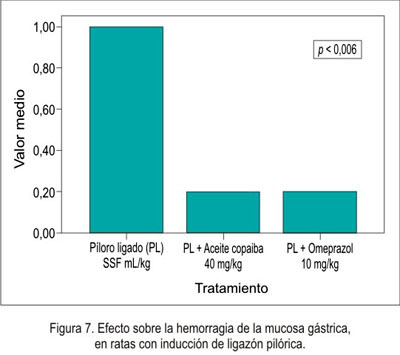
En el efecto antisecretor, se puede observar que el volumen fue menor en el omeprazol , así como en el aceite de copaiba, pero no comparado con el omeprazol. Esto nos indica que disminuyó la secreción ácida. Como era de esperar, el pH aumentó en los grupos de tratamiento, debido a que disminuyó el volumen de secreción; por lo tanto, existió un aumento de pH. Respecto a la necrosis local, hiperemia y úlcera, no existió una diferencia significativa, es decir, en ninguno de los grupos se presentó una lesión evidenciable; esto fue corroborado por el estudio anatomopatológico.
En caso de la hemorragia, sí existió diferencia significativa; por lo tanto, se relacionó con la disminución del pH, que tornó una zona agresiva frente a la presencia del ácido clorhídrico, evidenciando el efecto antisecretorio del aceite de copaiba, pero con efecto menor al omeprazol.
Se determinó el Anova y, por tener cifras estadísticamente significativas, se prefirió colocar los valores medios con su error estándar.
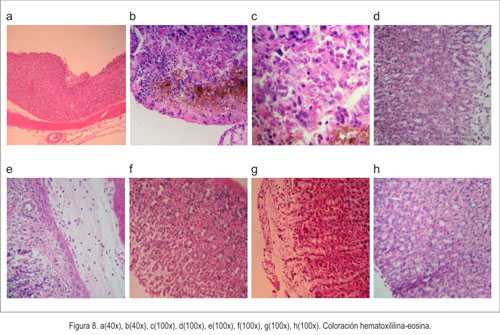
Con relación a la histopatología, en la figura 8-a se aprecia tejido indemne, sin alteraciones morfológicas, correspondiente al grupo normal que recibió solo suero fisiológico. Al evaluar la actividad agresora de la indometacina, se observó presencia de un material amorfo extraño, de color marrón, en la mucosa, la cual se hallaba necrosada, con destrucción de la arquitectura glandular (figura 8-b), hemorragia e inflamación aguda (figura 8-c). Al evaluar la actividad citoprotectora del aceite de copaiba, observamos atenuación del daño de la indometacina con conservación de la arquitectura glandular de la mucosa y edema de la submucosa y congestión en la capa muscular propia (figura 8-d). En la actividad citoprotectora del omeprazol, se mostró congestión vascular en la capa mucosa, submucosa y muscular (figura 8-e).
Al examinar la actividad antisecretora mediante la ligadura de píloro, se evidenció edema, con necrosis parcial de la mucosa, congestión vascular transmural severa de todas las capas del estómago (figura 8-f). En el grupo de trabajo de ligadura de píloro más aceite de copaiba, se observó congestión vascular y edema de la capa mucosa (figura 8-g), con capa submucosa, muscular y serosa indemnes. Y el grupo de ligadura de píloro más omeprazol mostró edema de la mucosa, permaneciendo el resto de las capas sin cambios (figura 8-h).
DISCUSIÓN
En este estudio, se demostró una significativa actividad citoprotectora sobre la mucosa gástrica, así como reducción del volumen de secreción ácido-gástrica. En los ensayos fitoquímicos realizados al aceite de copaiba, se identificó solo la presencia de terpenos, empleando el reactivo de Lieberman-Burchard, por lo que bien podría tratarse de diterpenos o triterpenos, aunque no se descarta la posibilidad de que el aceite de copaiba contenga mayor cantidad de triterpenos; se requiere más estudios para ratificar esta afirmación. Sin embargo, se ha informado en diversas especies de Copaifera -incluyendo Copaifera officinalis L., Copaifera cariácea M., Copaifera guianenses Desf., Copaifera oblonguifolia M., Copaifera multijuga Hayne, Copaifera cearensis Huber ex Ducke y Copaifera reticulata Ducke- la presencia de sesquiterpenos y diterpenos, los cuales varían de acuerdo a la especie, ubicación y tiempo de recolección (20). Se identifica en estas tres últimas especies 35 sesquiterpenos, siendo el β-cariofileno el de mayor cantidad (57,5, 19,7 y 40,9%, respectivamente), seguido de α-humuleno, α-copaeno, α-bergamoteno, δ-cadineno, con diferentes cantidades en cada tipo de aceite (21). Cabe resaltar que en un estudio se evidenció que el β-cariofileno tuvo efecto citoprotector gástrico, afectando la secreción de ácido clorhídrico y pepsina, además de efectos antiinflamatorios, sin ninguna manifestación de daño de la mucosa gástrica; esto es típico de los agentes antiinflamatorios no esteroideos, al inducirse lesión gástrica en ratas empleándose etanol absoluto y HCl 0,6 N como agentes inductores (22).
La tabla 1 indica que en el grupo de animales que recibió solo indometacina se produjo un daño de la mucosa gástrica, pasando por todas las etapas, como son la hiperemia, necrosis, hemorragia y finalmente la úlcera gástrica, tal como se comunica científicamente (23).
La actividad gastroprotectora del aceite de copaiba se evidenció en la reducción significativa de la úlcera local (p<0,0001) inducida con indometacina, siendo incluso mejor al grupo que recibió omeprazol como antiulceroso (tabla 1). El aceite de copaiba también mejoró la necrosis local (p<0,0001), hiperemia (p<0,004) y hemorragia (p<0,001) de la mucosa gástrica, siendo los valores obtenidos en estos dos últimos indicadores muy semejantes al grupo normal (tabla 1). Sin embargo, el omeprazole ofreció una mejor protección ante los parámetros antes mencionados, con excepción de que el aceite de copaiba resultó ser más efectivo en la cicatrización de la úlcera inducida por indometacina en las ratas (p<0,0001). Es conocido que la inducción de daño en la mucosa gástrica por parte de los AINEs, a través de múltiples mecanismos -como supresión de la generación de prostaglandinas, sobreproducción de leucotrienos-, actúa como un irritante tópico y reduce el flujo sanguíneo local (23). Por ello, esta reducción podría deberse al incremento en la producción de moco gástrico y/o quizás posible antagonismo de los leucotrienos, los que podrían contribuir a este efecto gastroprotector.
La actividad antisecretora del omeprazol y su mecanismo de acción muestran que es un potente inhibidor selectivo de la bomba de protones de las células parietales del estómago, por lo que reduce la secreción del ácido gástrico, por inhibición de la enzima H+/K+ ATPasa, uniéndose a la bomba de protones localizada en la membrana de las células parietales gástricas. Bloquea el transporte activo de los iones hidrógeno e incrementa el pH gástrico (24); lo que explica los hallazgos expresados en la tabla 3, donde omeprazol ha sido el mayor antisecretorio, seguido por el aceite de copaiba.
Las especies de copaiba contienen terpenos y sesquiterpenos, los que han demostrado efecto cicatrizante sobre heridas y úlceras en modelos animales. Cabe resaltar que, en los métodos de inducción de úlceras gástricas, se emplea como agentes lesivos el etanol, la indometacina y el estrés, los que contribuirían al daño al incrementar los leucotrienos-C4, favorecer la vasoconstricción de vénulas submucosomales con subsecuente estasis del flujo sanguíneo en la microcirculación mucosal, así como la formación de edema. Aunque el mecanismo citoprotector no ha sido establecido aún, se podría conjeturar que el aceite de copaiba inhibiría uno de estos procesos fisiopatológicos (24). Así mismo, se ha observado en otros estudios del genero Copaifera reversión de la depleción de grupos sulfihidrilos inducidas por el alcohol, confiriendo de esta manera un efecto gastroprotector (25).
Según los resultados obtenidos en la prueba de secreción, evaluando el pH, se evidenció un incremento significativo en el grupo que recibió aceite de copaiba (2,8 ± 0,8). Sin embargo, en el grupo que recibió omeprazol el incremento fue aún mayor, alcanzando un pH de 6,0 ± 0,1, lo cual condicionaría el riesgo de padecer infecciones respiratorias, debido a que la acidez gástrica es una importante barrera contra la invasión de patógenos a través del tracto gastrointestinal, ya que un pH elevado incrementa la colonización de virus y bacterias (26). Estudios más recientes, conducen a la hipótesis que las drogas supresoras de ácido podrían causar neumonía, producto de una sobrecolonización de bacterias gástricas, las cuales migrarían a los pulmones por vía digestiva alta y tracto respiratorio superior (27).
Es conocida la relación que existe entre la infección de Helicobacter pylori y la consecuente formación de úlceras gastroduodenales; esto es debido a los cambios fisiopatológicos, tales como atrofia de las microvellosidades, reducción de la secreción mucosa y daño epitelial, conllevando incluso al desarrollo de adenocarcinomas (28).
En este sentido, al haberse demostrado que el aceite de copaiba tiene efecto citoprotector y antisecretorio en ratas con inducción de úlcera gástrica, se recomienda proseguir con investigaciones que además verifiquen su seguridad y eficacia antibacteriana frente al Helicobacter pylori, in vitro e in vivo.
REFERENCIAS BIBLIOGRÁFICAS
1. Valle DL. Peptic ulcer diseases and related disorders. En: Braunwald E, Fauci AS, Kasper DL, Hauser SL, Longo DL, Jameson JL, editores. Harrisons principles of internal medicine. 16th ed. New York: McGraw-Hill; 2005:1746-62. [ Links ]
2. Ford AC, Delaney BC, Forman D, Moayyedi P. Tratamiento de erradicación de la úlcera péptica en pacientes con pruebas positivas para el Helicobacter pylori [Internet]. Biblioteca Cochrane Plus. 2008;(3) [accesada el 15noviembre de2008]. Disponible en: http://www.update-software.com. [ Links ]
3. Ramakrishnan K, Salinas RC. Peptic ulcer disease. Am Fam Phys. 2007;26(7):1005-12. [ Links ]
4. Montes P, Salazar S, Monge E, Cambios en la epidemiologia de la úlcera péptica y su relación con la infección con Helicobacter pylori. Hospital Daniel Carrión 2000-2005. Rev Gastroenterol Perú. 2007;27:382-8. [ Links ]
5. Sonnenberg A. Similar geographic variations in mortality from peptic ulcer and inflammatory bowel disease. Inflamm Bowel Dis. 2007;13(6):763-8. [ Links ]
6. Ohsaki A, Yan LT, Shigeru I, Edatsugi H, Iwata D, Komoda Y. The isolation and in vivo potent antitumor activity of clerodane diterpenoid from de oleoresin of the Brazilian medicinal plant, Copaiba. Bioorganic and Medicinal Chemistry Letters. 1994;4:2889-92.
7. Lima SRM, Veiga VF, Christo HB, Pinto AC, Fernandes PD. In vivo and in vitro studies on the anticancer activity of Copaifera multijuga Hayne and its fractions. Phytother Res. 2003;17:1048-53. [ Links ]
8. Matos N, Moraes C, Paredes S, Matheus ME, Dias P. Antinociceptive activity of Amazonian Copaiba oils. J Ethnopharmacol. 2007;109:486-92. [ Links ]
9. Kang R, Helms R, Stout MJ, Jaber H, Chen Z, Nakatsu T. Antimicrobial activity of the volatile constituents of Penilla frutescens and its synergistic effects with polygodial. J Agric Food Chem. 1992;40:2328-30.
10. Santos AO, Ueda-Nakamura T, Dias Filho BP, Veiga Junior VF, Pinto AC, Nakamura CV. Antimicrobial activity of Brazilian copaiba oils obtained from different species of the Copaifera genus. Mem Inst Oswaldo Cruz. 2008;103(3):277-81. [ Links ]
11. Basile AC, Sertie JA, Freitas PCD, Zanini AC. Anti-inflammatory activity of oleoresin from Brazilian Copaiba. J Ethnopharmacol. 1998;22:101-9. [ Links ]
12. Paiva LA, Gurgel LA, Silva RM, Tomé AR, Gramosa NV, Silveira ER, Santos FA, Rao VS. Anti-inflammatory effect of kaurenoic acid, a diterpene from Copaifera langsdorfii on acetic acid-induced colitis in rats. Vasc Pharmacol. 2002;39(6):303-7. [ Links ]
13. Lock de Ugaz O. Investigación fítoquímica; métodos en el estudio de productos naturales. 2da edición. Lima: Fondo Editorial Pontificia Universidad Católica del Perú; 1994:33-5.
14. OBrien P, Frydman G, Holmes R, Malcontenti C, Phelan D. Evaluation cytoprotective properties of antiulcer drug using quantitative histological techniques. Dig Dis Scien. 1990;35(9):1130-9.
15. Johnson CE, Cober MP, Ludwig JL. Stability of partial doses of omeprazole-sodium bicarbonate oral suspension. Ann Pharmacother. 2007;41(12):1954-61. [ Links ]
16. Alada ARA, Ajayi FF, Alaka OO, Akande OO. Gastric acid secretion and experimental ulceration in rats fed soybean diet preparations. African J Biomed Res. 2005;8:203-5. [ Links ]
17. Shay M, Kamarov SA, Fels D, Meranze D, Gruenstein H, Siplet H. A simple method for the uniform production of gastric ulceration in the rats. Gastroenterol. 1945;5:43-61.
18. Long JF, Chiu PJS, Derelanko MJ, Steinberg M. Gastric antisecretory and cytoprotective activities SCH28080. J Pharm Exp Therap. 1983;226(1):114-9.
19. Devi RS, Narayan S, Vani G, Shyamala Devi CS. Gastroprotective effect of Terminalia arjuna bark on diclofenac sodium induced gastric ulcer. Chem Biol Interact. 2007;167(1):71-83. [ Links ]
20. Paiva LA, Rao VS, Gramosa NV, Silviera ER. Gastroprotective effect of Copaifera langsdorffii oleo-resin experimental gastric ulcer models in rats. J Ethnopharmacol. 1998;62:73-8. [ Links ]
21. Veiga Junior VF, Rosas EC, Carvalho MV, Henriques MG, Pint AC. Chemical composition and anti-inflammatory activity of copaiba oils from Copaifera cearensis Huber ex Ducke, Copaifera reticulata Ducke and Copaifera multijuga HayneA comparative study. J Ethnopharmacol. 2007;112:248-54. [ Links ]
22. Tambe Y, Tsujiuchi H, Honda G, Ikeshiro Y, Tanaka S. Gastric cytoprotection of the non-steroidal anti-inflammatory sesquiterpene, β-caryophyllene. Planta medica. 1996;62(5):469-70.
23. Dajani EZ, Agrawal NM. Prevention and treatment of ulcers induced by nonsteroidal anti-inflammatory drugs: an update. J Physiol Pharmacol. 1995;46(1):3-16.
24. Santosa AO, Ueda-Nakamurab T, Dias Filho BP, Veiga Junior VF, Pintod AC, Nakamura CV. Effect of Brazilian copaiba oils on Leishmania amazonensis. J Ethnopharmacol. 2008;120:204-8. [ Links ]
25. Paiva LAF, Gurgel LA, Campos AR, Silveira ER, Rao VSN. Attenuation of ischemia/reperfusion-induced intestinal injury by oleo-resin from Copaifera langsdorffii in rats. Life Sciences. 2004;75:1979-87. [ Links ]
26. Laheij RJ, Sturkenboom MC, Hassing RJ, Dieleman J, Stricker BH, Jansen JB. Risk of community-acquired pneumonia and use of gastric acid-suppressive drugs. JAMA. 2004;292(16):1955-60. [ Links ]
27. Sinclair P, Barkun A. Community-acquired pneumonia and acid-suppressive drugs: Position statement. Can J Gastroenterol. 2006;20(2):119-21. [ Links ]
28. Al-Muhtaseb MH, Abu-Khalaf AM, Aughsteen AA. Ultrastructural study of the gastric mucosa and helicobacter pylori in duodenal ulcer patients. Saudi Med J. 2000;21(6):569-73. [ Links ]
Manuscrito recibido el 23 de abril de 2009 y aceptado para publicación el 20 de mayo de 2009.
Correspondencia:
Dr. Jorge Luis Arroyo Acevedo
Sección de Farmacología
Facultad de Medicina, UNMSM.
Av. Grau 750. Lima 1, Perú.
Correo-e: jorgeluis_arroyoacevedo@yahoo.es