Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.70 n.2 Lima jun. 2009
Enfoque actual del aborto recurrente
Current approach in recurrent pregnancy loss
José Pacheco1,2, María Isabel de Michelena3,4, Patricia Orihuela5,6
1 Profesor, Obstetricia y Ginecología, Facultad de Medicina San Fernando, UNMSM. Lima, Perú.
2 ExJefe de la Unidad de Reproducción Humana, Red Asistencial Rebagliati. Lima, Perú.
3 Profesora de Genética, Facultad de Medicina, Universidad Peruana Cayetano Heredia. Lima, Perú.
4 Instituto de Medicina Genética. Lima, Perú.
5 Médico Asistente, Ginecología, Red Asistencial Rebagliati. Lima, Perú.
6 Director Médico, Centro de Fertilidad y Reproducción Asistida - CEFRA. Lima, Perú.
Resumen
El tema de aborto recurrente ha tenido diversos planteamientos, de acuerdo a los progresos en la genética y biología molecular y conforme se avanzó en mejores métodos clínicos de diagnóstico. En la presente revisión, hacemos un alcance sobre los actuales conocimientos sobre la etiología, diagnóstico y manejo del aborto recurrente, así como su repercusión en la pareja que sufre de subfertilidad por esta causa.
Palabras clave: Aborto; aborto recurrente; inmunología; genética, diagnóstico.
Abstract
Recurrent pregnancy loss study approach has been related to progress in genetics and molecular biology as well as better diagnosis methods. In this review we recall current knowledge on the etiology, diagnosis and treatment of recurrent pregnancy loss, as well as its repercussion in the couple with subfertility due to this cause.
Key words: Abortion; abortion, habitual; immunology; genetics, diagnosis.
La pérdida reproductiva es la incapacidad de una gestante para alumbrar un niño vivo; mientras que el aborto recurrente consiste en la presentación de abortos repetidos, dos o más, consecutivos o no (1). De 12 a 15% de abortos recurrentes son embrionarios y 30 a 50% preclínicos (2); su incidencia se estima en 1 a 2% en parejas fértiles (3). En el caso del aborto habitual, se estima que han existido por lo menos tres abortos confirmados. En el campo de la reproducción, es importante evaluar a la pareja que ya tuvo por lo menos dos abortos. En la presente revisión, hacemos un alcance sobre los actuales conocimientos sobre la etiología, diagnóstico y manejo del aborto recurrente, así como su repercusión en la pareja que sufre de subfertilidad por esta causa.
Etiología
Entre las causas reconocidas de aborto recurrente se encuentran los factores genéticos, uterinos, endocrinos, infecciosos, inmunológicos, ambientales, entre otros, así como la edad de la mujer y la presencia de endometriosis. En más de 50% de los casos no se halla la causa (4). Dejaremos para más adelante la revisión de los factores inmunológicos y genéticos dada su mayor importancia. Y es que, en el estudio del aborto recurrente, las causas bien sustentadas son las anormalidades cromosómicas de los padres (ej. translocación), el síndrome antifosfolipídico, el síndrome de ovario poliquístico y la edad materna mayor de 40 años, con compromiso de la reserva ovárica.
Edad
La probabilidad de aborto aumenta con la edad de la mujer. Así, en las mujeres mayores de 40 años, más de la tercera parte de sus embarazos terminan en aborto espontáneo y la mayoría de estos embriones tienen un número anormal de cromosomas (1).
Factores uterinos
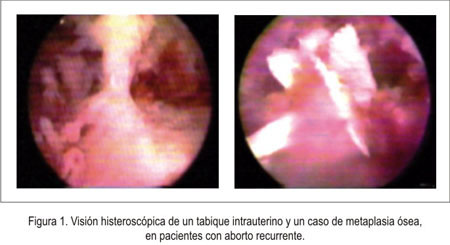
La prevalencia de anormalidades uterinas congénitas es 6,7% a 7,3% en mujeres infértiles y 16,7% en el aborto recurrente, lo que señala su importancia relativa en el estudio del trastorno. El útero arcuato es el hallazgo más frecuente (5). El diagnóstico de estas anomalías se realiza con la histerosalpingografía (6) y mejor, actualmente, con la ultrasonografía 3D (7), la histerosonografía con infusión salina (1) y la histerosalpingografía 3D (8). El manejo consiste principalmente en la resección histeroscópica de los tabiques, adherencias y de los miomas submucosos (9). Sin embargo, no existen estudios controlados que prueben los beneficios de la cirugía (10). (figura 1).
La existencia de la incompetencia cervical es controvertida, considerándose que más bien se trate de hallazgos de un cérvix que se encuentra en fase de acortamiento como parte de la fisiopatología del aborto y no como un problema congénito o adquirido (traumatismos previos). Sin embargo, se evalúa su acortamiento principalmente en el parto pretérmino recurrente, por medio de la ecografía seriada durante el embarazo, y se sugiere el cerclaje cervical vía vaginal o transabdominal (11), aunque por el momento los resultados son contradictorios (12).
Factores endocrinológicos
Los factores endocrinológicos pueden originarse en los componentes del eje sistema nervioso central-hipotálamo-hipófisis-ovario, tal como la controvertida deficiencia de la fase lútea (1); pero también pueden deberse a alteraciones en la tiroides, glándulas suprarrenales, prolactina, insulina, entre otros. Son ejemplos de alteraciones hormonales la hipersecreción de hormona luteinizante (LH), el hipotiroidismo, el hipertiroidismo, el hiperandrogenismo, la hiperprolactinemia, el síndrome metabólico, la resistencia a la insulina, el síndrome de ovario poliquístico (4,13,14). Tradicionalmente, como parte del estudio de los factores desencadenantes de aborto recurrente, se busca un factor endocrino, pero la prevalencia de alteraciones de dicho factor no es mayor en quien aborta que en la población general, por lo que dicho estudio algunos autores no lo consideran necesario (15). De todas maneras, si se encuentra una alteración endocrina, esta debe ser tratada, antes de que la mujer se someta a un nuevo embarazo. En el caso de deficiencia de progesterona, se emplea la inducción de la ovulación, la suplementación con progesterona o la administración parenteral de gonadotropina coriónica humana (hCG), sin actual evidencia que respalde la efectividad de estos tratamientos (1).
Síndrome de ovario poliquístico (SOPQ)
El SOPQ afecta de 5 a 10% de las mujeres en edad reproductiva (16). El Panel de Consenso de Rótterdam sobre el SOPQ, en el año 2003, definió al SOPQ como un síndrome de disfunción ovárica cuyo diagnóstico se hace con dos de las siguientes tres manifestaciones: oligoovulación o anovulación, signos clínicos y/o bioquímicos de hiperandrogenismo y demostración de ovarios poliquísticos por ultrasonido (17). Otras manifestaciones clínicas encontradas son las irregularidades menstruales, signos de exceso de andrógenos (testosterona libre o índice de testosterona libre elevados), obesidad y resistencia a la insulina. El Panel de Consenso hizo hincapié que aún no había criterios seguros sobre los signos clínicos y bioquímicos del hiperandrogenismo.
El manejo del SOPQ también ha sufrido variaciones con el tiempo. Son clásicos los estudios sobre el tratamiento del hirsutismo y acné con anticonceptivos orales, antiandrógenos, glucocorticoides, inducción de la ovulación, resección cuneiforme de los ovarios, manejo de la resistencia a la insulina, entre otros. Y la situación se vuelve más controversial con el manejo en infertilidad, principalmente la anovulación, debido a la alta tasa de embarazos múltiples y al síndrome de hiperestimulación ovárica (18). La tasa de embarazo es significativamente menor que la tasa de éxito en la inducción de la ovulación; además, existe una mayor prevalencia de aborto espontáneo (19).
Recientemente, la reunión de consenso sobre el manejo de los casos de síndrome de ovario poliquístico asociados a infertilidad, desarrollado en Thessaloniki, Grecia, determinó que antes de iniciar cualquier intervención, se debe proveer consejería preconcepcional sobre estilo de vida, disminuir el peso y hacer ejercicios para eliminar el sobrepeso. Asimismo, se debe restringir o eliminar el cigarrillo y el consumo de alcohol, y se sugirió iniciar la ingesta de ácido fólico. Se reafirmó que la primera línea de tratamiento recomendada para la inducción de la ovulación sigue siendo el antiestrógeno citrato de clomifeno. Si fallara el clomifeno, la segunda línea de intervención recomendada consiste en el empleo de gonadotropinas exógenas o la diatermia ovárica vía laparoscópica. La tasa acumulativa de parto con hijo vivo con estos tratamientos alcanza el 72%. Y la tercera línea de tratamiento recomendada es la fertilización in vitro (FIV). El empleo de rutina de la metformina en la inducción de la ovulación no es recomendable a menos que se demuestre hiperinsulinemia. Asimismo, existe evidencia insuficiente para recomendar el uso clínico de inhibidores de la aromatasa en la inducción rutinaria de la ovulación (16).
Infecciones
Entre los microorganismos asociados al aborto recurrente, se incluyen las bacterias (listeria, campylobacter, salmonella, brucella, clamidia, treponema), virus (citomegalovirus, rubeola, herpes, virus de inmunodeficiencia humana, varicela y viruela), micoplasmas (urealíticum, hominis), parásitos (toxoplasma, plasmodium). Se acostumbraba realizar anteriormente el estudio Torch (toxoplasma, rubeola, citomegalovirus, herpes), pero las evidencias indican que estos agentes no tienen importancia como factor causal en el aborto recurrente, por lo que ha dejado de ser utilizado en la evaluación del paciente con aborto recurrente (1,15). Hoy se da importancia a la existencia de infección por clamidia (20-22), para cuyo tratamiento se utiliza doxiciclina 200 mg, dos veces al día, por siete a diez días, o azitromicina 250 mg, dosis única, a ambos miembros de la pareja (23). (figura 2).
Factores nutricionales y ambientales
Relacionados al consumo de café, cigarrillo, alcohol, la hiperhomocisteinemia con deficiencia de ácido fólico, deficiencia de selenio, enfermedad celiaca, estrés, entre otros (4), los que tendrían que ser modificados o suplementados, según el caso.
Endometriosis
Una de las patologías más complejas por la presentación de sus síntomas, evolución y secuelas es la endometriosis, la cual se considera que afecta de 10 a 15% de las mujeres y 30 a 40% de las mujeres infértiles (24). Actualmente se considera que la endometriosis pudiera acontecer en la mayoría de mujeres, sino en todas, en diferentes etapas de su vida (25). La endometriosis consiste en implantes ectópicos de tejido endometrial (26), con efectos sobre el líquido peritoneal, el número y actividad de los macrófagos y los picos de LH. Es causa de dolor pélvico, defecto de la fase lútea, infertilidad y de un mayor número de abortos, embarazos ectópicos y mortinatos. Por ello, se debe considerar el tratamiento quirúrgico en la paciente con aborto recurrente con endometriosis demostrada. La edad media de las mujeres que la padecen es 30 años, durante la etapa de exposición a las menstruaciones (27). Ocurre más en la nulípara y tiene un factor hereditario, aunque el patrón mendeliano no es claro (28).
En el manejo médico de la endometriosis se emplea la medroxiprogesterona, los anticonceptivos orales, la metiltestosterona, el danazol, la gestrinona y los agonistas de la hormona liberadora de gonadotropina (GnRH). La acción de todos ellos es la disminución de la actividad del eje hipotálamo-hipófiso ovárico, con supresión de la función ovárica y de la estrogenicidad, con lo que se tiende a suprimir la función endometrial, las lesiones endometriósicas y la sintomatología de la enfermedad. La resección laparoscópica representa la cirugía menos traumática en la endometriosis mínima, leve y aún moderada, pero la laparotomía es necesaria en ciertos casos de endometriosis moderada y en la endometriosis severa sintomática (25). Es preferible la observación conservadora en las mujeres jóvenes con endometriosis mínima y leve. Utilizamos la supresión hormonal con danazol o agonistas de GnRH solo en la enfermedad asociada a dolor pélvico o si se va a posponer la maternidad. Cuando se decide por la fertilización asistida de baja complejidad, se emplea clomifeno o gonadotropinas e inseminación intrauterina concomitante, inmediatamente después de la laparoscopia quirúrgica y sin utilizar supresión hormonal, ya que el uso previo de danazol y agonistas de GnRh no tiene beneficio en cuanto a lograr una mayor tasa de embarazo. En la infertilidad prolongada y en la infertilidad multifactorial se pasa directamente a la fertilización de alta complejidad (FIV-TE, ICSI, GIFT) ante la falla de otros tratamientos.
Factores inmunológicos
La infertilidad y las pérdidas recurrentes del embarazo pueden ser ocasionadas por defectos y excesos en las defensas inmunológicas normales del organismo. Los trastornos pueden ser de tipo autoinmune o aloinmune.
- Desórdenes autoinmunes
Se estima que el síndrome antifosfolipídico puede ser causa en 3 a 15% de abortos recurrentes (1). Con relación a los mecanismos patogénicos de los anticuerpos antifosfolipídicos, estos actúan sobre los fosfolípidos de las células endoteliales y plaquetas, produciendo enfermedades tromboembólicas e hipercoagulación. Sin embargo, no existe consenso en los mecanismos del efecto autoinmune del anticuerpo antifosfolípido, aunque puede haber vasculopatía de las arterias espirales terminales (29,30). Entre las nuevas hipótesis de la actividad en el síndrome antifosfolípido (SAF), se señala el rol de los anticuerpos patógenos a la glicoproteína I beta2 (beta2GPI) y las señales de receptores parecidos a aduaneros (toll-like), en las oclusiones microvasculares. En los síndromes microangiopáticos (Hellp, púrpura trombocitopénica trombótica y síndrome microangiopático trombótico), no serían patógenos (31-33). También se hace énfasis en la variante catastrófica del SAF –ya descrita desde el año 1992-, con distintos factores desencadenantes, diferente presentación clínica y un pronóstico pobre. Así también, se señala un síndrome seronegativo, no claro (34). Se describe la alteración de la vía del factor tisular, que conduce a hipercoagulabilidad en las pacientes con anticuerpos antifosfolípidos (35).
En la tabla 1 se puede observar las consecuencias de la actividad de los anticuerpos antifosfolípidos en la reproducción y gestación.

En el aborto recurrente se estudian los anticuerpos antifosfolípidos (anticoagulante lúpico y anticuerpos anticardiolipina IgG - IgM y otros), los anticuerpos antinucleares, perfil de coagulación (tiempo parcial de protrombina activado).
La profilaxis de la pérdida del embarazo en el SAF consiste en la administración de prednisona (40 a 60 mg/día), que disminuye o suprime la producción de anticuerpos antifosfolípidos. Está indicada si otras alternativas terapéuticas fracasan o se presenta trombocitopenia. Son efectos colaterales la úlcera péptica, el síndrome de Cushing, osteoporosis, diabetes gestacional, susceptibilidad a infecciones, rotura prematura de membranas, parto pretérmino, preeclampsia.
La aspirina (80 mg/día) disminuye la agregación plaquetaria y estimula la producción de interleuquina 3 (IL-3). Está indicada en pacientes con títulos bajos de anticuerpos antifosfolípidos y aborto recurrente, además en aquellas pacientes con niveles persistentemente elevados de anticuerpos antifosfolípidos sin aborto recurrente.
Algunos autores consideran que, a las mujeres con SAF confirmado se les debe ofrecer tratamiento de anticoagulación antes y durante los embarazos subsiguientes (36-39). El manejo es con heparina de peso molecular bajo, 5 000 UI a 15 000 UI/ 24 h. En la mujer con historia de trombosis o aborto recurrente y títulos altos, se la emplea unida a aspirina, con mucho éxito. Hay que tener cuidado de los efectos secundarios, que son la osteoporosis y el riesgo de sangrado (40-42). Recientemente, se comunica que la prednisona en dosis alta y baja duración administrada conjuntamente con progesterona y aspirina es igualmente efectiva que la enoxaparina sola (43).
Existen pocos estudios sobre la eficacia y seguridad de la aspirina y la heparina en mujeres con historia de al menos dos abortos sin causa aparente, fuera de los casos de trombofilia hereditaria. En dos ensayos, no se encontró beneficio de un tratamiento sobre el otro. Por lo tanto, en una revisión sistemática, se recomendó no usar anticoagulantes en el aborto recurrente, requiriéndose ensayos aleatorios controlados grandes (44).
La administración de gamaglobulina por vía intravenosa modifica las proteínas anexina I, anexina Iim isomerasa disulfídica, Nedd8, proteínas RhoA, Hsp60, fibrinógeno, Hg (45). Se la usará cuando otros tratamientos han fracasado o se presentaron complicaciones obstétricas. Se debe tener cuidado con la reacción anafiláctica, isoinmunización, sida, hepatitis, meningitis aséptica.
- Desórdenes aloinmunes en el embarazo y reproducción
La respuesta inmunológica de la madre hacia la unidad fetoplacentaria se estudia como posible causa de abortos recurrentes. No se desarrolla inmunotolerancia hacia el concepto semialogénico, que es el embrión. La influencia del genotipo paterno no siempre es tomado en cuenta (46), pero varios estudios encuentran que cuando el padre y la madre comparten antígenos HLA, la madre y el feto resultan homocigotos entre sí para varios de estos loci, hecho que paradójicamente parece dificultar la protección inmunológica de la madre hacia el feto, produciéndose el aborto espontáneo, por rechazo inmunológico (47). Las reacciones inmunitarias celulares y humorales involucradas son, entre otras, los antígenos leucocíticos humanos (HLA), factores supresores, factores bloqueadores, anticuerpos antipaternos leucocitotóxicos anti HLA. Por ello, la evaluación debería incluir la tipificación HLA, el cultivo linfocítico mixto, cross-matching matrimonial, anticuerpos HLA y el factor embriotóxico. Lo anterior no es aceptado universalmente, ya que existen estudios que refutan esta hipótesis (48).
El balance entre la inmunidad celular (Th1) representada por los linfocitos T y sus citoquinas IL-2, TNF-α e IFN-γ y la humoral (Th2), efectuada por los linfocitos B y las citoquinas IL-4, IL-5, IL-10, parece tener un papel importante en el mantenimiento de la gestación, desde el punto de vista inmunológico, y podría estar en parte regulada por la progesterona (49-51). Otro estudio encontró que las células T endometriales tienen un repertorio del gen del receptor de la célula T beta variable (TCRBV) alterado, en casos de aborto recurrente, con restricción de la heterogeneidad de transcripción, lo que se atribuye a una posible exposición reciente o repetida a antígenos nominales o superantígenos (52). También se ha encontrado activación inmunológica de los linfocitos T y las células asesinas naturales (NK), con alteración del balance de receptores inhibitorios y activadores (KIRs) en las células NK uterinas durante la fase media lútea de pacientes con aborto espontáneo recurrente inexplicado (48,53,54). Sin embargo, muchos de los estudios que tratan de hallar una causa inmunológica son preliminares o contradictorios (1,55).
En el manejo de los desórdenes aloinmunes, la inmunoterapia puede ser activa o pasiva. La inmunoterapia activa consiste en la transfusión de linfocitos paternos, infusión de extractos trofoblásticos, soluciones de lípidos por vía subcuténea, intravenosa o subdérmica. En la inmunoterapia pasiva, se emplea la gamaglobulina IV 400 mg/kg/día, por 5 días, cada mes. Con relación a la inmunización con leucocitos paternos, el tratamiento exitoso del aborto recurrente debería modificar las respuestas Th1. Sin embargo, aunque la inmunización con leucocitos paternos ha sido usada por años, por diferencias metodológicas aún no existe consenso en el mecanismo de acción y su efectividad (1,56). Un estudio sobre inmunoterapia encontró que el aumento de células NK en el aborto recurrente, tanto en gestantes como no gestantes, disminuyó con el empleo de inmunoglobulina EV (0,5 g/kg peso), con 92,3% de embarazo exitoso (57). El tratamiento con inmunoglobulina EV representa, en el aborto recurrente, una alternativa a la inmunoterapia con leucocitos alogénicos, obteniéndose embarazo en 80% de los casos. Sin embargo, también hay éxito de embarazo en 60% de mujeres con tres abortos espontáneos sin recibir tratamiento alguno; lo que señala que habría un efecto placebo. Así, un estudio aleatorio alemán multicéntrico y doble ciego, no pudo verificar el efecto terapéutico específico de este tratamiento, cuando se le comparó con la administración de albúmina humana al 5% como placebo (58). La evidencia sobre la inmunoglobulina EV indica que este tratamiento se asocia con mayor tasa de nacimiento vivo en el manejo del aborto recurrente secundario, comparado con placebo, pero todavía con evidencia insuficiente para su empleo en el aborto recurrente primario (1,59). También, se observa que la administración de inmunoglobulina EV asociada al inhibidor del factor de necrosis tumoral (TNF) mejora la tasa de niños vivos comparado con la administración aislada de anticoagulantes; aún se requiere ensayos clínicos prospectivos (60).
Una revisión sobre las evidencias en la terapia inmune en el aborto recurrente encontró 20 ensayos de alta calidad, que señalaban que la inmunización con células paternas, donación de leucocitos, membranas trofoblásticas y globulina inmune EV no proveen efecto benéfico significativo sobre el placebo en mejorar la tasa de parto con niño vivo (61,62). En general, los tratamientos con aspirina más heparina, inmunoglobulinas IV, corticoesteroides y transferencia de células sanguíneas alogénicas portadoras de antígenos paternos pueden mejorar la tasa de niños vivos. Sin embargo, se requiere mejor diagnóstico de los subgrupos que responden a alguno de los tratamientos específicos, por existir fallas y errores de los protocolos inmunológicos existentes. Así como, determinar el cariotipo del embrión perdido (63).
Podemos concluir en esta sección de pérdida recurrente del embarazo que, dado el excelente resultado para la mayoría de parejas con aborto recurrente inexplicado en ausencia de tratamiento, es difícil recomendar terapias no probadas, especialmente si son invasivas y caras (64). El reto continuo será identificar apropiadamente los mecanismos mediados inmunológicamente asociados con el aborto recurrente, para así tratar apropiadamente cada paciente de manera individual (65).
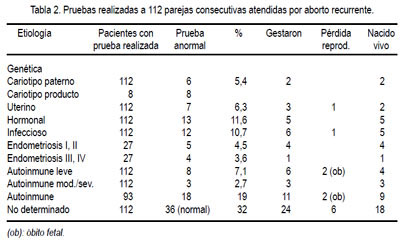
Durante el año 2003,en el Hospital Nacional Edgardo Rebagliati Martins - Lima, perteneciente a la seguridad social del Perú, tuvimos la oportunidad de hacer estudios autoinmunes y aloinmunes, así como genéticos, en pacientes con historia de aborto recurrente. Los resultados de los estudios realizados en 112 pacientes se muestran en la tabla 2.
A todas estas parejas se les realizó historia clínica detallada, perfil hormonal (FSH, estradiol, prolactina, progesterona, perfil tiroideo, reserva ovárica condicional), biopsia de endometrio, ecografía, antígeno para clamidia de secreción uretral (hombre) y secreción de cérvix uterino. Hubo factor uterino en 6%, hormonal en 12%, infeccioso en 11%, endometriosis en 11% y no se pudo establecer la causa del aborto en 36 pacientes (32%). Se observa en la tabla que, desde el punto genético, se encontró anormalidad en el cariotipo de los padres con aborto recurrente en 5,4% (6 casos). La mayor parte de las mujeres (41%) tenía entre 31 y 35 años de edad. El cariotipo del producto fue anormal en todos los casos que se pudo estudiar. Con relación al estudio inmunológico, para el estudio autoinmune se solicitó anticoagulante lúpico y anticuerpo anticardiolipina, tiempo de tromboplastina parcial activada y anticuerpos antinucleares; y, para el estudio aloinmune, tipificación HLA (se consideró aloinmune positivo cuando la pareja compartía 3 o más antígenos HLA), anticuerpos HLA (89% de la población de estudio no los presentó, a pesar del estímulo del embarazo; no fue considerada como prueba para definir la población aloinmune positiva), cultivo linfocitario mixto (se realizó en tres pacientes, las cuales gestaron y llegaron a término, a pesar de no revelar presencia de anticuerpos bloqueadores), cross matching matrimonial (se realizó en 7 pacientes; en 6 fue negativa, pero gestaron y tuvieron recién nacido vivo), DQA1.0401 (se consideró aloinmune positiva cuando la pareja compartía este antígeno HLA). Hubo 11 pacientes (10%) con factor autoinmune positivo; se obtuvo 9 gestaciones, con dos óbitos fetales y 7 recién nacidos vivos. Del estudio aloinmune, en 18 casos (19%) fue anormal, 11 gestaron, hubo 2 óbitos fetales y 9 tuvieron recién nacido vivo.
Con estos resultados, la Unidad de Reproducción Humana concluyó que la determinación del cariotipo de los padres es importante para un consejo genético adecuado. En todas las pacientes en quienes se realizó el cariotipo del embrión, se encontró una cromosomopatía, sugiriendo la importancia del factor genético como causa del aborto. En los casos que presentaron anticuerpos antifosfolípidos (9,8%), el manejo adecuado permitió una tasa alta de éxito en la evolución del embarazo. De los resultados, podemos concluir que no existe manera bien definida de diagnosticar adecuadamente el fallo del reconocimiento inmunológico del feto alogénico por parte de la madre. Las pacientes que lograron recién nacido vivo con problema aloinmune no recibieron terapia específica para este problema. Ni la determinación de anticuerpos HLA, ni la serotipificación HLA en las parejas, ni la detección de anticuerpos bloqueadores poseen significado diagnóstico o pronóstico del embarazo, lo que cuestionaría fuertemente el uso de inmunoterapia.
Genética en el aborto recurrente
Una proporción considerable de abortos espontáneos es causada por anomalía cromosómica del producto de la concepción, y lo mismo se aplica en caso del aborto recurrente. El porcentaje en que se encuentra anomalía cromosómica en uno y otro caso varía ligeramente en los diferentes estudios, dependiendo de los métodos empleados, la población estudiada y, sobre todo, la inclusión o no de abortos tardíos y óbitos fetales en la muestra. Pero, en todos ellos, la anomalía de cromosomas constituye la primera causa de pérdida gestacional, recurrente o no (66,67). Además, en cada familia con pérdida recurrente, esta tiende a ser, o recurrentemente anómala o recurrentemente normal (47).
Para sistematizar el estudio del aborto recurrente, podemos dividir la población en dos grandes grupos: el primer grupo corresponde a las pérdidas recurrentes, en las que hay anormalidad cromosómica del embrión- heredada o no-, que constituye entre el 50 y 60%; y, el segundo grupo, a los abortos múltiples con cariotipo normal, que son más frecuentes en las mujeres jóvenes, en quienes predominan las causas maternas (68).
- Aborto relacionado con anomalía de cromosomas
Alteraciones no heredadas. Las trisomías de cromosomas autosómicos son causa de más de 70% de las pérdidas gestacionales en mujeres mayores de 36 años, en quienes la disminución de reserva ovárica y otros factores propician la falta de separación de las cromátides durante la meiosis, especialmente en la meiosis 1 (69-71). La alta incidencia de aneuploidías espontáneas en este grupo etario hace posible que el aborto sea recurrente, mostrando diferente trisomía en cada gestación, y sin implicar factores propiamente hereditarios.
Entre las mujeres jóvenes también se ha demostrado recurrencia en quienes tienen un aborto aneuploide; la probabilidad de aneuploidía en subsecuentes gestaciones es mayor que la correspondiente a su edad (70,72,73). Este hecho sugiere que hay un subgrupo de mujeres (o parejas) jóvenes que, por razones genéticas, tendrían tendencia a la no disyunción cromosómica, hecho que tiene implicancia en la asesoría genética respecto a riesgo de nuevos abortos y también síndrome de Down y otros defectos de cromosomas. Mientras no se conozca los factores biológicos que condicionan esta tendencia, no hay forma de identificar a este subgrupo en riesgo.
Los eventos que ocurren durante la profase de la meiosis 1 son esenciales para la separación (disyunción) apropiada de los cromosomas homólogos y las variaciones en los diferentes genes que intervienen en este proceso pueden condicionar una tendencia a gametos aneuploides, femeninos o masculinos (74). El reciente descubrimiento de mutaciones del gen SYCP3 en un porcentaje importante de mujeres con aborto recurrente es un aporte importante a este concepto, por cuanto este gen codifica una proteína del complejo sinaptonémico (73).
Entre las parejas jóvenes con aborto recurrente por diferentes aneuploidías, estas no necesariamente se originan en el gameto femenino; también puede estar implicado el factor masculino. Se ha demostrado aumento de espermatozoides con aneuploidías detectados por FISH en algunos de estos casos (46) y en otros de infertilidad primaria o fracaso de la implantación en FIV. Se sabe que el embrión que no se implanta, con frecuencia tiene anomalía cromosómica (47) y, desde el punto de vista genético, podría ser equivalente al aborto recurrente muy temprano. Por otra parte, en el caso relativamente frecuente de aborto por monosomía de X y también en las nacidas vivas con síndrome Turner, es más frecuente que la no disyunción meiótica de los cromosomas sexuales haya ocurrido en el gameto masculino (46,47).
En las parejas con mayor riesgo de aneuploidía hay también menos probabilidad de éxito en una fecundación in vitro, ya que los embriones generados por ellos presentan altos índices de aneuploidía en el examen cromosómico preimplantacional (75).
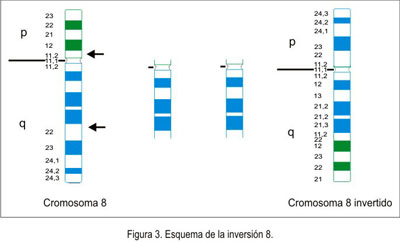
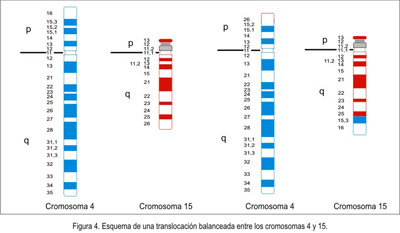
Alteraciones heredadas. Cuando no se conoce la composición cromosómica de los embriones o fetos abortados, o cuando se encuentra en el aborto una anomalía, no en el número, sino en la estructura de algún cromosoma, debe tomarse en cuenta que este tipo de defecto podría haber sido heredado de alguno de los padres. Es necesario entonces examinar los cromosomas de la pareja en busca de algún defecto equilibrado o balanceado; esto es, que ciertos segmentos de los cromosomas cambian su posición geográfica en el mapa cromosómico, sin que esto ocasione pérdida o ganancia de material genético importante.
Las inversiones (figura 3) y las translocaciones cromosómicas balanceadas (figura 4), en cualquiera de los padres, son causas destacadas de aborto recurrente; una en 500 personas (0,2%) en la población es portadora de translocación u otro rearreglo cromosómico equilibrado; pero, en quienes tienen abortos a repetición, las anomalías equilibradas se las encuentra en alguno de los miembros, en 3 a 8% de estas parejas (15,46,47,76,77). Cuando un miembro de la pareja porta una translocación cromosómica balanceada, el riesgo teórico de concepción con anomalía no balanceada es muy alto, alrededor de 50%, en el caso de translocaciones recíprocas y robertsonianas, y se puede reflejar no solo en aborto recurrente sino también en dificultad o imposibilidad para gestar o en el nacimiento de niños con anomalías fenotípicas por monosomía o trisomía parciales, como consecuencia de la translocación. Sin embargo, el riesgo empírico para estas ocurrencias puede diferir del teórico, dependiendo del sexo del padre portador, del tamaño del segmento cromosómico implicado en el rearreglo, y de otras variantes, por lo que cada caso debe ser evaluado individualmente (46,78,79). La historia familiar y otros diversos factores influencian la probabilidad de una determinada persona de ser portadora de un rearreglo cromosómico y permiten una asesoría genética más exacta. Por ello, es importante hacer una cuidadosa anamnesis en la pareja con aborto recurrente (76).
La introducción reciente de nuevas técnicas de citogenética molecular -como la hibridación genómica comparativa (CGH) y sus variantes usando microchips de ADN (array CGH) (79,80)- están contribuyendo a esclarecer la etiología de casos idiopáticos, mediante la detección de anomalías cromosómicas submicroscópicas, tanto en el producto abortado como en parejas con pérdida recurrente, en quienes el cariotipo no mostraba alteraciones visibles. Estos exámenes aplicados a embriones obtenidos por FIV, en etapa preimplantacional, revelan también la gran frecuencia (más de 50%) de anomalías cromosómicas espontáneas en las concepciones humanas (80), lo que sugiere que la pérdida gestacional temprana en la mayoría de los casos es simplemente un mecanismo regulatorio que elimina embriones no viables que excepcionalmente llegaron a implantarse. En muchos de estos casos, el diagnóstico preimplantación puede ayudar a evitar la recurrencia.
Diagnóstico genético preimplantación
El diagnóstico genético preimplantación (DGPI o PGD, por sus siglas en inglés) mejora el resultado del embarazo en el aborto recurrente idiopático, especialmente cuando ha habido más de 2 abortos y la mujer es mayor de 35 años. El DGPI disminuye la tasa de aborto espontáneo en mujeres fértiles (15,2% vs. 33,8% esperado) e infértiles (13,0% vs. 29,5%). El beneficio es menor en mujeres con edad menor a 35 años que en la mayor de 35 años (13,6% vs. 34,0% esperado). En general, el DGPI disminuye la tasa de aborto a 14% a 16% (81). El diagnóstico genético preimplantación es de beneficio en 3 subgrupos de pacientes con aborto recurrente: a) parejas con translocaciones u otros rearreglos cromosómicos; b) mujeres mayores de 35 años; y, c) mujeres de cualquier edad con abortos debidos a aneuploidías fetales (82). El DGPI con FISH es efectivo en el diagnóstico de algunas aneuploidías y de translocación Robertsoniana y translocación recíproca, equilibrada o no, en el embrión, lo que permite seleccionar los embriones más aptos para ser implantados; de esta manera, se obtiene una tasa alta de implantación y embarazo y se evita el aborto recurrente (78,83-86).
Sin embargo, no todo es positivo en el diagnóstico genético preimplantación, pues ensayos aleatorios recientes ponen en duda su eficacia en mujeres de edad avanzada. Además, los casos de fallas de implantación recurrente y aborto recurrente de etiología no conocida no han sido sometido a ensayos aleatorios controlados (87).
- Aborto recurrente no relacionado con anomalía de cromosomas
Aproximadamente el 40% de los casos de aborto recurrente no se relaciona con defectos de cromosomas. Esta situación es más frecuente cuanto mayor es el número de pérdidas y menor la edad de la paciente (68). Cuando en el producto de la gestación se encontró un cariotipo normal o cuando este no pudo ser analizado, pero en la pareja con pérdida recurrente no hay defectos visibles de cromosomas, es necesario investigar otras causas, maternas o fetales, muchas de las cuales tienen también un origen genético. Numerosos genes, de los cuales solo una fracción es actualmente conocida, intervienen en los procesos necesarios para llevar a cabo la culminación del embarazo, y la alteración en algunos de ellos puede ser causa de pérdida gestacional.
Estudios epidemiológicos y genéticos que indican agregación familiar de aborto recurrente (26) sugieren que muchas de las causas maternas son multifactoriales, determinadas por la interacción de múltiples variantes genéticas o polimorfismos (alelos de riesgo) y factores ambientales, no siempre identificados. Existen variantes asociadas con respuestas inflamatorias excesivas y autoinmunidad, sensibilidad y metabolismo de la insulina y andrógenos, trombofilia y otros, que son revisadas a continuación. Su identificación requerirá de estudios de asociación genómica en miles de individuos (68,88).
El síndrome antifosfolípido, discutido en otro acápite de este artículo, muestra, en algunos casos, agregación familiar, que sugiere herencia dominante con penetrancia incompleta, aunque los genes causantes aún no han sido identificados (89).
La trombofilia materna es otra de las posibles causas genéticas de aborto recurrente. Los polimorfismos de nucleótidos simples de los genes que codifican factores de coagulación más frecuentemente asociados a trombofilia son el factor V Leiden (1691G>A), la mutación 20210G>A del gen de la protrombina y la variante 677C>T del gen 5, 10-metilenetetrahidrofoliato reductasa, que produce homocisteinemia (90-92).
En las portadoras del factor V Leiden, el estado hipercoagulable más común, y en las portadoras de la mutación del gen de la protrombina, la probabilidad de pérdida gestacional, muchas veces tardía, es casi tres veces mayor que en mujeres no portadoras (92). Sin embargo, ningún gen actúa aisladamente; hay interacción del factor V Leiden con el gen del receptor de la proteína C endotelial (EPCR), que actúa como modulador; así, el haplotipo A1 del locus EPCR disminuye el riesgo relativo de aborto recurrente, de 2,2 a 1,0, en las portadoras del factor V Leiden (93). La trombofilia y la autoinmunidad tiroidea son la segunda causa más común, luego de la aneuplodía del embrión, de aborto recurrente y de falla de la implantación en FIV, y también se encuentran con mayor frecuencia en mujeres con infertilidad idiopática, lo que sugiere mecanismos comunes entre estas tres condiciones (90).
En las mujeres con aborto recurrente inexplicado, muerte fetal en la segunda mitad del embarazo o con historia personal y/o familiar de tromboembolismo, es importante realizar un tamizaje para trombofilia. De ser anormal, el siguiente paso es la detección de la mutación en el gen respectivo, un procedimiento sencillo que solo requiere de una muestra de sangre. Si el resultado es positivo, se requerirá, entre otras cosas, de asesoría genética para la familia. Para el manejo con aspirina o heparina, en estos casos, especialmente cuando hubo antecedentes de trombosis venosa profunda, debe evaluarse riesgos contra beneficios y contar con asesoramiento de un hematólogo (44,92).
Expresión de genes relacionados con la implantación
La implantación exitosa requiere que el blastocisto invasor consiga su propia provisión de sangre, por medio de la angiogénesis. Se conoce que el factor de crecimiento de endotelio vascular (VEGF) es el regulador mejor caracterizado de la angiogénesis. Algunas variantes, como la homocigosidad para el alelo VEGF -1154 A/A, son factores de riesgo para falla recurrente de implantación (94-96).
Durante la ventana de implantación -un periodo de receptividad endometrial máxima que ocurre entre 7 y 9 días después de la ovulación-, ocurre una serie de modificaciones estructurales y moleculares que hacen al endometrio susceptible a la implantación del embrión. Algunos de los genes que intervienen codifican citoquinas y moléculas de adhesión y la alteración en la expresión de dichos genes se asocia con infertilidad y aborto recurrente precoz (97). También, Lee (98) encontró diferencias de expresión entre 29 genes relacionados con la implantación durante el período de ventana y, en el estudio de Rull, se relacionó la pérdida recurrente con variantes de los genes de las gonadotropinas (3).
Las cascadas de factores de transcripción, intermediarios, moléculas efectoras y genes del tipo Homeobox, que controlan los procesos de invasión trofoblástica, perfusión y oxigenación al inicio del embarazo, continúan siendo estudiados, y el tema ha sido revisado recientemente (99).
Otras causas genéticas a tomar en cuenta son las enfermedades letales en el feto varón, los defectos congénitos del feto y ciertas enfermedades maternas hereditarias, como la distrofia miotónica, que pueden ser causa de aborto repetido y que pueden ser sospechadas a través de una adecuada anamnesis (99).
Respecto al factor masculino en el aborto recurrente, para algunos autores ciertas alteraciones en el espermatograma (hinchazón hipoosmótica, estado del acrosoma y descondensación de la cromatina nuclear), que sugieren anomalía cromosómica del espermatozoide y ocasionan un menor puntaje de función espermática, podrían tener relación con aborto recurrente, ya que se puede desarrollar un embrión que se pierde tempranamente (100-102). El análisis por FISH de los núcleos de los espermatozoides, antes de fertilización in vitro en casos de aborto recurrente o falla múltiple de FIV, puede ser útil en casos excepcionales en que se sospeche mosaicismo gonadal (103). Por último, la prevalencia de microdeleción del cromosoma Y en la región AZF es mayor en el aborto recurrente (46,104); esta anomalía, que hasta hace poco se consideraba relacionada solo con infertilidad por azoospermia u oligospermia severa, es fácilmente detectable con un estudio molecular, y debería ser investigada siempre que vaya a realizarse procedimientos como el ICSI. Así vemos que el hombre puede contribuir en la incidencia de aborto recurrente por factores genéticos, de semen o por edad (46).
Por último, recién se empieza a comprender ciertos factores epigenéticos relacionados tanto con mola hidatidiforme como con diferente expresión de ciertos genes, aunque la secuencia de ADN no presente cambios (105). Y si tomamos en cuenta que muchas veces el aborto recurrente es familiar y que otras causas de aborto revisadas en este artículo, por ejemplo algunas malformaciones uterinas (7), pueden ser transmitidas, debemos asumir que la influencia de los factores genéticos es aún mayor de lo que se supone actualmente. Mientras que la causa no sea identificada para cada caso, no existe un tratamiento específico a seguir.
Una opinión reciente de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) sobre aspectos genéticos en la reproducción femenina señala que la reproducción sexual provee los medios para preservar la identidad genética y, a su vez, la variabilidad genética puede afectar la posibilidad de reproducción. La búsqueda de información en Medline y otras bases de datos encuentra que una herencia genética compleja puede explicar los lazos familiares variables en el síndrome de ovario poliquístico y la endometriosis, pero aún no se conoce las vías genéticas definitivas (106).
La guía de evaluación genética en el aborto recurrente del Grupo de Trabajo de Pérdida del Embarazo Hereditario, de la Sociedad Nacional de Asesoría Genética (National Society of Genetic Counselors), de los EE UU, señala las siguientes pautas a ser desarrolladas durante la evaluación de la pareja (107) (tabla 3).

Manejo farmacológico del aborto recurrente
En el aborto recurrente se ha señalado la evaluación diagnóstica de los factores uterinos, endocrinos, infecciosos, ambientales, inmunológicos y genéticos, así como de la endometriosis. Es posible que se encuentre la causa –p.ej., tabiques uterinos, hiperprolactinemia, endometriosis, clamidia, cigarrillo, etc.-, lo que permitirá un tratamiento etiológico. Pero muchas veces, la causa no se encuentra –es inexplicada- o los tratamientos fallan en obtener un embarazo normal con nacido vivo. Hemos visto las controversias con relación a los tratamientos histeroscópicos, de la endometriosis, los problemas inmunológicos, entre otros. Desde luego, las pacientes con problemas cromosómicos tienen que ser referidos al genetista para asesoría genética. Hoy se considera la donación de gametos o la adopción, y el diagnóstico genético preimplantación o el prenatal, en embarazos posteriores. Mientras tanto, existe la recomendación de ciertos fármacos que pudieran asociarse con embarazos exitosos en el aborto recurrente.
Entre los agentes prometedores en modular el balance Th1/Th2 están los progestágenos, como progesterona y didrogesterona, que pueden modular la producción de citoquinas asociadas al aborto recurrente (108,109), como ya se ha expresado anteriormente. En términos de salud materna, la deficiencia de vitamina B12 puede ser causa de infertilidad o aborto recurrente (110,111), así como se recomienda administrar ácido fólico por la alta frecuencia de mutación heterocigota y homocigota para MTHFR C677T (112). En otra investigación por aborto recurrente, la administración de N-acetil cisteína 0,6 g asociada a ácido fólico 500 mg/día aumentó significativamente el número de embarazos de más de 20 semanas y de nacimientos vivos, comparado con la administración sola de ácido fólico (113). En mujeres con enfermedad celiaca y aborto recurrente, sin otras causas, se ha encontrado beneficio con la dieta libre de gluten (114).
Entre otros, se ha publicado que los óvulos de sildenafil, 25 mg intravaginal, 4 veces por día, por 36 días, mostraron disminución significativa de la actividad de las células asesinas naturales (NK) en sangre periférica y aumento del grosor endometrial, en pacientes con historia de aborto recurrente (115).
No debemos olvidar que las mujeres con aborto recurrente tienen el puntaje más bajo (comparadas con mujeres con embarazos de riesgo alto) en autoestima, en cada escala clínica, con diferencias estadísticamente significativas (116), por lo que este aspecto psicológico tiene que ser tenido en cuenta en el manejo respectivo.
Conclusiones
En el manejo del aborto recurrente, si se identifica una causa específica, hacer el tratamiento directo. La aspirina asociada a la heparina para el síndrome antifosfolipídico y el tratamiento de la vaginosis bacteriana entre las 10 y 22 semanas del embarazo con clindamicina son los únicos tratamientos probados por ensayos aleatorios controlados. Existe controversia con el empleo de la heparina en el tratamiento de las trombofilias heredadas, de la bromocriptina en la hiperprolactinemia y la supresión de LH en las pacientes fértiles con síndrome de ovarios poliquísticos. En la amenaza de aborto en el aborto recurrente o si no se encuentra una causa, el tratamiento es empírico. La didrogesterona, derivado de la progesterona, parece ser de ayuda. No se ha probado el beneficio del reposo en cama y no tener relaciones sexuales. Es controversial el empleo de relajantes uterinos, hCG, inmunoterapia y vitaminas, en el aborto recurrente (117). Como se ha recordado en el aspecto genético, las parejas cuyo estado de portador de anormalidad cromosómica se confirma después de dos o más abortos, tienen un riesgo real que es mejor que el teórico de descendencia con anormalidades cromosómicas no balanceadas (47,118), debido a que casi todos los embriones concebidos con aneuplodías parciales se abortarán espontáneamente.
Se ha encontrado un aumento no significativo de riesgo de preeclampsia en mujeres con aborto recurrente y en mujeres tratadas por infertilidad; el odds ratio aumenta a 2,4 cuando se combina ambos riesgos, habiendo la hipótesis de que la infertilidad, el aborto recurrente y la preeclampsia comparten elementos de factores etiológicos comunes (119).
Tres cuartas partes de las mujeres con aborto recurrente tendrán un embarazo exitoso (1) sin que se les ofrezca nada más y nada menos que ternura, calidez y tranquilidad (15). Y sobre todo, no emplear tratamientos alogénicos, que, además de caros, pueden causar daño eventual a la receptora, y las evidencias no han podido demostrar una clara ventaja. Siempre considerar el estudio genético de la pareja y del producto de la concepción, por los hallazgos cada vez más abundantes de alteraciones génicas en el aborto recurrente.
REFERENCIAS BIBLIOGRÁFICAS
1. American Society for Reproductive Medicine. Recurrent pregnancy loss. Patients fact sheet. Disponible en: http://www.asrm.org/Patients/FactSheets/recurrent_preg_loss.pdf Obtenido el 30 de marzo de 2009.
2. Wilcox AJ, Weinberg CR, OConnor JF, Baird DD, Schlatterer JP, Canfield RE, Armstrong EG, Nisula BC. Incidence of early loss of pregnancy. N Engl J Med. 1988;319(4):189-94. [ Links ]
3. Rull K, Nagirnaja L, Ulander VM, Kelgo P, Margus T, Kaare M, Aittomäki K, Laan M. Chorionic gonadotropin beta-gene variants are associated with recurrent miscarriage in two European populations. J Clin Endocrinol Metab. 2008 Dec;93(12):4697-706. [ Links ]
4. Li TC, Makris M, Tomsu M, Tuckerman E, Laird S. Recurrent miscarriage: aetiology, management and prognosis. Hum Reprod Update. 2002;8(5):463-81.
5. Saravelos SH, Cocksedge KA, Li TC. Prevalence and diagnosis of congenital uterine anomalies in women with reproductive failure: a critical appraisal. Hum Reprod Update. 2008;14(5):415-29. [ Links ]
6. Bustamante S, Pacheco J. Valor diagnóstico de la histerosalpingografía en infertilidad. Ginecol Obstet (Perú). 2000:46(1):29-32.
7. Puscheck EE, Cohen L. Congenital malformations of the uterus: the role of ultrasound. Semin Reprod Med. 2008;26(3):223-31. [ Links ]
8. Kupesic S, Bjelos D, Kurjak A. Three-dimensional ultrasound in the assessment of infertility. Ultrasound Rev Obstet Gynecol. 2001;1:149-66.
9. Pacheco J, Ángeles, R, Ishihara J, Orihuela P, Zúñiga C. Gestación en parejas con infertilidad. Experiencia en el Hospital Nacional E. Rebagliati Martins, EsSalud. Rev Per Ginecol Obstet. 2005;51(2):69-79.
10. ACOG: Practice Bulletin. 2001;24. American College of Obstetricians and Gynecologysts, Uterine fibroids. Education pamphlet AP074. Disponible en: www.acog.org/publications/patient_education/bp074.cfm - 23k
11. Fechner AJ, Alvarez M, Smith DH, Al-Khan A. Robotic-assisted laparoscopic cerclage in a pregnant patient. Am J Obstet Gynecol. 2009;200(2):e10-1. [ Links ]
12. Berghella V, Seibel-Seamon J. Contemporary use of cervical cerclage. Clin Obstet Gynecol. 2007;50(2):468-77. [ Links ]
13. Adashi EY. Genetically determined reproductive dysfunction in women. En: Shoham Z, Howles CM, Jacobs HS (editors). Female Infertility Therapy. London: Martin Dunitz Ltd. 1999:27-31.
14. Te Velde ER, Pearson PL, Broekmans FJ (Editors). Female Reproductive Aging. New York-London: The Parthenon Publishing Group. 2000: pgs 300.
15. Kavalier F. Investigation of recurrent miscarriages. Editorial. 2005:331:121-2.
16. Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome. Fertil Steril. 2008;89(3):505-22. [ Links ]
17. Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004;81(1):19-25.
18. Pacheco J, Malaverry H, Vargas R. Síndrome de hiperestimulación ovárica. A propósito de un caso. Rev Per Ginecol Obstet. 2005;51(2):84-93.
19. Yen SSC. Síndrome de ovario poliquístico. En: Yen SSC, Jaffe RB, Barbieri RL. Endocrinología de la reproducción. 4ª edición. Philadelphia: W.B.Saunders Co. 2001:465-510.
20. Boukes FS, Meijer LJ, Flikweert S, Assendelft WJ; Nederlands Huisartsen Genootschap. [Summary of the standard Vaginal bleeding (first revision) of the Dutch College of General Practitioners]. Ned Tijdschr Geneeskd. 2002;146(46):2179-83.
21. Wilson J. The impact of Chlamydia trachomatis and bacterial vaginosis on female reproductive health. En: Healy DL, Kovacs GT, McLachlan R, Rodriguez-Armas O (Editors). Reproductive Medicine in the Twenty-first Century. Boca Raton-London-New York-Washington DC: The Parthenon Publishing Group. 2002:163-72.
22. Pacheco J, Ávila G, Ángeles R. Chlamydia trachomatis infection prevalence in Peruvian infertile couples. Book of Abstracts FM2.05.03. XVI FIGO World Congress, Washington, D.C. Int J Gynecol Obstet 2000;70 Suppl 1:34.
23. Ángeles R, Pacheco J, Ávila G, Ishihara J, Orihuela P, Zúñiga C, Bustamante S. Contribución al estudio de la prevalencia de la infección por clamidia en parejas con infertilidad. Rev Per Ginecol Obstet. 1999;45(3):167-71.
24. Pacheco J. Papel del tratamiento médico en la endometriosis asociada a la infertilidad. Ginecol Obstet (Perú). 2001;47(4):232-7.
25. Pacheco J. Actualización sobre endometriosis. Ginecol Obstet (Perú). 1999;45:235-48.
26. DHooghe TM, Hill JA. Endometriosis. En Berek JS, Adashi EY, Hillard PA: Novaks Gynecology. 11th edit. Baltimore, USA: Williams & Wilkins. 1996:887-914.
27. Pacheco J, Ángeles R, Bustamante S, Díaz F, Ishihara J, Orihuela P, Zúñiga C, Bazán Z. Endometriosis: Experiencia en un servicio de infertilidad. Ginecol Obstet (Perú). 2000;46(1):40-6.
28. Kennedy S. Is there a genetic basis to endometriosis?. Semin Reprod Endocrinol. 1997;15(3):309-18.
29. Cervera R, Balasch J. Bidirectional effects on autoimmunity and reproduction. Hum Reprod Update. 2008;14(4):359-66. [ Links ]
30. Wong RC, Favaloro EJ. Clinical features, diagnosis, and management of the antiphospholipid syndrome. Semin Thromb Hemost. 2008;34(3):295-304. [ Links ]
31. Anderson RA, Cervera R, Merrill JT, Erkan D Antiphospholipid antibodies and the antiphospholipid syndrome: clinical significance and treatment. Semin Thromb Hemost. 2008;34(3):256-66. [ Links ]
32. Pierangeli SS, Chen PP, Raschi E, Scurati S, Grossi C, Borghi MO, Palomo I, Harris EN, Meroni PL. Antiphospholipid antibodies and the antiphospholipid syndrome: pathogenic mechanisms. Semin Thromb Hemost. 2008;34(3):236-50. [ Links ]
33. Perricone R, De Carolis C, Kröegler B, Greco E, et al. Intravenous immunoglobulin therapy in pregnant patients affected with systemic lupus erythematosus and recurrent spontaneous abortion. Rheumatology (Oxford). 2008;47(5):646-51. [ Links ]
34. Asherson RA. The primary, secondary, catastrophic, and seronegative variants of the antiphospholipid syndrome: a personal history long in the making. Semin Thromb Hemost. 2008;34(3):227-35. [ Links ]
35. Adams M. Novel considerations in the pathogenesis of the antiphospholipid syndrome: involvement of the tissue factor pathway of blood coagulation. Semin Thromb Hemost. 2008;34(3):251-5. [ Links ]
36. Goddijn M, van den Boogaard E, Steepers EA, Erwich JJ, Macklon NS, Land JA, Ankum WM. [The guideline Recurrent miscarriage (first revision) of the Dutch Society for Obstetrics and Gynaecology]. Ned Tijdschr Geneeskd. 2008;152(30):1665-70. Comentario en: Ned Tijdschr Geneeskd. 2008;152(45):2481; author reply 2481-2.
37. Qublan H, Amarin Z, Dabbas M, Farraj AE, Beni-Merei Z, Al-Akash H, Bdoor AN, et al. Low-molecular-weight heparin in the treatment of recurrent IVF-ET failure and thrombophilia: A prospective randomized placebo-controlled trial. Hum Fertil (Camb). 2008;11(4):246-53. [ Links ]
38. Rodger MA, Paidas M, McLintock C, Middeldorp S, Kahn S, Martinelli I, Hague W, Rosene Montella K, Greer I. Inherited thrombophilia and pregnancy complications revisited. Obstet Gynecol. 2008;112(2 Pt 1):320-4. [ Links ]
39. Badawy AM, Khiary M, Sherif LS, Hassan M, Ragab A, Abdelall I. Low-molecular weight heparin in patients with recurrent early miscarriages of unknown aetiology. J Obstet Gynaecol. 2008;28(3):280-4. [ Links ]
40. Dendrinos S, Sakkas E, Makrakis E. Low-molecular-weight heparin versus intravenous immunoglobulin for recurrent abortion associated with antiphospholipid antibody syndrome. Int J Gynaecol Obstet. 2008 Dec 28. [Epub ahead of print]
41. Goel N, Tuli A, Choudry R. The role of aspirin versus aspirin and heparin in cases of recurrent abortions with raised anticardiolipin antibodies. Med Sci Monit. 2006;12(3):CR132-6.
42. Sugiura-Ogasawara M, Ozaki Y, Nakanishi T, Sato T, Suzumori N, Kumagai K. Occasional antiphospholipid antibody positive patients with recurrent pregnancy loss also merit aspirin therapy: a retrospective cohort-control study. Am J Reprod Immunol. 2008;59(3):235-41. [ Links ]
43. Fawzy M, Shokeir T, El-Tatongy M, Warda O, El-Refaiey AA, Mosbah A. Treatment options and pregnancy outcome in women with idiopathic recurrent miscarriage: a randomized placebo-controlled study. Arch Gynecol Obstet. 2008;278(1):33-8. [ Links ]
44. Di Nisio M, Peters LW, Middeldorp S. Aspirin or anticoagulants for the treatment of recurrent miscarriage in women without antiphospholipid syndrome. Cochrane Database of Systematic Reviews 2005, Issue 2. Art. No.: CD004734. DOI: 10.1002/14651858.CD004734.pub2. Actualizado 30 abr 2008.
45. López-Pedrera C, Cuadrado MJ, Herández V, Buendïa P, Aguirre MA, Barbarroja N, Torres LA, Villalba JM, Velasco F, Khamashta M. Proteomic analysis in monocytes of antiphospholipid syndrome patients: Deregulation of proteins related to the development of thrombosis. Arthritis Rheum. 2008;58(9):2835-44.
46. Puscheck EE, Jeyendran RS. The impact of male factor on recurrent pregnancy loss. Curr Opin Obstet Gynecol. 2007;19(3):222-8.
47. Simpson J, Elias S. Genetics in Obstetrics and Gynecology. 3ra ed Philadelphia: Saunders; 2003.
48. Hiby SE, Regan L, Lo W, Farrell L, Carrington M, Moffett A. Association of maternal killer-cell immunoglobulin-like receptors and parental HLA-C genotypes with recurrent miscarriage. Hum Reprod. 2008;23(4):972-6. [ Links ]
49. Raghupathy R, Kalinka J. Cytokine imbalance in pregnancy complications and its modulation. Front Biosci. 2008;13:985-94. [ Links ]
50. Chaouat G. Innately moving away from the Th1/Th2 paradigm in pregnancy. Clin Exp Immunol. 2003;131:393-5.
51. Piccinni MP. T cells in normal pregnancy and recurrent pregnancy loss. Reprod Biomed Online. 2006;13(6):840-4.
52. Dokouhaki P, Moghaddam R, Rezvany M, Ghassemi J, Novin MG, Zarnani A, Akhondi MM, Ostadkarampour M, Mellstedt H, Razavi A, Jeddi-Tehrani M. Repertoire and clonality of T-cell receptor beta variable genes expressed in endometrium and blood T cells of patients with recurrent spontaneous abortion. Am J Reprod Immunol. 2008;60(2):160-71.
53. Prado-Drayer A, Teppa J, Sánchez P, Camejo MI. Immunophenotype of peripheral T lymphocytes, NK cells and expression of CD69 activation marker in patients with recurrent spontaneous abortions, during the mid-luteal phase. Am J Reprod Immunol. 2008;60(1):66-74. [ Links ]
54. Hong Y, Wang X, Lu P, Song Y, Lin Q. Killer immunoglobulin-like receptor repertoire on uterine natural killer cell subsets in women with recurrent spontaneous abortions. Eur J Obstet Gynecol Reprod Biol. 2008;140(2):218-23. [ Links ]
55. Laird SM, Tuckerman EM, Cork BA, Linjawi S, Blakemore AI, Li TC. A review of immune cells and molecules in women with recurrent miscarriage. Hum Reprod Update. 2003;9(2):163-74.
56. Gharesi-Fard B, Zolghadri J, Kamali-Sarvestani E. Effect of leukocyte therapy on tumor necrosis factor-alpha and interferon-gamma production in patients with recurrent spontaneous abortion. Am J Reprod Immunol. 2008;59(3):242-50. [ Links ]
57. Perricone R, Di Muzio G, Perricone C, Giacomelli R, De Nardo D, Fontana L, De Carolis C. High levels of peripheral blood NK cells in women suffering from recurrent spontaneous abortion are reverted from high-dose intravenous immunoglobulins. Am J Reprod Immunol. 2006;55(3):232-9.
58. Heine O, Mueller-Eckhardt. Intravenous immune globulin in recurrent abortion. Clin Exp Immunol. 1993;97 Suppl 1:39-42.
59. Hutton B, Sharma R, Fergusson D, Tinmouth A, Hebert P, Jamieson J, Walker M. Use of intravenous immunoglobulin for treatment of recurrent miscarriage: a systematic review, BJOG. 2007;114(2):134-42.
60. Winger EE, Reed JL. Treatment with tumor necrosis factor inhibitors and intravenous immunoglobulin improves live birth rates in women with recurrent spontaneous abortion. Am J Reprod Immunol. 2008;60(1):8-16. [ Links ]
61. Porter TF, LaCoursiere Y, Scott JR. Immunotherapy for recurrent miscarriage. The Cochrane Database of Systematic Reviews 2006 Issue 4. Copyright © 2006 The Cochrane Collaboration. Published by John Wiley and Sons, Ltd. Scott J. Update in: Cochrane Database Syst Rev. 2006;(2):CD000112.
62. Takeshita T. Diagnosis and treatment of recurrent miscarriage associated with immunologic disorders: Is paternal lymphocyte immunization a relic of the past? J Nippon Med Sch. 2004;71(5):308-13.
63. Clark DA. Immunological factors in pregnancy wastage: fact or fiction. Am J Reprod Immunol. 2008 Apr;59(4):277-300. [ Links ]
64. Reindollar RH. Contemporary issues for spontaneous abortion. Does recurrent abortion exist? Obstet Gynecol Clin North Am 2000;27(3):541-54.
65. Coulam C. Understanding the immunobiology of pregnancy and applying it to treatment of recurrent pregnancy loss. Early pregnancy: Biology and Medicine. 2000;4(1):19-29.
66. Rai R, Regan L. Recurrent miscarriage. The Lancet. 2006;368:601-11.
67. Howard C, Toder V, Aviram A, Daniely M, Mashiach S, Barkai G. Karyotype of the abortus in recurrent miscarriage. Fertil Steril. 2001;75(4):678-82.
68. Christiansen OB, Steffensen R, Nielsen HS, Varming K. Multifactorial etiology of recurrent miscarriage and its scientific and clinical implications. Gynecol Obstet Invest. 2008;66:257-67. [ Links ]
69. Warburton D, Biological aging and the etiology of aneuploidy. Cytogenet Genome Res. 2005;111:266-72.
70. Munné S, Sandalinas M, Magli C, Gianaroli L, Cohen J, Warburton D. Increased rate of aneuploid embryos in young women with previous aneuploid conceptions. Prenat Diagn. 2004;24:638-43.
71. Robinson W, McFadden D, Stephenson M. The origin of abnormalities in recurrent aneuploidy/polyploidy. Am J Hum Genet. 2001;69(6):1245-54.
72. Warbuton D, Dallaire L, Thangavelu M, Ross L, Levin B, Kline J. Trisomy recurrence: a reconsideration based on North American data. Am J Hum Genet. 2004;75:376-85.
73. Bolor H, Mori T, Nishiyama S, Ito Y, Hosoba E, Inagaki H, Kogo H, Ohye T, Tsutsumi M, Kato T, Tong M, Nishizawa H, Pryor-Koishi K, Kitaoka E, Sawada T, Nishiyama Y, Udagawa Y, Kurahashi H. Mutations of the SYCP3 gene in women with recurrent pregnancy loss. Am J Hum Genet. 2009;84(1):14-20.
74. Chávez M, Klein E. Genes que intervienen en la disyunción cromosómica. Rev Per Ginecol Obstet. 2008;54:175-8. [ Links ]
75. Rubio C, Simon C, Vidal F, Rodrigo L, Pehlivan T, Remohi J, Pellicer A. Chromosomal abnormalities and embryo development in recurrent miscarriage couples. Hum Reprod. 2003;18(1):182-8.
76. Franssen MT, Korevaar JC, Leschot NJ, Bossuyt PMM, Knegt AC, Gerssen-Schoorl KBJ, Wouters CH, Hansson KBM, Hochstenbach R, Madan K, van der Veen F, Goddijn M. Selective chromosome analysis in couples with two or more miscarriages: case-control study. BMJ. 2005;331(7509):137-41.
77. Sugiura-Ogasawara M, Aoki K, Fujii T, Fujita T, Kawaguchi R, Maruyama T, Ozawa N, Sugi T, Takeshita T, Saito S. Subsequent pregnancy outcomes in recurrent miscarriage patients with a paternal or maternal carrier of a structural chromosome rearrangement. J Hum Genet. 2008;53(7):622-8.
78. Engels H, Eggermann T, Caliebe A, Jelska A, et al. Genetic counseling in Robertsonian translocations der(13;14): frequencies of reproductive outcomes and infertility in 101 pedigrees. Am J Med Genet A. 2008 Oct 15;146A(20):2611-6.
79. De Gregori M, Ciccone R, Magini P, Pramparo T, Gimelli S, Messa J. Cryptic deletions are a common finding in balanced reciprocal and complex chromosome rearrangements: a study of 59 patients. J Med Genet. 2007;44(12):750-62.
80. Wells D, Alfarawati S, Fragouli E. Use of comprehensive chromosomal screening for embryo assessment: microarrays and CGH. Molec Hum Reprod. 2008;14(12):703-10.
81. Garrisi JG, Colls P, Ferry KM, Zheng X, Garrisi MG, Munné S. Effect of infertility, maternal age, and number of previous miscarriages on the outcome of preimplantation genetic diagnosis for idiopathic recurrent pregnancy loss. Fertil Steril. 2008 Aug 8 [Epub ahead of print].
82. Lalioti MD. Can preimplantation genetic diagnosis overcome recurrent pregnancy failure? Curr Opin Obstet Gynecol. 2008;20(3):199-204.
83. Qian YL, Xu CM, Jin F, Zhu YM, Luo Q, Huang HF. [Preimplantation genetic diagnosis of translocation]. Zhonghua Fu Chan Ke Za Zhi. 2008;43(8):581-3.
84. Pazarbaşi A, Demirhan O, Turgut M, Güzel I, Tastemir D. Inheritance of a translocation between chromosomes 12 and 16 in a family with recurrent miscarriages and a newborn with Down syndrome carrying the same translocation. Genet Couns. 2008;19(3):301-8.
85. Munné S, Fischer J, Warner A, Chen S, Zouves C, Cohen J; Referring Centers PGD Group. Preimplantation genetic diagnosis significantly reduces pregnancy loss in infertile couples: a multicenter study. Fertil Steril. 2006 Feb;85(2):326-32.
86. Kuliev A, Verlinsky Y. Impact of preimplantation genetic diagnosis for chromosomal disorders on reproductive outcome. Reprod Biomed Online. 2008 Jan;16(1):9-10.
87. Yakin K, Urman B. What next for preimplantation genetic screening? A clinicians perspective. Hum Reprod. 2008;23(8):1686-90.
88. Karvela M, Stefanakis N, Papadopoulou S, Tsitilou SG, Tsilivakos V, Lamnissou K. Evidence for association of the G1733A polymorphism of the androgen receptor gene with recurrent spontaneous abortions. Fertil Steril. 2008;90(5):2010.e9-12.
89. Goel N, Ortel TL, Bali D, Anderson JP, Gourley IS, Smith H, et al. Familial antiphospholipid antibody syndrome: criteria for disease and evidence for autosomal dominant inheritance. Arthritis Rheum. 1999;42(2)318-27.
90. Bellver J, Soares SR, Alvarez C, Muñoz E, Ramírez A, Rubio C, Serra V, Remohí J, Pellicer A. The role of thrombophilia and thyroid autoimmunity in unexplained infertility, implantation failure and recurrent spontaneous abortion. Hum Reprod. 2008;23(2):278-84.
91. Mtiraoui N, Zammiti W, Ghazouani L, Jmili N, Saidi S, Finan R, et al. Methylenetetrahydrofolate reductase C677T and A1298C polymorphism and changes in homocysteine concentrations in women with idiopathic recurrent pregnancy losses. Reproduction. 2006;131:395-401.
92. Martinelli I, Taioli E, Cetin I, Marnoni A, Gerosa S, Villa M, et al. Mutations in coagulation factors in women with unexplained late fatal loss. N Engl J Med. 2000;343:1015-8.
93. Hopmeier P, Puehringer H, van Trotsenburg M, Atamaniuk J, Oberkanins C, Dossenbach-Glaninger A. Association of endothelial protein C receptor haplotypes, factor V Leiden and recurrent first trimester pregnancy loss. Clin Biochem. 2008;41(12):1022-4.
94. Coulam CB, Jeyendran RS. Vascular endothelial growth factor gene polymorphisms and recurrent pregnancy loss. Am J Reprod Immunol. 2008;59(4):301-5.
95. Goodman C, Jeyendran RS, Coulam CB. Vascular endothelial growth factor gene polymorphism and implantation failure. Reprod Biomed Online. 2008;16(5):720-3.
96. Lee HH, Hong SH, Shin SJ, Ko JJ, Oh D, Kim NK. Association study of vascular endothelial growth factor polymorphisms with the risk of recurrent spontaneous abortion. Fertil Steril. 2009 Jan 6.
97. Skrzypczak J, Wirstlein P, Mikołajczyk M, Ludwikowski G, Zak T. TGF superfamily and MMP2, MMP9, TIMP1 genes expression in the endometrium of women with impaired reproduction. Folia Histochem Cytobiol. 2007;45 Suppl 1:S143-8.
98. Lee J, Oh J, Choi E, Park I, Han C, Kim do H, et al. Differentially expressed genes implicated in unexplained recurrent spontaneous abortion. Int J Biochem Cell Biol. 2007;39(12):2265-77.
99. Michelena M, Díaz A. Pérdida gestacional con cromosomas normales: otras posibles causas genéticas. Rev Per Ginecol Obstet. 2008;54:179-84.
100.Saxena P, Misro MM, Chaki SP, Chopra K, Roy S, Nandan D. Is abnormal sperm function an indicator among couples with recurrent pregnancy loss? Fertil Steril. 2008 Nov;90(5):1854-8.
101.Bhattacharya SM. Association of various sperm parameters with unexplained repeated early pregnancy loss--which is most important? Int Urol Nephrol. 2008;40(2):391-5.
102.Bernardini LM, Costa M, Bottazzi C, Gianaroli L, Magli MC, Venturini PL, Francioso R, Conte N, Ragni N. Sperm aneuploidy and recurrent pregnancy loss. Reprod Biomed Online. 2004;9(3):312-20.
103.Somprasit C, Aguinaga M, Cisneros PL, Torsky S, Carson SA, Buster JE, Amato P, McAdoo SL, Simpson JL, Bischoff FZ. Paternal gonadal mosaicism detected in a couple with recurrent abortions undergoing PGD: FISH analysis of sperm nuclei proves valuable. Reprod Biomed Online. 2004;9(2):225-30.
104.Karaer A, Karaer K, Ozaksit G, Ceylaner S, Percin EF. Y chromosome azoospermia factor region microdeletions and recurrent pregnancy loss. Am J Obstet Gynecol. 2008;199(6):662.e1-5.
105.Ostojić S, Pereza N, Volk M, Kapović M, Peterlin B. Genetic predisposition to idiopathic recurrent spontaneous abortion: contribution of genetic variations in IGF-2 and H19 imprinted genes. Am J Reprod Immunol. 2008;60(2):111-7.
106.ESHRE Capri Workshop Group. Genetic aspects of female reproduction. Hum Reprod Update. 2008;14(4):293-307.
107.Laurino MY, Bennett RL, Saraiya DS, Baumeister L, Doyle DL, Leppig K, Pettersen B, et al. Genetic evaluation and counseling of couples with recurrent miscarriage: recommendations of the National Society of Genetic Counselors. J Genet Counsel 2005;14(3):165-81.
108.Raghupathy R. Manipulation of cytokine production profiles as a therapeutic approach for immunologic pregnancy loss. Indian J Biochem Biophys. 2008;45(4):229-36.
109.Walch K, Hefler L, Nagele F. Oral dydrogesterone treatment during the first trimester of pregnancy: the prevention of miscarriage study (PROMIS). A double-blind, prospectively randomized, placebo-controlled, parallel group trial. J Matern Fetal Neonatal Med. 2005;18(4):265-9.
110.Molloy AM, Kirke PN, Brody LC, Scott JM, Mills JL. Effects of folate and vitamin B12 deficiencies during pregnancy on fetal, infant, and child development. Food Nutr Bull. 2008;29(2 Suppl):S101-11; discussion S112-5.
111.Hübner U, Alwan A, Jouma M, Tabbaa M, Schorr H, Herrmann W. Low serum vitamin B12 is associated with recurrent pregnancy loss in Syrian women. Clin Chem Lab Med. 2008;46(9):1265-9.
112.Cardona H, Cardona-Maya W, Gómez JG, Castañeda S, Gómez JM, Bedoya G, Alvarez L, Torres JD, Tobón LI, Cadavid A. [Relationship between methylenetetrahydrofolate reductase polymorphism and homocysteine levels in women with recurrent pregnancy loss: a nutrigenetic perspective]. Nutr Hosp. 2008;23(3):277-82.
113.Amin AF, Shaaban OM, Bediawy MA. N-acetyl cysteine for treatment of recurrent unexplained pregnancy loss. Reprod Biomed Online. 2008;17(5):722.6.
114.Tursi A, Giorgetti G, Brandimarte G, Elisei W. Effect of gluten-free diet on pregnancy outcome in celiac disease patients with recurrent miscarriage. Dig Dis Sci. 2008;53(11):2925-8.
115.Jerzak M, Kniotek M, Mrozek J, Górski A, Baranowski W. Sildenafil citrate decreased natural killer cell activity and enhanced chance of successful pregnancy in women with a history of recurrent miscarriage. Fertil Steril. 2008;90(5):1848-53.
116.Campillo GG, Bravo CS, López ME, Calva EA, Carmona FM. [Self-concept during high-risk pregnancy and recurrent gestational loss]. Ginecol Obstet Mex. 2008;76(3):143-50.
117.Tien JC, Tan TY. Non-surgical interventions for threatened and recurrent miscarriages. Singapore Med J. 2007;48(12):1074-90.
118.Franssen MTM, Korevaar JC, van der Veen F, Leschot NJ, Bossuyt PMM, Goddijn M. Reproductive outcome after chromosome analysis in couples with two or more miscarriages: case-control study. BMJ, 2006;332(7544):759-63.
119.Trogstad L, Magnus P, Moffett A, Stoltenberg C. The effect of recurrent miscarriage and infertility on the risk of pre-eclampsia. BJOG. 2009;116(1):108-13.
Manuscrito recibido el 9 de abril de 2009 y aceptado para publicación el 12 de mayo de 2009.
Correspondencia:
Dr. José Pacheco Romero
Facultad de Medicina - UNMSM
Av. Grau 755. Lima 1, Perú
Correo-e: jpachecoperu@yahoo.com