Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.70 no.3 Lima Sept. 2009
Efecto hipoglicemiante coadyuvante del extracto etanólico de hojas de Annona muricata L (guanábana), en pacientes con diabetes tipo 2 bajo tratamiento de glibenclamida
Coadjuvant hypoglycemiant effect of Annona muricata L (guanabana) leaves ethanolic extract in patients with type 2 diabetes mellitus receiving glibenclamide treatment
Jorge Arroyo1,2, Jaime Martínez3, Gerardo Ronceros1, Robert Palomino2, Aníbal Villarreal2, Pablo Bonilla4, Christian Palomino4, Mariano Quino1
1 Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Departamento de Ciencias Dinámicas, Sección de Farmacología, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Servicio de Medicina Interna, Hospital I Tingo María, EsSalud. Tingo María, Perú.
4 Instituto de Ciencias Farmacéuticas y Recursos Naturales, Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos. Lima, Perú.
Resumen
Objetivo: Determinar la eficacia y seguridad de cápsulas de extracto etanólico de hojas de Annona muricata L (guanábana) más glibenclamida para un mejor control de los niveles glicemia comparado con la administración de glibenclamida sola, en pacientes con diabetes mellitus tipo 2. Diseño: Estudio clínico, aleatorio, grupo paralelo, doble ciego. Lugar: Servicio de Medicina Interna, Hospital I EsSalud, ciudad de Tingo María, Departamento de Huánuco. Pacientes: Pacientes con diagnóstico de diabetes mellitus tipo 2, tratados con glibenclamida. Intervenciones: Entre mayo y setiembre de 2007, 60 pacientes fueron asignados a 6 grupos de manera aleatoria; 3 grupos recibieron cápsulas conteniendo 180 mg de extracto etanólico de hojas de Annona muricata L [CEAM] más 5 mg de glibenclamida y los otros 3 grupos continuaron solo con glibenclamida. Principales medidas de resultados: Evaluación de los niveles de glicemia. Resultados: El rango de edad de los pacientes estuvo entre 38 y 54 años de edad. Se encontró disminución del nivel de glicemia, siendo mayor el efecto en aquellos que recibieron guanábana más glibenclamida. Se presentó efectos adversos en 5 pacientes; dos de ellos refirieron dolor urente en epigastrio asociado en uno a náuseas, y en otros 3 solo náuseas. No se observó alteración de los exámenes de laboratorio. Conclusiones: El uso de las cápsulas conteniendo extracto etanólico de Annona muricata L más glibenclamida durante 30 días produjo una mayor disminución de los niveles de glicemia en diabéticos tipo 2.
Palabras clave: Annona; extractos vegetales; diabetes mellitus tipo 2; glibenclamida; glucemia.
Abstract
Objective: To determine efficacy and security of of Annona muricata L (guanábana) leaves ethanolic extract plus glibenclamide capsules in controlling glucose levels in type 2 diabetes mellitus patients compared to patients receiving with glibenclamide alone. Design: Randomized, double-blind, parallel-group controlled clinical trial. Setting: Internal Medicine service, Tingo María-EsSalud Hospital I, Huanuco city. Participants: Type 2 diabetes mellitus patients. Interventions: Between May 2007 and September 2007 sixty 38 to 60 year-old patients were randomly assigned to 6 groups, 3 receiving capsules containing 180 mg of Annona muricata L leaves ethanolic extract plus glibenclamide 5 mg and 3 receiving glibenclamide 5 mg tablets only. Main outcome measurements: Reduction of glycemia. Results: There was reduction of glycemic levels, higher in those receiving guanabana plus glibenclamida. Auxiliary exams did not reveal adverse effects. Two cases presente epigastric pain, one of them associated with nausea, and three cases presented only nausea. Conclusions: Treatment with capsules containing Annona muricata L leaves ethanolic extract 180 mg plus glibenclamide during thirty days produced better glycemic control in type 2 diabetic patients.
Key words: Annona; plant extracts; diabetes mellitus, type 2; glyburide; blood glucose.
INTRODUCCIÓN
La diabetes mellitus tipo 2 (DM2) es un desorden metabólico complejo y su patogénesis no se encuentra claramente definida. Esto implica varios grados de deficiencia del funcionamiento de las células beta, resistencia de la insulina periférica y metabolismo anormal de la glucosa hepática. El control de la glucosa en la DM2 se deteriora progresivamente en el tiempo y después del fracaso de la dieta y los ejercicios, se necesita en promedio una nueva intervención con fármacos hipoglicemiantes cada 3 a 4 años, para obtener un control adecuado de la glucosa. Eventualmente, con las actuales combinaciones terapéuticas y/o el tratamiento con insulina, un importante grupo de pacientes no se encuentra adecuadamente controlado. Diversos ensayos clínicos han mostrado que la disminución de los niveles de glucosa en sangre monitoreados por la hemoglobina glicosilada (HbA1c) reduce el riesgo de microangiopatía y múltiples factores de riesgo cardiovascular, por lo que el tratamiento es clave en la diabetes tipo 2. El sobrepeso, la hipertensión y la hiperlipidemia están asociados con la diabetes mellitus y son importantes factores para considerar en una terapéutica global de acercamiento a la enfermedad (1).
La incidencia y prevalencia de la diabetes tipo 2 se está incrementando rápidamente en países desarrollados y en desarrollo. La Organización Mundial de la Salud (OMS) proyecta un incremento de 135 millones en 1995 a 300 millones en 2025, con una prevalencia en aumento de 4% en 1995 a 5,4% en 2025, y tal elevación es de gran impacto en el estatus socioeconómico en las naciones (2). En el Perú, la prevalencia de diabetes es de 1 a 8% de la población general, siendo Piura y Lima los departamentos más afectados. Se menciona que en la actualidad la diabetes afecta a más de un millón de peruanos y de los cuales menos de la mitad han sido diagnosticados (3-5).
Al momento se dispone de 9 clases de medicamentos para el tratamiento de la diabetes mellitus tipo 2; sin embargo, los medicamentos recientemente desarrollados son generalmente menos potentes, a menudo menos efectivos en disminuir la glicemia, más caros y además se asocian a eventos adversos serios (6). En el 2006 y 2007 se evidenció que las glitazonas no solo incrementaron el riesgo de insuficiencia cardiaca, sino también de infarto de miocardio y el riesgo de fracturas óseas en mujeres (7,8). Además, recientes estudios clínicos han demostrado que los análogos de la insulina, y en particular la insulina glargina, incrementan el riesgo de cáncer de mama (9). El nuevo conocimiento generado sobre la seguridad de los fármacos hipoglicemiantes ha producido que la Food Drug Administration (FDA) y la European Medicines Agency (EMEA) evalúen estos fármacos, realicen nuevas advertencias, contraindicaciones y retiro de medicamentos para su comercialización (10).
Las hojas y brotes tiernos de Annona muricata (guanábana) son usados por algunas comunidades como anticancerígenos, antiespasmódicos, sedativos, antimaláricos, vasodilatadores y antidiabéticos (11-13); y los estudios experimentales han demostrado la eficacia hipoglicemiante al utilizar el extracto etanólico de las hojas en ratas diabéticas inducidas por aloxano, sin afectar el hígado y riñón (14).
El objetivo general del presente estudio fue determinar si la administración concomitante de cápsulas de extracto etanólico de Annona muricata [CEAM] más glibenclamida produce mayor disminución de la glicemia. Los objetivos específicos del estudio fueron evaluar los efectos de la coadministración sobre los exámenes auxiliares de laboratorio, y monitorizar los efectos adversos que se presentaran durante el ensayo clínico.
MÉTODOS
Se realizó un ensayo clínico de fase II, aleatorio, doble ciego, comparado con glibenclamida, con una duración de 30 días, en pacientes con diabetes mellitus tipo 2, en el Hospital I Tingo María, EsSalud, servicio de Medicina Interna. La elaboración de las cápsulas y los análisis de laboratorio fueron realizados en la Universidad Nacional Mayor de San Marcos (UNMSM). El estudio clínico fue aprobado por el Comité de Ética del Hospital en estudio; ejecutándose entre los meses de mayo y setiembre del año 2007.
Las cápsulas obtenidas fueron en promedio de 180 mg de extracto etanólico de las hojas de Annona muricata en una cápsula de capacidad de 750 mg en promedio. Se verificó la densidad del extracto siendo homogenizado con Veegum HV y Aerosil 200. En proporción requerida con el extracto obtenido, que permitió su encapsulación manual y verificación al estudio fitoquímico.
Atendiendo a las características físico-químicas del extracto a tratar y en virtud al inconveniente de poder obtener un extracto seco del mismo, es que se determinó utilizar excipientes que pudieran favorecer su encapsulación. Los excipientes para esta labor fueron el Veegum HV y el Aerosil 200, uno de retención de sustancias orgánicas por su capacidad de intercambio iónico -además de su capacidad aglutinante- y el segundo por su gran poder absorbente. Ambos son silicatos, cuya absorción por vía intestinal es despreciable o nula (15).
La muestra de estudio final estuvo constituida por 60 pacientes con diagnóstico definitivo de diabetes mellitus tipo 2 no complicada, de 2 a 6 años de evolución, 30 hombres y 30 mujeres, con glicemia en el rango de 185 a 291 mg/dL, que recibían glibenclamida como único tratamiento estándar y que voluntariamente decidieron ingresar al estudio. Las edades oscilaron para hombres entre 38 y 53 años y para mujeres entre 39 y 54 años. Durante el estudio no se permitió otro tratamiento. El criterio de exclusión consideró a pacientes que presentaban síntomas y signos de microangiopatía, macroangiopatía y neuropatía diabética.
Los pacientes fueron monitorizados durante los 3 primeros días, luego a la semana y finalmente al mes de tratamiento, teniendo en cuenta la evaluación permanente de los resultados de laboratorio (glicemia de inicio y final y hemoglucotest en las pruebas intermedias), además de los síntomas y signos presentes en las entrevistas de control.
Se enrolaron 68 pacientes, pero tres no empezaron el tratamiento con [CEAM] y 5 pacientes descontinuaron el tratamiento. Los 60 pacientes que finalmente fueron incluidos en el estudio fueron aleatorizados en 6 grupos: grupo A glibenclamida 5 mg/día más CEAM 180 mg/día; grupo B glibenclamida 5 mg/bid más CEAM 180 mg/bid; grupo C glibenclamida 5 mg/tid más CEAM 180 mg//tid; grupo D glibenclamida 5 mg/día más 1 cápsula placebo de CEAM/día; grupo E glibenclamida 5 mg/bid más 1 cápsula placebo de CEAM/bid; y grupo F glibenclamida 5 mg/tid más 1 cápsula placebo de CEAM/tid. Tanto la glibenclamida como el extracto etanólico de hojas de Annona muricata fueron preparados en cápsulas idénticas. Todos los pacientes fueron instruidos a tomar las cápsulas una vez al día, dos veces al día (bid) y tres veces al día (tid), durante la duración del estudio.
Los datos fueron evaluados mediante regresión logística y análisis de varianza multivariado, se consideró un nivel de significancia de 5%. Se utilizó el programa estadístico SPSS versión 13 del año 2004.
La información fue recolectada antes del inicio de la terapia y después de ser sometidos los pacientes al tratamiento con guanábana, en protocolos y formatos de estudio elaborados para el presente proyecto. Los datos también fueron obtenidos de las historias clínicas y entrevistas.
El consentimiento informado fue firmado por los pacientes en la primera cita, en la cual se les informó adecuadamente de las condiciones en las cuales se desarrollaba el estudio, quiénes eran los investigadores y cómo comunicarse con ellos en caso necesario.
RESULTADOS
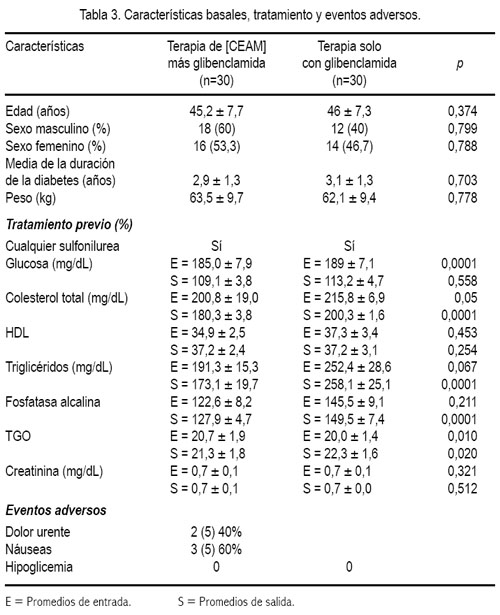
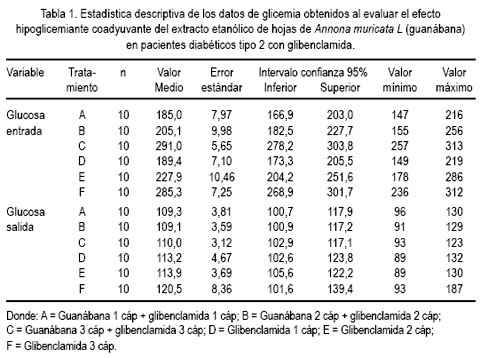
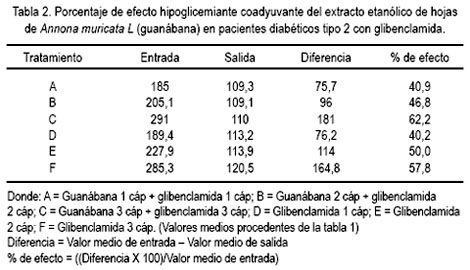
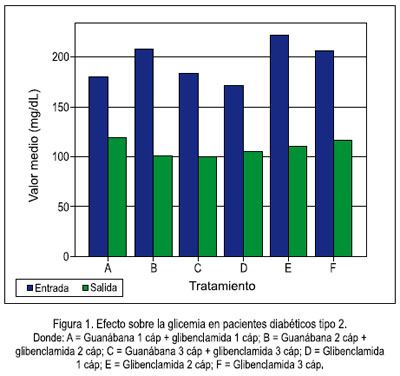
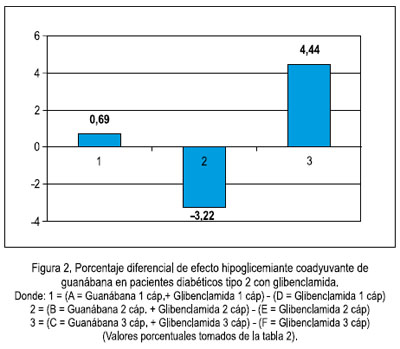
Del estudio clínico, se pudo observar disminución del nivel de glicemia en pacientes que recibieron guanábana y, mientras más fue la dosis, se apreció mayor efecto, a diferencia de quienes recibieron glibenclamida (5, 10 y 15 mg al día) sola, sin agregar la cápsula de extracto etanólico de la hoja de guanábana (tablas 1 y 2, figuras 1 y 2).
Entre los efectos adversos, dos pacientes presentaron dolor urente de leve intensidad en epigastrio, asociado en uno a náuseas; otros tres pacientes tuvieron solo náuseas.
Los exámenes de laboratorio clínico no evidenciaron cambios en los niveles de creatinina y urea, observándose una disminución de colesterol (tabla 3).
Se obtuvo un extracto etanólico total con aspecto de masa homogénea, consistencia blanda, color verde petróleo, libre de partículas extrañas; el rendimiento fue de 9,4% de planta entera.
El estudio fitoquímico indicó que los compuestos fenólicos estaban en abundante cantidad en la fracción metanólica y que los flavonoides, taninos y glicósidos lo hicieron en regular cantidad en el extracto etanólico y fracción metanólica.
DISCUSIÓN
Se puede apreciar que hay significancia en el efecto hipoglicémico de la guanábana y, mientras más es la dosis, se aprecia mayor efecto, a diferencia de los que recibieron glibenclamida, que fueron grupos similares con los mismos tratamientos estándar (1, 2 o 3 cápsulas al día), pero a los cuales no se les agregó la cápsula de extracto etanólico de la hoja de guanábana.
En cuanto a los efectos adversos, se pudo apreciar en 5 pacientes mientras que el resto no manifestó haber presentado problemas con la ingesta de las cápsulas. No se apreció alteración de los exámenes de laboratorio. Tanto los hematíes como los leucocitos no se alteraron, aunque hubo incremento de los eosinófilos en todas las muestras, incluyendo a los que no recibieron guanábana, probablemente por la medicación e independientemente del tipo; no se produjo daño aparente de la médula ósea y se demostró la seguridad del producto de no afectar la producción celular. La creatinina, urea, pruebas hepáticas y perfil lipídico permanecieron sin cambios significativos (tabla 3).
La reducción del nivel de glicemia evidenciada en la presente investigación se explicaría por la presencia de compuestos fenólicos y flavonoides en la guanábana (13). La literatura ha mostrado que los flavonoides poseen un amplio espectro de acciones biológicas incluyendo actividades hipotensiva, hipoglicémica, estrogénica, espasmoslítica, colagoga, antiinflamatoria, antilipidémica y antioxidante (16). En la actualidad existen estudios sobre un tipo de glicósido de flavona (derivados de flavonoide) (17) que demostró actividad hipoglicemiante debido a que estaría ligado a los receptores proliferadores de peroxisomas (PPARs) o antagonistas de receptores de glucagón, inhibidor dipeptidil peptidasa IV y activador de los receptores de insulina (18).
Hay tres subtipos de PPAR: PPAR-α, PPAR-γ y PPAR-δ. El PPAR-α se encuentra en el hígado, músculo esquelético y riñones, mientras que el PPAR-δ está ampliamente expresado. El PPAR-γ está relacionado con la regulación y maduración del adipocito, siendo el sitio de acción para los fármacos sensibilizadores a la acción de la insulina, como la troglitazona, pioglitazona y rosiglitazona, los que conllevan a la reducción de la glicemia (10,19,20). Este blanco molecular podría ser el sitio de acción donde posiblemente actuarían los flavonoides presentes en el extracto etanólico de las hojas de la guanábana, porque se ha demostrado actividad hipoglicemiante con derivados de flavonoides, como la quercetina (21) y la isoorientina (22).
La dipeptidil peptidasa IV (DPP-IV) es una enzima que degrada a la hormona incretina. El principal y predominante tipo de incretina es el GLP-1, que estimula la secreción de insulina, suprime la liberación de glucagón, enlentece el vaciamiento gástrico, mejora la sensibilidad a la insulina, y reduce el consumo de alimentos (23,24); y los flavonoides estarían favoreciendo la presencia del inhibidor dipeptidil peptidasa IV (25).
Otros metabolitos secundarios que estarían coadyuvando con el efecto hipoglicemiante son los alcaloides, que inducen la secreción de insulina solo en concentraciones altas de glucosa, lo cual disminuye el riesgo de hipoglicemia (26-28); esto ha sido confirmado mediante estudios in vitro, al aislar los islotes pancreáticos y someterlos al alcaloide tipo quinolizidine, que determinó secreción de insulina, medida por radioimmunoensayo (29).
Se concluye que los pacientes con diabetes tipo 2 compensados con terapia de glibenclamida y con tratamiento coadyuvante de las cápsulas conteniendo extracto etanólico de Annona muricata (guanábana) mostraron mayor reducción del nivel de la glicemia, que en aquellos que solo recibieron glibenclamida.
AGRADECIMIENTOS
Se da un agradecimiento muy especial al Consejo Superior de Investigaciones de la UNMSM, por el financiamiento del Proyecto FEDU de código 07003291, del año 2007.
REFERENCIAS BIBLIOGRÁFICAS
1. Girogino F, Laviola L, Leonardini A. Pathophysiology of type 2 diabetes: Rationale for different oral antidiabetic treatment strategies. Diabetes Res Clin Prac. 2005;68:S22-9. [ Links ]
2. Kobayashi M, Yamazaki K, Hirao K, Oishi M, Kanatsuka A, Yamauchi M, et al. The status of diabetes control and antidiabetic drug therapy in JapanA cross-sectional survey of 17,000 patients with diabetes mellitus (JDDM 1). Diab Res Clin Prac. 2006;73:198-204. [ Links ]
3. Villena J. Epidemiología de la diabetes mellitus en el Perú. Rev Med Peru. 1992;64(347):71-5.
4. Arbañil H, Valdivia H, Pando R. La diabetes mellitus en el Hospital Dos de Mayo. Aspectos epidemiológicos. Rev Med Peru. 1994;66(350):6-9. [ Links ]
5. Charlton Fe, Nuñez O, Tapia ZL, Tapia ZG. Complicaciones tardías en diabetes mellitus tipo 2 en el Hospital II Essalud – Cañete. Rev Med Hered. 2004;15:64-9. [ Links ]
6. Bowker SL, Majumdar SR, Veugelers P, Jonson JA. Increased cancer-related mortality for patients with type 2 diabetes who use sulfonylureas or insulin. Diab Care. 2006:29:254-8. [ Links ]
7. Glitazonas en la diabetes tipo 2: ¿Una relación beneficio-riesgo desfavorable?. butlletí groc. 2007;20(4):13-16. [ Links ]
8. Nissen S, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and deaht from cardiovascular causes. NEJM 2007;356:2457-71. [ Links ]
9. Smith U, Gale EAM. Does diabetes therapy influence the risk of cancer?. Diabetologia 2009; 52:1699-708. [ Links ]
10. Bailey CJ. Potential new treatments for type 2 diabetes. Trends in Pharmacological Sciences. 2000;21:259-65. [ Links ]
11. Farnsworth NR. Ethnopharmacoloy North American Experience. J Ethnopharmacol. 1993;38:145-52. [ Links ]
12. Duke JA, Vásquez R. Amazonian Ethnobotanical Dictionary. CRC press Inc. 1994. p. 22-3.
13. Arroyo J, Rojas J, Raez E, Ronceros G, Bonilla P, Li E. Influencia de compuestos fenólicos y triterpenoides de Annona muricata más Krameria lappacea sobre el proceso inflamatorio crónico. Estudio preclínico y clínico. An Fac med. 2004;65 Supl 1:36. [ Links ]
14. Palomino C. Tesis para al grado de magister en Farmacología. Universidad Nacional Mayor de San Marcos. Lima, Perú. 2006.
15. Fauli T. Tratado de Farmacia Galénica. Primera edición. Madrid: ed. Luzan 5 S.A.; 1993. [ Links ]
16. Adeneye AA, Adeleke TI, Adeneye AK. Hypoglycemic and hypolipidemic effects of the aqueous fresh leaves extract of Clerodendrum capitatum in Wistar rats. Journal of Ethnopharmacology. 2008 (116): 7-10. [ Links ]
17. Coskun O, Kanter M, Korkmaz A, Oter S. Quercetin, a flavonoid antioxidant, prevents and protects streptozotocin-induced oxidative stress and β-cell damage in rat pancreas. Pharmacol Res. 2005;51:117-23. [ Links ]
18. Varma SD, Kinoshita JH. Inhibition of lens aldose reductase by flavonoidsTheir possible role in the prevention of diabetic cataracts. Bioch Pharmacol. 1976;25:2505-13.
19. Asgary S, Naderi Gh, Sarrafzadegan N, Ghassemi N, Boshtam M, Rafie M, Arefian A. Anti-oxidant effect of flavonoids on hemoglobin glycosylation. Pharm Acta Helvetiae. 1999;73:223-6. [ Links ]
20. Feinstein D, Spagnolo A, Akar C, Weinberg G, Murphy P, Gavrilyuk V, Dello Russo C. Receptor-independent actions of PPAR thiazolidinedione agonists: Is mitochondrial function the key? Bioch Pharmacol. 2005;70:177-88. [ Links ]
21. Panunti B, Jawa A, Fonseca V. Mechanisms and therapeutic targets in type 2 diabetes mellitus Drug Discovery Today: Disease Mechanisms. 2004;1:151-7.
22. Jannetta PJ, Hollihan L. Type 2 diabetes mellitus, etiology and possible treatment: preliminary report. Surg Neurol. 2004;61:422-6. [ Links ]
23. Bradley C. The glitazones: a new treatment for type 2 diabetes mellitus. Intens Crit Care Nurs. 2002;18:189-91. [ Links ]
24. Vessal M, Hemmati M, Vasei M. Antidiabetic effects of quercetin in streptozocin-induced diabetic rats. Comparative Biochemistry and Physiology. Part C. Toxicol Pharmacol. 2003;135:357-64. [ Links ]
25. Sezika E, Aslana M, Yesiladaa E, Ito S. Hypoglycaemic activity of Gentiana olivieri and isolation of the active constituent through bioassay- directed fractionation techniques. Life Sci. 2005;76:1223-8. [ Links ]
26. Christopher H, McIntosh S, Hans-Ulrich Demuth, J, Pospisilik A, Raymond P. Dipeptidyl peptidase IV inhibitors: how do they work as new antidiabetic agents?. Regul Peptides. 2005;128:159-65. [ Links ]
27. Arechavaleta GR. El efecto fisiológico de las hormonas incretinas. Adv Stud Med. 2006;6:S581-5. [ Links ]
28.Vinson JA, Dabbagh YA, Serry MM, Jang J. Plant flavonoids, especially tea flavonols, are powerful antioxidants using an in vitro oxidation model for heart disease. J Agric Food Chem. 1985;43:2800-2. [ Links ]
29. Costantino L, Raimondi L, Pirisino R, Brunetti T, Pessotto P, Giannessi F, Paulino A, Barlocco D, Antolini L, El-Abady S. Isolation and pharmacological activities of the Tecoma stans alkaloids. Pharmacy Res. 2003;58:781-5. [ Links ]
Manuscrito recibido el 12 de junio de 2009 y aceptado para publicación el 20 de agosto de 2009.
Correspondencia:
Dr. Jorge Luis Arroyo Acevedo
Sección de Farmacología
Facultad de Medicina, UNMSM
Av. Grau 750. Lima 1, Perú
Correo-e: jorgeluis_arroyoacevedo@yahoo.es