Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.71 n.1 Lima ene./mar. 2010
Aspectos entomológicos de la enfermedad de Chagas en Huallaga y Picota, San Martín, Perú
Entomological aspects of Chagas disease in Huallaga and Picota, San Martin, Peru
Abraham G. Cáceres1a,2, Silvia Vega1b, Jenny Ancca1b, Jesús Pinto1b, Gregorio Vela3, Videla Cárdenas3, Juan Ruiz4d, Patricia Del Pilar Alva5, Javier Ruiz6, Arcadio Alvarado6, Heriberto Arévalo4d, Francisco Cruzado4d, Felipe Vela4d, César Náquira1
1 Instituto Nacional de Salud. Lima, Perú.
2 Departamento Académico de Microbiología Médica, Facultad de Medicina Humana, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Hospital de Saposoa. San Martín, Perú.
4 Dirección Regional de Salud San Martín. San Martín, Perú.
5 Laboratorio de la Red de Salud de Picota. San Martín, Perú.
6 Red de Salud Huallaga. San Martín, Perú.
a Laboratorio de Entomología, b Laboratorio de Leishmania y Chagas, c Laboratorio Referencial Regional, d Dirección General de Salud Ambiental
Resumen
Introducción: Existe escasa información y no actualizada sobre la presencia de triatominos en el departamento de San Martín, zona amazónica de nuestro país, y es importante actualizarla, ya que hay reportes recientes de casos de enfermedad de Chagas procedentes de la amazonía peruana cuyos vectores serían triatominos silvestres. Objetivos: Conocer la distribución geográfica de triatominos hematófagos en Huallaga y Picota, San Martín, Perú. Determinar los índices entomológicos, sus hábitos alimenticios y caracterizar los tripanosomatídeos que portan. Diseño: Investigación descriptiva observacional. Lugar: Red de Salud Huallaga y Picota, Laboratorio Regional de la Región de Salud San Martín. Laboratorios del Instituto Nacional de Salud. Participantes: Viviendas de 6 distritos de las provincia de Huallaga y 9 de Picota, del Departamento de San Martín. Intervenciones: La búsqueda de triatominos fue en 3 362 viviendas de áreas periurbanas y rurales. Mediante la prueba de precipitina, se determinó la fuente de alimentación. Se aisló tripanosomatídeos mediante infección en ratones Balb/C e inoculación en medio agar sangre, y por PCR se caracterizó el genoma por amplificación del espaciador intergénico del gen miniexón. Principales medidas de resultados: Determinar si Huallaga y Picota, San Martín, Perú, son zonas de riesgo de enfermedad de Chagas. Resultados: En 46 viviendas, de 3 362 muestreadas se capturó 53 triatominos adultos pertenecientes a Rhodnius pictipes (56,6%), Panstrongylus geniculatus (41,5%) y Eratyrus mucronatus (1,9%). Se reporta P. geniculatus por primera vez para las dos provincias. Los índices de infestación para ambas provincias fueron 1,4% y 3,8%, respectivamente, y corresponden al índice de infección natural; mientras que el índice de dispersión fue 30,1%. En R. pictipes se identificó cinco fuentes de alimentación (pollo, humano, perro, cobayo y gato) y en P. geniculatus un perfil alimentario mixto: perro/gato/pollo. Los Trypanosoma spp. aislados de R. pictipes, procedente de Sacanche (Huallaga), corresponden a TCI (350 pb); resultado similar se obtuvo en los 10 clones de este aislamiento. Conclusiones: Los resultados nos indican que, en las localidades estudiadas, R. pictipes y P. geniculatus estarían pasando por un proceso de domiciliación y que en las localidades de Huallaga R. pictipes sería el principal vector de Trypanosoma cruzi TC1; por lo que, dichas localidades estarían consideradas como zonas de riesgo de enfermedad de Chagas.
Palabras claves: Enfermedad de Chagas; Panstrongylus; Rhodnius; Trypanosoma cruzi; Perú, San Martín.
Abstract
Introduction: There is little and not recent information on the presence of triatomine bugs in San Martin department, Amazon area of our country where Chagas disease has been reported by wild triatomine insects as vectors. Objectives: To determine the geographic distribution of hematophagous triatomine insects in Huallaga and Picota provinces, San Martin department, Peru. To determine the domiciliary infestation by triatomine vectors indexes, trypano-triatomine infection as well as their dispersion. To determine the insects feeding source and to genetically characterize the tripanosomatidae they carry. Design: Observational and descriptive study. Setting: Health and Laboratories region networks. National Institute of Health laboratories. Participants: Houses from 6 districts of Huallaga province and 9 from Picota province (San Martin department). Interventions: Triatomine insects collection was carried out in 3 362 homes located in semi-urban and rural zones accounting for 30% of the total area of studied provinces. Feeding preferences were assessed by a precipitin test using specific antibodies against guinea pig, dog, cat, chicken and human beings sera. Trypanosomes were isolated by inoculation of stool samples from infected insects in Balb/c mice and using axenic culture media. Genetic characterization was done by PCR amplification of the genome by gene intergenic spacer of the miniexon. Main outcome measures: To assess if Huallaga and Picota, San Martin, Peru, are Chagas disease risk areas. Results: In 46 of the 3 368 homes visited, 53 triatomine adults were collected belonging to the species Rhodnius pictipes (56,6%), Panstrongylus geniculatus (41,5%) and Eratyrus mucronatus (1,9%). For the first time, P. geniculatus was reported in both provinces included in the study. Domiciliary infestation index was 1,4%, trypano-triatomine infection index was 3,8% and dispersion index was 30,1%. For R. pictipes 5 sources of food were identified (chicken, human, dog, guinea pig and cat) and for P. geniculatus, a mix feed: dog, cat and chicken. Trypanosoma spp. isolates of R. pictipes from Sacanche (Huallaga) belonged to T. cruzi TCI (350 pb); similar result was obtained in 10 clones studied. Conclusions: Results indicate that R. pictipes and P. geniculatus are undergoing colonization of the regions included in this study. Within the province of Huallaga, R. pictipes is the predominant vector of T. cruzi; therefore these locations must be considered high risk areas for Chagas disease.
Key words: Chagas disease; Panstrongylus; Rhodnius; Trypanosoma cruzi; Peru, San Martin.
INTRODUCCIÓN
La enfermedad de Chagas es causada por el Trypanosoma cruzi y es transmitida a vertebrados por algunas especies de triatominos de la subfamilia Triatominae; afecta aproximadamente entre 16 a 18 millones de personas en 18 países de América Latina y alrededor de 120 millones están en riesgo de adquirir esta infección (1). Las especies de triatominos reportadas para el departamento de San Martín, Perú, son: Panstrongylus herreri, P. lignarius, P. geniculatus, Rhodnius pictipes, R. robustus, Triatoma nigromaculata y Eratyrus mucronatus (2). De ellos, P. herreri es la única especie de hábito doméstico, sobretodo en ciertas localidades de las provincias de Moyobamba, Rioja, Lamas y Tarapoto, mientras que las otras especies son de hábitos silvestres (3-5).
Los primeros casos de infección humana por T. cruzi en San Martín, fueron comunicados por Lumbreras (2) y Buck (6), no existiendo registro de nuevos casos humanos hasta años recientes, probablemente porque la sintomatología y signos de la infección pasan desapercibidos con otros diagnósticos. El año 2002, Arévalo examinó, mediante la técnica de ELISA e inmunofluorescencia indirecta, una muestra de 638 sueros obtenidos de humanos, procedentes de Huallaga y Picota, provincias del departamento de San Martín, detectando 25% de anticuerpos anti T. cruzi en ambas pruebas (7).
Los triatominos, de acuerdo a su hábitat, presentan un perfil de alimentación variado. Con la identificación apropiada de sus fuentes de alimentación se puede conocer su comportamiento en relación a humanos, animales domésticos y animales silvestres; además, se puede determinar su hábitat e identificar a los responsables de la transmisión de T. cruzi y/o T. rangeli en las áreas endémicas de la enfermedad, pautas ya mencionadas por Pinto (8).
La necesidad de diseñar e implementar estrategias de control vectorial a triatominos de hábitos silvestres y a las especies que incursionan ocasionalmente a las viviendas nos obliga a conocer aspectos de su biología y eco-epidemiología. Así, los objetivos del presente estudio fueron: conocer la distribución geográfica de triatominos hematófagos de Huallaga y Picota en el departamento de San Martín; determinar los indicadores entomológicos; estudiar y caracterizar la infección natural por Trypanosoma spp y determinar la fuente de alimentación de triatominos capturados en el interior de las viviendas.
MÉTODOS
Se realizó un estudio observacional y descriptivo de junio del año 2005 a octubre del año 2006, en 41 localidades pertenecientes a 6 distritos de la provincia de Huallaga y en 32 localidades correspondientes a 9 de los 10 distritos de la provincia de Picota, del departamento de San Martín, Perú.
El área de estudio fue el departamento de San Martín, ubicado en la región nororiental del Perú (selva alta), que presenta cuatro zonas: a) la occidental, que limita con la Cordillera Oriental de los Andes y presenta una topografía accidentada; b) zona de valles amplios, con presencia de terrazas escalonadas que han sido formadas por el río Huallaga y sus afluentes, zona agropecuaria por excelencia; c) zona sureste, con un relieve que es continuación de la llamada Cordillera Azul, de poca elevación, pues sus cumbres no sobrepasan los 3 000 msnm; y, d) zona noreste, poco accidentada, que se caracteriza por ser selva baja. Tiene clima subtropical y tropical, con dos estaciones, una seca (junio a septiembre) y otra lluviosa (octubre a mayo). El promedio de temperatura es de 32°C máxima y 28°C mínima, con una temperatura anual media de 24°C y la precipitación media anual de 1 500 mm.
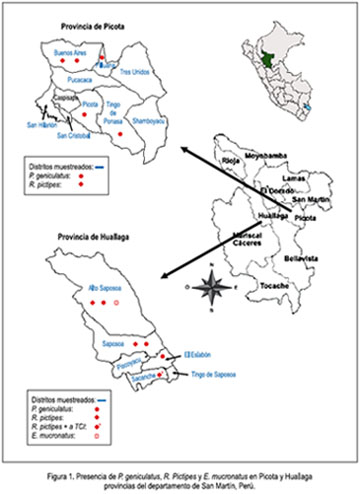
La provincia de Huallaga está constituida por 6 distritos, mientras que la provincia de Picota por 10 (figura 1). En ambas provincias, la población en su mayoría se ha establecido progresivamente a partir del año 2000, con pobladores que proceden de Cajamarca, Amazonas y Piura.
El mayor porcentaje de viviendas está disperso en las áreas rurales, próximos a la floresta y entre los terrenos de cultivo. El 83% de las viviendas de Huallaga y 73% de Picota son de material rústico. Un menor número de viviendas tiene paredes de adobe con techo de calamina, pero las paredes del mayor número de viviendas son de quincha (caña brava y/o carrizo a la cual se adiciona barro); ocasionalmente utilizan tablas y, como techo, hojas de palmera; todas las viviendas tienen piso de tierra. Las viviendas dispersas en el campo se localizan de ocho a diez horas a pie de un centro poblado mayor, lugar donde termina la carretera.
La población de ambas provincias se dedica al cultivo del cacao, café, naranja, maíz, algodón; además, en el interior de sus viviendas crían cuyes, perros, gatos; las aves están en los alrededores de las viviendas. Algunas personas han domesticado al Tayassu tajacu (sajino) y al Agouti paca (majaz), los cuales sacrifican para en su alimentación.
Para la captura de triatominos, se procedió a la búsqueda intradomiciliaria previa información básica sobre la enfermedad de Chagas, objetivos de la investigación y autorización por parte de la persona responsable de la vivienda a evaluar. La búsqueda se realizó mediante el método activo de captura/ hora/ hombre, desde 08:00 a 13:00 horas y de 14:00 a 19:00 horas (9). El tiempo fue de 15 a 20 minutos por vivienda, utilizando linterna de mano, alambre de 30 cm de largo, pinzas largas y vasos colectores. La búsqueda fue en viviendas de zonas periurbanas y de campo, específicamente en el interior de las viviendas y el peridomicilio, hasta unos 30 m alrededor de la vivienda. En el primer caso, se dio preferencia a los dormitorios, donde la búsqueda fue entre tablas del catre o tarima, entre el colchón y las frazadas, ángulos superiores de los mosquiteros, hendiduras, grietas de las paredes, detrás de los cuadros y roperos, papeles adheridos a la pared, así como en cocina-comedor-cuyero; en estos ambientes, la búsqueda fue en las hendiduras de las paredes donde se ubica el comedor y encierran los cuyes. Mientras que, en el segundo caso, la búsqueda fue en las hendiduras externas de la pared, troncos de madera, aglomeraciones de tablas, muros de adobes y piedras, lugares donde reposan perros, gatos, encierran aves y nidos de gallinas.
Los triatominos capturados fueron colocados en vasos de plástico con tapas herméticas conteniendo papel corrugado. En el exterior del vaso se consignó los datos (localidad, ambiente y fecha de captura) y fueron enviados al Laboratorio de Entomología del Instituto Nacional de Salud, donde se realizó la identificación morfológica mediante la clave de Lent y Wygodzinsky (10).
Para el estudio de la infección natural de Trypanosoma spp. en triatominos, el contenido del tubo digestivo de los triatominos vivos y muertos fueron examinados individualmente; se homogenizó la muestra con solución salina sobre un portaobjeto limpio y se cubrió con laminilla; luego, se observó al microscopio (10X y 40X).
El aislamiento de Trypanosoma fue mediante:
a) Infección experimental en ratones: 0,1 mL de homogenizado del tubo digestivo de cada triatomino positivo a tripanosomatideos fue inoculado vía intraperitoneal en dos ratones Balb/C. El seguimiento de la parasitemia en el ratón fue mediante el método de microconcentración (microhematocrito), que consiste en colectar 70 ul de sangre del ratón infectado en tubos capilares heparinizados y concentrarlos por centrifugación durante 1 minuto, a 5 000 RPM. Los elementos de la sangre se separan por gradiente de densidad y los Trypanosoma presentes en la muestra se ubican entre los glóbulos blancos y el plasma (11).
El examen se realizó diariamente, durante siete días; posterior a ello, fue una vez por semana, durante tres meses consecutivos.
b) Medio agar sangre: 0,1 mL de sangre de ratón infectado con Trypanosoma spp. de la infección experimental fue sembrado en el medio de cultivo bifásico (agar sangre enriquecido con sangre desfibrinada de conejo al 15% y suero fisiológico al 8,5%) y mantenido a 28°C; la lectura y repiques se realizó una vez por semana durante dos meses.
Para la caracterización genómica de Trypanosoma spp, los Trypanosoma spp. aislados fueron sometidos a técnicas moleculares. El ADN genómico fue extraído a partir de parásitos mantenidos en medio de cultivo mediante el kit DNAeasy Tissue Handbook de QUIAGEN y el procedimiento fue de acuerdo al protocolo indicado por el fabricante.
La amplificación por la reacción en cadena de la polimerasa (PCR) del kADN de trypanosomatideos se realizó utilizando los iniciadores S35 (5´AAA TAA TGT ACG GGT CCA GAT GCA TGA 3´), S36 (5´GGG TTC GAT TGG GGT TGG TGT 3´) y KP1L (5´ATA CAA CAC TCT CTA TAT CAG G 3´) (12). El PCR fue ejecutado en las siguientes condiciones de ciclaje: 5 minutos a 94°C; 29 ciclos a 60°C -1 minuto, 72°C-1 minuto, 92°C-1 minuto, con una extensión final a 72°C por 5 minutos.
Se visualizó los productos de reacción por electroforesis en geles de poliacrilamida al 6%, teñidos con nitrato de plata, utilizando el marcador de peso molecular de 50 pb (Fermentas Life Science, GEN LAB del Perú S.A.C.).
La amplificación por PCR del espaciador intergénico del gen miniexón de los tripanosomatídeos se realizó utilizando los iniciadores TCC (5´ CCC CCC TCC CAG GCC ACA CTG 3´), TC1 (5´ GTG TCC GCC ACC TCC TTC GGG CC 3´) y TC2 (5´ CCT GCA GGC ACA CGT GTG TGT G 3´) (12). El perfil térmico utilizado fue el siguiente: 5 minutos a 94°C; 34 ciclos a 50°C-30 segundos, 72°C-30 segundos, 94°C-30 segundos, con una extensión final a 50°C-72°C por 5 minutos. Como en el caso anterior, los productos fueron separados por electroforesis en gel de poliacrilamida al 6% y teñidos con nitrato de plata. Se utilizó el marcador de peso molecular de 50 pb (Fermentas Life Science, GEN LAB del Perú S.A.C ).
Se calculó los siguientes indicadores entomológicos, según la OPS (13):
a) Índice de dispersión (ID). El presente índice determina la distribución del vector y de las especies presentes por localidades. Sirve para determinar el área en la que se va a actuar. Es indicador operacional y sirve para la toma de decisión. Se determina mediante:
ID = (No de localidades infectados por triatominos / No de localidades examinadas) X 100
b) Índice de infestación (IIF). Es el principal indicador operacional y determina la magnitud o grado de distribución del vector en las viviendas. Se determina mediante:
IIF = (No de casas infestadas por triatominos / No de casas examinadas) X 100
c) Índice de infección natural (IIN). Nos permite conocer el porcentaje de triatominos infectados con Trypanosoma cruzi en un área determinada. Conocido también como índice trypano triatomínico (ITT), es determinado mediante:
IIN = (No de triatominos infectados por Trypanosoma cruzi / No de triatominos examinados) X 100
Con relación a la preferencia alimentaria, la preparación de los antisueros, la titulación y la determinación de la especificidad se realizó mediante la técnica de Siquiera (14). Los títulos de los antígenos utilizados en la prueba de precipitina fueron: anti-cobayo 1:10 000, anti-perro 1:15 000, anti-gato (1:10 000), anti-pollo (1:15 000) y anti-humano (1: 25 000).
Se obtuvo los antisueros anti-cobayo, anti-perro, anti-gato, anti-pollo y anti-humano mediante inoculaciones de sangre de Cavia porcellus (cobayo), Canis familiaris (perro), Felis catus (gato), Gallus gallus (pollo) y Homo sapiens (humano), respectivamente, en conejos Nueva Zelandia.
El contenido intestinal de cada triatomino se impregnó en papel Whatman N° 4, fue secado en estufa a 37°C por 24 horas y se conservó en bolsitas plásticas a -20°C hasta el momento de ser procesado.
La prueba de precipitina consistió en enfrentar cada antisuero con el contenido intestinal de cada triatomino, según la metodología de Pinto (8).
RESULTADOS
Resultados previos del estudio fueron presentados al Instituto Nacional de Salud (INS) como informe preliminar, el cual fue publicado en la página web del INS, disponible en http://www.bvs.ins.gob.pe/insprint/cindoc/informes_tecnicos/46.pdf (15).
En esta oportunidad, se da a conocer los resultados finales del estudio:
El estudio se desarrolló de junio 2005 a octubre 2006 y se visitó 3 362 viviendas pertenecientes a 73 localidades de las provincias de Huallaga y Picota, del departamento de San Martín.
En el interior de 46 viviendas de ambas provincias se capturó 53 triatominos adultos (41 ejemplares en Huallaga y 12 en Picota); no se encontró estadios inmaduros, huevos ni exuvias.
En las dos provincias, las especies capturadas fueron Rhodnius pictipes (56,6%), P. geniculatus (41,5%) y 1,9% de Eratyrus mucronatus, de los cuales dos ejemplares de P. pictipes estaban infectados con Trypanosoma cruzi linaje I (TCI); los ejemplares fueron capturados en una localidad del distrito de Sacanche (Huallaga) (figura 1).
Se reporta por primera vez P. geniculatus para las provincias de Huallaga y Picota. En Huallaga, esta especie se encontró en cinco localidades de los distritos de Saposoa, El Eslabón y Alto Saposoa, mientras que en Picota fue en cinco localidades, pertenecientes a los distritos de Buenos Aires, Tingo de Ponasa, Picota y Pilluana (figura 1).
Se reporta por primera vez R. pictipes para la provincia de Picota, con ejemplares capturados en la localidad de Paujilzapa, distrito de Buenos Aires; mientras que en la provincia de Huallaga fue detectada en 13 localidades pertenecientes a los distritos de Saposoa, Alto Saposoa y Sacanche. Por primera vez se comunica esta especie para el distrito de Alto Saposoa (figura 1).
En la localidad de Yacusisa, distrito de Alto Saposoa (Huallaga), se capturó un ejemplar de E. mucronatus, lo cual es una comunicación nueva para el mencionado distrito (figura 1).
Todos los ejemplares de R. pictipes y de P. geniculatus fueron capturados en el interior de las casas ubicadas en periurbanas y rurales; mientras que E. mucronatus fue capturado en la cara interna de la base foliar de Attalea spp. Estas palmeras se ubican a 40 metros de distancia de las viviendas.
De los datos obtenidos en campo, se calculó los siguientes índices entomológicos:
a) El índice de dispersión de los triatominos para ambas provincias fue 30,1%, mientras que para Huallaga fue 39% y para Picota 18,8% (tabla 1).
b) El índice de infestación para las viviendas de la provincia de Huallaga fue 2% y los de Picota 0,6% y 1,4% para ambas provincias (tabla 1).
c) El índice de infección natural en la provincia de Huallaga, para R. pictipes fue 7,2%, mientras que para las tres especies de triatominos 4,9%. Para ambas provincias, 6,7% fue para R. pictipes y 3,8% para las tres especies de triatominos (tabla 1).
En 10 de 13 ejemplares de R. pictipes (77%) se identificó el tipo de alimentación, siendo la sangre de pollo el más frecuente (23,1%), seguido de humano, perro y cobayo, cada uno con 15,4%, y sangre de gato (7,7%). En tres ejemplares (23,1%) no se logró identificar la fuente de alimentación (tabla 2).
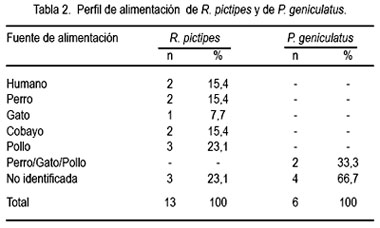
En dos de seis ejemplares (33,3%) de P. geniculatus se detectó hasta tres tipos de fuentes de alimentación, correspondiendo a sangre de perro, gato y pollo; el resto de triatominos (66,7%) no fue reactivo a los antisueros empleados (tabla 2).
Al correlacionar el perfil alimentario con la infección por tripanosomatídeos, solo se evidenció esta correlación en el contenido intestinal de dos R. pictipes (Rp01ac y Rp220), ambos ejemplares procedentes de Huallaga.
Se determinó que Rp220 fue reactivo al antisuero anti-gato, mientras que en Rp01ac no se pudo detectar algún tipo de fuente alimenticia.
Con relación a la infección natural de los triatominos, al examinar el homogenizado del contenido intestinal de los 53 triatominos capturados, en dos de ellos se observó tripanosomatídeos; ambos triatominos fueron identificados como R. pictipes, capturados en la localidad de Sacanche (Huallaga).
El examen de las glándulas salivales y hemolinfa de ocho ejemplares de R. pictipes y de seis P. geniculatus fueron negativos a T. rangeli.
Para el aislamiento de Trypanosoma spp. y caracterización genómica, las muestras del contenido digestivo de los dos R. pictipes (Rp 220 y Rp 221) positivos a infección por tripanosomatídeos fueron inoculadas intraperitonealmente por separado en dos ratones Balb/C. La parasitemia en el ratón inoculado con muestra del Rp 220 fue positiva a Trypanosoma spp. a los 30 días, mientras que el Rp 221 fue negativo en el transcurso de dos meses de evaluación.
Se inoculó una alícuota de sangre del ratón positivo a Trypanosoma spp. en medio bifásico agar sangre 15% y solución salina 0,85% y se incubó a 28°C. A los cultivos se realizó lecturas microscópicas cada cinco días, observándose Trypanosoma spp. en el cultivo a los 30 días después de la siembra.
Para la caracterización genómica, los parásitos aislados a partir de R. pictipes (Rp 220), fueron caracterizados , obteniendo lo siguiente:
Mediante la amplificación de minicírculos de kADN se tipificó como T. cruzi (330 pb) y mediante la amplificación de la región ínter génica del gen miniexón como Trypanosoma cruzi linaje I (TCI) (350 pb).
Mediante la amplificación de minicírculos de kADN no se evidenció la existencia de T. rangeli.
A partir de las formas tripomastigotes del aislado se obtuvo 10 clones; estos fueron caracterizados mediante amplificación de minicírculos del kADN y por amplificación de la región ínter génica del gen miniexón; todos los clones fueron caracterizados como TC1, determinándose que no existió multiclonalidad en este aislado.
DISCUSIÓN
Las viviendas muestreadas se ubicaron en zona periurbana y rural de Huallaga y Picota, provincias del departamento de San Martín. Las viviendas ubicadas en zonas rurales están dispersas entre los terrenos de cultivo, rodeadas de floresta primaria y/o secundaria. En dicha floresta existen diversas especies de animales silvestres que comparten el hábitat con los triatominos (16).
El 80% de las viviendas en las que se capturó los triatominos se ubica en zonas rurales, mientras que 20% corresponden a zona periurbana. Las viviendas positivas a triatominos están en contacto con la floresta y en ellos los perros y gatos frecuentan a diario el campo en busca de alimento, lo cual sería una probabilidad que se infecten con tripanosomatídeos de los triatominos silvestres.
Los triatominos silvestres, al no encontrar alimento en su hábitat natural como consecuencia de la caza indiscriminada de animales silvestres y la constante deforestación y quema de arbustos y árboles, migran e ingresan a las viviendas próximas a la floresta o a las zonas periurbanas (17,18), donde entran en contacto temporal con mamíferos domésticos (perros, gatos, cuyes, caballos, ovinos, vacunos) y también con personas, de las cuales obtienen su alimento.
El bajo porcentaje de IIF (1,4%) obtenido para las viviendas de ambas provincias nos sugiere que las tres especies de triatominos tienen un comportamiento silvestre y que ocasionalmente ingresan a las viviendas de las zonas periurbanas y rurales en busca de alimentos o son atraídas por la luz. En el interior y en el peridomicilio del 100% de las viviendas muestreadas no se ha encontrado estadios inmaduros ni huevos o exuvias de triatominos; pero, sí se ha observado restos fecales impregnados en las paredes internas del dormitorio y de la cocina - comedor.
El Panstrongylus geniculatus es una especie silvestre y de amplia distribución en el Perú; se le considera vector secundario de T. cruzi. Estadios adultos de esta especie han sido colectados en el interior de viviendas periurbanas y rurales de las localidades de los departamentos de Amazonas, norte de Cajamarca, Ayacucho y de Puno, este de Huánuco, Junín y Pasco, Loreto, Madre de Dios, San Martín y Ucayali, localizados en la amazonía del Perú (19). En San Martín, esta especie ha sido encontrada en las provincias de Mariscal Cáceres, Tocache, Lamas, Moyobamba y San Martín (20) y es considerado como un triatomino en proceso de domesticación, pues en múltiples ocasiones se halla en estadios adultos en el interior de las viviendas ubicadas en áreas periurbanas y de campo (19).
Se comunica la presencia de P. geniculatus en localidades de cuatro distritos de la provincia de Picota (Buenos Aires, Pilluana, Picota y Tingo de Ponasa); así mismo, en localidades de Alto Saposoa, Saposoa y El Eslabón, distritos de la provincia de Huallaga (figura 1). Las viviendas donde fueron capturados estos ejemplares se ubican en zonas periurbanas y rurales rodeadas de bosques primarios.
Ya Lent y Wygdzinsky han mencionado que esta especie ingresa a las viviendas a la atracción por la luz (10). Posiblemente esto mismo suceda en Huallaga y Picota. O también pueden ingresar en busca de alimento. Wolf y Castillo informan de la domiciliación de esta especie en viviendas de Antioquía, Colombia (21). Este cambio de comportamiento de P. geniculatus podría ocurrir también en Huallaga y Picota, puesto que en los últimos nueve años han ingresado grupos poblacionales a la zona de selva alta y selva baja, originando una modificación en la ecología de la zona, obligando a P. geniculatus y a otros triatominos vectores silvestres que cambien de comportamiento.
El Rhodnius pictipes es una especie reportada para Loreto, Ucayali, San Martín, Cusco, Madre de Dios, Huánuco, Ayacucho, Junín y Pasco (19,20). En San Martín, se le informa para las provincias de Rioja, Lamas, Huallaga, Bellavista, San Martín y Mariscal Cáceres (20). Hasta el momento se le considera como especie silvestre, pero por necesidad de alimento ingresa a viviendas periurbanas y de áreas rurales.
Investigadores peruanos mencionan de la infección natural de R. pictipes con T. cruzi, evidencia constatada mediante inoculaciones en ratones (2,20). Recientemente, en Ucayali se ha capturado en el interior de las viviendas varios ejemplares de esta especie infectados naturalmente con tripanosomatídeos y que al procesamiento por técnicas de biología molecular (PCR) han sido caracterizados como T. cruzi (Cáceres GA, trabajo en preparación).
Miles y colaboradores realizaron un estudio en la ciudad de Belém, Brasil, en donde, atraídos por la luz, colectaron dentro de las casas una gran cantidad de estos vectores, de los cuales varios ejemplares de R. pictipes estaban infectados naturalmente con T. cruzi. Asimismo, los autores a pocos metros de las casas encontraron algunas palmeras infestadas con este vector y algunos marsupiales, como Didelphis marsupialis, y demostraron que el T. cruzi aislado de vector y reservorio correspondía al zymodema 1 (T. cruzi Z1) (22).
En las 73 localidades muestreadas, 90% de las viviendas están rodeadas de diversas especies de palmeras. Estas palmeras podrían constituir hábitats naturales de R. pictipes y de ellas vuelan a las viviendas en busca de alimento (22).
Los dos ejemplares de R. pictipes infectados naturalmente con TCI fueron capturados en el interior de una misma vivienda, pero en fechas diferentes; dicha vivienda se ubica en zona rural del distrito de Sacanche, provincia de Huallaga (figura 1).
Nuestros resultados son concordantes respecto al comportamiento de R. pictipes con los trabajos realizados por Teixeira y colaboradores en relación a la transmisión de T. cruzi en palmeras de la amazonía (16) y por Fé y colaboradores, quienes capturaron R. pictipes en el interior de viviendas y en peridomicilios de ecotopos silvestres de la amazonía brasileña (17).
El Eratyrus mucronatus es un triatomino silvestre. En el Perú, esta especie es comunicada para los departamentos de San Martín, Loreto, Ucayali, Junín, Puno y Madre de Dios (19). En San Martín, ha sido encontrado en las provincias de Lamas, Mariscal Cáceres y Huallaga (20).
Durante el desarrollo de la investigación, se capturó una ninfa de cuarto estadio de E. mucronatus, en la cara interna de la base foliar de Atallea spp. Dicha palmera se ubica a 40 m de una vivienda de Yacusisa, distrito de Alto Saposoa, provincia de Huallaga. La ninfa se adaptó al laboratorio y se alimentó con sangre de pollo cada 15 días y, después de cuatro meses, se la obtuvo adulta. En ciertas localidades del mencionado distrito esta especie al parecer está mudando de comportamiento, pues, desde 2003, en ciertas localidades del departamento de San Martín, en numerosas oportunidades se ha encontrado buen número adultos de E. mucronatus en el interior de las viviendas ubicadas próximas a la floresta primaria y/o secundaria. Esto podría ser una consecuencia del ingreso de grupos de personas a los ambientes amazónicos, ya que en los últimos cinco años estas personas han establecido sus viviendas en el interior de la floresta primaria de la provincia de Huallaga, con la finalidad de realizar trabajos de agricultura, originando un desequilibrio ecológico de la zona, como la caza indiscriminada de animales silvestres, la tala y quema de árboles, dando lugar a que los triatominos silvestres migren en busca de alimento en los alrededores de las viviendas ya establecidas.
Los resultados de nuestro estudio, referente a la parte entomológica, son muy similares a los obtenidos por Serrano y colaboradores en el Municipio Costa de Oro, Estado Aragua, Venezuela, donde recolectaron P. geniculatus, R. pictipes y E. mucronatus (23), con la única diferencia de que el mayor porcentaje de triatominos capturados por nosotros fue R. pictipes.
Con relación a la preferencia alimentaria, la principal fuente de alimentación de R. pictipes fue la sangre de pollo, seguido de la del humano y de perro. Nuestros resultados obtenidos son similares a los de Solís (24), quien realizó un estudio en tres localidades del departamento de Ica, donde menciona que la principal fuente de alimentación de T. infestans es la sangre de aves, seguido de la de roedores, humanos y perros.
El P. geniculatus tuvo un perfil de alimentación mixto (33,3%), es decir, fue reactivo a antisueros de perro/gato/pollo. Se ha descrito que P. geniculatus se introduce en la vivienda humana atraído por la luz (25), situación que podría estar ocurriendo en esta zona, puesto que solo se capturó especímenes adultos. La fuente de alimentación múltiple encontrada en dos P. geniculatus nos indica la movilidad que tiene esta especie de triatomino y a la vez aprovecha la toma de alimento de diversos animales existentes en el interior y exterior de las viviendas. En 1994, Salvatella identificó hasta ocho tipos de fuente de alimentación en una ninfa de V estadio (26).
El hecho de encontrar dos ejemplares de P. geniculatus con alimentación múltiple nos indica que tiene una buena capacidad de dispersión para buscar diversos tipos de hospederos.
En tres ejemplares de R. pictipes (23,08%) y en cuatro P. geniculatus (66,67%) no se definió los perfiles alimentarios, por lo que se sugiere que para estudios futuros se debe utilizar antisueros obtenidos de animales silvestres o domésticos propios de esta zona a estudiar.
De acuerdo a nuestro estudio, en relación al perfil alimentario de R. pictipes, las personas y los animales domésticos serían sus hospederos preferidos y solamente los animales domésticos para P. geniculatus. Pero, esto estaría en relación con la disminución de los animales silvestres y de la cantidad de personas y animales domésticos existentes en cada vivienda.
Respecto a la caracterización genómica de los Trypanosoma spp. de R. pictipes, el hallazgo de Trypanosoma cruzi linaje I en el contenido intestinal de R. pictipes nos permite comentar que TCI siempre está asociado con los ciclos de transmisión silvestre; sin embargo, TCI incluye circulación en ambientes silvestres y domésticos (27-29). Ello indica que TCI no es el único linaje que circula por esta área, por lo que se requiere continuar con los estudios de caracterización molecular de los parásitos obtenidos de pacientes, vectores, así como de reservorios.
Se sabe que las cepas naturales de T. cruzi son multiclonales. Sin embargo, el número de clones podría cambiar drásticamente en diferentes ambientes como resultado de su incapacidad para competir o propagarse en su hospedero o la acción de los mecanismos de defensa del hospedero, disminuyendo la complejidad de la infección. Por tanto, debido a la alta diversidad genética de los clones que conforman una cepa, se ha sugerido que las características biológicas de cada grupo de T. cruzi deben ser estudiadas por separado para cada clon natural (30). En nuestro trabajo, al realizar el estudio de genotipificación, encontramos que los 10 clones aislados de Rp 220 corresponden a T. cruzi linaje I (TCI).
Con el presente estudio se demuestra la circulación de TCI en localidades de la provincia de Huallaga asociada a R. pictipes capturados en el intradomicilio. La provincia de Huallaga está circunscrita en la amazonía, donde la mayoría de las localidades se ubica entre la floresta primaria, rodeadas de árboles y palmeras, por lo que es factible que los triatominos silvestres ingresen a las viviendas con la finalidad de alimentarse o atraídos por la luz. En la amazonía brasileña, Fé y colaboradores mencionan las capturas en mayor número de R. pictipes en el interior de las viviendas, los cuales han estado infectados con tripanosomatídeos (17). Ya en 1999, Aguilar y colaboradores mencionaban la importancia epidemiológica que tiene R. pictipes como vector de T. cruzi en la amazonía del Ecuador (31). Estos dos aspectos mencionados estarían sucediendo en ciertas localidades de la amazonía peruana.
En nuestro estudio no se capturó P. herreri, que es un triatomino doméstico en las provincias de Rioja, Moyobamba, Lamas y Tarapoto (San Martín) (2-5,20), en las seis provincias de Amazonas y algunas provincias del norte y centro de Cajamarca (5,19,32,33), así como en la provincia La Mar (Ayacucho) (19,34).
La ausencia de P. herreri en las localidades de estudio se debe a que dichas viviendas muestreadas se ubican a una distancia de 40 a 50 km de zonas urbanas; así mismo, de una carretera principal. El P. herreri ha sido capturado en mayor porcentaje en el interior de viviendas ubicadas en zonas urbanas, como sucede en la provincia de Utcubamba, en ciertos distritos de Bagua (Amazonas) y en la provincia de Jaén y San Ignacio (Cajamarca), donde la carretera une las zonas urbanas y, en otras, las viviendas se ubican a lo largo de la carretera (19).
Los resultados obtenidos representan el inicio del estudio de triatominos amazónicos en el Perú, lo que servirá de base para estudios futuros dirigidos a la eco-biología de los triatominos silvestres, ya que han sido reportados en humanos casos agudos de enfermedad de Chagas, como en Oxapampa (Pasco) (35), Mariscal Ramón Castilla (Loreto) y últimamente en Coronel Portillo (Ucayali) y Puerto Inca (Huánuco), departamentos ubicados en la amazonía del Perú.
Finalmente, mencionamos que el conocimiento de la biología de los triatominos amazónicos es de gran utilidad para diseñar nuevas estrategias de control vectorial, ya que la estrategia tradicional de control vectorial contempla el rociamiento de las viviendas con insecticidas, cosa que no da resultados favorables cuando los vectores de T. cruzi son de hábitos silvestres.
AGRADECIMIENTOS
Agradecemos al Técnico Alejandro Arenas por apoyar en mantener los animales de experimentación. Al Blgo. Édgar Condori por las facilidades brindadas para ejecutar los ensayos preliminares de biología molecular. A la Dra. Betty Millán Salazar, Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, y al Blgo. Jorge Cabrera Meléndez, Centro Nacional de Salud Intercultural, Instituto Nacional de Salud, botánicos que determinaron el género de la palmera.
REFERENCIAS BIBLIOGRÁFICAS
1. TDR WHOs Special Program for Research and Training in Tropical Diseases. Report of the Scientific Working Group on Chagas Disease. 2005. [ Links ]
2. Lumbreras H, Arrarte J, Guevara B, Sipán F. Observaciones preliminares sobre la Enfermedad de Chagas en la Provincia de Moyobamba y Rioja del Departamento de San Martín. Rev Med Per. 1955;26:233-55. [ Links ]
3. Herrer A. Observaciones sobre la Enfermedad de Chagas en la Provincia de Moyobamba (Departamento de San Martín). Rev Med Exp. 1956;10:59-74. [ Links ]
4. Lumbreras H. El problema de la enfermedad de Chagas en los diferentes departamentos del Perú. Rev Viernes Médico. 1972;23:43-77. [ Links ]
5. Guillen Z, Cáceres I, Elliot A, Ramírez J. Distribución geográfica de los triatominos en el oriente del Perú. Rev Per Med Trop UNMSM. 1992;6:93-7. [ Links ]
6. Buck A, Sasaki T, Anderson R, Hitchcock J, Leigh G. comprehensive epidemiologic studies of four contrasting Peruvian villages. Geographic Epidemiology Unit. Baltimore, Maryland: The Johns Hopkins University; 1967.
7. Arévalo H. Valor diagnóstico del antígeno calreticulina de Trypanososma cruzi (TcCRT) y su aplicación en estudios de seroprevalencia. Tesis para optar el grado de Magíster en Ciencias Biológicas. Mención Parasitología. Universidad de Chile. 2002. [ Links ]
8. Pinto J, Cáceres GA, Vega S, Martínez R, Akira C. Fuentes de alimentación de Panstrongylus herreri (Hemiptera: Triatominae) capturados en Utcubamba, Amazonas - Perú. Rev Peru Med Exp Salud Publica. 2008;25:179-84. [ Links ]
9. Schofield CJ. A comparison of sampling techniques for domestic populations of Triatominae. Trans R Soc Trop Med Hyg. 1978;72:449-55. [ Links ]
10. Lent H, Wygodzinsky PW. Revision of the Triatominae (Hemiptera, Reduviidae), and their significance as vectors of Chagas' disease. Bull Am Mus Nat His. 1979;163:125-520. [ Links ]
11. Instituto Nacional de Salud. Manual de procedimientos de laboratorio para el diagnóstico de la tripanosomiosis americana (Enfermedad de Chagas). Serie de Normas Técnicas N° 26. Lima. 2005.
12. Vallejo G, Macedo AM, Chiari E, Pena SD. Kinetoplast DNA from Trypanosoma rangeli contains two distinc classes of minicircles whith different size and molecular organization. Mol Biochem Parasitol. 1994;67(2):245-53. [ Links ]
13. Organización Panamericana de la Salud. Guía para muestreo en actividades de vigilancia y control vectorial de la enfermedad de Chagas. OPS; 2003. 46 pp.
14. Siqueira A. Estudos sobre a reacao de precipitina aplicada a identificao do sangue ingerido por triatomineos. Rev Inst Med Trop Sao Paulo. 1960;2:41-53. [ Links ]
15. Cáceres AG, Vega Chirinos S, Pinto Caballero J, Anca Juárez J, Arévalo H, Náquira Velarde C. Informe Técnico: Vectores de la Trypanosomiosis Americana en Huallaga y Picota, San Martín - Perú. En: Instituto Nacional de Salud. Serie Informes Técnicos Nº 46 (Código OGITT: 2-01-05-03-108), Lima. 2005. Disponible en: http://www.bvs.ins.gob.pe/insprint/cindoc/informes_tecnicos/46.pdf
16. Teixeira ARL, Monteiro PS, Rebelo JM, Enrique R, Argañaraz ER, Vieira D, et al. Emerging Chagas disease: trophic network and cycle of transmission of Trypanosoma cruzi from palm trees in the Amazon. Emerg Infect Dis. 2001;7:100-12. [ Links ]
17. Fé NF, Franca MS, Carvalho-Costa FA. Reassessing the entomological investigation around the first autochthonous case of Chagas disease in Western Brazilian Amazon. Mem Inst Oswaldo Cruz. 2009;104:121-3. [ Links ]
18. Valente S, Valente V, Neto H. Considerations on the epidemiology and transmission of Chagas Disease in the Brasilian Amazon. Mem Inst Oswaldo Cruz. 1999;94(Suppl 1):395-8. [ Links ]
19. Cáceres AG, Troyes L, Gonzáles-Pérez A, Llontop E, Bonilla C, Murias E, et al. Enfermedad de Chagas en la región nororiental del Perú. I. Triatominos (Hemiptera, Reduviidae) presentes en Cajamarca y Amazonas. Rev Peru Med Exp Salud Publica. 2002;19:17-23. [ Links ]
20. Guillen Z, Cáceres I, Elliot A, Ramírez J. Distribución geográfica de los triatominos en el Oriente del Perú. Rev Per Med Trop UNMSM. 1992;93-7. [ Links ]
21. Wolff M, Castillo D. Evidencias de domesticación y aspectos biológicos de Panstrongylus geniculatus (Latreille, 1811) (Hemiptera: Reduviidae). Acta Ent Chilena. 2000;24:77-83. [ Links ]
22. Miles MA, Arias JR, De Souza AA. Chagas disease in the Amazon Basin. V. Periurban palms as habitats of Rhodnius robustus and Rhodnius pictipes - Triatomine vectors of Chagas disease. Mem Inst Oswaldo Cruz. 1983;78:391-8. [ Links ]
23. Serrano O, Mendoza F. Suarez B. Soto A. Seroepidemiología de la Enfermedad de Chagas en dos localidades del Minicipio Costa de Oro, Estado de Aragua, Venezuela. Biomédica. 2008;28:108- 15. [ Links ]
24. Solís H, Carvalho E, Ferreria C, Casanova C, Huamán A, Mendoza V. Contribución al estudio de la epidemiología de la Enfermedad de Chagas en tres localidades de la zona sur del Perú. An Fac med. 2003;64:223-7. [ Links ]
25. Valente VC, Valente SAS, Noireau F, Carrasco HJ, Miles MA. Chagas disease in the Amazon basin: association of Panstrongylus geniculatus. (Hemiptera-Reduviidae) with domestic pigs. J Med Entomol. 1998;35:99-103. [ Links ]
26. Salvatella R, Calegari L, Puime A, Basmadjian Y, Rosa R, Guerrero J, et al. Perfil alimentario de Triatoma rubrovaria (Blanchard, 1834) (Hemiptera, Triatominae) en ámbitos peridomiciliarios, de una localidad rural de Uruguay. Rev Inst Med trop Sao Paulo. 1994;36:311-20. [ Links ]
27. Brisse S, Verhoef J, Tibayrenc M. Characterisation of large and small subunit rRNA and miniexon genes further supports the distinction of six Trypanosoma cruzi lineages. Int J Parasitol. 2001;31:1218-26. [ Links ]
28. Montilla MM, Guhl F, Jaramillo C, Nicholls S, Barnabe C, Bosseno MF, et al. Isoenzme clustering of Trypanosomatidae colombian populations. Am J Trop Med and Hyg. 2002;66:394-400. [ Links ]
29. Triana O, Ortiz S, Dujardin JC, Solari A. Trypanosoma cruzi: Variability of stocks from Colombia determined by molecular karyotype and minicircle Southern blot analysis. Exp Par. 2006;113:62-6. [ Links ]
30. Macedo AM, Pena SDJ. Genetic variability of Trypanosoma cruzi: Implications for the pathogenesis of Chagas disease. Parasitol Today. 1998;14:119-23. [ Links ]
31. Aguilar VHM, Abad-Franch F, Racines VJ, Paucar CA. Epidemiology of Chagas disease in Ecuador. A brief review. Mem Inst Oswaldo Cruz. 1999;94(Suppl I):387-97. [ Links ]
32. Herrer A. Distribución geográfica de la Enfermedad de Chagas y sus vectores en el Perú. Bol Of Sanit Panam. 1960;49:572-81.
33. Guillen Z, Cáceres I, Elliot A, Ramírez J. Triatominos del norte peruano y su importancia como vectores de Trypanosoma spp. Rev Per Med Trop UNMSM. 1988;25-30. [ Links ]
34. Guillen Z, Cáceres I, Elliot A. Los triatominae (Hemiptera, Reduvidae) de la zona centro del Perú. Rev Per Med Trop UNMSM. 1992:89-91. [ Links ]
35. Vega S, Mendoza M, Cabrera R, Cáceres GA, Campos E, Ancca Y, y col. Primer caso de Enfermedad de Chagas aguda en la selva central del Perú: investigación de colaterales, vectores y reservorios. Rev Peru Med Exp Salud Publica. 2006;23:288-92. [ Links ]
Manuscrito recibido el 18 de diciembre de 2009 y aceptado para publicación el 3 de marzo de 2010.
Correspondencia:
Abraham G. Cáceres
Departamento Académico de Microbiología Médica
Facultad de Medicina Humana, UNMSM.
Av. Santos Chocano 199
Callao 2, Perú.
Correo-e: acaceres31@hotmail.com