Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.71 no.2 Lima Apr./June 2010
CASOS CLÍNICOS
Trasplante simultáneo de páncreas y riñón: reporte del primer caso realizado en el Perú
Simultaneous pancreas and kidney transplant: report of the first case performed in Peru
José De Vinatea1 ; Gustavo Reaño1 ; Edgar Gonzáles1 ; Freddy Valdivia2 ; Fernando Bautista3 ; Félix Carrasco4 ; Carlos Molina4 ; Wilmer Basilio4 ; Antonio Sánchez4 ; Martín Padilla4 ; Liliana Gonzáles5
1 Servicio de Cirugía de Páncreas, Bazo y Retroperitoneo. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
2 Servicio de Endocrinología. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
3 Servicio de Cirugía vascular. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
4 Departamento de Trasplantes. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
5 Servicio de Nefrología. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
Resumen
El trasplante simultáneo de páncreas y riñón es la opción terapéutica ideal para pacientes con diabetes mellitus tipo 1 con insuficiencia renal crónica. Permite recuperar la insulino-independencia y evita la necesidad de diálisis, mejorando notablemente la calidad de vida. Así mismo, la restitución de la euglicemia logra que las complicaciones tardías de la diabetes no progresen e incluso regresionen, prolongando la supervivencia global de estos pacientes. Estos beneficios superan a los riesgos de la cirugía y de la inmunosupresión inherentes al trasplante. A nivel mundial, desde 1966, en que se llevó a cabo el primer trasplante de páncreas en Minnesota (Estados Unidos), se han registrado más de 20 000 trasplantes de páncreas, con resultados cada vez mejores gracias al refinamiento en las técnicas quirúrgicas y a los nuevos esquemas de inmunosupresión. En el presente caso clínico, se reporta y describe la realización del primer trasplante simultáneo de páncreas y riñón en el Perú.
Palabras clave: Trasplante; páncreas; riñón; diabetes mellitus.
Abstract
Simultaneous pancreas and kidney transplantation is the ideal treatment option for patients with type 1 diabetes mellitus with chronic renal failure. Restoring insulin independence and avoiding the need for dialysis dramatically improves the quality of life. Also, the return of euglycemia accomplishes progression and even regression of late diabetes complications, extending overall survival in these patients. These benefits outweigh surgery and immune suppression risks inherent to transplantation. Globally, since 1966 when the first pancreas transplant in Minnesota (United States) was conducted there have been more than 20 000 pancreas transplants with increasing success thanks to the refinement in surgical techniques and new immune suppression schemes. In the present clinical case we report and describe the completion of the first simultaneous pancreas and kidney transplant in Peru.
Key words: Transplantation; pancreas; kidney; diabetes mellitus.
INTRODUCCIÓN
Comúnmente se acepta que la primera referencia por escrito de la diabetes corresponde al papiro encontrado por el egiptólogo alemán George Ebers, en 1873, cerca de las ruinas de Luxor, fechado hacia el 1 500 antes de la era Cristiana. Hoy en día se conserva este papiro en la biblioteca de la Universidad de Leipzig (Alemania). Un párrafo está dedicado a la extraña enfermedad, a la que siglos después los griegos llamarían diabetes. Otro hito importante en la diabetes fue el descubrimiento y su utilización en humanos de la insulina por Banting y Best, en el año 1921, y el año 1942 se describe el efecto hipoglicemiante de las sulfonilureas por el francés Marcel Jambon (1).
La diabetes mellitus es un trastorno metabólico de múltiples etiologías, caracterizado por hiperglicemia crónica con alteraciones en el metabolismo de los carbohidratos, grasas y proteínas, que resulta de defectos en la secreción y/o acción de la insulina. La hiperglicemia crónica de la diabetes mellitus está asociada con daño a largo plazo, disfunción y falla de varios órganos, especialmente los ojos, riñones, nervios, corazón y vasos sanguíneos.
La diabetes mellitus ha sido dividida en dos grandes grupos: diabetes mellitus de causa autoinmune, en la cual no hay producción de insulina, y la diabetes mellitus tipo 2 (DM2) (la más frecuente), enfermedad poligénica desencadenada por la obesidad y el sedentarismo, en la cual hay exceso de producción de insulina, pero deficiente acción de esta. En la diabetes mellitus 1 (DM1) existe mayor compromiso microvascular (ocasionada por la hiperglicemia); se produce retinopatía diabética, la cual lleva a amaurosis, y nefropatía diabética, que conlleva a la insuficiencia renal. La diabetes mellitus es actualmente la principal causa de insuficiencia renal, por lo cual estos pacientes son candidatos a trasplante renal. En la diabetes mellitus 1, al haber deficiencia de insulina, es posible solucionar el problema de la deficiencia de insulina y de la insuficiencia renal crónica (IRC) realizando el trasplante simultáneo de páncreas-riñón (2).
A fines del siglo 19, Von Mering y Minkowski demostraron que la glucosuria en perros pancreatectomizados podía revertirse utilizando implantes subcutáneos de fragmentos pancreáticos. Al mismo tiempo, Watson y Williams trasplantaron el páncreas de una oveja subcutáneamente en un niño diabético de 15 años (2). Pero, no fue hasta 1966 en que se realiza con éxito el primer trasplante alogénico de páncreas (en un procedimiento combinado con un trasplante renal), por Kelly y Lillehei, en la Universidad de Minnesota (3,4). Actualmente, se ha convertido en la mejor opción terapéutica para la mayoría de pacientes con DM1e IRC, siendo un procedimiento de rutina en numerosos centros de trasplantes en el mundo (5,6).
El presente caso es el primer trasplante simultáneo de páncreas y riñón realizado en el Perú.
CASO CLÍNICO
Se consideró los siguientes criterios para incluir a pacientes en la lista de espera de trasplante simultáneo páncreas-riñón: (1) edad entre 18 y 55 años; (2) diagnóstico de diabetes mellitus tipo 1; (3) nefropatía diabética (depuración de creatinina <40 mL/min); (4) paciente en diálisis o muy cercano a iniciar diálisis; (5) condición física que permitiera tolerar cirugía e inmunosupresión; (6) condición psicológica y social adecuada; (7) capacidad de comprender y cumplir con el tratamiento inmunosupresor a largo plazo y la necesidad de seguimiento (1,7,8).
Se definió los siguientes criterios de exclusión: (1) reserva cardiovascular insuficiente (coronariografía con enfermedad no corregible, fracción de eyección menor de 50% e infarto de miocardio reciente); (2) enfermedad vascular periférica aortoilíaca severa, sin posibilidad de corrección quirúrgica; (3) malignidad; (4) alcoholismo o drogadicción; (5) historia de incumplimiento con tratamiento; (6) enfermedad psiquiátrica mayor; (7) infección activa; (8) edad mayor de 55 años; (9) ausencia de complicación diabética secundaria; (10) índice de masa corporal >30 kg/m2; (11) inestabilidad psicológica (1,7,8).
Se definió los siguientes criterios de selección para el donante: (1) edad de 15 a 45 años; (2) sin signos clínicos de infección; (3) pruebas virales negativas; (4) sin hipotensión ni parada cardíaca, o necesidad de bajas dosis de inotrópicos; (5) sin historia de enfermedad pancreática, traumatismo abdominal o alcoholismo; (6) IMC <30 kg/m2; (7) amilasa sérica <300 e hiperglicemia <300; (8) función renal correcta; (9) estancia en unidad de cuidados intensivos <de 7 días; (10) causa de muerte vascular coronaria.
Adicionalmente, se estableció criterios de exclusión del injerto: (1) fibrosis; (2) marcada infiltración grasa; (3) evidencia de traumatismo pancreático; (4) presencia de tumores; (5) tiempo de isquemia fría >12 horas (1,7-11).
La evaluación preoperatoria fue realizada por el equipo multidisciplinario, compuesto por el endocrinólogo, nefrólogo, cirujano, urólogo, oftalmólogo, cardiólogo, enfermera coordinadora, asistenta social, psicólogo, nutricionista y odontólogo. Los exámenes de laboratorio incluyeron: hematológicos y bioquímicos generales, ácido úrico, calcio-fósforo, proteinuria en 24 horas, depuración de creatinina, perfil hepático, amilasa, lipasa y función tiroidea; hemoglobina glicosilada, péptido C e insulina, como pruebas relacionadas a la diabetes; pruebas serológicas para hepatitis B y C, HIV, citomegalovirus (CMV), sífilis, toxoplasma, virus de Epstein Barr, rubeola y PPPD; y urocultivo como prueba microbiológica. Se realizó como estudios imagenológicos, radiografía de tórax, ecografía abdominopélvica, tomografía tóraco-abdómino-pélvica, eco-Doppler y angiotomografía de vasos aortoilíacos. Como estudios cardiológicos, se llevó a cabo electrocardiograma, ecocardiografía y prueba de esfuerzo. Desde el punto de vista inmunológico, se evaluó el grupo sanguíneo ABO, el HLA serológico y tipificación DR, anticuerpos HLA circulantes, PRA (panel de reactividad a antígenos) y el crossmatch. Así mismo, se realizó descarte de cáncer de cuello uterino, con evaluación por ginecólogo y realización de Papanicolau.
La cirugía constó de tres momentos definidos: la remoción o procura multiorgánica, el trabajo de banco y el implante en el receptor. La procura multiorgánica consistió en una amplia incisión mediana desde la horquilla esternal al pubis del donante. Se realizó una amplia maniobra de Catell hasta la raíz del mesenterio, exponiendo y liberando la arteria aorta, ligando la arteria mesentérica inferior. Se disecó la vena mesentérica inferior (VMI) para la posterior canulación de esta junto con la aorta. Se disecó también la arteria mesentérica superior (AMS) en su raíz y la arteria aorta descendente intratorácica (AAT), para posterior clampaje. Se realizó la búsqueda de arterias hepáticas anómalas en omento menor y cara derecha o posterior del ligamento hepatoduodenal, para evitar lesionarlas. Se disecó la arteria hepática común y sus ramas, así como la raíz de la arteria esplénica. Se seccionó la vía biliar luego de lavar la bilis contenida en ella con suero salino, a través de una incisión en la vesícula. Se canuló la aorta y la VMI con catéteres de 24 y 14 French, respectivamente, momento en el cual se inició anticoagulación sistémica con 300 U/kg de heparina no fraccionada. Se procedió a la perfusión de solución preservante HTK a 100 cm H2O de presión, completando un volumen total de 5 L (3 L por aorta y 2 L por VMI). Se clampó la AMS y la esplénica luego de 2 L de perfusión, para evitar edema pancreático. Simultáneamente, se clampó AAT, se colocó suero salino congelado picado en cavidad abdominal y se seccionó la vena cava inferior intratorácica, para que la solución de perfusión se evacuara por esta vía. Se procedió enseguida a la remoción hepática, ligando la arteria gastroduodenal, esplénica y resecando el tronco celíaco con parche de aorta. Se seccionó la vena porta dejando un mínimo de 1,5 cm de esta con el páncreas. Se realizó maniobra de Kocher amplia y se seccionó la vena cava inferior por encima de la desembocadura de las venas renales, con lo que se extrajo el hígado. Se dividió el ligamento gastrocólico y se inspeccionó y palpó el páncreas, encontrándolo apto para trasplante. Se liberó el bazo y el cuerpo y cola de páncreas. Se seccionó el duodeno con sutura mecánica 60 azul, a 1 cm del píloro, previo lavado duodenal con solución de iodopovidona y solución con amikacina 500 mg, metronidazol 500mg y anfotericín B 50 mg, ambas en 500 mL de suero salino. Se seccionó duodeno a nivel del ángulo de Treitz, con sutura mecánica igualmente. La AMS y la vena mesentérica superior fueron seccionadas con otra autosutura 60 azul. Se disecó la raíz de AMS y se seccionó con parche de aorta, evitando lesionar las arterias renales. Se extrajo el páncreas con duodeno y bazo en bloque. Luego, se finalizó esta fase con la extracción de ambos riñones en bloque y los vasos ilíacos. Se tomó muestras de ganglios mesentéricos, para el crossmatch.
Durante el trabajo de banco, se realizó la inspección y palpación cuidadosa del páncreas (figura 1), para detectar fibrosis, tumores, nodulaciones o excesiva infiltración grasa, en cuyo caso debe abortarse el procedimiento. Luego, se procedió a la esplenectomía, ligando vasos esplénicos. Se disecó cuerpo y cola de páncreas, ligando y resecando ganglios y tejido graso peripancreático. Posteriormente, se disecó los vasos, empezando con la vena porta hasta la desembocadura de la vena esplénica, prosiguiendo con la AMS, extirpando el máximo de grupos ganglionares posibles en esta área y lo mismo se realizó con la arteria esplénica. Se resecó duodeno, tercera y cuarta porciones, dejando segmento de 8 a 10 cm de la segunda porción, reforzando los bordes de sección con sutura continua de PP 3/0. Lo mismo se complementó en muñón de vasos mesentéricos. Luego, se preparó los vasos ilíacos del donante y se confeccionó injerto vascular en Y, anastomosando la arteria ilíaca interna del donante con la arteria esplénica y la arteria ilíaca externa con la AMS, utilizando PP 6/0, quedando preparado el injerto pancreático. En simultáneo, se preparó el injerto renal por el equipo de trasplante renal, siguiendo la técnica habitual.
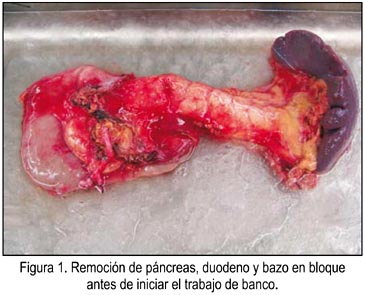
El implante en el receptor se realizó mediante una incisión mediana supra e infraumbilical. Se expuso los vasos ilíacos derechos y la bifurcación de la aorta, con amplia movilización del colon derecho. Se disecó dichos vasos, liberando la vena ilíaca externa, seccionando la vena ilíaca interna y venas pélvicas, con el fin de lateralizar y superficializar dicho vaso y permitir una cómoda anastomosis venosa. Se clampó los vasos ilíacos y se realizó venotomía y arteriotomía. Se realizó primero la anastomosis de la vena porta a la vena ilíaca externa, con PP 6/0, y la anastomosis de la arteria ilíaca común del injerto en Y a la arteria ilíaca común del receptor. Se desclampó los vasos, se verificó la perfusión del injerto y se revisó la hemostasia. Posteriormente, se finalizó realizando anastomosis duodeno-yeyunal latero-lateral en asa desfuncionalizada, en Y de Roux, a 90 cm del ángulo de Treitz, en un plano continuo de PP 3/0. Se dejó drenes siliconados de 19 Fr, peripancreáticos. El implante renal se realizó en vasos ilíacos izquierdos siguiendo técnica habitual, en ubicación extraperitoneal, siguiendo técnica estándar.
La paciente receptora fue una mujer de 34 años, con diagnóstico de diabetes mellitus tipo 1 (péptido C <0,1 ng/mL), con requerimientos de insulina NPH de 35 U por día y hemoglobina glicosilada de 10,1%. Se encontraba en diálisis peritoneal ambulatoria automatizada durante 3 años, por insuficiencia renal crónica terminal. Así mismo, cursaba con amaurosis del ojo izquierdo por retinopatía proliferativa y desprendimiento de retina, y pie de Charcot derecho. No refirió episodios de hipoglicemia no consciente, desde el inicio de su enfermedad. Completó estudios de enfermería y demostró en la evaluación psicológica y social estar apta para tolerar y cumplir el tratamiento propuesto. La evaluación preoperatoria incluyó todo lo mencionado previamente, cumpliendo con todos los criterios establecidos.
Se realizó la procura multiorgánica (hígado, páncreas, riñones, córneas y piel) de donante de 30 años con diagnóstico de muerte cerebral por accidente cerebro-vascular hemorrágico por malformación arteriovenosa rota. Su índice de masa corporal fue 27,5. No presentaba antecedentes patológicos ni mostraba evidencias de sepsis. Al momento de iniciar la procura, se utilizaba dopamina a dosis bajas (5 microg/kg/min). Cursó con 2 paradas cardíacas que lograron revertirse con desfibrilación, obligando a pasar a la fase de isquemia fría en forma rápida. Se obtuvo el consentimiento para la donación firmado por los familiares. Esta fase duró 4 horas.
El trabajo de banco duró 5 horas, completando los pasos descritos anteriormente en forma satisfactoria.
Así mismo, se procedió al implante según técnica descrita, fase que duró 5 horas, sin mayores dificultades, verificándose adecuada perfusión del injerto y realizando la hemostasia prolija, sobretodo del área de los vasos mesentéricos. Luego de la anastomosis entérica, se verificó buenos flujos vasculares, tanto con palpación como con eco-Doppler intraoperatorio.
El equipo de trasplante renal realizó el implante renal en fosa ilíaca izquierda sin complicaciones, en un lapso de 4 horas, luego de lo cual se volvió a revisar la vitalidad del injerto pancreático, antes del cierre definitivo de la pared abdominal.
La evolución y manejo postoperatorio se resume en la figura 2. La paciente en el postoperatorio fue transferida a UCI, donde permaneció diez días. Fue evaluada con controles de laboratorio diarios, durante la primera semana, que incluyeron pruebas hematológicas, bioquímicas y microbiológicas. Cabe resaltar el control periódico de amilasa y lipasa sérica cada 6 horas, y en drenajes peritoneales cada 2 días; así como glicemias capilares cada 2 horas los dos primeros días y luego cada 4 a 6 horas, hasta completar la primera semana. Se dosificó también procalcitonina, para evaluar signos de respuesta inflamatoria y se utilizó el tromboelastograma para control de la función de coagulación. El eco-Doppler del injerto se realizó 2 veces al día durante la primera semana.
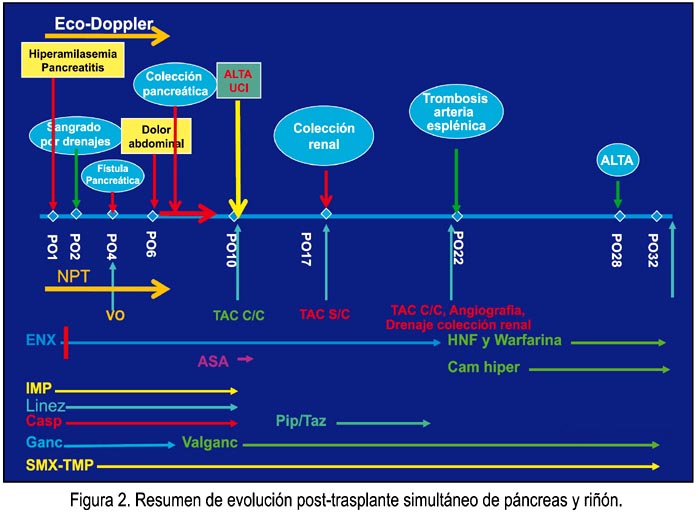
Los estudios de imágenes constaron de tomografías abdómino-pélvicas y angio-tomografía con contraste, así como angiografía (figura 2). La anticoagulación se realizó con enoxaparina 60 mg/12 h, el primer día, disminuyendo a 60 mg/24 h debido a sangrado por drenajes con la dosis inicial, que revirtió suspendiendo la anticoagulación por 24 h hasta que la hemoglobina se normalizó, luego de trasfusión de 2 paquetes globulares. En la antibiótico-profilaxis se utilizó imipenem y linezolid y como antimicótico caspofungin, los dos esquemas por 10 días. Para la profilaxis antiviral se usó ganciclovir endovenoso, pasando luego a valganciclovir oral; sulfametoxazol-trimetoprim como profilaxis contra pneumocystis carinii. Como esquema de inmunosupresión, se utilizó basiliximab durante el transoperatorio y, al cuarto día postoperatorio, como inducción; y tacrolimus, micofenolato mofetil y metilprednisolona endovenosa, pasando luego a prednisona vía oral, como esquema de mantenimiento. Inició dieta oral al cuarto día postoperatorio, suplementándose nutrición parenteral total durante 7 días.
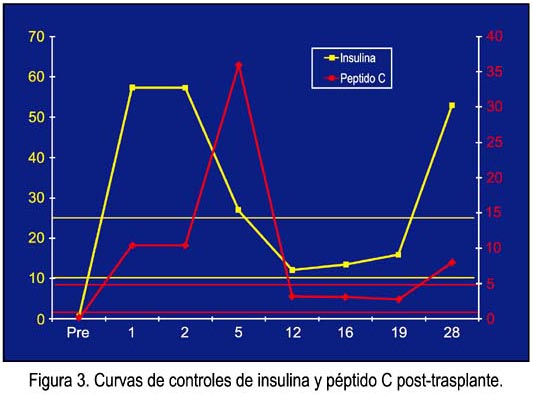
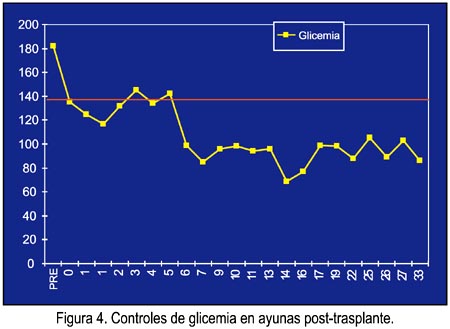
La insulina y el péptido C mostraron una elevación rápida a valores supranormales, para luego pasar a rangos normales (figura 3). Las glicemias en ayunas se normalizaron rápidamente y no fue necesario utilizar insulina en momento alguno de la evolución (figura 4). La creatinina y la urea se normalizaron al cuarto día postoperatorio, con diuresis normal desde el postoperatorio inmediato.
La paciente desarrolló una marcada hiperamilasemia, en rangos compatibles con pancreatitis leve del injerto, con poca sintomatología y sin disfunción orgánica ni alteración de la función digestiva. Se demostró fuga de líquido rico en amilasas mayor de 3 veces el valor sérico durante toda la evolución por uno de los drenes, pero que no causó mayor impacto clínico ni requirió ningún procedimiento invasivo para su manejo, a excepción del uso de octreótide, produciéndose el cierre espontáneo de la fístula pancreática a los 30 días del postoperatorio.
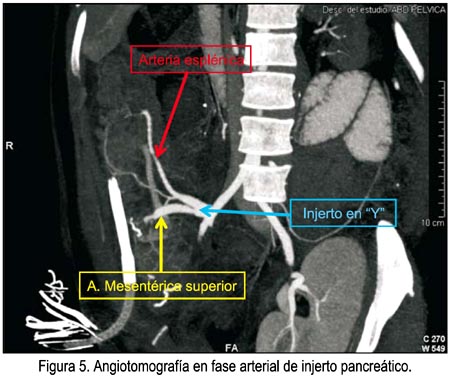
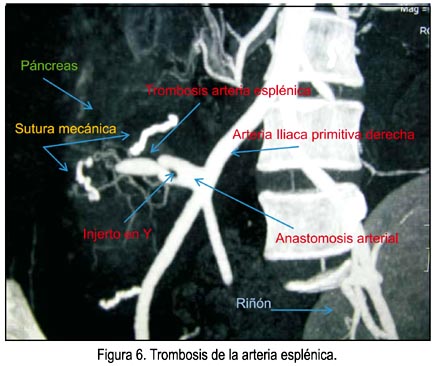
Presentó cuadro de dolor abdominal intenso en el hipocondrio derecho, del sexto al noveno día postoperatorio, que requirió narcóticos, para luego desaparecer espontáneamente. La angiotomografía del décimo día se muestra en la figura 5, verificándose fases arterial, venosa y parenquimal adecuadas del injerto pancreático, no observándose trombosis de las anastomosis vasculares. La evolución favorable permitió el alta de UCI y prosiguió sin mayores incidentes hasta el vigésimo primer día después del trasplante, en que se detecta en control antes del alta la sospecha de trombosis de la arteria esplénica (figura 6), la cual fue confirmada con angiografía convencional. Se inició heparina no fraccionada en infusión, pasando luego a warfarina. La paciente no mostraba en esos momentos síntoma alguno y sus controles de laboratorio se los encontró normales. Se le sometió a 10 sesiones de cámara hiperbárica, sin mayores complicaciones, siendo dada de alta a los 28 días post-trasplante.
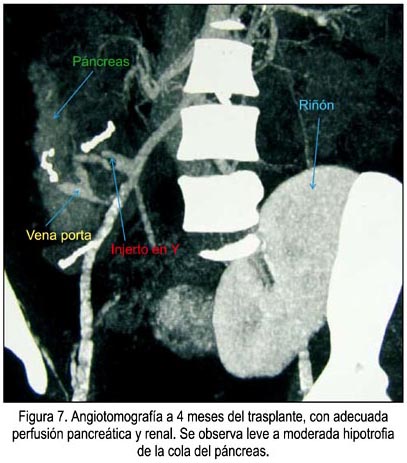
La paciente, luego de 9 meses del trasplante, continúa insulino independiente, con perfecto control de la glicemia, con valores de péptido C e insulina en rangos normales. Así mismo, sus controles de hemoglobina glicosilada se han normalizado, siendo actualmente de 4,6%. No ha presentado complicaciones de la inmunosupresión, hasta el momento. Los injertos pancreático y renal se encuentran bioquímica e imagenológicamente funcionantes, aunque se logra apreciar leve a moderada hipotrofia de la cola del páncreas (figura 7).
DISCUSIÓN
La diabetes mellitus sigue siendo una enfermedad que ocasiona gran morbilidad y mortalidad en la población mundial, así como un elevado gasto en costos hospitalarios. Las complicaciones tardías, tales como, la nefropatía, coronariopatía, neuropatía y retinopatía, son responsables de la disminución de la expectativa y la calidad de vida de estos pacientes. En 1993, el DCCT (Diabetes Control and Complications Trial) demostró claramente que el estricto control de la glicemia con terapia intensiva con insulina retardaba la aparición y la progresión de estas complicaciones (12). Sin embargo, este uso intensivo de insulina, utilizando bombas de infusión continua inclusive, conlleva riesgos inherentes a la administración exógena de esta hormona (episodios de hipoglicemia), siendo pues una solución imperfecta para esta enfermedad, por la dificultad en igualar la secreción endógena y los finos controles de retroalimentación que esta tiene. Actualmente, la única opción confiable para alcanzar la insulino-independencia es el trasplante de páncreas. Según el IPTR (International Pancreas Transplant Registry), se han registrado 23 043 trasplantes de páncreas a nivel mundial, hasta el 2004, habiéndose realizado 17 000 en Estados Unidos (13).
En 1966, Kelly y Lillehei, de la Universidad de Minnesota, en Estados Unidos, proponen por primera vez la posibilidad de reemplazar la función endocrina del páncreas nativo en pacientes con diabetes mellitus tipo 1 insulinodependiente, mediante el trasplante parcial y completo de este órgano, proveniente de donante cadavérico. A partir de esta experiencia inicial exitosa, el desarrollo y avance progresivo en el conocimiento de las técnicas de preservación de órganos, técnica quirúrgica e inmunosupresión, han permitido que el trasplante de páncreas sea actualmente considerado, por la Asociación Americana de Diabetes, como una alternativa de tratamiento ideal para el paciente con diabetes mellitus tipo 1 que ha desarrollado insuficiencia renal y es candidato también de trasplante renal (14,15).
Existen tres formas de realizar el trasplante de páncreas. El trasplante simultáneo de páncreas y riñón (SPK) es la forma de trasplante más utilizado a nivel mundial (78%), permitiendo que el paciente abandone la diálisis y deje de utilizar insulina desde el postoperatorio inmediato, mejorando con esto su supervivencia y su calidad de vida (16-19). La adecuada función del injerto pancreático, además, protegerá al riñón trasplantado del daño que la diabetes produciría en el nuevo órgano y a su vez la vigilancia de la función del injerto renal permite la detección precoz de rechazo, mediante la elevación de la creatinina, tanto del riñón como del páncreas (19). Los beneficios de este doble trasplante han sido demostrados en múltiples estudios realizados en centros con gran experiencia; sin embargo, debe considerarse que existen riesgos derivados de la inmunosupresión y del acto operatorio en sí y sus potenciales complicaciones (20,21). El trasplante de páncreas después de riñón (PAK) (16% según el IPTR) es otra alternativa aplicable principalmente en pacientes que tuvieron trasplante renal de donante vivo o cadavérico, que les permite acortar su tiempo en lista de espera para un SPK y gozar precozmente de los beneficios del trasplante renal, hasta tener un páncreas disponible (22). Existe también el trasplante de páncreas aislado (PTA), diseñado para pacientes con la llamada diabetes lábil, es decir, diabéticos insulino-dependientes que cursan con mala respuesta a la insulina, desarrollando episodios de hipoglicemia e hiperglicemia, así como de eventos de hipoglicemia no conciente, y que no tienen aún insuficiencia renal. Este tipo de trasplante se realiza con mucho menos frecuencia (7%), principalmente en Estados Unidos, teniendo como principal desventaja una disminución en la supervivencia durante el primer año del injerto pancreático y del paciente, comparado con el SPK y el PAK, en relación a la dificultad de detectar precozmente el rechazo inmunológico al no contar con el riñón (23).
En el Perú, existe como antecedente, un estudio experimental realizado en el Hospital Dos de Mayo, en donde se demostró el funcionamiento adecuado de páncreas trasplantados en perros, en los que se les produjo diabetes mediante el uso de aloxano. Sin embargo, no se ha realizado este tipo de trasplante en humanos en nuestro país (24).
El presente caso es el primer trasplante simultáneo de páncreas y riñón llevado a cabo en el Perú. Requirió de un entrenamiento previo del equipo multidisciplinario, que incluyó capacitación con expertos internacionales, con entrenamiento en las técnicas quirúrgicas en cadáveres y en modelos animales.
Durante la fase de planificación para llevar a cabo el trasplante, se tuvo diversas consideraciones para establecer los criterios de selección del donante y del receptor y basándonos en pautas establecidas en centros de gran experiencia en trasplante de páncreas (1,7-11,20,21). Existe consenso en que el donante ideal debe ser joven (10 a 40 años) y no debe ser obeso (30 a 80 kg) (25). Además, el no cursar con infecciones activas y no haber requerido el uso de inotrópicos, o bajas dosis de estos, para el soporte hemodinámico del donante, también aseguran un buen resultado del trasplante (9,10). Varios de los potenciales donantes tuvieron que ser descartados por no reunir uno o varios de estos criterios. En cuanto al receptor, es importante hacer un estudio prolijo de los órganos blanco de la diabetes, principalmente, el cardiovascular, siendo necesario como mínimo estudios de función cardíaca con gammagrafía con talio e incluso coronariografía de ser necesario, ya que la macroangiopatía coronaria es la causa de morbimortalidad más importante en estos pacientes (1,8). La angiotomografía de vasos ilíacos permite descartar compromiso aterosclerótico severo a este nivel que impida el adecuado implante del injerto pancreático y prevenir el síndrome de robo arterial en la extremidad inferior derecha del paciente.
La preservación del páncreas es un aspecto también de gran importancia, que empieza desde el manejo adecuado del donante en área de cuidados intensivos, la perfusión oportuna de soluciones preservantes (Wisconsin, histidine-tryptophan-ketoglutarate-HTK, Eurocollins, etc.), y un tiempo corto de isquemia fría (desde el clampaje aórtico en el donante hasta el desclampaje de vasos ilíacos en el receptor), siendo hasta 20 horas el máximo tolerado para páncreas, luego de lo cual se incrementa notablemente el porcentaje de complicaciones post-trasplante (26). El congelamiento de los órganos a remover, con el uso de suero salino picado una vez producido el clampaje aórtico, y el uso de estas soluciones preservantes son imprescindibles para el éxito del trasplante. La solución preferida en la mayoría de centros es la de la Universidad de Wisconsin. En nuestro caso tuvimos que utilizar HTK (debido a que no se dispone de solución de Wisconsin actualmente en el Perú), una solución que también ha mostrado buenos resultados, aunque existen reportes de una mayor tasa de pancreatitis del injerto, al parecer, por la necesidad de mayor volumen de perfusión (5 litros) con esta solución (27).
Los tres momentos quirúrgicos en el trasplante, la remoción del órgano, el trabajo de banco o de mesa y el implante, tienen cada uno su grado de dificultad y todos deben ser realizados sin fallas, para que el resultado final sea óptimo (11).
En cuanto a la remoción multiorgánica, esta se encuentra estandarizada en el hospital, siguiéndose una secuencia sistemática establecida durante los 10 años de experiencia en el servicio de trasplante hepático del hospital, en la que se incorporó la remoción pancreática como parte de la secuencia en la procura de los órganos. Para la extracción del páncreas, se tomó importantes consideraciones, como son: a) evaluar cuidadosamente el páncreas, puesto que un órgano fibrótico o con excesiva infiltración grasa no es adecuado para trasplante; b) así mismo, se debe ser escrupuloso en preservar las estructuras vasculares (arterias esplénica y mesentérica y vena porta), puesto que una lesión de estas puede conllevar a la pérdida del injerto. En un inicio, el equipo se planteó la necesidad de contar con todo el suministro vascular para el injerto pancreático (tronco celíaco y arteria mesentérica), incluyendo un parche de aorta (parche de Carrell), desechando el hígado, con el fin de minimizar la posibilidad de trombosis, una de las complicaciones más frecuentes, al tener que confeccionar una Y de arteria ilíaca para reconectar la arteria esplénica y mesentérica superior, en caso de no contar con el parche descrito. Así también, se creyó conveniente contar con toda la extensión de la vena porta para permitir mayor comodidad en la realización de la anastomosis venosa y no requerir la realización de un injerto venoso para extender la longitud de esta vena, lo cual incrementa notablemente el riesgo de trombosis (27). Posteriormente, se descartó esta alternativa, ya que el hígado es un órgano imprescindible para la vida y la lista de espera para trasplante hepático es larga en nuestro centro, siendo por eso, prioridad antes que el páncreas. Así mismo, se concluyó que con 2 cm de vena porta sería suficiente para el éxito del trasplante, en base a la experiencia mundial (28-30). Esta anastomosis arterial en Y se practicó en un modelo en perros, utilizando injertos pancreáticos que fueron descartados por no reunir los criterios de inclusión descritos previamente. Esta técnica de reconstrucción arterial es la que se realiza en los centros más importantes del mundo, como son los Hospitales de las Universidades de Minnesota y Wisconsin (20,21). Es también la que se realiza en el Hospital italiano de Buenos Aires, tal como nos lo demostró el Prof. Sung Hyo Hyon, cirujano con destacada experiencia en Sudamérica (31). Además, hemos podido conocer los buenos resultados de la anastomosis arterial esplenomesentérica (entre el extremo distal de la arteria mesentérica superior y el cabo proximal de la arteria esplénica), propuesta por el Prof. Laureano Fernández-Cruz, del Hospital Clínico de Barcelona, mucho más simple, rápida y con mayor chance de compatibilidad de los diámetros arteriales en la anastomosis, disminuye el tiempo del trabajo de banco al realizar solo una anastomosis, sin usar un injerto arterial de la bifurcación de las ilíacas del donante, obteniendo resultados similares al comparar ambas técnicas (32,33).
Para el implante, se tuvo que establecer qué método quirúrgico se utilizaría para el drenaje exocrino (intestino o vejiga) y el drenaje venoso (sistémico o portal) del páncreas (28-30). El drenaje vesical ha sido hasta la década de los 90 el método más utilizado, debido a la menor morbilidad asociada frente a un fracaso de la anastomosis duodenovesical, ya que cuando esta ocurre existe la alternativa de realizar un manejo conservador, utilizando una sonda urinaria sin la necesidad de remover el injerto por peritonitis, como sí ocurre cuando hay dehiscencia de la anastomosis duodenoentérica (34). También ofrece la ventaja de monitorizar los niveles de amilasas urinarias para el diagnóstico precoz de rechazo agudo (35). Sin embargo, el drenaje vesical se asocia a una frecuencia alta de complicaciones urinarias -como trastornos metabólicos, deshidratación, uretritis, infección urinaria, hematuria- y del injerto, como, pancreatitis por reflujo, obligando a convertir el drenaje hacia intestino en cerca de 30% de los casos (36,37). El drenaje entérico ofrece una vía más fisiológica al jugo pancreatoduodenal y evita las complicaciones urinarias descritas, por lo que la tendencia actual es a utilizar esta ruta considerando que el monitoreo de rechazo agudo pancreático se realiza a través de la función del injerto renal en el SPK (38), mientras que en el PAK y el PTA se depende principalmente de la clínica, los hallazgos ecográficos y la confirmación mediante biopsia pancreática percutánea. Es por esto que, en el PAK y el PTA, la frecuencia de uso del drenaje vesical es mayor (13). En este caso de trasplante simultáneo renopancreático decidimos realizar el drenaje entérico a 70 cm del ángulo de Treitz con asa desfuncionalizada en Y de Roux, con el objetivo de reducir el impacto de una potencial dehiscencia de anastomosis (39). En cuanto al drenaje venoso, decidimos optar por la vía sistémica, a través de la vena ilíaca externa derecha, puesto que la vía portal es técnicamente más difícil y obliga a colocar el páncreas con la cabeza en sentido cefálico, requiriendo algunas veces largos injertos arteriales. Sin embargo, consideramos que la vía portal plantea la ventaja de ser más fisiológica, evitando el hiperinsulinismo post-trasplante del drenaje sistémico, por la ausencia del efecto de primer paso hepático (40,41). Esta elevación de insulina se asocia, a largo plazo, a un mayor riesgo de aterogénesis (42).
Las complicaciones más frecuentes que conllevan al fracaso del injerto son de causa inmunológica, como el rechazo agudo (7 a 25%) y crónico (2 a 33%), y de causa técnica (trombosis, pancreatitis, sangrado, dehiscencia de anastomosis duodenal, pseudoaneurismas, fístula pancreática), actualmente en menos del 8% (27,43-47). Las complicaciones más frecuentes son la trombosis y el rechazo agudo, siendo las dos causas principales de pérdida del injerto (48). Por tal razón, el seguimiento estrecho en el postoperatorio, con ecografía Doppler y el monitoreo de la función pancreática y renal, permitirán la detección precoz de estas complicaciones, para poder realizar las intervenciones necesarias y evitar la pérdida del órgano (49,50). En este primer caso, se produjeron, como hemos documentado, complicaciones que fueron de impacto leve (pancreatitis leve, fístula controlada y autolimitada, y trombosis de la arteria esplénica, compensada por el suministro de colaterales de la arteria mesentérica superior), no requiriendo de reoperaciones ni readmisiones hospitalarias. El páncreas es uno de los órganos más propensos a la trombosis después del trasplante, debido al bajo flujo sanguíneo a nivel parenquimal, el cual disminuye aún más al extirpar el bazo, y al invariable edema del órgano por injuria por isquemia-reperfusión y manipulación durante las fases de extracción y trabajo de banco (46,47,51). La trombosis es principalmente venosa, se produce precozmente en los primeros días post-trasplante, y habitualmente obliga a la extirpación del injerto. La frecuencia de esta complicación va de 5 a 12% y su detección precoz puede permitir la preservación del injerto mediante la realización de procedimientos de revascularización percutánea o quirúrgica (trombectomía y/o trombolisis). Para prevenir este evento, se propone el uso de anticoagulación con heparina no fraccionada a dosis de 300 a 500 U por hora desde el intraoperatorio, asociado a antiagregación plaquetaria con aspirina 100 mg por día (44). Sin embargo, Sollinger y cols., de la Universidad de Wisconsin (20), no utilizaron anticoagulación en su serie de 1 000 pacientes, comunicando una de las frecuencias más bajas de trombosis (3,5%) y argumentando que esta morbilidad se previene utilizando una prolija técnica quirúrgica para las anastomosis vasculares. En nuestro caso, la trombosis fue muy tardía (después del décimo día postoperatorio), silente clínicamente y a nivel arterial (arteria esplénica). Se diagnosticó en el contexto de una paciente asintomática, con buena función pancreática, euglicémica, insulino-independiente, en quien se le realizó angiotomografía previa al alta, para corroborar el estatus de las anastomosis vasculares. Ya se había verificado la permeabilidad de las conexiones vasculares hasta el décimo día postoperatorio, con control diario con eco Doppler y angio-tomografía. Se confirmó por angiografía convencional y se verificó que la irrigación del cuerpo y cola del páncreas era suministrada por colaterales originadas en la arteria mesentérica superior. Sin embargo, el método diagnóstico suficiente para detectar trombosis es la ecografía Doppler, donde se evalúa parámetros de tamaño y ecogenicidad pancreáticos, presencia de colecciones, el índice de resistencia y los flujos arteriales y venosos, aunque como se sabe es operador-dependiente y la sensibilidad del método dependerá de la experiencia en esta área (49,50). Es probable que esa sea la razón del uso excesivo de la angio-tomografía en este caso inicial. Como anticoagulación se utilizó inicialmente enoxaparina a dosis plena, con lo que se presentó sangrado por drenajes que, al disminuir la dosis a niveles profilácticos (60 mg cada 24 horas), se logró revertir sin necesidad de relaparotomía. No se llegó a utilizar antiagregación plaquetaria, por temor a un resangrado. La falta de consenso a nivel mundial a este respecto no nos permitió llegar a un esquema claro de tromboprofilaxis en este primer caso.
Los avances en las técnicas quirúrgicas, la adecuada selección del receptor y donante, y en las técnicas de preservación pancreática han permitido los buenos resultados que son obtenidos actualmente en la supervivencia del injerto y del paciente (29). Sin embargo, en gran medida, los trasplantes en general han logrado tasas altas de éxito debido al uso de cada vez mejores esquemas de inmunosupresión (52). Desde los desalentadores resultados en el pasado, en la era de los corticoides, insuficientes para la alta inmunogenicidad del páncreas y duodeno, en comparación con el riñón y el hígado, pasando por la era de la ciclosporina y la azatioprina, hasta la actualidad con el uso de los inhibidores de calcineurina como el tacrolimus, se ha logrado llegar a una supervivencia del injerto de 85% y del paciente de 95%, al año del trasplante. Así mismo, el uso de esquemas de inducción con inmunoterapia, que incluyen drogas como la timoglobulina que produce depleción de clonas de células T o con nuevos anticuerpos selectivos no depletantes que inhiben la función de las células T como el daclizumab y el basiliximab, ayudan a prevenir el rechazo agudo y permiten prescindir de los corticoides a los 3 o 6 meses, evitando sus severas reacciones adversas, quedando como esquema de mantenimiento el tacrolimus y el micofenolato mofetil, potentes inmunosupresores (53-55). En el manejo postoperatorio, se siguió pautas de cobertura antibiótica (imipenem, linezolid, cotrimoxazol), antimicótica (caspofungina) y antiviral (ganciclovir, valganciclovir) necesarias para la prevención de infecciones, como consecuencia de la inmunosupresión.
El seguimiento a largo plazo implica vigilar la adecuada funcionalidad del injerto, alertas a la aparición de las complicaciones tardías de importancia, como son el rechazo crónico y las consecuencias de la infecciones oportunistas, la de mayor importancia la causada por citomegalovirus (pancreatitis y fístula anastomótica tardía) (51,56). Se realiza a través del monitoreo de la hemoglobina glicosilada y los niveles de péptido C, amilasas y lipasas séricas, así como con ecografía y serología para infección por citomegalovirus. Para evitar el rechazo crónico y una excesiva inmunosupresión, se debe controlar mensualmente los niveles plasmáticos de tacrolimus y micofenolato mofetil, y con ello ir regulando las dosis de estos fármacos (35,57).
A pesar de la morbilidad postoperatoria y de los efectos adversos de la inmunosupresión crónica, la calidad de vida del trasplantado mejora notablemente al obtenerse la insulino-independencia y al liberarse de la diálisis. Las complicaciones tardías de la diabetes, como la retinopatía, la neuropatía y la macroangiopatía, se ha demostrado que se detiene su progresión e incluso a largo plazo tiende a regresionar, dando esto como resultado una mayor supervivencia global (1,7). La paciente presentada lleva 9 meses de trasplantada, no habiendo necesitado ni diálisis ni insulina desde el postoperatorio inmediato; sus niveles de péptido C y hemoglobina glicosilada son normales hasta la actualidad. Se ha reincorporado a su vida profesional y personal, con gran mejoría de su calidad de vida, no habiendo presentado hasta el momento de la realización de este manuscrito alguna complicación consecuencia de la inmunosupresión.
Existe experiencia, en un limitado número de pacientes, con el uso de injerto pancreático parcial de donante vivo, con baja morbimortalidad para el donante y el receptor, con las ventajas de una mayor compatibilidad inmunológica, un reducido tiempo de isquemia fría y una disminución en el tiempo de espera, que permitirían una mayor supervivencia del paciente y del injerto. Así también, el trasplante de islotes pancreáticos, concentrados tras su extracción y luego inoculados por vía percutánea al torrente portal para que se siembren en el hígado, ha probado ser una alternativa útil, con la ventaja de no requerir una intervención quirúrgica y sus riesgos, pero con la desventaja de no asegurar la independencia a la insulina a largo plazo y la necesidad de 3 o 4 órganos completos para obtener el número suficiente de islotes para el trasplante (1).
En conclusión, creemos que el trasplante simultáneo de páncreas y riñón fue factible y seguro en esta paciente, en nuestro centro, y que esta primera experiencia con resultado óptimo debe repetirse en forma sistemática en hospitales que cuenten con el recurso humano capacitado y la infraestructura necesaria para la realización de este tipo de trasplantes, y ofrecer así los beneficios de esta terapia a los pacientes portadores de diabetes mellitus tipo 1 con insuficiencia renal, en diálisis.
REFERENCIAS BIBLIOGRÁFICAS
1. Hakim N, Stratta R, Gray D. Pancreas and Islet Transplantation. Oxford, UK: Oxford University Press; 2002.
2. Morath C, Schmied B, Mehrabi A, Weitz J, Schmidt J, Werner J, et al. Simultaneous pancreas-kidney transplantation in type 1 diabetes. Clin Transplant 2009:23 Suppl 21:115-20.
3. Kelly WD, Lillehei RC, Merkel FK, Idezuki Y, Goetz FC. Allotransplantation of the pancreas and duodenum along with the kidney in diabetic nephropathy. Surgery. 1967;61(6):827-37.
4. Lillehei RC, Simmons RL, Najarian JS, Weil R, Uchida H, Ruiz JO, et al. Pancreatico-duodenal allotransplantation: experimental and clinical experience. Ann Surg. 1970;172:405-36.
5. Di Carlo A, Odorico J, Sollinger H. Pancreas transplantation: an overview. Transplant Reviews. 2004:18:1-9.
6. van der Boog P, Ringers J, Paul LC, Jukema JW, Baranski A, Lemkes HHPJ, et al. Simultaneous kidney-pancreas transplantation: the preferred option for patients with type 1 diabetes mellitus and approaching end-stage renal disease. Transplant Reviews. 2004;18:129-38.
7. Lipshutz G, Wilkinson AH. Pancreas-kidney and pancreas transplantation for the treatment of diabetes mellitus. Endocrinol Metab Clin N Am. 2007;36:1015-38.
8. Stuart F, Abecassis M, Kaufman D. Organ Transplantation. Georgetown, Texas: Landes Bioscience; 2000.
9. Michalak G, Kwiatkowski A, Czerwinski J, Chmura A, Lisik W, Kosieradzki M, et al.
Simultaneous pancreas-kidney transplantation: analysis of donor factors. Transplant Proc. 2003;35:2337-8.10. Neidlinger N, Odorico J, Sollinger H, Fernandez L. Can extreme pancreas donors expand the donor pool? Current Opin Organ Transplant. 2008;13:67-71.
11. Humar A, Matas A, Payne W. Atlas of Organ Transplantation. Springer-Verlag London Limited; 2006.
12. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications insulin-dependent diabetes mellitus. N Engl J Med. 1993;329:977.
13. Gruessner AC, Sutherland DE. Pancreas transplant outcomes for United States (US) and non-US cases as reported to the United Network for Organ Sharing (UNOS) and the International Pancreas Transplant Registry (IPTR) as of June 2004. Clin Transplant. 2005;19:433.
14. American Diabetes Association. American Diabetes Association clinical practice recommendations 2001. Diabetes Care. 2001;24 Suppl 1:S1-133.
15. Robertson P, Davis C, Larsen J, Stratta R, Sutherland DE; American Diabetes Association. Pancreas transplantation in type 1 diabetes. Diabetes Care. 2004;27 Suppl 1:S105.
16. Tyden G, Bolinder J, Solders G, Brattström C, Tibell A, Groth CG. Improved survival in patients with insulin-dependent diabetes mellitus and end-stage diabetic nephropathy 10 years after combined pancreas and kidney transplantation. Transplantation. 1999;67(5):645-8.
17. Larsen JL, Colling CW, Ratanasuwan T, Burkman TW, Lynch TG, Erickson JM, et al. Pancreas transplantation improves vascular disease in patients with type 1 diabetes. Diabetes Care. 2004;27(7):1706-11.
18. Gruessner RW, Sutherland DE, Gruessner AC. Mortality assessment for pancreas transplants. Am J Transplant. 2004;4(12):2018-26.
19. Bohman SO, Tydén G, Wilczek H, Lundgren G, Jaremko G, Gunnarsson R, et al. Prevention of kidney graft diabetic nephropathy by pancreas transplantation in man. Diabetes. 1985;34(3):306-8.
20. Sollinger H, Odorico JS, Becker YT, D'Alessandro AM, Pirsch JD.
One thousand simultaneous pancreas-kidney transplants at a single center with 22-year follow-up. Ann Surg. 2009;250:1-13.21. Sutherland DE, Gruessner RW, Dunn DL, Matas AJ, Humar A, Kandaswamy R, et al. Lessons learned from more than 1000 pancreas transplants at a single institution. Ann Surg. 2001;233:463–501.
22. Young BY, Gill J, Huang E, Takemoto SK, Anastasi B, Shah T, et al. Living donor kidney versus simultaneous pancreas-kidney transplant in type I diabetics: an analysis of the OPTN/UNOS database. Clin J Am Soc Nephrol. 2009;4:845-52.
23. Odorico JS, Pirsch JD, Becker YT, Knechtle SJ, D'Alessandro A, Werwinski C, et al. Results of solitary pancreas transplantation with enteric drainage: is there a benefit from monitoring urinary amylase levels? Transplant Proc. 2001;33:1700.
24. Mendivil R, Garmendia F, Yeren C, Torres W. Trasplante de Aloinjerto de Pancreas en perros con Diabetes mellitus experimenta. An Fac med 1998: 59:267-276.
25. Wullstein C, Woeste G, de Vries E, Persijn GG, Bechstein WO. Acceptance criteria of pancreas grafts: how do surgeons decide in Europe? Transplant Proc. 2005:37:1259-61.
26. Ridway D, Manas D, Shaw J, White S. Preservation of the donor pancreas for whole pancreas and islet transplantation. Clin Transplant. 2010;24:1-19.
27. Troppmann C. Complications after pancreas transplantation. Curr Opin Organ Transplant. 2010;15:112-8.
28. Dawahra M, Petruzzo P, Lefrançois N, Dubernard JM, Martin X. Evolution of surgical techniques of pancreas transplantation. Curr Opin Organ Transplant. 2001;6:183-7.
29. Martin X, Badet L, Dubernard JM. Recent technical aspects in pancreas transplantation. Curr Opin Organ Transplant. 2004; 9:82-5.
30. Boggi U, Vistoli F, Del Chiaro M, Signori S, Di Candio G, Amorese G, et al. Surgical techniques for pancreas transplantation. Curr Opin Organ Transplant. 2005;10:155-68.
31. Hyon SH, Groppa R, Pekolj J, Guidice C, Domenech A, Litwak L, et al. Trasplante renopancreático. Experiencia inicial en un centro de trasplantes en Argentina. Medicina (Buenos Aires). 1999;59:685-92.
32. Fernandez-Cruz L, Astudillo E, Sanfey H, Llovera JM, Saenz A, Lopez-Boado MA, et al. Combined whole pancreas and liver retrieval: a new technique for arterial reconstruction of the pancreas graft. Br J Surg. 1992;79:239-40.
33. Fernandez-Cruz L, Astudillo E, Sanfey H, Llovera JM, Saenz A, Lopez-Boado MA, et al. Combined whole pancreas and liver retrieval comparison between Y-iliac graft and splenomesenteric anastomosis. Transplant Int 1992;5(1):54-6.
34. Pirsch JD, Odorico JS, DAlessandro AM, Knechtle SJ, Becker BN, Sollinger HW. Posttransplant infection in enteric versus bladder-drained simultaneous pancreas-kidney transplant recipients. Transplantation. 1998;66:1746-50.
35. Gaber L, Egidi MF. Surveillance and monitoring of pancreas allografts. Curr Opin Organ Transplant. 2002;7:191-5.
36. Sollinger HW, Messing EM, Eckhoff DE, Pirsch JD, D'Alessandro AM, Kalayoglu M, et al. Urological complications in 210 consecutive simultaneous pancreas-kidney transplants with bladder drainage. Ann Surg. 1993;218(4):561-8, [discusión: 568-70].
37. Ploeg RJ, Eckhoff DE, DAlessandro AM, Stegall MD, Knechtle SJ, Pirsch JD, et al. Urological complications and enteric conversion after pancreas transplantation with bladder drainage. Transplant Proc. 1994;26(2):458-9.
38. Reddy KS, Stratta RJ, Shokouh-Amiri MH, Alloway R, Egidi MF, Gaber AO. Surgical complications after pancreas transplantation with portal-enteric drainage. J Am Coll Surg. 1999;189(3):305-13.
39. Badosa F, Mital D, Sands L, Hisey M, Raja R, Bannett A, et al. Our experience with Roux-Y intestinal drainage in simultaneous kidney and pancreas transplantation. Transplant Int. 1994;7 Suppl 1:S412-3.
40. Diem P, Abid M, Redmon JB, Sutherland DE, Robertson RP. Systemic venous drainage of pancreas allografts as independent cause of hyperinsulinemia in type I diabetic recipients. Diabetes. 1990;39(5):534-40.
41. Gaber AO, Shokouh-Amiri MH, Hathaway DK, Hammontree L, Kitabchi AE, Gaber LW, et al. Results of pancreas transplantation with portal venous and enteric drainage. Ann Surg. 1995;221(6):613-22, [discusión: 622-4].
42. Stout RW. Insulin and atheroma. 20-yr perspective. Diabetes Care. 1990;13(6):631-54.
43. Goodman J, Tai Becker Y. Pancreas surgical complications. Curr Opin Organ Transplant. 2009:14:85-9.
44. Humar A, Kandaswamy R, Granger D, Gruessner RW, Gruessner AC, Sutherland DE. Decreased surgical risks of pancreas transplantation in the modern era. Ann Surg. 2000;231(2):269-75.
45. Humar A, Ramcharan T, Kaudaswamy R, Gruessner RW, Gruessner AC, Sutherland DE. Technical failures after pancreas transplants: why grafts fail and the risk factors multivariate analysis. Transplantation. 2004;78(8):1188-92.
46. Benz S, Bergt S, Obermaier R, Wiessner R, Pfeffer F, Schareck W, et al. Impairment of microcirculation in the early reperfusion period predicts the degree of graft pancreatitis in clinical pancreas transplantation. Transplantation. 2001;71:759-63.
47. Spiros D, Christos D, John B, Burke G, Miller J, Ciancio G. Vascular complications of pancreas transplantation. Pancreas. 2004;28:413-20.
48. Sollinger HW. Pancreatic transplantation and vascular graft thrombosis [editorial]. J Am Coll Surg. 1996;182:362-3.
49. Gilabert R, Fernandez-Cruz L, Bru C, Sans A, Andreu J. Duplex-Doppler ultrasonography in monitoring clinical pancreas transplantation. Transplant Int. 1988;1:172-7.
50. Baert A, Knauth M, Sartor K. Imaging in Transplantation. Springer-Verlag Berlin Heidelberg; 2008.
51. Fernandez-Cruz L, Gilabert R, Sabater L, Gilabert R, Ricart MJ, Saenz A, et al.
Native and graft pancreatitis. Br J Surg. 1993;80:1429-32.52. Axelrod D, Kaufman D. Novel immunosupresion in pancreas transplantation and outcomes. Curr Opin Organ Transplant. 2007;12:77-81.
53. Gruessner RW, Sutherland DE, Troppmann C, Benedetti E, Hakim N, Dunn DL, et al. The surgical risk of pancreas transplantation in the cyclosporine era: an overview. J Am Coll Surg. 1997;185(2):128-44.
54. Stratta RJ, Lo A, Shokouh-Amiri MD, Egidi MF, Gaber LW, Gaber AO. Improving results in solitary pancreas transplantation with portal-enteric drainage, thymoglobin induction, and tacrolimus/mycophenolate mofetil-based immunosuppression. Transpl Int. 2003;16(3):154-60.
55. Magliocca JF, Odorico JS, Pirsch JD, Becker YT, Knechtle SJ, Leverson GE, et al. A comparison of alemtuzumab with basiliximab induction in simultaneous pancreas-kidney transplantation. Am J Transplant. 2008;8:1702-10.
56. Nath D, Gruessner A, Kandaswamy R, Gruessner RW, Sutherland DE, Humar A. Late anastomotic leaks in pancreas transplant recipients – clinical characteristics and predisposing factors. Clin Transplant. 2005;19:220-4.
57. Mai M, Ahsan N, Gonwa T. The long-term management of pancreas transplantation. Transplantation. 2006;82:991-1003.
Manuscrito recibido el 12 de mayo de 2010 y aceptado para publicación el 10 de junio de 2010.
Correspondencia:
José De Vinatea
Hospital Nacional Guillermo Almenara Irigoyen
Av. Grau No. 800. La Victoria.
Lima 13, Perú.
Correo-e: jomal@terra.com.pe
Gustavo Reaño
Correo-e: gustavoreanop@yahoo.es














