Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.71 n.3 Lima jul./dic. 2010
TRABAJOS ORIGINALES
Efecto antioxidante y citoprotector del Solanum tuberosum (papa) en la mucosa gástrica de animales de experimentación
Antioxidant and cytoprotection effects of Solanum tuberosum (potato) on gastric mucosa in experimental animals
Miguel Sandoval-Vegas1 ; Oscar Huamán-Gutiérrez1 ; Raquel Oré-Sifuentes1 ; Amalia Loli-Ponce1 ; Salomón Ayala-Pío1
1 Centro de investigación de Bioquímica y Nutrición. Facultad de Medicina, UNMSM. Lima, Perú.
Resumen
Introducción: Existen alternativas terapéuticas con productos naturales oriundos usados de manera empírica en la población. Tal es el caso del zumo de papa (Solanum tuberosum) usado para problemas de mucosa gástrica. Objetivos: Evaluar la capacidad antioxidante y el efecto citoprotector a la mucosa gástrica del zumo de papa (Solanum tuberosum). Diseño: Experimental. Institución: Centro de Investigación de Bioquímica y Nutrición de la Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima. Materiales biológicos: Solanum tuberosum, variedad Tomasa y ratas albinas machos. Métodos: Se administró vía oral post ayuno las fracciones de sobrenadante y sedimento del zumo de Solanum tuberosum. Una hora después se administró alcohol como injuria de mucosa gástrica. Por laparotomía abdominal se obtuvo el tejido gástrico. Se midió en la mucosa gástrica el estrés oxidativo por lipoperoxidación, la formación de moco por alcian blue y la protección midiendo la extensión del área lacerada en imagen digitalizada. Principales medidas de resultados: Capacidad antioxidante y efecto citoprotector a la mucosa gástrica. Resultados: El sobrenadante de la dosis 5 mL/ kg produjo mayor protección al estrés oxidativo; el precipitado en dosis 5 mL/kg presentó mayor producción de moco, sin superar al control. El precipitado 20 mL/kg produjo mayor citoprotección (73,8%). Conclusión: La fracción sobrenadante del zumo de la papa (Solanum tuberosum) posee actividad de defensa antioxidante y la fracción del sedimento, mayor actividad citoprotectora de la mucosa gástrica.
Palabras clave: Mucosa gástrica; citoprotección; Solanum tuberosum; antioxidantes.
Abstract
Background: There are therapeutic alternatives in Peru with empirical native products such as potato juice. Objectives: To assess the antioxidant capacity and the gastric mucosa cytoprotection effect by Solanum tuberosum juice. Design: Experimental. Institution: Research Center of Biochemistry and Nutrition, Faculty of Medicine, Universidad Nacional Mayor de San Marcos. Biological materials: Solanum tuberosum, tomasa variety, and male albino rats. Methods: Oral solid fractions of supernatant and sediment from Solanum tuberosum juice were administered to fasting rats and an hour later, alcohol was given for gastric injury; gastric tissue was obtained by laparotomy. Oxidative stress was measured in the gastric mucosa by lipoperoxidation, formation of mucus by alcian blue, and the extent of protection by measuring lacerated areas in scanned image. Main outcome measures: Antioxidant capacity and gastric mucosa cytoprotection. Results: The 5 mL/kg supernatant produced greater oxidative stress protection; the 5 mL/kg pellet dose showed increased production of mucus, without exceeding controls. The 20 mL/kg precipitate produced greater cytoprotection, 73,8%. Conclusion: Supernatant fraction of Solanum tuberosum juice has antioxidant effect and the fraction of the sediment increased cytoprotective activity on gastric mucosa.
Key words: Gastric mucosa; cytoprotection; Solanum tuberosum; antioxidants.
INTRODUCCIÓN
El gobierno del Perú presentó una iniciativa ante la Asamblea General de las Naciones Unidas (ONU) para reconocer al año 2008 como el año internacional de la papa, hecho que fue aprobado, realizándose posteriormente diversas actividades en la programación de la FAO respecto a la trascendencia de la papa como alimento mundial, original de América del Sur. Es pues la papa uno de los cuatro cultivos más importantes del mundo, junto con el trigo, maíz y arroz, con una producción mundial de más de 323 millones de toneladas, ya desde 2005. Su origen, con más de 8 000 años de antigüedad, se localiza en los andes peruanos, al norte del lago Titicaca, estimándose en 5 500 sus distintas variedades, de las cuales más de 2 000 se cultiva en Perú (1,2).
Entre las diversas formas de uso de la papa figura el uso medicinal. El consumo de este producto así como otras plantas y productos naturales ha aumentado significativamente en los últimos años, tanto en la prevención y como para el tratamiento de ciertas enfermedades. Esta actividad ha sido promovida por la Organización Mundial de la Salud, adoptando el nombre de medicina tradicional (3); sin embargo, es preciso verificar científicamente los beneficios de estos productos, dado que se ha reportado algunos efectos adversos con su uso (4).
Las formas del uso de la papa en la medicina tradicional son diversas (2-5). Se ha determinado que el zumo entero de papa tiene efecto citoprotector sobre la mucosa gástrica (6) y el zumo solo o administrado con el látex de Croton lecheri (sangre de grado) tiene efecto regenerativo en gastritis y úlceras gástricas inducidas con etanol (7). La papa aporta carotenoides, siendo los más abundantes la violaxantina, anteraxantina y luteína; se encuentran en menor cantidad neoxantina, beta-criptoxantina, zeaxantina y beta-carotenos (8,9).
Tradicionalmente, muchas plantas han sido utilizadas en el tratamiento de enfermedades gastrointestinales. Se ha determinado que varias especies vegetales y sus compuestos químicos producen efectos benéficos sobre el tracto gastrointestinal. Así, terpenoides, flavonoides y alcaloides son ejemplos de sustancias con demostrada actividad protectora sobre la mucosa gástrica, características que también serían propiedad del zumo de papa (10-12). Existen diferentes formas del uso de la papa referidas en la medicina tradicional, se señala que el zumo crudo tiene propiedades antiácidas y antiinflamatorias sobre la mucos gástrica, pero hay carencia de observaciones científicas que señalen tales efectos (2,13).
Existen en nuestro país diversos productos naturales que tienen acción medicamentosa preventiva y/o curativa con gran potencial de industrialziación; para ello es necesario realizar estudios de su efectividad, mecanismo de acción, dosificación así como sus posibles reacciones adversas (10). Así, el objetivo de la presente investigación es la determinación del efecto citoprotector y la capacidad antioxidante de las fracciones del zumo de papa (Solanum tuberosum, variedad Tomasa) sobre la mucosa gástrica en animales de experimentación.
MÉTODOS
Se usó 80 animales de experimentación: ratas albinas, machos, adultos, entre 213 a 260 g de peso, adquiridas del bioterio de la Universidad Nacional Agraria La Molina. Se las dividió aleatoriamente en 8 grupos experimentales, cada uno constituido por 10 animales:
-
Grupo control (c): solución de cloruro de sodio 0,9 g% a 10 mL/kg de peso.
-
Grupos experimentales:
(G1) Zumo de papa precipitado equivalente a 5 mL/kg de peso.
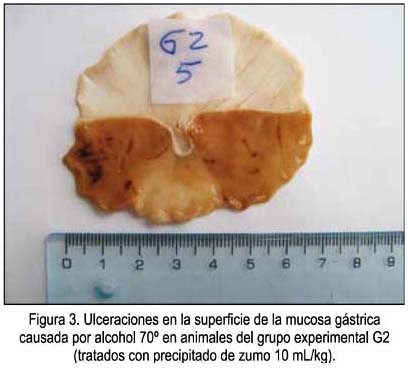
(G2) Zumo de papa precipitado equivalente a 10 mL/kg de peso.
(G3) Zumo de papa precipitado equivalente a 20 mL/kg de peso.
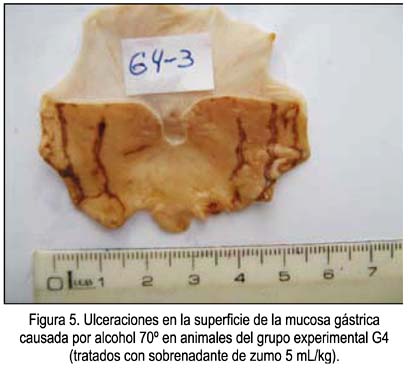
(G4) Zumo de papa sobrenadante equivalente a 5 mL/kg de peso.
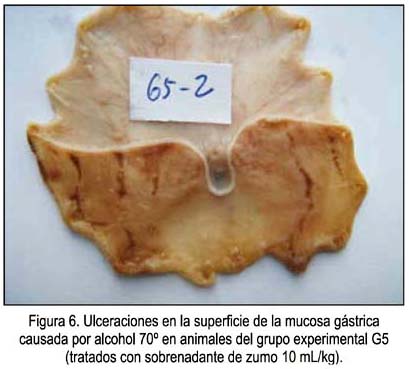
(G5) Zumo de papa sobrenadante equivalente a 10 mL/kg de peso.
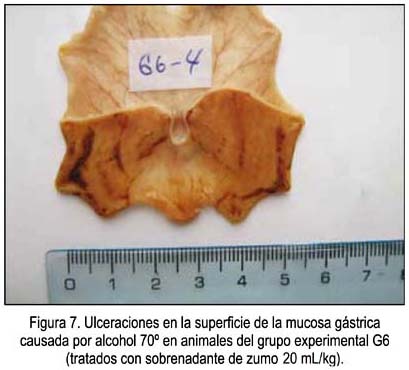
(G6) Zumo de papa sobrenadante equivalente a 20 mL/kg de peso.
Grupo control fármaco. Administración de solución mylanta II.
Se obtuvo dos fracciones de Solanum tuberosum a partir de zumo fresco y entero, que fue obtenido mediante el procedimiento casero de rayado en superficie porosa y áspera de metal. El zumo entero fue filtrado en gasa; luego, se colocó en una probeta por espacio de 60 minutos para la separación de dos fracciones por decantación; se obtuvo así el sedimento y el sobrenadante.
Se administró a las ratas las diferentes dosis de fracción del zumo de papa, equivalente a 5, 10 y 20 mL por kilogramo de peso del animal, por vía digestiva, mediante canulación orogástrica, en una sola aplicación. La administación se realizó en estado de ayuno sólido de 24 horas y ayuno líquido de 12 horas. En todos los casos, una hora después, a los animales se les indujo gastritis y úlceras gástricas mediante la administración de solución del etanol al 70%, volumen/ volumen con agua, mediante canulación orogástrica, siguiendo el modelo modificado de Vissher (14).
Posteriormente, los animales fueron anestesiados con éter vaporizado y se les practicó laparotomía y gastrectomía, para la evaluación de la mucosa gástrica, la cual fue extendida y fijada en superficie adherente, para luego ser fotografiadas, digitilizadas y trasferidas a una computadora, para su analisis con el software Advance CS-3. Con dicho software se identificó y cuantificó las áreas con laceración tipo ulceración (megapixeles cuadrados: MGPix2), así como el área total de la zona mucosa de los estómagos. La valoración numérica del recuento se analizó estadisticamente en SPSS 15.0, a un nivel de confianza 95% y significancia p < 0,05.
A partir de los datos numéricos, se calculó el porcentaje de lesión o daño de la superficie de la mucosa (megapixeles cuadrados), asumiendo como 100% de daño o 0% de protección al valor de los animales del grupo control (MGPix2AC) tratados solo son solución de NaCl y calculando posteriormente el daño en los animales de los grupos experimentales (MGPix2AE), mediante la siguiente fórmula:
% protección: 100 – (MGPix2AE/ MGPix2AC*100)
El grado de estrés oxidativo se midió a través del moco gástrico. Se tomó dos muestras de la mucosa, cada una aproximadamente de 0,5 g, se pesó y destinó para realizar la lipoeroxidación mediante la prueba de TBARS (determinacion de las especies reactivas al ácido tiobarbitúrico) y otra parte para la cuantificación de la producción de moco gástrico mediante el método de alcian blue modificado. Dicho método se basa en el método de Corne, que se fundamenta en la adsorción del alcian blue sobre el moco, el cual posteriormente es extraido con MgCl2. El alcian blue solubilizado en alcohol etílico 70% fue cuantificado por espectrofotometría a 598 nm (7).
Se realizó ensayos preliminares para la verificación y ajuste de los procedimientos, como curvas de calibración, medición de los límites de detección en el procedimiento espectrofotométrico, solubilidad de los reactivos, así como la preparación de reactivos correpondientes a cada procedimiento, desarrollando los cálculos convenientes para cumplir con las especificaciones de concentración para su uso (NaCl 0,152 mol/L, alcian blue 76,9 umol/L, ácido tricloroacético 0,122 mol/L, ácido tiobarbiturico 46,48 mmol/L en ácido clorhídrico 0,25N, sacarosa 0,25 mol/L, alcohol 70%, cloruro de magnesio 0,5 mol/L). Se realizó pruebas previas con animales de experimentación, para el adiestramiento y práctica del software Advance CS-3.
RESULTADOS
Se observó menores niveles de lipoperoxidación (capacidad antioxidante) en la mucosa gástrica tratada con el precipitado de 5 mL/kg (sin diferencia significativa) y en la mucosa gástrica tratada con sobrenadante en dosis de 5 mL/kg (p < 0,001). Asimismo, la producción de moco gástrico en todos los grupos tratados, ya fuera con la fracción sobrenadante o sedimento del zumo de Solanum tuberosum, fue menor que los grupos control y mylanta (tabla 1).
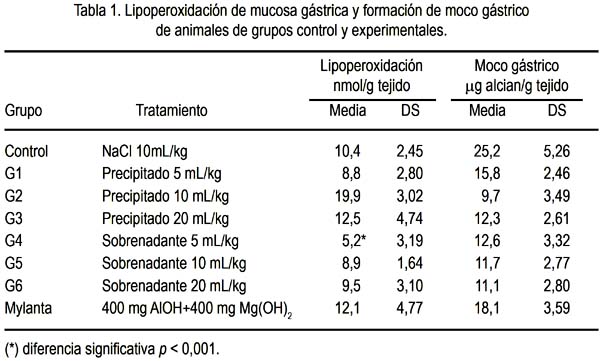
Hubo citoprotección a la injuria por etanol en todos los grupos, ya sea en el tratamiento con la fracción sobrenadante como con el sedimento del zumo de Solanum tuberosum, observándose mejor citoprotección (menor superficie alterada) en los grupos tratados con la fracción sedimento: hasta 73,8% de protección en el grupo tratado con el precipitado en dosis de 20 mL/kg (tabla 2).
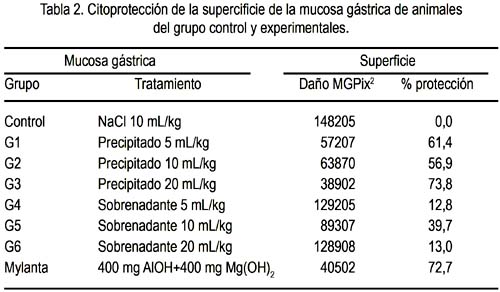
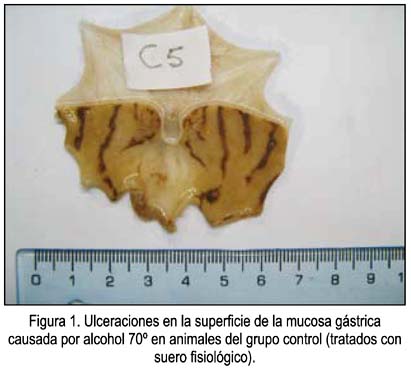
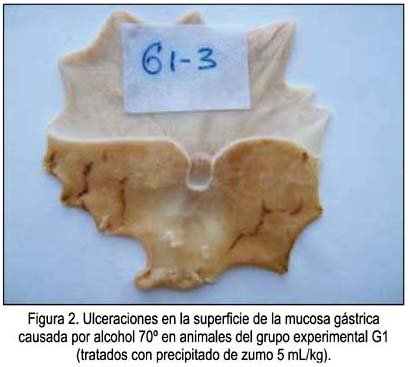
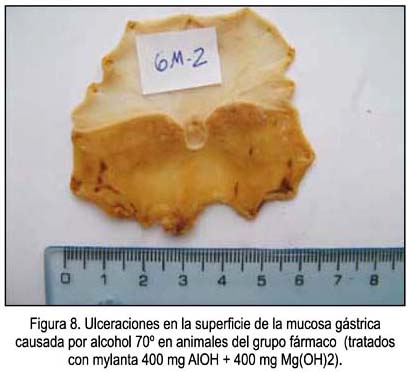
Un ejemplo de las vistas de las úlceras causadas por el etanol en animales sin ninguna protección se muestra en la figura 1, correspondientes a las zonas más oscuras de la mucosa. En las figuras 2, 3 y 4 se muestra las ulceraciones en menor superficie, es decir, con citoprotección en los grupos tratados con el precipitado a diferentes dosis. El grupo tratado con precipitado de 20 mL/kg de peso tuvo menor superficie ulcerada (mejor citoprotección). En las figuras 5, 6 y 7 se observa las ulceraciones causadas por el alcohol, aún con tratamiento con sobrenadante, lo que muestra menor citoprotección en comparación a los animales tratados con el precipitado. En la figura 8 se aprecia la protección conferida por el fármaco mylanta (menor superficie ulcerada).

DISCUSIÓN
Según la medicina tradicional, algunos productos naturales tienen efectos en hígado y riñones (13,15,16). Para el caso de la papa, se dice que esta es diurética, hipotensora, produce una reacción muy alcalinizante y que es favorable a quienes padecen de acidez, úlcera o gastritis. El cocimiento ancestral de las hojas le da un uso antiespasmódico y utilizado localmente es recomendado para las hemorroides. Sin embargo, lo anterior carece de evidencia científica.
Existen investigaciones referidas a productos naturales que han comprobado efecto sobre la mucosa gástrica, como por ejemplo el matico (17,18), sangre de grado, sábila (19), achiote (20).
En el presente estudio, mediante sedimentación separamos la papa en dos fracciones; ambas fracciones han sido evaluadas por separado para determinar su capacidad antioxidante, cuantificando los niveles de lipoperoxidación por la prueba de TBARs. Así, el sobrenadante en dosis de 5 mL/kg de peso produjo significativamente una menor lipoperoxidación. Es decir, que esa dosis confiere protección ante la injuria del alcohol, que es un fuerte agente oxidante (21). Esta citoprotección se debe en gran medida a los polifenoles, que son parte constituyente de la cáscara y pulpa de la papa y cuyo rol es limpiar de los radicales libres al producto y mantenerlo en buen estado de conservación (22). Al igual que otros productos vegetales, como frutas y verduras, su concentración y capacidad funcional dependen del grado de maduración (23).
Se conoce que los mecanismos de protección al estrés oxidativo son varios y entre ellos la presencia de glutatión es fundamental para la protección gástrica. Se conoce también el efecto de las prostaglandinas como inductoras de la protección de la mucosa gástrica (24); estas prostaglandinas aumentan su concentración cuando existe un estímulo de flavonoides (24,25). Para el caso de la papa, los polifenoles tienen capacidad antioxidante como agentes quelantes de iones de metales de transición, uniéndose a estos y reduciendo su capacidad de generar radicales libres; además, tienen capacidad de inhibir, activar o proteger enzimas específicas que inhiben oxigenasas celulares y por tanto la producción de especies oxidantes del oxígeno y del nitrógeno, controlando de esta manera la actividad enzimática de la oxidación del tubérculo (26). Otros estudios indican que una dieta rica en sustancias antioxidantes, incluyendo a las vitaminas como el ácido ascórbico y la vitamina E y el beta caroteno, aumentan la capacidad antioxidante, evitando así el daño oxidativo (27,28); dichos componentes también están presentes en la papa (8,29).
La dosis en que encontramos mayor protección antioxidante fue a 5 mL/kg del sobrenadante, la cual tuvo un valor más bajo de lipoperoxidación, es decir, 5,22 nmol/g tejido, a comparación del control, que tuvo 10,4 nmol/g tejido (tabla 1); al observar estos valores, notamos que el sobrenadante es el que confiere mayor protección antioxidante, con marcada diferencia significativa.
La producción de moco es un mecanismo de protección natural que posee la mucosa gástrica (30). Algunos productos vegetales, como la sangre de grado (31) y el aloe vera (19), estimulan la producción de moco gástrico, como también lo hacen algunos fármacos, como el sucralfato (22).
Nuestros resultados de la determinación de moco gástrico indican que, tanto el precipitado del zumo como el sobrenadante de este, administrados por separado, no tienen capacidad estimulante sobre la mucosa para inducir a la formación de moco. Ello difiere de algunas sustancias que el equipo investigador ha estudiado anteriormente, como el látex de Croton palanostigma (7) y Croton lecheari (18). Por el contrario, sí hubo efecto protector de la mucosa con el uso de mylanta, como se observó en dicho grupo experimental. El mismo efecto también fue demostrado con el uso de sucralfato (30,31). Sin embargo, la disminución o carencia de moco y la disminución del flujo circulatorio producen un efecto de retrodifusión de H+ al tejido, provocando irritación, ulceración, dilución, tamponamiento o eliminación del exceso de acidez (30,32), no hay daño tisular o este es mínimo, de tal manera que no solo se da por la formación y calidad de la barrera protectora del moco, sino además por la disminución de la acidez del medio gástrico, un factor que conlleve a la protección de la mucosa.
La mucosa gástrica puede sufrir agresiones causadas por diferentes agentes externos que son ingeridos junto con los alimentos o de manera individual, como por ejemplo el alcohol, el mismo que nos sirve como modelo para demostrar cuánto de la superficie de la mucosa fue protegida. En la cuantificación de la extensión del daño de la mucosa gástrica en los animales de experimentación, medidas digitalmente en megapixeles cuadrados (MGPix2), se puede apreciar que es el precipitado del zumo de Solamum tuberosum el que confiere mayor protección a la mucosa gastrica. La posible explicación a la protección que confiere el precipitado del zumo es que, al ser fundamentalmente almidón el componente del precipitado o sedimento, este tiene la propiedad de adsorberse a las superficies, lo que al adherirse a la mucosa gástrica conferiría un efecto protector de barrera frente a la agresión posterior que se realizó con el alcohol etílico, efecto que puede ser comparado al de otros estudios y fármacos (30-32).
La demostración del efecto citoprotector del sedimento o precipitado se puede apreciar además en las diferentes figuras, denotando que el control presentó mayor área de ulceración e irritación a diferencia de la protección que le confirió un farmaco de elección, como mylanta (compuesto por hidróxido de aluminio e hidróxido de magnesio). Según nuestros resultados, el sobrenadante del zumo posee capacidad antioxidante y el sedimento, protección. Así, la conjunción de ambas propiedades es lo que ejerce la acción citoproptectora de la mucosa gástrica.
Concluimos que, en condiciones experimentales, a partir del fraccionamiento del zumo crudo de Solanum tuberosum, variedad tomasa, la fracción sobrenadante posee antividad de defensa antioxidante en dosis de 5mL/kg de peso y la fracción del precipitado brinda citoprotección a la mucosa gástrica de manera dosis dependiente.
REFERENCIAS BIBLIOGRÁFICAS
1. Agapito T, Song I. Fitomedicina 1100 plantas medicinales. Ed. Isabel. 2000.
2. Arellano P. El libro verde. Guía de recursos terapeuticos vegetales. Ministerio de Salud. Lima, 1992;33:46-53.
3. Velasco RG, Meléndez CR. Registro de medicamentos herbarios. Rev Cubana Plant Med. 1999;4:44-7.
4. Caiozzi AG, Cabrera TD, Mardonez UJ y Saldias PF. Hierbas medicinales y graves efectos adversos: Angioedema de úvula causado por uso de Ecballium elaterium. Rev méd Chile. 2002;130: 12.
5. Sung I. Nutrición y Salud. Primera Edición. Editorial Isabel E.I.R.L. 2000. Lima-Perú.
6. Sandoval M, Ayala S, Oré R, Loli A, Huamán O, Valdiviezo R, Béjar E. Capacidad antioxidante de la sangre de grado (Croton palanostigma) por la prueba de TBARS sobre la mucosa gástrica en animales de experimentación. An Fac med. 2006;67(3):199-205.
7. Sandoval M, Ayala S, Oré R, Loli A, Huamán O, Béjar E. Efecto protector del zumo de Solanum tuberosum (papa) sobre la mucosa gástrica, comparada con fármacos antiácidos y citoprotectores, en animales de experimentación. An Fac med. 2007;68 Suppl 1.
8. Breithaupt de Bamedia. Carotenoids and carotenoid esters in potatoes (Solanum tuberosum L.): new insights into an ancient vegetable. J Agric Food Chem. 2002;50(24):7175-81.
9. Olmeedilla B, Granado F, Blanco I, Gil-Martinez E, Rojas-Hidalgo E. Composición en carotenoides y en equivalentesde retinoldeverduras, hortalizas y frutas -crudas y cocidas- por 100 g de porción comestible. En: Moreiras O, Carvajal A, Cabrera L, Cuadrado M, eds. Tablas de Composición de Alimentos. Madrid: Ediciones Pirámide. 2001.
10. Agapito T, Sung I. Fitomedicina. Tomo II. Lima: Editorial Isabel I.R.L. 2000:398-539.
11. Fundación HogaresJuvenilesCampesinos. Manual Agropecuario. Bogotá: Editorial Quebecor World. 2002:959-60.
12. Ellisseche D. La patata. En: Tirilly Y, Bourgeois CM, eds. Tecnología de las hortalizas. Zaragoza: Editorial Acribia. 2002:67-93.
13. NaranjoP. Revista de cienciay tecnología. Casa de la Cultura Ecuatoriana. Quito Ecuador, 2002;I:11-36.
14. Sandoval M, Ayala S, Oré M, Ricra V, Ugarte G. Incremento del moco gástrico y reducción de grupos sulfhidrilo no proteicos por estimulación con sangre de grado de Croton palanostigma. An Fac med. 2004;65 Suppl 1:21.
15. Estrella E. Planta medicinales anazónicas. Tratado de Cooperación amazónica. Lima, Perú. 1995:210-2.
16. Renner JH. Manual de remedios caseros. Lincolnwood, Illinois, USA: Publications International Ltd. 1993:194-6.
17. Placencia M. Evaluación dermatológica de la Buddleia globosa (matico) en el tratamiento de úlcera gástrica inducida en animales de experimentación. Tesis para optar el grado de Magíster. Universidad Nacional Mayor de San Marcos. Lima, Perú. 2001.
18. Arroyo AJ. Actividad antiulcerosa de Piper angustifolium (Matico). Tesis para optar el grado de Doctor. Universidad Nacional Mayor de San Marcos, Facultad de Medicina. Lima, Perú. 1998.
19. Ayala S, Díaz D, Palomino M, Armas S, Paz J. Efecto protector de Croton palanostigma y Aloe vera frente a la injuria aguda de mucosa gástrica inducida por etanol en ratas. An Fac med. 1999;60(1):22-9.
20. Huamán O, Arnao I, Béjar E, Sandoval M. Efecto del extracto hidroalcohólico liofilizado de hojas de Bixa orellana (achiote), en la secreción gástrica de ratas. An Fac med. 2007;68(4):314-20.
21. Aregueta-Robles U, Hernández-Ruiz E, Juárez M, Rendón-Ramírez A. Lipoperoxidación y alcoholismo en jóvenes. Asoc Mex Bioquím clín. 2004;29 (supl 1):125.
22. Oki T, Masuda M, Furuta S, Nishiba Y, Terahera N, Suda I. Involvement of Anthocyanins and other phenolic compounds in radical-scavenging activity of purple-fleshed sweet potato cultivars. J Food Sci. 2002;67(5):1752–6.
23. Sandoval M,LazarteK, Arnao I. Hepatoprotección antioxidante de la cáscara y semilla de Vitis vinifera L. (uva). An Fac med. 2008;69(4):250-9.
24. Hiruma-Lima CA, Calvo T, Rodríguez C, Pezzuto F, Vilegas W, Sousa Brito A. Antiulcerogenic activitiy of Alchornea castaneafolea: Effects on somastostatin, gastrin and prostaglandin. J Ethnopharmacol. 2006;104:215-24.
25. Victor BE, Schmidt KL, Smith GS, Reed RL, Thompson DA, Miller TA. Prostaglandin–induced gastric mucosal protection against stress injury. Ann Surg. 1989;209(3):289-96.
26. Coetzer C, Corsini D, Love S, Pavek J, Tumer N. Control of enzymatic browning in potato (Solanum tuberosum L.) by sense and antisense RNA from tomato polyphenol oxidase. J Agric Food Chem. 2001;49(2):652-7.
27. Taylor A. Cataract: relationship between nutrition and oxidation. J Am Coll Nutr. 1993;12:138-46.
28. Gerster H. b-carotene, vitamin E and vitamin C in different stages of experimental carcinogenesis. Eur J Clin Nutr. 1995;49:155-68.
29. Friedman M. Chemistry, biochemistry, and dietary role of potato polyphenols. A Review. J Agric Food Chem. 1997;45(5):1523-40.
30. Esplugues J, Martinez-Tuesta M, Moreno L, Calatayud S, Beltran B. Mecanismos defensivos de la mucosa gástrica, bases funcionales y actuación farmacológica. Gastroenterol Hepatol. 1997;20(4):50-61.
31. Sandoval M, Ayala S, Oré R, Arroyo J. Inducción de la formación de moco gástrico por la sangre de grado, Crotón palanostigma. An Fac med. 2002;63(4):241-56.
32. EamLamnam K, Patumraj S, Visedopas N, Thong-Ngam D. Effects of Aloe Vera and sucralfate on gastric microcirculatory changes, cytokine levels and gastric ulcer healing in rats. World J Gastroenterol. 2006;12(13):2034-9.
Manuscrito recibido el 21 de agosto de 2010 y aceptado para publicación el 30 de setiembre de 2010.
Correspondencia:
Lic. TM. Miguel Sandoval Vegas
Centro de Investigación de Bioquímica y Nutrición, Facultad de Medicina, UNMSM.
Av. Grau 755. Lima 1, Perú.
Correo-e: mhsave@gmail.com














