Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.72 n.2 Lima abr./jun. 2011
TRABAJOS ORIGINALES
Modificaciones en la presión arterial y el pulso por ketamina, con y sin succinilcolina
Changes in blood pressure and heart rate by ketamine with and without succinylcholine
Andrés Callegari M1 ; Pedro P. Álvarez-Falconí2,3 ; Edmundo Céspedes4
1 Ex Profesor Principal, Facultad de Medicina, Universidad Nacional Mayor de San Marcos.
2 Ex Tutor de Anestesiología, Escuela de Graduados, Facultad de Medicina, Universidad Nacional Mayor de San Marcos.
3 Instituto Nacional de Salud; Lima, Perú.
4 Ex Médico Anestesiólogo de la Clínica Maison de Santé; Lima, Perú.
Resumen
Introducción: La ketamina es utilizada como anestésico general, de inducción y como analgésico. Objetivos: Evaluar los cambios en la presión arterial sistólica (PAS), diastólica (PAD) y frecuencia del pulso (FP) producidos por la ketamina, y la influencia de la succinilcolina. Diseño: Comparativo y de observación. Institución: Clínica Maison de Santé, Lima, Perú. Participantes: Pacientes que recibieron ketamina. Intervenciones: La ketamina fue empleada como anestésico general único y de inducción. Por cada modalidad, se consideró doce pacientes. Los doce primeros recibieron ketamina 2 mg/kg endovenosa, con medición de la PAS, PAD y FP antes y después de la anestesia. Los otros doce recibieron ketamina más succinilcolina, midiéndose los parámetros antes y después. Se comparó los cambios. Principales medidas de resultados: Variaciones en la PAS, PAD y FP. Resultados: En los primeros doce pacientes, la ketamina elevó la PAS 26 ± 3 mmHg, p < 0,001, la PAD 19 ± 3 mmHg, p < 0,001, y la FP 15 ± 3 por minuto, p < 0,001. En los otros doce, la ketamina más succinilcolina elevaron la PAS 28 ± 3 mmHg, p < 0,001, la PAD 18 ± 2 mmHg, p < 0,001 y la FP 13 ± 1 por minuto, p < 0,001. Comparándolos porcentualmente, la succinilcolina no afectó esos cambios. Conclusiones: El incremento de la presión arterial y pulso producidos por la ketamina no fueron afectados por la succinilcolina.
Palabras clave: Ketamina, succinilcolina, anestesia, presión arterial, pulso.
Abstract
Introduction: Ketamine is used as a general anesthetic as well as for anesthesia induction and analgesia. Objectives: To assess modifications in systolic blood pressure (SBP), diastolic blood pressure (DBP), and heart rate (HR) caused by ketamine, and if there is any influence of succinylcholine. Design: Comparative and observational study. Setting: Maison de Santé Clinic, Lima, Peru. Participants: Patients receiving ketamine. Interventions: Ketamine was used as a single drug for general anesthesia and for induction. Twelve patients were considered for each modality. The twelve first patients received ketamine, 2 mg/kg IV, and SBP, DBP and HR were measured before and after administering the drug. The second group received ketamine plus succinylcholine, and same parameters were measured. Main outcome measures: SBP, DBP, and HR variations. Results: Following ketamine injection in the first twelve patients there were elevations in SBP 26 ± 3 mmHg, p < 0,001, DBP 19 ± 3 mmHg, p < 0,001, and HR 15 ± 3 per minute, p < 0,001. In the second group after ketamine plus succinylcholine administration there were increases in SBP 28 ± 3 mmHg, p < 0,001, DBP 18 ± 2 mmHg, p < 0,001, and HR 13 ± 1 per minute, p < 0,001. There were no statistically significant differences when comparing both groups, i.e. succinlycholine did not have any influence in modifying the aforementioned parameters. Conclusions: Increases in blood pressure and heart rate induced by ketamine were not affected by succinylcholine.
Key words: Ketamine, succinylcholine, anesthesia, blood pressure, heart rate.
INTRODUCCIÓN
El clorhidrato de ketamina es un agente anestésico general (1), que también es utilizado para la inducción anestésica (2). Su empleo se ha orientado hacia dolores agudos postoperatorios (3), traumatismos múltiples (4), traumatología pediátrica (5). Además, en anestesia de riesgo alto en niños (6), analgesia y sedación en quemados (7), cirugía cardiovascular, entre otros. Su incorporación en anestesiología correspondió a sus posibilidades farmacológicas y a su perfil de seguridad (8), facilitando la intubación endotraqueal en las emergencias (9), favoreciendo los periodos cortos de recuperación anestésica y el tiempo menor para el alta (10).
Sin embargo, presentaba como reacción adversa un ocasional efecto psicotomimético alucinatorio (11), que según estudios en dosis subanestésicas, no ha producido efecto residual alguno en años posteriores al estudio (12). Pero esa reacción, unido a que es considerado fármaco de abuso (13), constituyó una limitación en su empleo. Pese a ello, sigue siendo empleada en los procedimientos señalados; más aún, continúa siendo uno de los agentes anestésicos preferidos en cirugía de desastres, como se demostró en el terremoto de Haití, del año 2010 (14), y potencialmente de elección en la anestesia para cirugía en conflictos armados (15), todo lo cual la mantiene en expectativa.
Los primeros estudios sobre la ketamina fueron publicados en 1968 y 1969. Dentro de la completa revisión del fármaco (16), se describió la elevación transitoria de la presión arterial y de la frecuencia cardiaca (17). Los estudios subsecuentes encontraron en los pacientes el incremento sérico del neurotransmisor simpático (18), lo cual explicaba tales efectos, considerándose que era una ventaja en pacientes quirúrgicos en quienes se requería el mantenimiento y mejora de la presión arterial, habitualmente disminuida por los anestésicos generales convencionales. En adición, se halló que el mecanismo por el cual incrementaba la presión arterial y la frecuencia cardiaca era la inhibición de la captación neuronal del neurotransmisor simpático noradrenalina (19). Sin embargo, no se estudió si ese incremento transitorio de presión y frecuencia podía ser modificado con la succinilcolina, bloqueante neuromuscular despolarizante persistente (20), de empleo en anestesiología.
A su ingreso al Perú, la ketamina confirmó sus posibilidades y limitaciones de agente anestésico disociativo (21), caracterizado por producir una especie de catalepsia, ojos entreabiertos y mantenimiento del tono muscular estriado. En ese periodo se ejecutó el presente estudio, no publicado en revista alguna y presentado parcialmente en el XVII Congreso Peruano de Cirugía con el título Empleo del clorhidrato de ketamina en anestesia, donde se exploró sus efectos en la presión arterial y frecuencia del pulso, y su interacción con la succinilcolina, no habiéndose encontrado hasta donde se ha buscado en la actualidad trabajos específicos al respecto.
El objeto del presente estudio fue evaluar los efectos del agente anestésico ketamina sobre la presión arterial y frecuencia del pulso, así como su interacción con el bloqueante neuromuscular succinilcolina, en pacientes con tratamientos quirúrgicos diversos. Siendo aún un agente útil en la práctica médica anestesiológica en humanos, como se ha referido, su estudio sobre las posibles interacciones en un campo no explorado será un aporte al conocimiento para el mejor manejo farmacológico.
MÉTODOS
En este estudio prospectivo, comparativo y observacional, se consideró 200 pacientes con diversos procedimientos quirúrgicos, en la Clínica Maison Santé de Lima, alrededor del año 1970. Se empleó clorhidrato de ketamina, como anestésico general único o como agente de inducción anestésica. Como en todo procedimiento quirúrgico y anestésico, el consentimiento informado y entendido fue otorgado por los pacientes y por los padres en el caso de los niños.
Todos recibieron, 30 a 90 minutos antes de la anestesia, una medicación con atropina (dosis pediátrica de 0,03 a 0,01 mg/kg, dosis media para adulto 0,50 mg), meperidina (50 a 100 mg), triflupromazina (10 mg), o la combinación de estos fármacos, dependiendo del estado preoperatorio del paciente. La ketamina se administró por vía endovenosa en la dosis de 2 mg/kg de peso, en un tiempo no menor de un minuto. En seis niños, se administró por vía intramuscular a la dosis de 8 a 10 mg/kg de peso, pero sus parámetros no fueron considerados para la evaluación estadística. Se les controló continuamente la presión arterial y frecuencia del pulso.
Para el presente estudio, se consideró solamente veinticuatro pacientes adultos, divididos en dos grupos, A y B, de doce pacientes cada grupo, todos medicados con atropina más meperidina más triflupromazina, determinándose los valores de la presión y pulso en condiciones basales. Los doce del grupo A recibieron solo ketamina y no se practicó intubación endotraqueal, mientras los doce del grupo B recibieron ketamina más succinilcolina. Después de la administración de tales fármacos, en alrededor de dos a tres minutos se volvió a determinar en todos la presión arterial y frecuencia del pulso.
Cuando era necesario, para el mantenimiento de la anestesia y según la duración del acto quirúrgico, se administró dosis adicionales de ketamina, menores que la inicial. De otro lado, en quienes se empleó la ketamina como anestésico de inducción recibieron casi inmediatamente después succinilcolina, practicándoseles intubación e inmediatamente después se obtuvo los datos de la presión arterial y frecuencia del pulso, continuándose casi simultáneamente la anestesia con halotano. La succinilcolina se empleó en dosis de 20 a 40 mg por vez (2 mg/kg en niños, 0,6 mg/kg en adultos), vía endovenosa lenta.
La ketamina no fue empleada en personas hipertensas ni con problemas emocionales. La observación continuó durante la inducción, mantenimiento y recuperación de la anestesia. Los datos obtenidos fueron analizados usando los procedimientos estadísticos de la prueba t de Student. Las diferencias fueron consideradas significativas cuando p < 0,05.
RESULTADOS
La ketamina, como anestésico único o inductor, fue empleada en 200 pacientes, cuyo rango de edad fue entre menos de uno y 80 años; la mayoría (41%) tuvo 16 a 30 años. Se administró como anestésico general único en 38 pacientes y en la inducción en 162.
En los pacientes del grupo A del estudio (8 mujeres y 4 varones, entre 20 a 40 años), que recibieron ketamina como anestésico único, esta elevó la presión arterial sistólica (26 ± 3 mmHg, p < 0,001), la presión arterial diastólica (19 ± 3 mmHg, p < 0,001) e incrementó la frecuencia del pulso (15 ± 3 pulsaciones por minuto, p < 0,001). En tanto que, en los pacientes del grupo B (6 mujeres y 6 varones, entre 22 a 45 años), con succinilcolina inmediatamente después de la ketamina, esta también elevó la presión arterial sistólica (28 ± 3 mmHg, p < 0,001), la presión arterial diastólica (18 ± 2 mmHg, p < 0,001) e incrementó la frecuencia del pulso (13 ± 1 pulsaciones por minuto p < 0,001) (tabla 4). Tales cambios se presentaron alrededor de los dos a tres minutos de la administración endovenosa de la ketamina y fueron transitorios, comenzando a desaparecer alrededor de los 5 a 10 minutos de presentados (tabla 1).
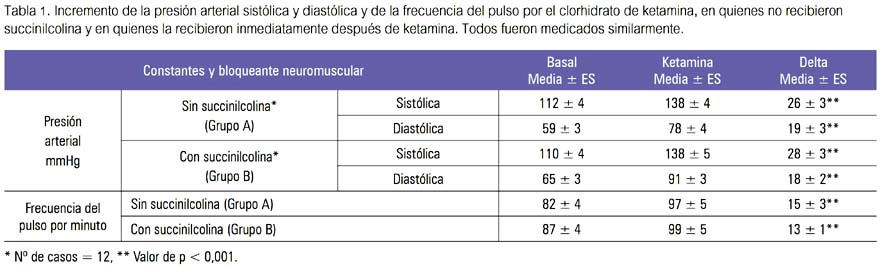
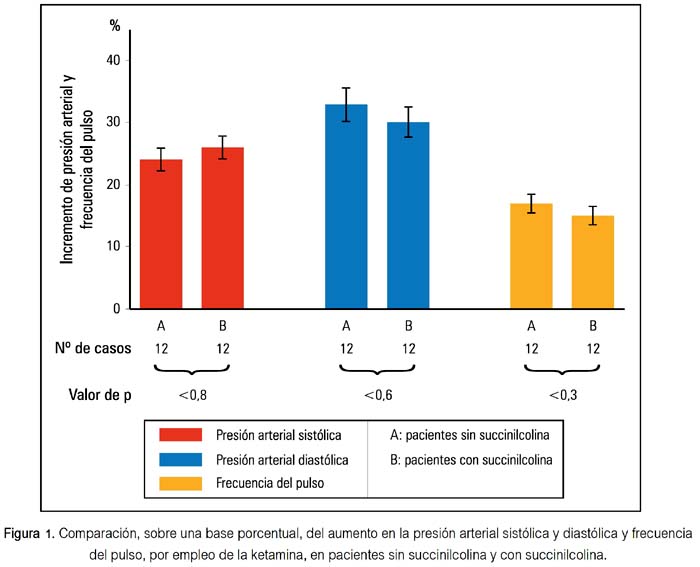
Comparando ambos grupos sobre una base porcentual, se encontró que los incrementos de presión arterial sistólica y diastólica, así como los cambios de la frecuencia del pulso, no fueron estadísticamente diferentes, es decir, que la succinilcolina no interfirió en la elevación de la presión arterial sistólica o diastólica o en el incremento de la frecuencia del pulso producidas por la ketamina, no presentando interacción con ella en las condiciones señaladas y solo para tales constantes vitales (figura 1).
La administración endovenosa de la ketamina en la dosis y velocidad de administración señaladas, fue satisfactoria en más de 95% de los pacientes. Los restantes presentaron manifestaciones discretas a moderadas de excitación pasajera y leve durante la administración, o eritema facial transitorio. En la mayoría en que se utilizó como agente anestésico único, los párpados se mantuvieron entreabiertos transitoriamente, con movimientos oculares de breve duración, dando la impresión de que el paciente estuviera desconectado de su medio ambiente. En ellos se observó discreto aumento del tono muscular, mientras que, la frecuencia respiratoria en estos pacientes adultos no se afectó significativamente.
El mantenimiento de la anestesia en los pacientes con ketamina como anestésico único, fue satisfactoria. La anestesia que ofreció la primera dosis de ketamina fue eficaz habitualmente durante 10 a 15 minutos y aún más, necesitándose ocasionalmente nuevas dosis, según la duración y naturaleza del acto quirúrgico. En la recuperación de la anestesia en algunos pacientes adultos con ketamina como anestésico único, se observó ocasionalmente leve a medianos grados de excitación, expresiones incoherentes, alucinaciones y sensación de mareos, todas de breve duración y que no obligaron a terapia adicional. En los pacientes que recibieron la ketamina como anestésico de inducción, en la recuperación anestésica no presentaron las manifestaciones de excitación descritas.
DISCUSIÓN
En el presente estudio, se encontró la elevación de la presión arterial sistólica y diastólica así como el incremento de la frecuencia del pulso, de modo significativo. Este es uno de los efectos de la ketamina, porque los diversos efectos del agente anestésico no corresponden a un mecanismo de acción único, sino a mecanismos complejos (22). Para intentar explicar tales efectos estimulantes cardiovasculares, inicialmente se sugirió que el aumento del volumen minuto que acompaña a la taquicardia transitoria se debía al bloqueo o la desensibilización de la actividad refleja barorreceptora, con el subsecuente incremento de la actividad simpática, lo que fue abandonado. Poco después se encontró que realmente el incremento de la actividad simpática obedecía a un mecanismo directo de la ketamina sobre centros simpáticos del sistema nervioso central e inhibición de la captación de la catecolamina neuronal (23), demostrado porque el bloqueo ganglionar impedía los efectos estimulantes cardiovasculares.
De otro lado, se sustentó que la ketamina no promovía la liberación de catecolaminas desde la médula suprarrenal, lo que hubiera podido explicar su respuesta hipertensora transitoria e incremento de la frecuencia del pulso. Sin embargo, se halló que más bien inhibe la liberación de catecolaminas adrenales (24). Por todo ello, se admite un incremento en el tono simpático a nivel del sistema nervioso central.
Se ha encontrado que el efecto anestésico disociativo corresponde a un antagonismo no competitivo de los receptores del NmetilDaspartato (NMDA) encefálicos, que incluiría la anestesia/analgesia(25). En realidad, esos efectos se deberían específicamente a la reducción de la excitación sináptica mediada por tales receptores. Ese es un mecanismo de acción predominante y que define al fármaco como anestésico y analgésico, con acción casi selectiva en los receptores encefálicos NMDA (26), posiblemente sobre subtipos de esos receptores que constituyen los denominados receptores ionotrópicos. Estos son receptores del neurotransmisor glutamato, y son considerados canales iónicos, de los cuales se ha descrito varios subtipos (27), que no están totalmente definidos, pero que serían bloqueados por la ketamina (28). La respuesta hipertensiva no parece estar relacionada a estos receptores NMDA, ni centrales ni periféricos. En estos últimos, experimentalmente en arterias mesentéricas in vitro de rata, la ketamina actúa produciendo más bien vasodilatación (29), mecanismo no esperado en la respuesta hipertensiva y que es independiente de los receptores NMDA que no parecen ser funcionales en la estructura muscular lisa mesentérica.
Por la amplitud y complejidad de los mecanismos de acción de la ketamina, es que deben ser señalados para diferenciarlos en lo posible de su participación en los efectos estimulantes cardiovasculares. En el caso de los efectos psicoestimulantes y alucinógenos, parecerían ser resultado, al menos en parte, de un mecanismo agonista de los receptores encefálicos o centrales D2 de dopamina (30), que explicaría tal respuesta observada en la recuperación anestésica.
Adicionalmente, para confirmar sus efectos y acción complejos, se ha encontrado que la ketamina puede expresar una respuesta antidepresiva rápida (31), cuyo mecanismo no ha sido aún identificado, aunque se ha sugerido que también corresponde a una respuesta en diversos receptores del glutamato (32). En efecto, se ha hallado que los antagonistas de los receptores NMDA, como la ketamina, son útiles en pacientes resistentes al tratamiento antidepresivo, como en el trastorno depresivo mayor (33), mejorando en horas lo que con otras terapias lleva hasta meses.
Completa esta complejidad del mecanismo de acción de la ketamina, su influencia sobre la transmisión histaminérgica, al encontrarse que promueve la liberación de histamina en tres regiones límbicas cerebrales (34). Por estos múltiples mecanismos que no suelen presentar otros fármacos, era importante explorar si presenta o no interacción con fármacos como la succinilcolina, para su mejor manejo terapéutico.
La succinilcolina (35), de biotransformación rápida, no produce cambios de presión arterial ni frecuencia del pulso. Actúa sobre la placa mioneural despolarizándola persistentemente, sin exhibir efecto en los ganglios autónomos, por lo cual no afecta la neurotransmisión. Nuestros hallazgos demostraron que no hay interacción entre ketamina y succinilcolina en lo que respecta a presión arterial y frecuencia del pulso, lo que no era conocido ni demostrado fehacientemente antes y constituye el principal aporte del presente estudio. El haber considerado las mismas medicaciones preanestésicas en los pacientes, permitió uniformar los casos a comparar y evitar la influencia que pudieran tener sobre la presión arterial si hubieran sido diferentes (36). En ambos grupos se encontró que las variaciones en presión arterial y frecuencia de pulso eran significativas; pero, cuando se comparó esos resultados sobre una base porcentual, se encontró que no había diferencia entre ambos grupos, es decir que, la succinilcolina no afectó los cambios producidos por ketamina en tales parámetros.
En los pacientes, el empleo de la ketamina como anestésico general único y de inducción fue satisfactorio, encontrándose ocasionalmente los efectos psicotomiméticos o alucinatorios en el periodo postanestésico.
Se concluye que la ketamina no presenta interacción con la succinilcolina y por ello no modifica los cambios transitorios sobre la presión arterial sistólica y diastólica, ni sobre la frecuencia del pulso, producidos por dicho agente anestésico.
REFERENCIAS BIBLIOGRÁFICAS
1. Deasy C, Babl FE. Intravenous vs intramuscular ketamine for pediatric procedural sedation by emergency medicine specialists: a review. Paediatr Anaesth. 2010;20(9):787-96.
2. Sungur Ulke Z, Kartal U, Orhan Sungur M, Camci E, Tugrul M. Comparison of sevoflurane and ketamine for anesthetic induction in children with congenital heart disease. Paediatr Anaesth. 2008;18(8):715- 21.
3. Chazan S, Buda I, Nesher N, Paz J, Weinbroum AA. Low-dose ketamine via intravenous patient-controlled analgesia device after various transthoracic procedures improves analgesia and patient and family satisfaction. Pain Manag Nurs. 2010;11(3):169-76.
4. Porter K. Ketamine in prehospital care. Emerg Med J. 2004;21:351-4.
5. Lee-Jayaram JJ, Green A, Siembieda J, Gracely EJ, Mull CC, Quintana E, et al. Ketamine/midazolam versus etomidate/fentanyl: procedural sedation for pediatric orthopedic reductions. Pediatr Emerg Care. 2010;26(6):408-12.
6. Lois F, De Kock M. Something new about ketamine for pediatric anesthesia? Curr Opin Anaesthesiol. 2008;21(3):340-4.
7. Bayat A, Ramaiah R, Bhananker SM. Analgesia and sedation for children undergoing burn wound care. Expert Rev Neurother. 2010;10(11):1747-59.
8. Rowland LM. Subanesthetic ketamine: how it alters physiology and behavior in humans. Aviat Space Environ Med. 2005;76(7 Suppl):C52-8.
9. Sibley A, Mackenzie M, Bawden J, Anstett D, Villa- Roel C, Rowe BH. A prospective review of the use of ketamine to facilitate endotracheal intubation in the helicopter emergency medical services (HEMS) setting. Emerg Med J. 2010 Oct 6 [Publicación electrónica antes de la impresión].
10. Gloor A, Dillier C, Gerber A. Ketamine for short ambulatory procedures in children: an audit. Paediatr Anaesth. 2001;11(5):533-9.
11. K arapinar B, Yilmaz D, Demirağ K, Kantar M. Sedation with intravenous ketamine and midazolam for painful procedures in children. Pediatr Int. 2006;48(2):146-51.
12. Perry EB Jr, Cramer JA, Cho HS, Petrakis IL, Karper LP, Genovese A, et al. Yale Ketamine Study Group. Psychiatric safety of ketamine in psychopharmacology research. Psychopharmacology (Berl). 2007;192(2):253-60.
13. Stirling J, McCoy L. Quantifying the psychological effects of ketamine: from euphoria to the k-Hole. Subst Use Misuse. 2010;45(14):2428-43.
14. Rice MJ, Gwertzman A, Finley T, Morey TE. Anesthetic practice in Haiti after the 2010 earthquake. Anesth Analg. 2010;111(6):1445-9.
15. Mercer SJ. "The drug of war" - a historical review of the use of ketamine in military conflicts. J R Nav Med Serv. 2009;95(3):145-50.
16. Callegari AA, Álvarez P. Ketamina en Anestesia. Ed. Instituto Peruano de Anestesiología, Clínica Maison de Santé. Lima, Perú. 1970.
17. Hörnchen U, Tauberger G. [Investigations on the mechanism of the effects of ketamine (Ketanest) on circulation and respiration (author's transl)]. Anaesthesist. 1980;29(10):547-51.
18. Appel E, Dudziak R, Palm D, Wnuk A. Sympathoneuronal and sympathoadrenal activation during ketamine anesthesia. Eur J Clin Pharmacol. 1979;16(2):91-5.
19. Cook DJ, Housmans PR, Rorie DK. Effect of ketamine HCl on norepinephrine disposition in isolated ferret ventricular myocardium. J Pharmacol Exp Ther. 1992;261(1):101-7.
20. Taylor P. Agentes que actúan en la unión neuromuscular y en los ganglios autónomos. En: Goodman & Gilman´s. The Pharmacological Basis of Therapeutics. 11 edición en español. Madrid: McGraw-Hill Interamericana Editores. 2007:217-36.
21. Green SM, Roback MG, Kennedy RM, Krauss B. Clinical practice guideline for emergency department ketamine dissociative sedation: 2011 update. Ann Emerg Med. 2011;57(5):449-61.
22. Wolff K, Winstock AR. Ketamine: from medicine to misuse. CNS Drugs. 2006;20(3):199-218.
23. Bovill JG. Intravenous anesthesia for the patient with left ventricular dysfunction. Semin Cardiothorac Vasc Anesth. 2006;10(1):43-8.
24. K o YY , Jeong YH, Lim DY. Influence of ketamine on catecholamine secretion in the perfused rat adrenal medulla. Korean J Physiol Pharmacol. 2008;12(3):101-9.
25. Anis NA, Berry SC, Burton NR, Lodge D. The dissociative anaesthetics, ketamine and phencyclidine, selectively reduce excitation of central mammalian neurones by N-methyl-aspartate. Br J Pharmacol. 1983;79(2):565-75.
26. K otermanski SE, Johnson JW. Mg2+ imparts NMDA receptor subtype selectivity to the Alzheimer's drug memantine. J Neurosci. 2009;29(9):2774-9.
27. Álvarez-Falconí PP. Ácido domoico e intoxicación amnésica por moluscos en salud pública. Rev Peru Med Exp Salud Publica. 2009;26(4):505-16.
28. Jerabek H, Pabst G, Rappolt M, Stockner T. Membrane-mediated effect on ion channels induced by the anesthetic drug ketamine. J Am Chem Soc. 2010;132(23):7990-7.
29. N oh HJ, Bae YM, Park SH, Kim JG, Kim B, Kim YS, et al. The vasodilatory effect of ketamine is independent of the N-methyl-D-aspartate receptor: lack of functional N-methyl-D-aspartate receptors in rat mesenteric artery smooth muscle. Eur J Anaesthesiol. 2009;26(8):676-82.
30. Seeman P, Guan HC, Hirbec H. Dopamine D2 (High) receptors stimulated by phencyclidines, lysergic acid diethylamide, salvinorin A, and modafinil. Synapse. 2009;63(8):698-704.
31. Li N, Lee B, Liu RJ, Banasr M, Dwyer JM, Iwata M, et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 2010;329(5994):959-64.
32. Hashimoto K. The role of glutamate on the action of antidepressants. Prog Neuropsychopharmacol Biol Psychiatry. 2010 Jun 20. [Publicación electrónica antes de la impresión].
33. Machado-Vieira R, Salvadore G, Diazgranados N, Zarate CA Jr.
Ketamine and the next generation of antidepressants with a rapid onset of action. Pharmacol Ther. 2009;123(2):143-50.34. Fell MJ, Katner JS, Johnson BG, Khilevich A, Schkeryantz JM, Perry KW, et al. Activation of metabotropic glutamate (mGlu)2 receptors suppresses histamine release in limbic brain regions following acute ketamine challenge. Neuropharmacology. 2010;58(3):632-9.
35. Sparr HJ, Jöhr M. [Succinylcholine--update]. Anaesthesist. 2002;51(7):565-75.
36. Callegari Morin A, Alvarez-Falconí PP. Posibles efectos en la presión arterial de diversas medicaciones preanestésicas en cirugía torácica. Rev Med Vallejiana. 2009;6(2):63-8.
Trabajo recibido el 10 de setiembre de 2010 y aceptado para publicación el 22 de abril de 2011.
Correspondencia:
Dr. Pedro P. Álvarez-Falconí
Cápac Yupanqui 1400
Lima 11, Perú
Correo: catecol@hotmail.com














