Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.72 n.3 Lima jul./set. 2011
ARTÍCULO DE REVISIÓN
La importancia de la ecografía a las 11+0 a 13+6 semanas de embarazo.
ActualizaciónImportance of ultrasound evaluation at 11+0 - 13+6 weeks of pregnancy. An update
Conny Nazario-Redondo1
; Jéssica Ventura-Laveriano1 ; Édgar Flores-Molina2 ; Walter Ventura, MD31 Médico Residente, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Médico Sub-especialista en Medicina Materno Fetal, Hospital de Gineco-Obstetricia Luis Castelazo Ayala, México DF.
Resumen
La evaluación ecográfica del primer trimestre (11+0 a 13+6 semanas) constituye actualmente una de las herramientas fundamentales en el manejo de toda paciente obstétrica. Es el mejor ejemplo de tamizaje en Obstetricia por medio del cálculo de riesgo de anormalidades cromosómicas y, sumado a ciertas características obstétricas y clínicas, se constituye en un potencial predictor de riesgo de las principales complicaciones obstétricas. Es nuestro objetivo presentar en forma resumida y simplificada los avances en este importante tópico de Medicina Fetal, con la finalidad de que sea reafirmada y asumida por todos los responsables del cuidado de la salud materno-fetal, incluyendo los padres.
Palabras clave: ecografía, primer trimestre, obstetricia.
Abstract
First trimester ultrasound scan (11+0 to 13+6 weeks) is currently one of the most important clinical tools in managing pregnant women and their fetuses. It represents the best example of screening in Obstetrics to assess risk for chromosomal abnormalities and combined with maternal and obstetrical characteristics could be a useful predictor of obstetrical complications. We aim to present comprehensive summary of this important topic in Fetal Medicine for people involved in providing maternal and perinatal care, i.e. obstetricians, midwives and parents.
Key words: ultrasound, first trimester, obstetrics.
INTRODUCCIÓN
La ecografía del primer trimestre del embarazo empezó a ser utilizada hace más de 35 años con la intención de medir la longitud cráneo-caudal (LCN) del feto y estimar la edad gestacional (1). Actualmente no solo se mide LCN sino también se evalúa una serie de detalles ecográficos entre las 11+0 y 13+6 semanas, con los siguientes objetivos principales:
-
Confirmar la ubicación intrauterina del embarazo
-
Confirmar la viabilidad fetal
-
Determinar el número de fetos y corionicidad en caso de embarazos múltiples
-
Determinar la edad gestacional
-
Evaluación de marcadores de anormalidades cromosómicas
-
Valoración de la anatomía fetal, para excluir anormalidades mayores
-
Valoración Doppler de las arterias uterinas para determinar riesgo de pre-eclampsia
-
Medición de la longitud cervical como potencial predictor de parto pretérmino.
Haremos una breve descripción de estas indicaciones.
Confirmación del embarazo intrauterino
Durante los últimos 25 años, la incidencia de embarazo ectópico se ha incrementado progresivamente, mientras la morbilidad y mortalidad asociada ha disminuido sustancialmente (2). Esto es debido principalmente al diagnóstico temprano y la evidencia a favor de manejos mínimamente invasivos (i.e. laparoscopia) o no invasivos (i.e. manejo expectante, manejo médico). La ecografía entre las 11+0 y 13+6 semanas nos permite confirmar la presencia del embarazo intrauterino o determinar su localización en caso de tratarse de un embarazo ectópico. Si bien la ecografía transvaginal convencional puede detectar confiablemente un embarazo viable intrauterino a las 6 y 7 semanas (3), no debe ser realizada en forma rutinaria para tamizar embarazo ectópico a esta edad gestacional, por el alto número de falsos positivos que requerirán después evaluaciones innecesarias y porque definitivamente no ha demostrado ser costo efectiva (4). Dado que la forma común de presentación de un embarazo ectópico es sangrado vaginal o dolor abdominal, la ecografía temprana solo debe ser realizada ante este escenario clínico o tras la identificación de otros factores de riesgo.
Confirmar la viabilidad fetal
Igualmente, no existen evidencias actuales que hagan necesaria una evaluación temprana de la viabilidad del producto. La mayoría de anormalidades cromosómicas severas no evolucionarán y se harán clínicamente evidentes bajo la forma de abortos espontáneos, los cuales pueden ser manejados de la forma estándar. En un estudio prospectivo de viabilidad fetal entre las 6 a 10 semanas, los únicos factores relacionados con pérdida fetal fueron edad materna avanzada, hábito de fumar y sangrado vaginal (5). Adicionalmente, encontraron un menor diámetro del saco gestacional y bradicardia fetal; sin embargo, debido al alto número de falsos positivos en estos casos, no se recomienda la evaluación ecográfica de rutina antes de las 11 semanas.
Determinar el número de fetos y corionicidad
El embarazo múltiple es cada vez más frecuente, debido a que nuestra población de mujeres tiende a postergar su embarazo (6) y a que las técnicas de reproducción son cada vez más accesibles a la población. La incidencia actual de embarazo múltiple es de 1 a 2% (7). Su seguimiento y manejo de las complicaciones plantean serios retos en nuestra práctica. De 1 a 2% de las gestaciones bicoriales va hacia muerte perinatal, mientras lo propio ocurre en 3 a 4% de las gestaciones monocoriales (8). El 20% de las gestaciones monocoriales desarrolla transfusión feto-fetal y de estas, 50% presentará la forma más grave, que ameritará tratamiento (9). Por lo que, la determinación de la corionicidad definirá el futuro, manejo y pronóstico de un embarazo múltiple. La determinación de la corionicidad entre las 11 y 13 semanas es sencilla y confiable, alcanzando una sensibilidad y especificidad de casi 100% (10). Sin embargo, el diagnóstico en el segundo y tercer trimestre es inexacto, por lo que no se debe dejar pasar la oportunidad de evaluar la corionicidad y etiquetar el embarazo de aquí en adelante. El signo de lambda λ indica que la gestación es dicoriónica y el signo de la T invertida hace el diagnóstico de monocoriónicodiamniótico (10). Adicionalmente, la ecografía del primer trimestre puede identificar marcadores de riesgo para transfusión feto-fetal (i.e. discordancia de translucencia nucal de 20%) (11). Excepcionalmente, se puede diagnosticar complicaciones severas en embarazos múltiples de mayor orden, como lo publicamos recientemente (12).
Determinar la edad gestacional
La determinación de la edad gestacional clásicamente fue basada en el número de semanas de amenorrea, la cual fija como criterios absolutos ciclos regulares de 28 días, no dudas en la fecha exacta y no uso de anticonceptivos por lo menos tres meses previos (13). Sin embargo, solo 50% cumple con estos criterios, por lo que la determinación actual de la edad gestacional debe hacerse en base a la ecografía del primer trimestre o ser confirmada con esta última. El momento más exacto y confiable para determinar la edad gestacional es entre las 8 y 12 semanas (14). La evaluación ecográfica del primer trimestre incluye la medida de LCN (figura 1), que es el método más exacto para la estimación de la edad gestacional (15).
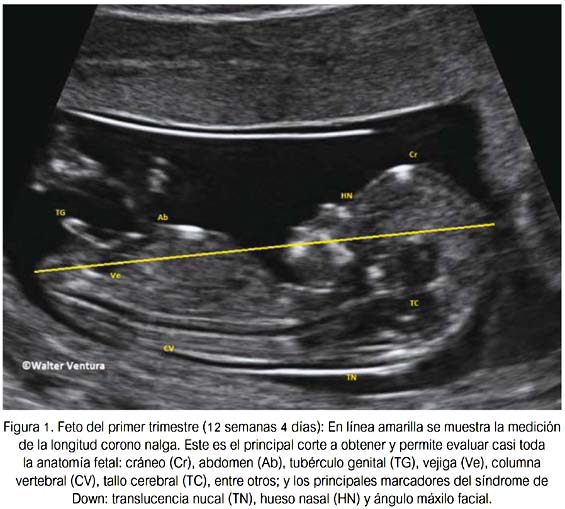
Evaluación de marcadores de anormalidades cromosómicas
En 1866, Langdon Down describió ciertas características fenotípicas comunes en pacientes con trisomía 21 (síndrome de Down): piel redundante, nariz pequeña y cara plana (16) . Son estas características las que pueden ser visualizadas en la ecografía del primer trimestre por medio de la translucencia nucal (TN), la hipoplasia del hueso nasal y el ángulo máxilo-facial, respectivamente (figura 2). Asimismo, es conocido que casi el 50% de infantes portadores de síndrome de Down tiene alguna cardiopatía asociada (17), por lo que la valoración de la función cardiaca a través de marcadores como el flujo tricuspídeo (18), el ductus venoso (19) y la frecuencia cardiaca fetal (20) también constituyen importantes marcadores en su evaluación.
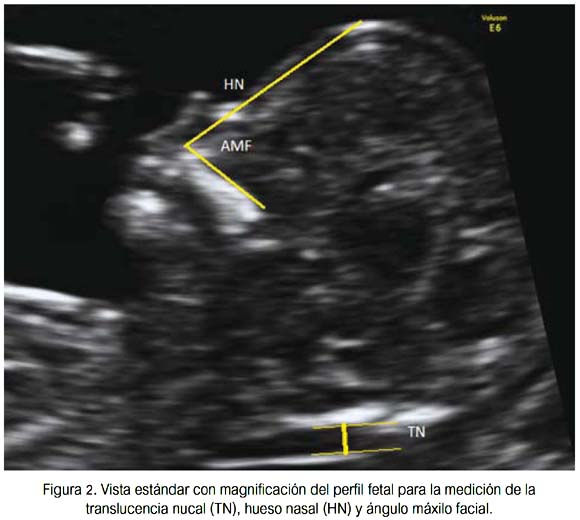
El diagnóstico prenatal de fetos con síndrome de Down es posible en la mayoría de hospitales de referencia. Es llevado a cabo por medio de la biopsia de las vellosidades coriales o de amniocentesis, las cuales buscan células fetales para la realización del cariotipo.
Clásicamente, se suele comunicar una tasa de pérdida de 1%. Sin embargo, la tasa de pérdidas fetales ocasionada por la invasión de la placenta o cavidad amniótica es dependiente de la técnica del procedimiento, debiendo cada centro tener su propia estadística de acuerdo al número de procedimientos anuales y al personal involucrado en su realización. Debido a este número indeseado de pérdidas, una prueba de tamizaje con buen nivel de detección y un menor número de falsos positivos es crucial. La translucencia nucal y los otros marcadores son el mejor método de tamizaje para este propósito y han cambiado nuestra práctica obstétrica en los últimos 20 años.
El tamizaje de fetos con síndrome de Down empezó en la década de los 70, teniendo como único criterio edad materna mayor de 35 años para proceder a la prueba invasiva. Sin embargo, la tasa de detección lograda con este criterio solo permitirá diagnosticar 30% de fetos afectos. En la década de los 80, se añadió ciertos marcadores bioquímicos en plasma materno durante el segundo trimestre (alfa fetoproteína, subunidad β de la hormona gonadotropina coriónica y estriol), mejorándose la tasa de detección a 50 y 70%. La década de los 90 fue crucial para el futuro del tamizaje de fetos con síndrome de Down. En 1990, se informó por primera vez la asociación de la colección del fluido nucal en fetos del primer trimestre y el síndrome de Down (21). Simultáneamente, Nicolaides, en su centro pionero de Medicina Fetal del Kings College Hospital empieza a colectar la serie más grande de fetos del primer trimestre y denomina translucencia nucal (TN) a esa colección de fluido en la nuca, reportando mayor número de casos de T21 en fetos con TN aumentada (22). Gracias a sus trabajos, actualmente medimos la translucencia nucal y sabemos qué riesgo representa cada medida. Por primera vez en Obstetricia convertimos una apreciación subjetiva en un número y este número representa un riesgo diferente para cada paciente, dándole la oportunidad de interpretar ese riesgo al personal de salud y a los padres, quienes al final deben tomar la decisión tras un asesoramiento objetivo y conociendo todas las opciones de manejo. Así por ejemplo, hoy sabemos que combinando la edad materna con la TN obtenemos una tasa de detección de 75% y una tasa de falsos positivos de 10% (23). Si a esto agregamos marcadores bioquímicos, como gonadotropina coriónica beta (β-hCG) y proteína plasmática A asociada al embarazo (PAPP-A), la tasa de detección es de 90% y la tasa de falsos positivos de 5% (24). Si a esto le agregamos los otros marcadores, la tasa de detección puede ser tan alta como de 97% y la tasa de falsos positivos tan bajas como 2,5% (25). Esta herramienta de tamizaje no solo nos permite detectar fetos con T21, sino también fetos con T13, T18, 45X0, entre otras aneuploidías (25). Sin embargo, aún se sigue trabajando para mejorar las tasas de detección y reducir el número de falsos positivos. Probablemente, el futuro del tamizaje o diagnóstico prenatal de anormalidades cromosómicas está en aislar material genético fetal libre en sangre materna. En los últimos años se viene usando el ADN fetal libre que circula en sangre materna para casos puntuales, como determinar el estado Rhesus (Rh) del feto en aquellos casos de riesgo de isoinmunización (26). Sin embargo, había ciertas limitaciones metodológicas que no hacían posible lograr tasas altas de detección para fetos con T21. Este año se ha publicado una nueva metodología que permite obtener tasas de detección muy altas de casi 100% procesando específicamente regiones diferenciadas metiladas de ADN fetal. Su uso extensivo en la práctica clínica necesita ser probado en estudios más grandes, evaluándose además factibilidad y accesibilidad de este promisorio método.
Valoración de la anatomía fetal
La anatomía fetal clásicamente se revisa entre las 18 y 23 semanas. Este es el mejor momento para valorar la anatomía fetal y descartar la mayoría de patologías severas y el segundo momento para buscar marcadores de cromosomopatías, así como discutir la opción de una prueba invasiva. Sin embargo, en centros donde se hace rutinariamente este examen la tasa de detección de anormalidad estructural es de 50 a 60% (27). Si el mismo examen es llevado a cabo en un centro de referencia, la tasa de detección puede llegar hasta 90% (28). La evaluación de la morfología fetal puede hacerse más temprano, a las 16 o 18 semanas en casos indicados. Actualmente, la anatomía fetal puede ser evaluada en el primer trimestre, con tasas de detección hasta del 100% para los casos de acrania, holoprosencefalia alobar, onfalocele, gastrosquisis, entre otros, 30% para el caso de anormalidades cardiacas mayores y 5% para defectos faciales (29). Asimismo, puede evaluarse tempranamente marcadores de patología estructural severa que ayuden a referir las pacientes a centros de mayor experiencia. El principal marcador en el primer trimestre es la translucencia nucal, y debe orientar a la búsqueda de patología estructural -principalmente cardiaca-, después de haberse descartado cromosomopatía (30). Otros marcadores actuales son la evaluación del tronco cerebral (31) o translucencia intracraneal (32) para tamizar defectos del tubo neural, y la evaluación del triangulo retronasal para tamizar defectos de paladar (33). A pesar de no existir el amparo legal para la terminación del embarazo en nuestro país, nuestro deber es estar actualizados, proporcionar un adecuado diagnóstico a proporcionar a la pareja y darle la oportunidad a la madre de saber si está portando un feto sano, con un defecto incompatible con la vida o con riesgo de hándicap severo.
Valoración doppler de las arterias uterinas para determinar riesgo depreeclampsia
La preeclampsia afecta a 2% de las gestantes y es causa principal de morbimortalidad materna y perinatal (34). En nuestros países, su incidencia suele ser mayor, llegando hasta el 4,8% (35). Su etiología es aún desconocida, pero está claro que el deterioro en la placentación es el evento fisiopatológico clave en la preeclampsia, por lo que la valoración de la función placentaria en el primer trimestre por medio de la flujometría Doppler de las arterias uterinas y/o biomarcadores en plasma materno producidos por la placenta constituye herramienta importante de predicción. La medición del índice de pulsatilidad de las arterias uterinas de acuerdo a la metodología estándar (36) es sencilla y reproducible y debe ser evaluada en todas nuestras gestantes. Recientemente, se ha descrito que combinando las características clínicas obstétricas -el Doppler de las arterias uterinas y biomarcadores específicos como proteína plasmática A asociada al embarazo (PAPP-A) y factor de crecimiento placentario (PlGF)- se puede lograr una tasa de detección de preeclampsia de presentación temprana (i.e. antes de las 34 semanas) hasta de 91%, con una tasa de falsos positivos de 5% (37).
Medición de la longitud cervical como potencial predictor de parto pretérmino
En países desarrollados, el parto pretérmino es responsable de 75% de todas las muertes neonatales y de más de 50% de hándicap neurológico en niños (38). Si bien el parto pretérmino es considerado el nacimiento antes de las 37 semanas, el gran problema perinatal está concentrado en infantes nacidos antes de las 34 semanas. En la actualidad, el único método que ha demostrado ser efectivo en el tamizaje de parto pretérmino antes de las 34 semanas es la medición de la longitud cervical por ecografía transvaginal, entre las 20 a 24 semanas, y que combinado con ciertas características clínicas obstétricas puede detectar hasta 50% de estos casos (39). Por otro lado, dado que el cérvix en el segundo trimestre debería tener la misma longitud que en el primer trimestre, la evidencia preliminar señala que la medición del cérvix en el primer trimestre puede ser un importante predictor de parto pretérmino espontáneo antes de las 34 semanas (40). Asimismo, nosotros encontramos que la combinación de características clínicas y obstétricas, independientemente de los biomarcadores, ha demostrado ser útil en la predicción de parto pretérmino (41). Queda aún por determinar si la longitud cervical, en el primer trimestre, integrado a nuestro modelo matemático mejora la tasa de predicción de parto pretérmino, con lo cual tendríamos una herramienta temprana de tamizaje y se podría empezar a ensayar tratamientos alternativos para la prevención del parto pretérmino.
CONCLUSIÓN
Sin bien el objetivo del presente documento es remarcar la importancia de la ecografía en el primer trimestre, la evaluación de nuestra paciente gestante no se limita a una valoración ecográfica, sino más bien es una evaluación que integra clínica, ecografía y bioquímica, con la finalidad de señalar el camino que lleva del embarazo, determinando el número de visitas futuras y evaluaciones posteriores, anticipándonos a posibles complicaciones, que en un futuro próximo deben de tener prevención. Esta primera visita debiera llamarse valoración obstétrica del primer trimestre a ser llevada a cabo entre las 11+0 y las 13+6 semanas; será realizada por personal capacitado en el entendimiento de la fisiología y patología obstétrica y de ninguna manera debe estar limitada a la evaluación ecográfica. Esto es denominado Medicina Fetal, la práctica de una nueva subdisciplina de la Obstetricia, que cuenta con tamizaje, diagnóstico, tratamiento y prevención. Este enfoque de valoración obstétrica del primer trimestre comprende mayores tópicos que traspasan los objetivos de esta primera publicación. Todo embarazo está expuesto a sufrir complicaciones. Sin embargo, existen ciertos datos clínicos, ecográficos y biomarcadores que modifican la posibilidad de presentar problemas específicos. Creemos que quedaron atrás los tiempos de clasificar a la paciente en simplemente de riesgo bajo y alto, de acuerdo a los antecedentes. Integremos ahora las herramientas disponibles y determinemos el riesgo verdadero de nuestra gestante en una primera visita integral.
REFERENCIAS BIBLIOGRÁFICAS
1. Robinson HP, Fleming JE.
A critical evaluation of sonar "crown-rump length" measurements. Br J Obstet Gynecol.1975;82(9):702-10.2. Centers for Disease Control and Prevention. Ectopic pregnancy - United States, 1990-1992. MM WR Morb Mortal Wkly Rep.1995;44:46-8.
3. Bottomley C, Van Belle V, Mukri F, Kirk E, Van Huffel S, Timmerman D, et al. The optimal timing of an ultrasound scan to assess the location and viability of an early pregnancy. Hum Reprod. 2009;24(8):1811-7.
4. Mol BW, van der Veen F, Bossuyt PM . Symptom-free women at increased risk of ectopic pregnancy: should we screen? Acta Obstet Gynecol Scand. 2002;81(7):661-72.
5. Makrydimas G, Sebire NJ, Lolis D, Vlassis N, Nicolaides KH. Fetal loss following ultrasound diagnosis of a live fetus at 6-10 weeks of gestation. Ultrasound Obstet Gynecol. 2003;22(4):368-72.
6. Ventura W, Ayala F, Ventura J. Embarazo después de los 40 años: Características epidemiológicas. Rev Per Ginecol Obstet. 2005;51(1):49-52.
7. Gielen M, van Beijsterveldt CE, Derom C, Vlietinck R, Nijhuis JG, Zeegers MP , et al. Secular trends in gestational age and birthweight in twins. Hum Reprod. 2010;25(9):2346-53.
8. Sebire NJ, Snijders RJ, Hughes K, Sepulveda W, Nicolaides KH. The hidden mortality of monochorionic twin pregnancies. Br J Obstet Gynaecol. 1997;104(10):1203-7.
9. Lewi L, Van Schoubroeck D, Gratacos E, Witters I, Timmerman D, Deprest J. Monochorionic diamniotic twins: complications and management options. Curr Opin Obstet Gynecol. 2003;15(2):177-94.
10. Dias T, Arcangeli T, Bhide A, Napolitano R, Mahsud-Dornan S, Thilaganathan B. First-trimester ultrasound determination of chorionicity in twin pregnancy. Ultrasound Obstet Gynecol. 2011 31 ene. doi: 10.1002/uog.8956. [Publicación electrónica antes de la impresión].
11. Kagan KO, Gazzoni A, Sepulveda-Gonzalez G, Sotiriadis A, Nicolaides KH. Discordance in nuchal translucency thickness in the prediction of severe twin-to-twin transfusion syndrome. Ultrasound Obstet Gynecol. 2007;29(5):527-32.
12. Ventura W, Nazario C, Ventura J. Triplet pregnancy complicated by two acardiac fetuses. Ultrasound Obstet Gynecol. 2011 21 mar. doi: 10.1002/ uog.9001. [Publicación electrónica antes de la impresión].
13. Kramer MS , McLean FH, Boyd ME, Usher RH. The validity of gestational age estimation by menstrual dating in term, preterm, and postterm gestations. JAMA. 1988;260(22):3306-8.
14. Bottomley C, Bourne T. Dating and growth in the first trimester. Best Pract Res Clin Obstet Gynaecol. 2009;23(4):439-52.
15. Wisser J, Dirschedl P, Krone S. Estimation of gestational age by transvaginal sonographic measurement of greatest embryonic length in dated human embryos. Ultrasound Obstet Gynecol. 1994;4(6):457-62.
16. Down LJ. Observations on an ethnic classification of idiots. 1866. Ment Retard. 1995;33(1):54-6.
17. Freeman SB , Taft LF, Dooley KJ, Allran K, Sherman SL, Hassold TJ, et al. Population-based study of congenital heart defects in Down syndrome. Am J Med Genet. 1998;80(3):213-7.
18. Falcon O, Faiola S, Huggon I, Allan L, Nicolaides KH. Fetal tricuspid regurgitation at the 11 + 0 to 13 + 6-week scan: association with chromosomal defects and reproducibility of the method. Ultrasound Obstet Gynecol. 2006;27(6):609-12.
19. Matias A, Huggon I, Areias JC, Montenegro N, Nicolaides KH. Cardiac defects in chromosomally normal fetuses with abnormal ductus venosus blood flow at 10-14 weeks. Ultrasound Obstet Gynecol. 1999;14(5):307-10.
20. Liao AW, RS , Snijders R, Spencer K, Nicolaides KH. Fetal heart rate in chromosomally abnormal fetuses. Ultrasound Obstet Gynecol. 2000;16(7):6110-3.
21. Szabo J, Gellen J. Nuchal fluid accumulation in trisomy-21 detected by vaginosonography in first trimester. Lancet. 1990;336(8723):1133.
22. Nicolaides KH, Azar G, Byrne D, Mansur C, Marks K. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregnancy. BM J. 1992;304(6831):867-9.
23. Snijders RJ, Johnson S, Sebire NJ, Noble PL, Nicolaides KH. First-trimester ultrasound screening for chromosomal defects. Ultrasound Obstet Gynecol. 1996;7(3):216-26.
24. Nicolaides KH. Screening for chromosomal defects. Ultrasound Obstet Gynecol. 2003;21(4):313-21.
25. Kagan KO, Wright D, Valencia C, Maiz N, Nicolaides KH. Screening for trisomies 21, 18 and 13 by maternal age, fetal nuchal translucency, fetal heart rate, free beta-hCG and pregnancy-associated plasma protein-A. Hum Reprod. 2008;23(9):1968-75.
26. Bianchi DW, Avent ND, Costa JM, van der Schoot CE. Noninvasive prenatal diagnosis of fetal Rhesus D: ready for Prime(r) Time. Obstet Gynecol. 2005;106(4):841-4.
27. Grandjean H, Larroque D, Levi S. The performance of routine ultrasonographic screening of pregnancies in the Eurofetus Study. Am J Obstet Gynecol. 1999;181(2):446-54.
28. VanDorsten JP, Hulsey TC, Newman RB , Menard MK. Fetal anomaly detection by second-trimesterultrasonography in a tertiary center. Am J Obstet Gynecol. 1998;178(4):742-9.
29. Syngelaki A, Chelemen T, Dagklis T, Allan L, Nicolaides KH. Challenges in the diagnosis of fetal non-chromosomal abnormalities at 11-13 weeks. Prenat Diagn. 2011;31(1):90-102.
30. Hyett J MG, Papapanagiotou G. Abnormalities of the heart and great arteries in chromosomally normal fetuses with increased nuchal translucency thickness at 11-13 weeks of gestation. Ultrasound Obstet Gynecol. 1996;7(4):245 - 50.
31. Lachmann R, Chaoui R, Moratalla J, Picciarelli G, Nicolaides KH. Posterior brain in fetuses with open spina bifida at 11 to 13 weeks. Prenat Diagn. 2011;31(1):103-6.
32. Chaoui R, Nicolaides KH. From nuchal translucency to intracranial translucency: towards the early detection of spina bifida. Ultrasound Obstet Gynecol. 2010;35(2):133-8.
33. Sepulveda W, Wong AE, Martinez-Ten P, Perez- Pedregosa J. Retronasal triangle: a sonographic landmark for the screening of cleft palate in the first trimester. Ultrasound Obstet Gynecol. 2010;35(1):7- 13.
34. WHO. Make Every Mother and Child Count. World Health Report, 2005 Geneva, Switzerland: World Health Organization.
35. Conde-Agudelo A, Belizan JM.
Risk factors for pre-eclampsia in a large cohort of Latin American and Caribbean women. Br J Obstet Gynecol. 2000;107(1):75-83.36. Martin AM, Bindra R, Curcio P, Cicero S, Nicolaides KH. Screening for pre-eclampsia and fetal growth restriction by uterine artery Doppler at 11-14 weeks of gestation. Ultrasound Obstet Gynecol. 2001;18(6):583-6.
37. Akolekar R, Syngelaki A, Sarquis R, Zvanca M, Nicolaides KH. Prediction of early, intermediate and late pre-eclampsia from maternal factors, biophysical and biochemical markers at 11-13 weeks. Prenat Diagn. 2011; 31(1):66-74.
38. CMACE. Perinatal Mortality 2008: United Kingdom. CMACE : London. 2010.
39. Celik E, To M, Gajewska K, Smith GC, Nicolaides KH. Cervical length and obstetric history predict spontaneous preterm birth: development and validation of a model to provide individualized risk assessment. Ultrasound Obstet Gynecol. 2008;31(5):549-54.
40. Greco E, Lange A, Ushakov F, Calvo JR, Nicolaides KH. Prediction of spontaneous preterm delivery from endocervical length at 11 to 13 weeks. Prenat Diagn. 2011;31(1):84-9.
41. Beta J, Akolekar R, Ventura W, Syngelaki A, Nicolaides KH. Prediction of spontaneous preterm delivery from maternal factors, obstetric history and placental perfusion and function at 11-13 weeks. Prenat Diagn. 2011;31(1):75-83.
Trabajo recibido el 5 de julio de 2011 y aceptado para publicación el 25 de julio de 2011.
Financiamiento: La presente revisión no requirió de financiamiento.
Conflicto de interes: Ningún conflicto de interés de parte de los autores.
Correspondencia:
Walter Ventura, MD
Harris Birthright Research Centre for Fetal Medicine, Kings College Hospital London, United Kingdom
Correo electrónico: walterichard@hotmail.com














