Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.73 no.1 Lima Jan./Mar. 2012
SECCIÓN ESPECIAL DE MEDICINA TROPICAL
Virus sincicial respiratorio: presentación, manejo y prevención de un brote intrahospitalario en una unidad de cuidados intensivos neonatales de Lima
Respiratory syncytial virus: presentation, treatment and prevention of a neonatal intensive care unit outbreak in Lima
Paredes T1 ; Velásquez C2 ; Sánchez E3
1 Médico Jefe, Servicio de Cuidados Intensivos Neonatales, Instituto Nacional Materno Perinatal, Lima, Perú.
2 Médico Pediatra, Departamento de Neonatología, Instituto Nacional Materno Perinatal, Lima, Perú.
3 Enfermera Jefe, Servicio de Cuidados Intensivos Neonatales, Instituto Nacional Materno Perinatal, Lima, Perú.
Resumen
El virus sincicial respiratorio (VSR) es el principal patógeno causante de infecciones del tracto respiratorio bajo durante el primer año de vida y ocasiona un elevado índice de hospitalización en niños menores de 12 meses; la presentación clínica severa y su aparición como brotes epidemiológicos en las unidades con recién nacidos prematuros representa un riesgo elevado de morbimortalidad. Se realiza la presentación de dos casos y el análisis sobre la importancia del diagnóstico precoz, el manejo individualizado y las medidas de control de infecciones como factores que reducen la morbimortalidad en estas situaciones y previenen la diseminación de los casos en una unidad de cuidados intensivos neonatales (UCIN).
Palabras clave: Virus sincicial respiratorio, infecciones del tracto respiratorio bajo, niños prematuros hospitalizados.
Abstract
Respiratory syncytial virus (RSV) is the main pathogen causing lower respiratory tract infections during the first year of life and causes high rate of hospitalizations in children under 12 months. Its clinical presentation and emergence as severe outbreaks in preterm units represents high risk of morbidity and mortality. Two cases are presented and analysis of importance of early diagnosis, ventilatory management and hygienic measures is done in order to reduce hospitalization and prevent presentation of new cases in a Lima, Perus neonatal intensive care unit.
Key words: Respiratory syncytial virus, lower respiratory tract infections, hospitalized premature children.
INTRODUCCIÓN
El virus sincicial respiratorio (VSR) es un mixovirus RNA, del género Pneumovirus, que pertenece a la familia de los Paramyxoviridae. Desde el punto de vista antigénico, hay dos grupos virales bien definidos, denominados A y B, con una capacidad antigénica de 50% para el grupo A, variabilidad en la secuencia de aminoácidos de 20% y tasa de mutación de 0,25% anual para la proteína completa, lo que determina la posibilidad de circulación de cepas idénticas en distintas partes del mundo produciendo epidemias comunitarias. El VSR fue recuperado por primera vez en 1956, por J.A. Morris, de un chimpancé, durante una epidemia de coriza en una colonia de animales (1) y, en 1957, Chanock y col. realizaron el aislamiento del virus en dos niños con neumonía (2). El VSR tiene 90 a 120 nm de diámetro, se transmite por contacto con material infectado (superficies de cunas, manos o ropa del personal de salud, entre otros) y la transmisión por aerosoles parece no ser la vía principal. La distribución mundial, por lo general, produce epidemias estacionales en invierno y al inicio de la primavera, con regularidad prácticamente cronométrica en amplias zonas del hemisferio norte y sur y con una afectación que puede llegar al 50% de los lactantes. La infección por el VSR produce alrededor de 100 000 hospitalizaciones por año en EE UU; la mayor parte ocurre en lactantes menores de un año (3-7). A nivel mundial, el VSR está asociado a una mortalidad anual entre 160 000 y 600 000 pacientes y los neonatos son los más susceptibles a complicaciones severas, como neumonías y apneas (8).
En la población neonatal existe una subpoblación de riesgo alto para adquirir el VSR y desarrollar infecciones severas, como el grupo de prematuros, principalmente si cursan con displasia broncopulmonar, cardiopatías y estados de inmunodepresión. En estos grupos, la mortalidad por infección por VSR puede llegar al 5%, aún en países industrializados (9).
Adicionalmente, se ha comunicado en numerosas publicaciones la aparición de brotes nosocomiales dentro de las unidades de hospitalización neonatal, luego del ingreso de pacientes con infecciones severas por VSR o por infecciones adquiridas durante la hospitalización (10-13). Estos brotes se asocian con el quiebre de las normas de prevención de infecciones nosocomiales y la necesidad de un mayor grado de intervención que requieren los pacientes con infecciones severas, que en un alto porcentaje necesita asistencia ventilatoria e intervenciones frecuentes a cargo del personal asistencial del servicio.
El objetivo del reporte de los casos es presentar las características clínicas más frecuentes de la infección por VSR en prematuros y revisar las recomendaciones vigentes para prevenir la aparición de brotes nosocomiales en las unidades de cuidados intensivos neonatales (UCIN).
REPORTE DE CASOS
Caso 1
Paciente de sexo masculino, ingresa por emergencia el 25/3/11 a los 34 días de vida, con un tiempo de enfermedad de un día caracterizado por alza térmica, hipoactividad, succión lenta, episodios de apnea frecuentes y cianosis perioral; la saturación de O2 fue 85%, temperatura 36ºC, presión arterial media 37 mmHg. Al examen clínico presentó mal estado general, hipoactividad, palidez de piel, tiraje intercostal, murmullo vesicular disminuido en hemitórax izquierdo, poco reactivo a estímulos, e hipotonía. El paciente ingresó a UCIN para asistencia respiratoria.
Tenía antecedentes de peso al nacer 1 840 gramos, edad gestacional de 31 semanas, con diagnóstico de recién nacido pretérmino y sepsis temprana. No requirió surfactante ni ventilación mecánica. Recibió tratamiento antibiótico y soporte nutricional durante su hospitalización de 31 días.
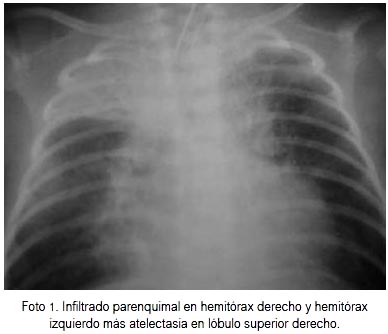
Análisis de gases arteriales (AGA) al ingreso: pH 7,4, p02 91,8, pC02 36, HC03 21,6, exceso de gases -2,7; sodio 145, potasio 3,7, hemoglobina 11 g/ dL. Hemograma (25-03-11): leucocitos 22 840/mL, abastonados 1%, segmentados 55%, linfocitos 41%, mielocitos 3%, hemoglobina 11,2, plaquetas 503 000. Proteína C reactiva 1,8 mg/L. Hemocultivo negativo. El paciente se mantuvo febril en forma intermitente los tres primeros días. Al tercer día de reingreso se confirmó la infección por VSR (inmunofluorescencia indirecta de hisopado nasofaríngeo). Cursó con evolución tórpida, con requerimiento de ventilación mecánica por atelectasias a repetición e incremento de la extensión del infiltrado parenquimal pulmonar. La evolución de las radiografías de tórax fue de infiltrado intersticial bilateral (25 y 26-03-11), infiltrado parenquimal en hermitórax derecho (HTD) + atelectasia lóbulo superior derecho (LSD) (28-03-11), infiltrado parenquimal en HTD y HTI + atelectasia LSD (30-03-11) (ver foto 1), infiltrado parenquimal difuso por auscultación cardiopulmonar (02-04-11), infiltrado parenquimal en disminución + atelectasia LSD (07-04-11), signos de atrapamiento de aire, infiltrados parenquimales en disminución, atelectasia LSD resuelta (09-04-11). El paciente recibió tratamiento antibiótico con meropenem y vancomicina hasta el 04-04-11. Se realizó extubación el 15º día de reingreso, pasó a 02 por CBN y entrenamiento de la succión. Salió de alta a los 22 días del reingreso.
Caso 2
Paciente de sexo masculino, ingresa por emergencia el 29/3/11 a los 39 días de vida, con un tiempo de enfermedad de tres días caracterizado por rinorrea acuosa, estornudos. Luego de 24 horas presenta hipoactividad, succión pobre, tendencia al sueño, tos exigente y vómitos. Al examen físico de reingreso muestra temperatura 36,6º C, frecuencia respiratoria 64 x minuto, frecuencia cardiaca 140 x minuto, saturación 95%, piel terrosa, llenado capilar normal, fontanela normotensa, patrón respiratorio superficial con CBN. Tiraje intercostal, murmullo vesicular. Auscultación cardiopulmonar: ritmo cardiaco regular, de buena intensidad, no soplos. Abdomen: portador de colostomía. Ruidos hidroaéreos normales.
Tenía como antecedentes peso de nacimiento 1 712 gramos, talla 41 cm, edad gestacional 34 semanas, Ápgar 6 al minuto y 8 a los 5 minutos, con diagnósticos previos de prematuridad, sepsis temprana, enterocolitis necrotizante (NEC) III b (que requirió colostomía), colestasis hepática, anemia, sepsis tardía con hemocultivo positivo. Recibió tratamiento antibiótico con ampicilina y gentamicina, luego meropenem y metronidazol. Requirió ventilación mecánica post cirugía NEC, nutrición parenteral prolongada. Salió de alta a los 36 días de vida del Servicio de Cuidados intermedios.
Ingresó a UCIN a presión continua vía aérea (CPAP) nasal, pero presentó episodios de apnea y patrón respiratorio superficial, por lo que se realizó intubación y fue colocado en asistencia respiratoria. Se indicó tratamiento antibiótico con meropenem por sospecha de sepsis tardía y meningoencefalitis.
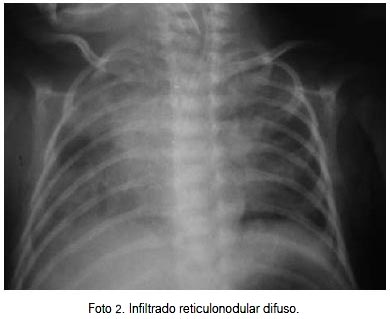
AGA: pH 7,38, pC02 46,1, P02 38,3, HC03 26,9. Radiografía de tórax mostró radio opacidad en tercio superior de HTD, infiltrado reticulonodular difuso (29-03-11) (foto 2). Líquido cefalorraquídeo normal, cultivo negativo. Al segundo día se realizó confirmación por IFI positivo a virus respiratorio sincicial. AGA: hipercapnea permisiva. Se indicó transfusión de paquete globular por anemia (Hb 9,8). Se mantuvo en ventilación mecánica. AGA: pH 7,277, p02 68,6, pC02 54,6, HC03 24,9, EB -2,2. Al tercer día de reingreso, radiografía de tórax con infiltrado parenquimal difuso, con áreas hiperventiladas, atelectasia LSD. Se mantuvo con ventilación mecánica, tratamiento antibiótico con meropenem por siete días, inhaloterapia, fisioterapia respiratoria, nutrición enteral en progreso. Hemocultivo negativo. Al octavo día de reingreso se realizó extubación y pasó a CPAP nasal por 48 horas y posteriormente no requirió oxígeno suplementario. Se indicó el alta a los 11 días de reingreso.
DISCUSIÓN
Los neonatos prematuros se encuentran muy susceptibles de desarrollar infecciones por VSR, entre otros factores debido a que existe una elevada proporción de neonatos prematuros que permanecen hipogammaglobulinémicos a los 6 meses de edad; y aún en los recién nacidos a término sanos se ha determinado una reducción de los niveles de anticuerpos maternos específicos para el VSR durante un periodo de 6 meses (14). Muchos estudios sugieren que los anticuerpos maternos IgG específicos para VSR ofrecen protección para formas severas de la enfermedad en los infantes a término durante los primeros meses de vida y ayudan a explicar la razón por la que los infantes prematuros tienen un riesgo alto de enfermedad severa (15).
El rápido diagnóstico de infección por VSR en neonatos es muy importante para su manejo, ya que permite incluir la posibilidad de un adecuado aislamiento y medidas de cohorte para prevenir la diseminación nosocomial y comunitaria; hace posible evaluar la necesidad del uso adecuado de antibióticos y las intervenciones de salud pública en situaciones de predominio estacional con agentes de costo alto, como el palivizumab, así como la identificación de complicaciones únicas de este virus (16).
Las infecciones nosocomiales son particularmente una preocupación en la población neonatal, donde el VSR puede presentarse atípicamente, generando confusión con otras etiologías. Las infecciones nosocomiales son más severas que las adquiridas en la comunidad por VSR. Aproximadamente 50% de niños con infecciones nosocomiales por VSR requiere internamiento en UCIN, mientras que solo 9% de las adquiridas en la comunidad. La ventilación mecánica es requerida en 2 a 10% de pacientes con infecciones adquiridas en el hospital y la mortalidad en los pacientes con infecciones comunitarias es casi inexistente, mientras que la mortalidad en pacientes con infección nosocomial por VSR es elevada (13).
La transmisión nosocomial puede ser atenuada con la identificación temprana del VSR y el aislamiento del paciente. El VSR se transmite a través del contacto directo con secreciones infectadas, pero no tiene transmisión por aerosoles de partículas pequeñas (17). La replicación viral ocurre dentro del epitelio respiratorio. La sobrevida del virus extracorporal se encuentra en alrededor de 12 horas; por ejemplo, la superficie de mesas pueden permanecer contaminadas por siete horas. La exposición al virus está claramente correlacionada con riesgo de transmisión. El periodo de incubación es de 5 a 8 días.
Considerando que el personal hospitalario es el factor más importante de diseminación del VSR, mediante la transmisión del virus en sus manos, llegando a infectarse ellos mismos mediante la autoinoculación de sus membranas mucosas, uno de los aspectos más importantes para la prevención de infecciones nosocomiales por VSR es proteger al personal que realiza la atención de los pacientes infectados de adquirir la infección (18).
Con la aplicación de medidas de prevención estándar (lavado de manos, uso de guantes y mandilón al contacto de secreciones corporales) se ha comunicado un elevado porcentaje de transmisión nosocomial del VSR, estimado en 26% (19). Madge y colaboradores (18) estudiaron diferentes medidas para reducir la transmisión nosocomial de VSR en un periodo de tres años y se identificó que la mayor reducción se logra con la combinación del uso de medidas de barrera (mandilón y guantes) para la atención de cada paciente infectado, adicionado a la disposición de personal exclusivo para la atención de los pacientes positivos. Con estas medidas se redujo el porcentaje de transmisión nosocomial a 3%. Actualmente, las recomendaciones para la prevención de la transmisión nosocomial de VSR incluyen el tamizaje de pacientes sintomáticos, el aislamiento de cohorte, la exclusión de personal sintomático de las salas de pacientes susceptibles, lavado de manos antes y después de cada manipulación del paciente, así como el uso de medidas de barrera (mandilón, guantes y posiblemente mascarillas) (18,19).
En la situación presentada en el mes de marzo de 2011 en UCIN del Instituto Nacional Materno Perinatal (que tiene una capacidad para 30 pacientes, divididos en tres salas), se aplicó inmediatamente las medidas para la prevención de transmisión nosocomial de infecciones respiratorias, ante la elevada sospecha inicial de estar frente a cuadros de etiología viral. Se procedió a solicitar la confirmación virológica en los dos pacientes ingresados, lo cual presentó alguna demora, pues a nivel institucional no se cuenta con este tipo de pruebas diagnósticas. Una vez que se contó con los resultados de inmunofluorescencia indirecta en secreción nasofaríngea positivas al VSR, se reforzó las medidas ya implementadas: aislamiento tipo cohorte de los pacientes de la sala (10 en el momento de la confirmación diagnóstica), se asignó personal de enfermería exclusivo para la atención de los casos infectados, verificando el cumplimiento estricto del lavado de manos antes y después de la atención de los pacientes, uso de mascarilla, mandilón y guantes limpios para todas las atenciones de los pacientes infectados. En el caso de los otros pacientes hospitalizados en la misma sala, se mantuvo las medidas de prevención de infecciones de aplicación general y se excluyó a todo el personal asistencial con sintomatología respiratoria.
En el momento de establecer el aislamiento de cohorte en la sala de UCIN se encontraban hospitalizados cuatro neonatos muy susceptibles (dos prematuros menores de 1 000 gramos con displasia broncopulmonar, con soporte ventilatorio prolongado; un prematuro de 1 300 gramos con sepsis tardía en tratamiento, y un neonato con síndrome Down y cardiopatía congénita) con riesgo alto de mortalidad en caso de contraer la infección por VSR en el ambiente hospitalario. De acuerdo a publicaciones revisadas sobre el uso de anticuerpos monoclonales contra el VSR (palivizumab) en pacientes durante los brotes nosocomiales de VSR, conjuntamente con la aplicación de las medidas de prevención, se logró reducciones importantes en el porcentaje de transmisión nosocomial del virus en UCIN (20-23). Por ello, en la situación presentada en el INMP se decidió realizar la administración de palivizumab (15 mg/kg vía IM) a los cuatro pacientes de riesgo de la sala. La administración fue realizada dentro de los primeros siete días de ingreso del caso índice. Sin embargo, es necesario señalar que esta medida aún no se encuentra dentro de las recomendaciones estándar para el uso de palivizumab (25) y que, en nuestro país, aún las recomendaciones aprobadas para la administración de palivizumab en neonatos prematuros no han logrado ser implementadas, debido principalmente a motivos económicos.
Con la aplicación estricta de las medidas de prevención de infecciones intrahospitalarias en el servicio de UCIN del Instituto Nacional Materno Perinatal no se presentó algún caso de transmisión nosocomial de la infección por VS. Estas acciones pueden constituirse como recomendaciones para prevenir la diseminación del VSR en otras UCIN del país.
REFERENCIAS BIBLIOGRÁFICAS
1. Morris JA, Blount RE Jr, Savage RE. Recovery of cytopathogenic agent from chimpanzees with coryza. Proc Soc Exper Biol. Med. 1956;92:544-9.
2. Sandiford B, Spence B. Respiratory syncytial virus in epidemic bronchiolitis of infants. BMJ. 1962;2(5309):881-2.
3. Krilov LR. Respiratory syncytial virus disease: update on treatment and prevention. Expert Rev Anti Infect Ther. 2011;9(1):27-32.
4. Hall CB. Respiratory syncytial virus and parainfluenza virus. N Engl J Med. 2001;344:1917-28.
5. Hall CB, Weinberg GA, Iwane MK, Blumkin AK, Edwards KM, et al. The burden of respiratory syncytial virus infection in young children. N Engl J Med. 2009;360:588-98.
6. Leader S, Kohlhase K. Respiratory syncytial viruscoded pediatric hospitalizations, 1997 to 1999. Pediatr Infect Dis J. 2002;21:629-32.
7. Shay DK, Holman RC, Newman RD, Liu LL, Stout JW, Anderson LJ. Bronchiolitis-associated hospitalizations among US children, 1980-1996. JAMA. 1999;282:1440-6.
8. Subcommittee on Diagnosis and Management of bronchiolitis. Diagnosis and management of bronchiolitis. Pediatrics. 2006;118:1774-93.
9. Ruotsalainen M, Piippo-Savolainen E, Hyvarinen MK, Korppi M. Respiratory morbidity in adulthood after respiratory syncytial virus hospitalization in infancy. Pediatr Infect Dis J. 2010;29:872-4.
10. Ditchburn RK, McQuillin J, Gardner PS, Court SDM. Respiratory syncytial virus in hospital crossinfection. BMJ. 1971;3:671-73.
11. Hall CB, Douglas RG, Geiman JM, Messner MK. Nosocomial respiratory syncytial virus infections. N Engl J Med. 1975;293:1343e1346.
12. Garcia Perez A, Caritg Bosch J, Junconsa Morros T, Krauel Vidal J. Outbreak of respiratory syncytial virus in a neonatal unit. An Esp Pediatr. 1989;30:480e482.
13. Langley JM, LeBlanc JC, Wang EE, Law BJ, MacDonald NE, et al. Nosocomial respiratory syncytial virus infection in Canadian pediatric hospitals: a Pediatric Investigators Collaborative Network on Infections in Canada Study. Pediatrics. 1997;100(6):943-6.
14. Brandenburg AH, Groen J, Van Steensel-Moll HA, Claas EC, Rothbarth Ph, et al. Respiratory syncytial virus specific serum antibodies in infants under six months of age: limited serological response upon infection. J Med Virol. 1997;52(1):97-104.
15. Groothuis J, Hoopes M, Hemming V. Prevention of Serious respiratory syncytial virus-related illness. I: Disease pathogenesis and early attempts at prevention. Adv Ther. 2011;28(2):91-109.
16. Hall CB. Nosocomial respiratory syncytial virus infections: the "cold war" has not ended. Clin Infect Dis. 2000;31:590–6.
17. Goldmann DA. Transmission of viral respiratory infections in the home. Pediatr Infect Dis J. 2000;19:S97-S102.
18. Madge P, Paton JY, McColl JH, Mackie PL. Prospective controlled study of four infection control procedures to prevent nosocomial infection with respiratory syncytial virus. Lancet. 1992;340(8827):1079-83.
19. Snydman DR, Greer C, Meissner HC, McIntosh K. Prevention of nosocomial transmission of respiratory syncytial virus in a newborn nursery. Infect Control Hosp Epidemiolog. 1988;9(3):105-8.
20. Cox RA, Rao P, Brandon-Cox C. The use of palivizumab monoclonal antibody to control an outbreak of respiratory syncytial virus infection in a special care baby unit. J Hosp Infect. 2001;48:186e192.
21. Abadesso C, Almeida HI, Virella D, Carreiro MH, Machado MC. Use of palivizumab to control an outbreak of syncytial respiratory virus in a neonatal intensive care unit. J Hosp Infect. 2004;58:38e41.
22. Kurz H, Herbich K, Janata O, Sterniste W, Bauer K. Experience with the use of palivizumab together with infection control measures to prevent respiratory syncytial virus outbreaks in neonatal intensive care units. J Hosp Infect. 2008;70:246e252.
23. Dizdar EA, Aydemir C, Erdeve O, Sari FN, Oguz S, Uras N, Dilmen U. Respiratory syncytial virus outbreak defined by rapid screening in a neonatal intensive care unit. J Hosp Infect. 2010;75:292e294.
24. Halasa NB, Williams JV, Wilson GJ, Walsh WF, Schaffner W, Wright PF. Medical and economic impact of a respiratory syncytial virus outbreak in a neonatal intensive care unit. Paediatr Infect Dis J. 2005;24:1040-4.
25. Committee on Infectious Diseases. Modified recommendations for use of palivizumab for prevention of respiratory syncytial virus infections. Pediatrics. 2009;124;1694-701.
Correspondencia:
Dra. Tania Paredes
Jr. Miroquesada 941, Lima 1, Perú
Correo electrónico: taniagisella2@yahoo.com.ar













