Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.73 n.2 Lima abr./jun. 2012
COMUNICACIÓN CORTA
Características clínicas y bioquímicas de la diabetes mellitus tipo 2 (DMt2) en el Instituto Nacional de Salud del Niño
Clinical and biochemical characteristics of type 2 diabetes mellitus (DMt2) at Instituto Nacional de Salud del Niño
Martha Calagua-Quispe1, Juan Falen-Boggio2,3, Carlos Del Águila-Villar2,3, RómuloLu-de Lama2, María Isabel Rojas-Gabulli2,3
1 Ex Residente, Instituto Nacional de Salud del Niño.
2 Servicio de Endocrinología, Instituto Nacional de Salud del Niño.
3 Facultad de Medicina Hipólito Unanue, Universidad Nacional Federico Villarreal.
Resumen
Objetivo: Evaluar las características clínicas y bioquímicas al momento del diagnóstico de diabetes mellitus tipo 2 (DMt2), en pacientes pediátricos. Diseño: Estudio clínico retrospectivo. Institución: Servicio de Endocrinología, Instituto Nacional de Salud del Niño, Lima, Perú. Pacientes: Niños con diabetes mellitus tipo 2. Métodos: Se revisó las historias clínicas de 187 pacientes con diabetes mellitus y se identificó 17 (9,2%) con diabetes mellitus tipo 2. Se preparó una ficha para la recolección de datos, en la cual se consignó características personales y familiares, síntomas y signos y datos bioquímicos. Principales medidas de resultados: Características clínicas y bioquímicas de los niños. Resultados: La edad promedio al momento del diagnóstico fue de 12,8 ± 3 años; 11 fueron de sexo masculino (64,7%) y 6 de sexo femenino (35,3%). Todos nacieron a término, de los cuales 17,6% fueron macrosómicos. Se encontró que 82,4% tenía antecedente familiar de diabetes tipo 2. Los síntomas más frecuentes fueron: poliuria, polidipsia, polifagia y pérdida de peso; 35,3% presentó sobrepeso, 41,2% obesidad y 65% del conjunto, acantosis nigricans. Cinco pacientes desarrollaron cetoacidosis. Se encontró que 60% tenía alteración de alguno de los componentes del perfil lipídico, siendo la más frecuente la alteración de los LDL (46,5%). Los anticuerpos anti-insulina, anti-GAD y anti-ICA fueron negativos en 85,7%; 14,3% de los pacientes mostró alguno de ellos positivos. Conclusiones: La mayor parte de los niños con DMt2 estudiados presentó antecedentes familiares de diabetes tipo 2, 75% de ellos con signos y síntomas clásicos de esta patología, acompañados de presencia de sobrepeso u obesidad y dislipidemia.
Palabras clave: Diabetes tipo 2, obesidad, resistencia a la insulina, dislipidemias, cetoacidosis diabética.
Abstract
Objective: To determine clinical and biochemical characteristics in type 2 diabetes mellitus (T2DM) in pediatric patients at time of diagnosis. Design: Clinical retrospective study. Setting: Endocrinology Service, Instituto Nacional de Salud del Niño, Lima, Peru. Patients: Children with diabetes mellitus type 2. Methods: Medical records of 187 registered patients with diabetes mellitus were reviewed and 17 (9%) with T2DM were identified. Personal and familiar characteristics, symptoms and biochemical data were obtained. Main outcome measures: Clinical and biochemical characteristics of pediatric patients. Results: Average age at diagnosis was 12.8±3 years, 11 were male (64.7%) and 6 female (35.3%). All were born at term and 17.6% were macrosomic. Fourteen patients (82.4%) had a family history of T2DM. Most frequent symptoms were polyuria, polydipsia, polyphagia and weight loss; 35.3% were overweight, 41.2% obese and 65% showed acanthosis nigricans. Five patients developed ketoacidosis. Some component of the lipid profile was abnormal in 60% with elevation of low-density lipoprotein cholesterol in 46.5%. Anti-insulin antibodies, anti-GAD and islet cell antibodies (anti-ICA) were negative in 85.7% and any of them positive in 14.3%. Conclusions: In this series of children with type 2 diabetes most had a family history of type 2 diabetes, 75% showed classical signs and symptoms of the disorder accompanied by overweight or obesity and dyslipidemia.
Key words: Diabetes mellitus/type 2, obesity, insulin resistance, dyslipidemias, diabetes ketoacidosis.
INTRODUCCIÓN
La obesidad constituye la epidemia del siglo XXI a nivel mundial, la cual involucra no solo a los adultos, sino, también, a niños y adolescentes (1). El Perú no escapa a este fenómeno y se señala que la obesidad infanto-juvenil se ha incrementado en las últimas décadas, estando ella presente en forma significativa en los niños de 6 a 9 años y un poco mayor en adolescentes; un dato interesante es que la obesidad es mayor en el niño con talla corta (desnutrido crónico) que en aquel con talla dentro de límites normales (2). De otro lado, diversos reportes señalan la fuerte asociación entre obesidad y diabetes tipo 2 en el adulto y, desde mediados del siglo pasado, se informa su incremento en la población pediátrica (3). A este fenómeno no escapan los países en vías de desarrollo (4).
Se señala que los pacientes en edad pediátrica portadores de diabetes mellitus tipo 2 (DMt2) presentan como síntomas poliuria, polidipsia, deshidratación y, en algunos casos, cetoacidosis como inicio de la enfermedad, a lo cual hay que agregar el rápido deterioro del estado general, que requiere el uso de insulina como tratamiento inicial a fin de revertir dicho deterioro. De otro lado, se puede observar que algunos pacientes inician la enfermedad en forma insidiosa y con ausencia de cetoacidosis y no requieren insulina para su tratamiento. Esto hace que el diagnóstico de DMt2, en edad pediátrica revista cierta dificultad (5,6).
La DMt2 en su forma clásica se caracteriza por presencia de resistencia a la insulina e incapacidad de la célula ß de mantener niveles adecuados de secreción de insulina. Además, se suele encontrar dislipidemia, acantosis nigricans, hipertensión arterial y familiares cercanos con DMt2.
El propósito del presente trabajo es presentar la casuística de DMt2 y sus características clínicas, forma de presentación y principales hallazgos bioquímicos en una población de niños.
MÉTODOS
En el presente estudio clínico retrospectivo, se revisó las historias clínicas de los pacientes con diagnóstico de diabetes que acudieron para su atención en el Programa de Atención Integral del Niño Diabético (PAINDI), del Servicio de Endocrinología del Instituto Nacional de Salud del Niño, de enero de 2001 a enero de 2011. De los 187 pacientes que tenían historia clínica completa, se encontró 17 historias correspondientes a pacientes con DMt2; el resto correspondía a DMt1. Los criterios diagnósticos para niños y adolescentes de ambos sexos menores de 18 años fueron no requerir insulina para su manejo y tener dos de los siguientes criterios: obesidad y resistencia a la insulina, anticuerpos antiinsulina, antidecarboxilasa del ácido glutámico (antiGAD) negativos, valores de péptido C normales o altos, valores de péptido C normales o altos después del año del diagnóstico (6,7).
Los datos de edad, sexo, peso de nacimiento (se catalogó como paciente con peso bajo aquel que tuviese <2 500 g y de macrosomía cuando el peso fue >4 500 g), antecedentes perinatales, patología asociada, historia familiar de diabetes y obesidad, fueron recolectados en una ficha confeccionada para el presente estudio.
Además, en cada visita los pacientes fueron tallados, pesados y se les calculó el IMC (peso/talla2). La clasificación de los pacientes con sobrepeso u obesidad se hizo siguiendo los criterios de Dietz y col (8,9). Las variaciones de la talla y del IMC fueron expresados como número de desviaciones estándar o puntaje Z. El desarrollo puberal se realizó según los criterios descritos por Tanner para mujeres (10) y varones (11). Los signos y síntomas que se señala en los resultados corresponden al primer examen realizado a cada paciente. La presión arterial medida en la primera consulta fue catalogada según los criterios señalados por la National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents (12). Igualmente, se consignó los valores de glicemia, HbA1c, péptido C, perfil lipídico, anticuerpos antiinsulina, antiGAD y antiislote (ICA).
Los datos fueron analizados utilizando el programa SPSS 15 para Windows.
RESULTADOS
La muestra estuvo constituida por 17 pacientes, que representó 9,2% de todos los pacientes diabéticos de nuestro archivo; de ellos 11 fueron de sexo masculino (64,7%) y seis de sexo femenino (35,3%). La edad promedio de todos los pacientes con DMt2 fue 12,8 ± 3 años, correspondiendo 12,7 ± 3,1 para los varones y 12,9 ± 3,2 para las mujeres.
Al momento del diagnóstico, cuatro pacientes eran prepúberes (23,5%) y la edad promedio era 9,1 ± 3,3 años; ocho eran púberes (47,1%) y la edad promedio era 13,2 ±1,6 años, y cinco habían concluido su desarrollo puberal (pospúberes) (29,4%), con una edad promedio de 15 ±1,8 años.
El análisis de los datos correspondientes a antecedentes perinatales mostró que todos habían nacido a término, que la talla de nacimiento fue 49,8 ± 0,8 cm y el peso de 3 566 ± 618 g. El 83,3% recibió lactancia materna exclusiva durante 4,2 ± 2,3 meses. Como antecedentes familiares saltantes, debe señalarse que 82,4% de los pacientes tenía antecedentes de DM, 52,9% de línea materna, 17,6% de línea paterna y 11,8% de ambos progenitores; así mismo, se encontró que 35,3% de los pacientes presentaba antecedentes de obesidad familiar, de los cuales 66,7% por línea materna y 16,7% por la paterna.
Cabe destacar que 5 pacientes (29,4%) iniciaron su enfermedad con cetoacidosis, 10 (58,8%) fueron diagnosticados en forma ambulatoria y otros al ser hospitalizados por otras causas. El tiempo de enfermedad en el momento del diagnóstico fue 3,4 ± 4,1 meses.
La cetoacidosis que presentaron los pacientes con DMt2 fue documentada por pH <7,3, disminución del bicarbonato sérico (<15 mmol/L) y presencia de cuerpos cetónicos en orina.
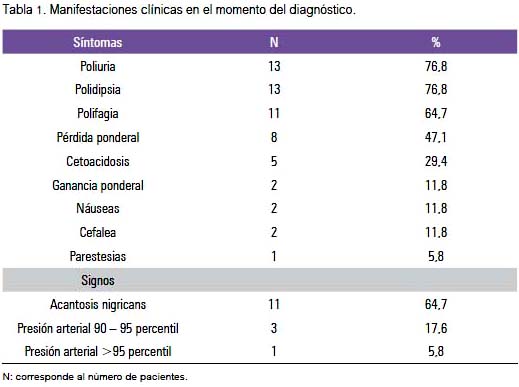
Los signos y síntomas más frecuentes de los pacientes con DMt2 son presentados en la tabla 1.
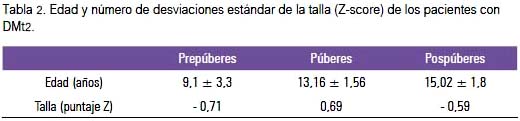
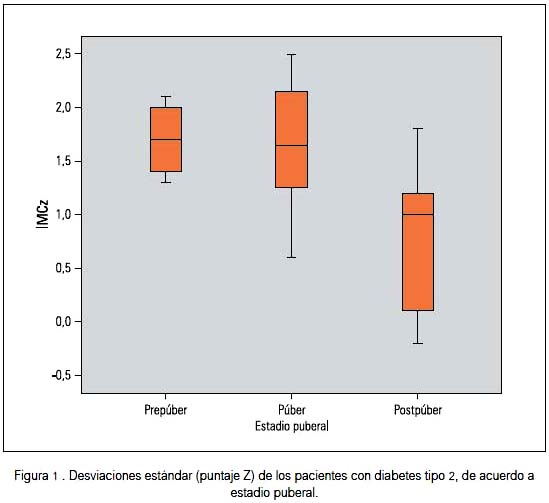
En la tabla 2 se muestra la edad expresada en años y la talla de los pacientes con DMt2, expresada como número de desviaciones estándar o puntaje Z; y en la figura 1, el número de desviaciones estándar (puntaje Z) del IMC de los pacientes diabéticos según estadio puberal. Cabe destacar que en la evaluación del peso corporal mediante el IMC se encontró que 81,8% de los varones presentó sobrepeso u obesidad y en el caso de las mujeres, 66,7%.
De todos los pacientes con DMt2 estudiados, dos (11,8%) presentaron talla corta (< -2 DE) y uno (5,9%) tenía talla grande (> 2 DE).
En la tabla 3 se muestra los valores de la evaluación bioquímica de los pacientes estudiados.

Sesenta por ciento de los pacientes con DMt2 presentó incremento de los lípidos estudiados; 46,2% mostró colesterol LDL superior a 100 mg/dL, 33% colesterol HDL inferior a 40 mg/dL y 25% triglicéridos superior a 150 mg/dL.
Tanto los anticuerpos antiinsulina, así como los antiGAD y los anticuerpos anti islote pancreático (ICA) fueron negativos en 15 pacientes (85,7%) y dos pacientes (14,3%) presentaron un anticuerpo positivo.
En relación al manejo, todos los pacientes recibieron indicaciones nutricionales en relación a consumo de calorías acorde con su edad y sexo, así como plan de ejercicios; cabe destacar que 35,3 de ellos inició tratamiento con antidiabético oral, 29,4% con insulina y 23,5% con ambos medicamentos.
DISCUSIÓN
La obesidad infantil se encuentra en incremento en los países en vías de desarrollo (13), no escapando a este fenómeno el Perú (2). Los países en vías de desarrollo otrora con tasas altas de malnutrición, al mejorar su ingreso per cápita han visto incrementar la tasa de obesidad y en algunas familias coexisten niños con desnutrición y adultos obesos (4). A ello debe añadirse la aparición de trastornos metabólicos tales como dislipidemia, intolerancia a la glucosa, resistencia a la insulina y DMt2 (14,15). Como consecuencia de lo anterior, los adultos jóvenes que son obesos suelen presentar mayor riesgo de enfermedades cardiovasculares que los no obesos (16).
Clásicamente, la DMt2 se caracteriza por la existencia de resistencia a la insulina e incapacidad de la célula ß de mantener niveles adecuados de dicha hormona. La resistencia a la insulina es la expresión de la incapacidad de la insulina en promover la utilización de la glucosa por parte de los tejidos muscular y adiposo; en este último existe, además, disminución de la enzima lipasa regulada por la insulina, produciendo concentración exagerada de ácidos grasos no esterificados (AGNE), que alteran la captación de glucosa a nivel muscular. De otro lado, los AGNE intervienen bloqueando el transporte endotelial de la insulina. A nivel hepático, la resistencia a la insulina se manifiesta como incremento de la producción de glucosa, dándose como respuesta incremento de la secreción de insulina y, si este fenómeno persiste, se produce un efecto glucotóxico y declinación de la función secretora y del número de células ß (17-19).
Cabe destacar que la DMt2 en niños y adolescentes se encuentra en incremento a nivel mundial, constituyendo un problema de salud pública, por todas las implicancias anteriormente señaladas. Así, se ha comunicado que la prevalencia varía de 0,1 a 5%, señalándose que se ha producido un aumento de 10 veces en las últimas décadas (20). No obstante, debe señalarse que existen variaciones atribuidas a localización geográfica y etnicidad; así, en adolescentes de 10 a 19 años, en Europa la incidencia es 2%, en Estados Unidos de América del Norte 15% en blancos no hispánicos y 90% en Hong Kong (3,21). En nuestra casuística, hemos encontrado 17 pacientes portadores de DMt2, que representó 9,2% del total de diabéticos atendidos. Por su parte, Pimhas-Hamiel y col (22) señalan que, entre 1982 y 1995, la diabetes mellitus tipo 2, en niños y adolescentes, se ha incrementado 10 veces, en especial en el grupo etario comprendido entre 10 y 19 años de edad, lo cual va en paralelo con el incremento de la obesidad, y señala que a fin de evitar las complicaciones que implica la DMt2 a largo plazo debe prevenirse la obesidad tan pronto como ella haya sido detectada.
Como lo descrito por diversos autores, los antecedentes de existencia de familiares de primera línea o cercanos al paciente son notorios; ello oscila entre 75 y 85% en familiares de primer y segundo grado. En el presente estudio, se encontró esta presencia en 82,4%.
La resistencia a la insulina es una manifestación que suele verse en los adultos que desarrollan DMt2. De otro lado, la resistencia a la insulina se encuentra asociada a la obesidad, acantosis nigricans, síndrome metabólico, hipertensión arterial y patología cardiovascular. Este fenómeno también se observa en niños y adolescentes, en particular en aquellos que tienen antecedentes de peso bajo al nacer (23-25). La presencia de niveles altos de insulina ha sido señalada en diversos estudios realizados en niños obesos y portadores de estigmas compatibles con síndrome metabólico (26-28). Es probable que el fenómeno de resistencia a la insulina constituya un mecanismo de adaptación y de sobrevivencia según la teoría de genotipo ahorrador; habría acción alterada de la insulina durante la etapa fetal, con la consiguiente restricción de crecimiento intrauterino y, en la etapa posnatal, en la infancia o en la edad adulta, en presencia de obesidad, el desarrollo de intolerancia a la glucosa y el desarrollo de diabetes (14,15,17,26,29). Una asociación importante con la resistencia a la insulina lo constituye la presencia de la acantosis nigricans; se trata de una lesión de la piel caracterizada por hiperqueratinización e hiperpigmentación localizada en el cuello, axilas, pliegue del antebrazo y otros pliegues cutáneos; se encuentra presente en porcentaje alto en niños obesos (30-32).
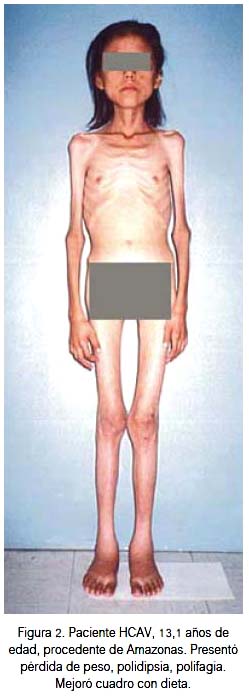
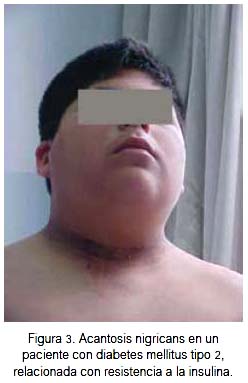
Un hecho de observación en los pacientes en edad pediátrica con diabetes tipo 2 es la presencia de cetoacidosis como parte de la enfermedad; esto hace difícil la diferenciación entre DMt1 y DMt2, para lo cual se requiere de estrategias diagnósticas (6). En el Consenso de la ADA publicado en el año 2010, se señala que como criterios diagnósticos de DMt2 en niños y adolescentes debería tomarse en cuenta aquellos adoptados en el año 1999, es decir, IMC >85 percentil para edad y sexo o exceso ponderal mayor del 20% con respecto al peso ideal, y dos de los siguientes hechos: historia familiar de diabetes de uno de los padres o familiares cercanos, criterios étnicos o signos de resistencia a la insulina (33).
En nuestra casuística de 17 pacientes con DMt2, cinco presentaron cetoacidosis al momento del diagnóstico (29,4%); todos ellos eran obesos, presentaban acantosis nigricans e hiperinsulinemia y deshidratación. Algunos de ellos tuvieron anticuerpos tipo ICA débilmente positivos y péptido C bajo; fueron tratados como pacientes con DMt1 cetoacidóticos; poco después se notó que requerían poca cantidad de insulina para obtener niveles adecuados de glicemia, hasta dejar de recibirla.
Poco se conoce acerca de los mecanismos involucrados en la génesis de este cuadro en los pacientes adolescentes. Así, podría tener rol importante la resistencia a la insulina que se produce durante la pubertad (3,20), por el cuadro de obesidad (18,19). De otro lado, se ha señalado que la DMt2 se caracteriza por resistencia a la insulina e incapacidad de la célula ß en mantener una secreción adecuada de la misma, lo que ha llevado a señalar a Linfoot y col (34) que la cetoacidosis se debería a disfunción de la célula ß causada por incremento de la hormonas reguladoras y disminución de producción de insulina. A este hecho hay que agregar las observaciones de Maldonado y col (35), quienes señalan que la diabetes mellitus-cetosis prona es heterogénea, que su causa se debería a defectos de novo de la célula ß, en las cuales estarían incluidas aquellas nuevas de carácter no inmunológico, ligados a síndromes A-ß+ y A-ß-.
Podemos concluir que la diabetes mellitus tipo 2 en nuestro medio no es infrecuente en adolescentes, con preferencia en la edad pediátrica. Un porcentaje de ellos, además de los signos y síntomas clásicos, al inicio de la enfermedad suelen presentar cuadro de cetoacidosis, lo que dificulta el diagnóstico. Después de un cierto tiempo de uso de insulina para su equilibrio metabólico, no se la requiere más y pueden mantenerse en euglicemia con dieta y ejercicio; algunos de ellos requieren tratamiento con antidiabéticos orales, en especial metformina.
REFERENCIAS BIBLIOGRÁFICAS
1. Rosenbaum M, Leibel RL, The physiology of body weight regulation: relevance to the etiology of obesity in children. Pediatrics. 1998;101;525–39.
2. Pajuelo J, Rocca J, Gamarra M. Obesidad infantil: sus carácter+isticas antropométricas y bioquímicas. An Fac med. 2003;64(1):21-6.
3. Rosenbloom AL, Silverstein JH, Amemiya S, Zeitler P, Klingensmith GJ. Type 2 diabetes in children and adolescents. Pediatr Diabetes. 2009;10(Suppl12):17–32.
4. Hossain P, Kawar B, El Nahas M. Obesity and diabetes in developing world – A growing challenge. N Engl J Med. 2007;356:213–5.
5. Lu R, Dextre A, Falen J, Del Águila C, Rojas MI y col. Características clínicas y sociales de 105 niños diabéticos del Instituto de Salud del Niño. Diagnóstico. 2000;39:240–4.
6. Zeitler P. Approach to the obese adolescent with new-onset diabetes. J Clin Endocrin Metab. 2010;95:5163–70.
7. Shaw J. Epidemiology of childhood type 2 diabetes and obesity. Pediatr Diabetes. 2007;8(Suppl7):7–15-
8. Dietz WH, Robinson TN. Use of the body mass index (bMI) as a measure of overweight in children and adolescents. J Pediatr. 1998;132:1913.
9. Cole TJ, Bellizzi MC, Flegal KM, Dietz WH. Establishing a standard definition for child overweight and obesity worldwide: international survey. bMJ. 2000;320:1240–3.
10. Marshall WA, Tanner JM. Variation in the patternof pubertal changes in girls. Arch Dis Child.1969;44:291–303.
11. Marshall WA, Tanner JM. Variation in the patternof pubertal changes in boys. Arch Dis Child. 1970;45:13–23.
12. National High Blood Pressure Education Program Working Group on High blood Pressure in Children and Adolescents. The Fourth report on the Diagnosis, Evaluation, and Treatment of High blood Pressure in Children and Adolescents. Pediatrics. 2004;114:555–76.
13. De Onis M, Blösner M. Prevalence and trends of overweight among preschool children in developing countries. Am J Clin Nutr. 2000;72:1032–9.
14. Weiss R, Caprio S. The metabolic consequences of childhood obesity. Best Pract Res Clin Endocrinol Metab. 2005;19:405–19.
15. Goran MI, Bergman RN, Avila Q, Watkins M, Ball GD, Shaibi GQ, Weigensberg MJ, Cruz ML. Impaired glucose tolerance and reduced ß-cell function in overweight Latino children with a positive family history for type 2 diabetes. J Clin Endocrinol Metab.2004;89:207–12.
16. Lowlor DA, Leon DA. Association of body mass index and obesity measured in early childhood with risk of coronary heart disease and stroke in middle age: finding from the Aberdeen children of the 1950s prospective cohort study. Circulation. 2005;111:1891–6.
17. Saad MF, Knowler WC, Pettitte DJ, Nelson RG, Mott DM, Bennett PH. The natural history of impaired glucose tolerance in the Pima Indians. N Engl J Med. 1988;319(23):1500–6.
18. Boden G. Role of fatty acids in the pathogenesis on insulin-resistance and NIDDM. Diabetes. 1997;46:3–10.
19. Wajchenberg BL. ß-cell failure in diabetes and preservation by clinical treatment. Endocrine Rev. 2007;28:187–218.
20. Frenk-Barón P, Márquez E. Diabetes mellitustipo 2 en niños y adolescentes. Med Int Mex.2010;26:36–47.
21. Shaw J. Epidemiology of childhood type 2 diabetes and obesity. Pediat Diabetes. 2007;8(Suppl9):7–15.
22. Pinhas-Hamiel O, Doland LM, Daniels SR, Standiford D, Khoury PR, Zeitler P. Increased incidence of non-insulin-dependent diabetes mellitus among adolescents. J Pediatr. 1996;128(5 Pt 1):608–15.
23. Ten S, MacLaren N. Insulin resistance syndrome in children. J Clin Endocrinol Metab. 2004;89:2526– 39.
24. Wilson PWF, Umpierrez GE. Insulin resistance and pubertal changes. J Clin Endocrinol Metab. 2008;93:2472–3.
25. Levy-Marchal C, Arslanian S, Cutfield W , Sinaiko A, Druet C, Marcovecchio ML, Chiarelli F; ESPELWPES-ISPAD-APPES-APEG-SLEP-JSPE; Insulin Resistance in Children Consensus Conference Group. Insulin resistance in children: Consensus, perspective, and future directions. J Clin Endocrinol Metabol. 2010;95(12):5189–98.
26. Weiss R, Dziura J, Burgert TS, Tamborlane WV, Taksali SE, et al. Obesity and metabolic syndrome in children and adolescents. N Engl J Med. 2004;350(23):2362–74.
27. Burrows R, Leiva L, Burgueño M, Maggi A, Giadrosic R y col. Sensibilidad insulínica en niños de 6 a 15 años: asociación con estado nutricional y pubertad. Rev méd Chile. 2006;134:1417–26.
28. Rojas-Gabulli MI, Nuñez O, Del Águila C, Briceño M, Valenzuela N. Resistencia a la insulina en adolescentes obesos. An Fac med. 2010;71(1):13–7.
29. Zeitler P. Approach to the obese adolescent with new-onset diabetes. J Clin Endocrinol Metab. 2010;95:5163–70.
30. Nguyen TT, Keil MF, Russell DL Pathomvanich A, Uwaifo GI, et al. Relation of acanthosis nigricans tohiperinsulinemia and insulin sensitivity in over weight African American and white children. J Pediatr. 2001;138(4):474–80.
31. Hirschler V, Aranda C, Oneto A, González C, Delfino AM y col. ¿Es la acantosis nigricans un signo de insulinorresistencia en adolescentes obesos? Arch Argent Pediatr 2004;102(2):115–20.
32. Aranibar Machaca JS. Acantosis nigricans e hiperinsulinemia en niños y adolescentes obesos del Instituto Nacional de Salud del Niño. Pediatrica (INSN – Perú). 2006;8:64–7.
33. American Diabetes Association. Type 2 diabetes in children and adolescentes. Diabetes Care. 2000;23:381–9.
34. Linfoot P, Bregstrom C, Ipp E. Pathophysiology of ketoacidosis in type 2 diabetes mellitus. Diabet Med.2005;22:1414-19.
35. Maldonado M, Hampe CS, Gaur LK, DAmico S, Iyer D, et al. Ketosis-prone diabetes: dissection of heterogenous syndrome using immunogenetic and ß-cell functional classification, prospective analysis, and clinical outcomes. J Clin Endcorinol Metab. 2003;88:5090-8.
Artículo recibido el 21 de octubre de 2011 y aceptado para publicación el 6 de marzo de 2012.
Un resumen del presente trabajo fue presentado a la reunión de la Sociedad Latinoamericana de Endocrinología Pediátrica (SLEP), Cartagena - Colombia, septiembre 2011
Correspondencia:
Carlos Del Aguila Villar
caguilav@hotmail.com













