Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. vol.74 no.3 Lima jul./set. 2013
ARTÍCULOS ORIGINALES
Asociación entre el polimorfismo genético de la apolipoproteína E (ApoE) y la enfermedad de Parkinson
Association between apolipoprotein E (ApoE) genetic polymorphism and Parkinsons disease
Victoria Marca1, Oscar Acosta2, Luis Torres3, Olimpio Ortega1, Mario Cornejo-Olivas1,4, Saúl Lindo-Samanamud1, Doris Huerta5 ,Carlos Cosentino3,6, Oscar Núñez1, Pilar Mazzetti1,6
1 Servicio y Centro de Investigación Básica en Neurogenética, Instituto Nacional de Ciencias Neurológicas, Lima, Perú.
2 Laboratorio de Biología Molecular, Facultad de Farmacia y Bioquímica, UNMSM, Lima, Perú.
3 Unidad de Movimientos Anormales, Instituto Nacional de Ciencias Neurológicas, Lima, Perú.
4 International Northern Global Health Research Fellows Consortium.
5 Centro de Investigación de Bioquímica y Nutrición, Facultad de Medicina, UNMSM, Lima, Perú.
6 Facultad de Medicina, Universidad Nacional Mayor de San Marcos.
Resumen
Introducción: En nuestro país, con el incremento en la esperanza de vida, existe una tendencia creciente de enfermedades neurodegenerativas, por lo que se hace necesario realizar estudios sobre factores de riesgo genético en personas afectadas con la enfermedad de Parkinson (EP), entre ellos el gen de la apolipoproteína E (ApoE), ya que esta asociación es desconocida en nuestra población. Objetivo: Determinar la asociación del polimorfismo en el gen ApoE con la EP. Diseño: Estudio asociativo, observacional tipo casos y controles. Lugar: Instituto Nacional de Ciencias Neurológicas, Lima, Perú. Participantes: Personas de ambos sexos, 163 pacientes con la EP y 176 controles. Intervenciones: Extracción de ADN genómico según metodología estándar. Análisis del gen APOE mediante técnica PCR-RFLP. Principales medidas de resultados: Frecuencias genotípicas y alélicas del gen ApoE en los casos y controles, medidas de asociación y de riesgo. Resultados: No se encontró diferencias significativas entre el grupo control y los pacientes según genotipo de ApoE. La frecuencia del alelo ε4 fue similar en pacientes y en controles. El odds ratio para el alelo ε4 de la ApoE fue 1,0852 (IC 95%: 0,5812 a 2,0266). La edad de inicio de la EP no tuvo relación con los genotipos ApoE. Conclusiones: El alelo ε4 de la ApoE no podría ser considerado un factor de riesgo para la EP, y los genotipos de la ApoE no se asociaron con la edad de inicio en esta muestra evaluada.
Palabras clave: Enfermedad de Parkinson, alelos, apolipoproteína E.
Abstract
Introduction: Due to the increase in life expectancy in our country, it is necessary to study risk factors for Parkinsons disease (PD), including apolipoprotein E (ApoE) gene, as this association is not known in our country. Objectives: To determine association of ApoE gene polymorphism and PD. Design: Associative, observational case-control analytic study. Setting: Instituto Nacional de Ciencias Neurologicas, Lima, Peru. Participants: Male and females with and without Parkinson's disease. Interventions: Genomic DNA was extracted from 163 patients and 176 controls. PCR_RFLP technique was used for ApoE gene genotyping. Main outcome measures: ApoE gene genotype and allele frequencies in cases and controls, association and risk. Results: No significant ApoE genotype differences between the control group and patients were found. Allele ε4 frequency was similar in patients and controls: 6.5 and 6.0. Odds ratio for ApoE ε4 allele associated with PD was 1.2163 (IC 95%, 0.6574-2.2507). Conclusions: ApoE ε4 allele could not be considered a risk factor for PD in the population studied.
Keywords: Parkinson's disease, alleles, apolipoprotein E.
INTRODUCCIÓN
La enfermedad de Parkinson (EP) es el segundo trastorno neurodegenerativo más frecuente, después de la enfermedad de Alzheimer. Clínicamente se caracteriza por la presencia de temblor en reposo, bradiquinesia e inestabilidad postural, además presencia de psicosis, depresión, deterioro cognitivo, trastorno del sueño, pérdida del olfato, entre otros. La prevalencia de la EP es de más de 1% en personas mayores de 65 años y más de 4% en personas mayores de 85 años (1). La EP es de etiología compleja, pues interaccionan factores genéticos y ambientales (2).
La EP era considerada de naturaleza esporádica, sin origen genético. Pero, estudios de grupos de familias con la EP de diferentes regiones del mundo han hipotetizado que la EP tiene un sustancial componente genético. El primer gen estudiado fue el SNCA en el locus PARK1, de tipo de herencia autosómico dominante. Hasta el momento se ha identificado 16 variantes genéticas o loci denominadas PARK 1 a PARK 16, con patrón de herencia autosómica dominante o recesiva y 11 genes asociados con formas hereditarias de parkinsonismo (3). Además, se han realizado estudios sobre algunos polimorfismos de genes candidatos que podrían dar susceptibilidad para desarrollar la enfermedad al interactuar entre sí y con determinados factores ambientales, entre los que se propone al gen de la apolipoproteína E (ApoE) (4,5).
El gen ApoE está localizado en el cromosoma 19 (19q. 13.2). Consta de 4 exones y 3 intrones. Un polimorfismo en el exón 4 del gen determina los tres alelos más comunes, ε2, ε3 y ε4, en la población humana (6). El alelo ε4 de la ApoE es un gen de susceptibilidad para la EA y está asociado con el riesgo de adelantar la edad de inicio de la enfermedad (7). Además, las placas de beta amiloide y proteínas Tau se incrementan en el cerebro de los individuos que tienen el alelo ε4 (8). La EP comparte algunos rasgos clínicos, neuroquímicos y patológicos con la EA; por ejemplo, los pacientes con EP frecuentemente desarrollan demencia y pacientes con EA con frecuencia desarrollan parkinsonismo (9,10).
Ambas enfermedades se caracterizan por muerte neuronal y depósito de proteínas, ya sea beta amiloide o alfasinucleína. Varios estudios han examinado el rol del gen de la ApoE en la susceptibilidad a la EP, estudiando la frecuencia de los alelos ApoE en pacientes y en controles sanos (11), con resultados contradictorios y variaciones de esta asociación según la población estudiada (12-14).
En nuestro país, el Instituto Nacional de Ciencias Neurológicas (INCN) constituye un centro de referencia nacional para enfermedades neurológicas. La Oficina de Estadística del Instituto informó 970 pacientes atendidos en consulta externa con el diagnóstico de EP en el año 2006, 1 004 pacientes el año 2007, 1 056 en el año 2008 y 2 500 en el 2010, siendo una de las patologías más frecuentes de consulta en la Institución. El objetivo de este estudio es estimar la asociación entre el alelo ε4 del gen ApoE y la EP.
MÉTODOS
Se realizó un estudio observacional analítico asociativo tipo casos y controles en una población de 163 personas diagnosticadas con la EP, de acuerdo a los criterios de UK Brain Bank. Se excluyó pacientes con antecedente familiar de la enfermedad y aquellos con algún origen extranjero en tres generaciones previas. Los controles fueron obtenidos de muestras donadas por trabajadores del INCN mayores de 45 años no afectados por la EP u otra enfermedad neurodegenerativa. Los pacientes y controles fueron enrolados previo consentimiento informado. El estudio fue aprobado por los Comités de Investigación y de Ética en Investigación Biomédica del INCN.
Para el análisis molecular se extrajo ADN genómico a partir de sangre periférica (pacientes) y de hisopado bucal (controles), con técnica estandarizada en el laboratorio (15). Para determinar los genotipos y alelos del gen ApoE se empleó la técnica de PCR-RFLP, amplificándose un fragmento de 227 bp y con los siguientes cebadores (16):
Directo: 5´ TCCAAGGAGCTGCAGGCGGCGCA-3´, y
Reverso: 5´ ACAGAATTCGCCCCGGCCTGGTACACTGCCA-3
La amplificación por PCR de 100 ng de ADN genómico fue llevado a cabo en 20 uL de reacción conteniendo buffer de PCR 1X, 1,6 uL de MgCl2 de 25 mM, 0,8 uL de mix de dNTPs (dATP, dTTP, dCTP, y dGTP) de 10 mM c/u, 0,4 uL de primer de 25 pmol c/u y 1 U de la enzima Stoffel. La amplificación se realizó a una denaturación inicial de 95° C por 3 min, seguido de 30 ciclos de 94° C por 30 seg para la denaturación, 65° C por 30 seg para el acoplamiento y 70° C por 1,5 min para la extensión. El ciclo final de extensión se realizó a 72° C por 10 min. Los productos amplificados fueron digeridos con 0,5 U de la enzima de restricción HhaI por 6 horas a 37º C. Los fragmentos obtenidos fueron separados por electroforesis en geles de poliacrilamida al 12% y visualizados con tinción de plata. Se analizó bandas características para cada genotipo: ε2 /ε2 (91 y 83 pb); ε3 /ε3 (91 y 48 bp); ε4 /ε4; (72, y 48 bp); ε2 /ε3 (91, 83 y 48 pb); ε2 /ε4 (91, 83, 72 y 48 pb); ε3 /ε4 (91, 72 y 48 pb). Los fragmentos obtenidos fueron determinados comparándolos con un marcador de peso molecular de 10 bp (Invitrogen).
Para corroborar los resultados obtenidos, se secuenció (Macrogen, USA http://www.macrogen.com/eng/macrogen/macrogen_main.jsp) seis amplificados tomados aleatoriamente y representativos de los diferentes genotipos de la APOE, confirmándose los resultados obtenidos en el laboratorio.
Las frecuencias genotípicas y alélicas en casos y controles fueron obtenidas por conteo directo. Para comparar las frecuencias genotípicas observadas y las esperadas, según la hipótesis del equilibrio de Hardy-Weinberg, se aplicó la prueba exacta según Guo y Thompson. Para comparar las frecuencias genotípicas y alélicas de la ApoE entre los dos grupos, se utilizó la prueba X2 de independencia o la prueba exacta de Fisher, según el caso, con α = 0,05. Para evaluar el factor genético de riesgo del alelo E4 y la EP se aplicó la razón de Momios u odds ratio (OR). Se usó la prueba Kruskal Wallis para evaluar las edades de inicio de la enfermedad de Parkinson según genotipos ApoE. Todos los cálculos fueron realizados con el paquete estadístico SPSS 14.0 (http://www-01.ibm.com/software/analytics/spss/) y el programa de genética poblacional Arlequín 3.11. (http://cmpg.unibe.ch/software/arlequin3).
RESULTADOS
Las características demográficas de ambos grupos y su distribución según departamentos en el país están resumidas en la tabla 1. Las frecuencias alélicas y genotípicas de los grupos estudiados son mostradas en la tabla 2. El genotipo ε3/ε3 fue el más frecuente, tanto en pacientes como controles: 85,3% y 85,8%. No se encontró los genotipos ε2 /ε2 y ε2 /ε4 en ninguno de los dos grupos. Las frecuencias alélicas para ε2, ε3 y ε4 fueron similares en casos y controles.
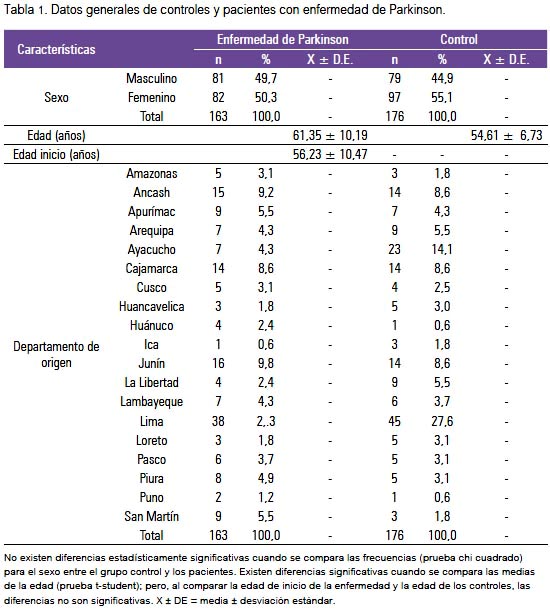
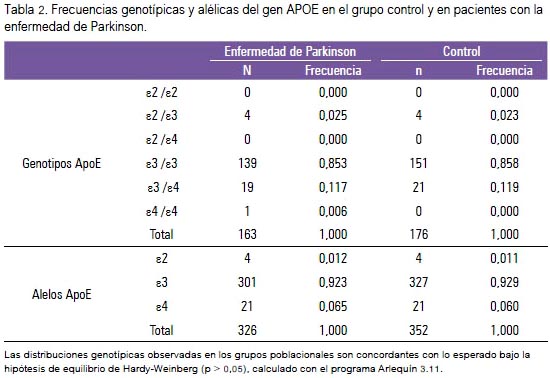
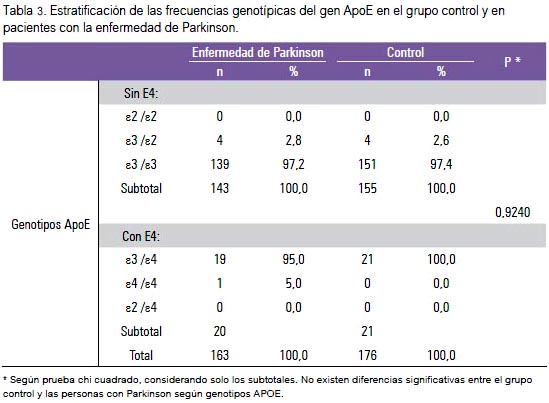
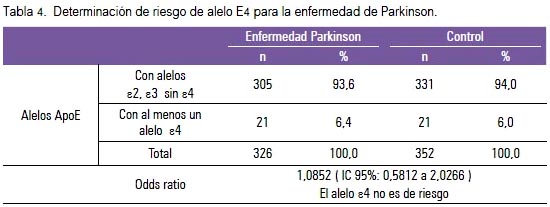
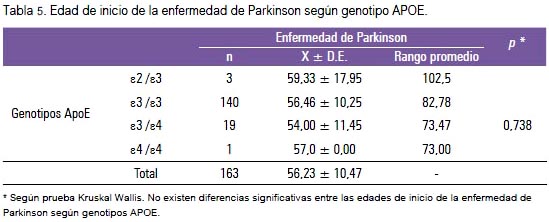
No encontramos diferencias significativas para las frecuencias genotípicas estratificadas por presencia y ausencia del alelo E4, entre casos y controles (tabla 3). No encontramos evidencia suficiente para afirmar que el alelo ε4 sea un factor de riesgo para la EP en la población estudiada (OR: 1.0852) (IC 95%: 0,5812 a 2,0266) (tabla 4). Los rangos de las edades de inicio de la EP, con respecto a los genotipos de ApoE, no mostraron diferencias significativas (tabla 5).
DISCUSIÓN
La tabla 1 muestra la distribución poblacional de sujetos con la EP y sujetos controles en 19 departamentos del Perú, constituyendo el 75% del total de departamentos existentes en el Perú.
Diversos autores mostraron que el alelo ε2, y no el ε4 está asociado con un mayor riesgo para la EP, contrariamente a lo que se encontró en la EA, donde el ε2 es considerado protector (14,17). Además, en poblaciones latinoamericanas, como en México (18), se halló que el alelo ε3 es protector y el ε4 aumenta el riesgo para la enfermedad. Sin embargo, en esta muestra peruana no hubo diferencias entre el grupo de pacientes y el grupo control en cuanto a presencia de genotipos o de los alelos ε2, ε2 y ε4 (tabla 3).
Como en investigaciones previas (19), en este estudio (tabla 5) no se halló disminución de la edad de inicio de la EP con algunos de los alelos. Los resultados podrían estar sesgados por cuanto la información de la edad de inicio de la EP fue proporcionada por el mismo paciente, quien pudiera no dar información exacta debido a que en muchos individuos el inicio de manifestaciones no motoras puede preceder al inicio de síntomas motoras por muchos años. Por lo tanto, es probable que para la mayoría de los individuos que informaron su edad de inicio de la EP era unos años tar los síntomas clínicos de la EP más temprano que aquellos con menor nivel educativo (20).
En este estudio no se halló asociación entre el polimorfismo de la ApoE y el riesgo de desarrollar la EP. Los resultados de falta de asociación entre ApoE y la EP en la muestra peruana, acorde a lo encontrado en estudios realizados en otros países cuyos resultados son variables (14), pueden reflejar la existencia de factores que influyen e interactúan, como por ejemplo distintos genes y factores medioambientales, es decir, la EP como un estado multifactorial.
Este es el primer estudio en el Perú que muestra la distribución de los alelos del gen APOE en pacientes que padecen la EP y sujetos no afectados como controles. Las frecuencias de los alelos encontrados en el grupo control mostraron diferencias y similitudes con otras poblaciones del mundo (21,22).
En conclusión, basados en la población estudiada, no hubo evidencia suficiente para considerar que el alelo ε4 del gen ApoE, ni otro alelo, están asociados con el riesgo de desarrollar la EP en la muestra estudiada. Asimismo, el polimorfismo en el gen de la ApoE no estuvo relacionado con la edad de inicio de la enfermedad.
Es importante considerar que los resultados obtenidos pueden estar influenciados por el tamaño de la muestra, la etnicidad, la edad y género de los participantes, pues es posible que el efecto de la ApoE en el inicio de la EP difiera entre grupos, como sucede en la enfermedad de Alzheimer (7).
REFERENCIAS BIBLIOGRÁFICAS
1. Bekris LM, Mata IF, Zabetian CP. The genetics of Parkinson disease. J Geriatr Psychiatry Neurol. 2010;23(4):228–42.
2. Payami H, Zareparsi S. Genetic epidemiology of Parkinsons disease. J Geriatr Psychiatry Neurol. 1998;11(2):98-106.
3. Corti O, Lesage S, Brice A. What genetics tells us about the causes and mechanisms of Parkinsons disease. Physiol Rev. 2011;91(4):1161–218.
4. Gilgun-Sherki Y, Djaldetti R, Melamed E, Offen D. Polymorphism in candidate genes: implications for the risk and treatment of idiopathic Parkinsons disease. Pharmacogenomics J. 2004;4(5):291–306.
5. Maraganore DM, Farrer MJ, Hardy JA, McDonnell SK, Schaid DJ, Rocca WA. Case-control study of debri soquine 4-hydroxylase, N-acetyltransferase 2, and apolipoprotein E gene polymorphisms in Parkinsons disease. Mov Disord. 2000;15(4):714–9.
6. Siest G, Pillot T, Régis-Bailly A, Leininger-Muller B, Steinmetz J, Galteau MM, et al. Apolipoprotein E: an important gene and protein to follow in laboratory medicine. Clin Chemistry. 1995;41(8):1068–86.
7. Farrer LA, Cupples LA, Haines JL, Hyman B, kukull WA, Mayeux R, et al. Effects of age, sex,and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. JAMA. 1997;278(16):1349–56.
8. Schmechel DE, Saunders AM, Strittmatter WJ, Crain BJ, Hulette CM, Joo SH, et al. Increased amyloid beta-peptide deposition in cerebral cortex as a consequence of apolipoprotein E genotype in late-onset Alzheimer disease. Proc Nat Acad Sci. 1993;90(20):9649–53.
9. Peri DP, Olanow CW, Calne D. Alzheimers disease and Parkinsons disease: distinct entities or extremes of a spectrum of neurodegeneration? AnnNeurol. 1998;44:19–31.
10. Marder K, Tang MX, Cote L, Stern Y, Mayeux R. Thefrequency and associated risk factors for dementia in patients with Parkinsons disease. Arch Neurol. 1995;52(7):695.
11. López M, Guerrero J, Yescas P, Boll M-C, Familiar I, Ochoa A, et al. Apolipoprotein E epsilon4 allele is associated with Parkinson disease risk in a Mexican Mestizo population. Mov Disord. 2007;22(3):417–20.
12. Marder K, Maestre G, Cote L, Mejia H, AlfaroB, Halim A, et al. The apolipoprotein ε4 allele in Parkinsons disease with and without dementia. Neurology. 1994;44(7):1330–1.
13. Blázquez L, Otaegui D, Sáenz A, Paisán-Ruiz C, Emparanza JI, Ruiz-Martinez J, et al. Apolipoprotein E epsilon4 allele in familial and sporadic Parkinsons disease. Neurosci Lett. 2006;406(3):235–9.
14. Huang X, Chen PC, Poole C. APOE-$\varepsilon$2 allele associated with higher prevalence of sporadic Parkinson disease. Neurology. 2004;62(12):2198–202.
15. Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res. 1988;16(3):1215.
16. Hixson JE, Vernier DT. Restriction isotyping of human apolipoprotein E by gene amplification and cleavage with HhaI. J Lipid Res. 1990;31(3):545–8.
17. Apolipoprotein E genotype in familial Parkinsonsdisease. The French Parkinsons Disease Genetics Study Group. J Neurol Neurosurg Psychiatr.1997;63(3):394–5.
18. Gallegos-Arreola MP, Figuera LE, Ortiz GG,Jiménez-Gil FJ, Ramírez-Vega J, Ruíz-SandovalJL, et al. Apolipoprotein E genotypes in Mexican patients with Parkinsons disease. Dis Markers. 2009;27(5):225–30.
19. Parsian A, Racette B, Goldsmith LJ, Perlmutter JS. Parkinsons disease and apolipoprotein E: possible association with dementia but not age at onset.Genomics. 2002;79(3):458–61.
20. Pankratz N, Byder L, Halter C, Rudolph A, Shults CW, Conneally PM, et al. Presence of an APOE4 allele results in significantly earlier onset of Parkinsons disease and a higher risk with dementia. Mov Dis. 2005;21(1):45–9.
21. Marca V, Acosta O, Cornejo-Olivas M, Ortega O, Huerta D, Mazzetti P. [Genetic polymorphism of apolipoprotein E in a Peruvian population]. Rev PeruMed Exp Salud Publica. 2011;28(4):589–94.
22. Singh PP, Singh M, Mastana SS. APOE distribution in world populations with new data from India and the UK. Ann Hum Biol. 2006;33(3):279–308.
Artículo recibido el 14 de marzo de 2013 y aceptado para publicación el 1 de abril de 2013.
Agradecimiento:
Este trabajo fue parte de la tesis de la autora principal, para optar el Grado de Magíster en Bioquímica en la UNMSM.
Los autores declaran que no existen conflictos de intereses.
Correspondencia:
María Victoria Marca Ysabel
Servicio de Neurogenética
Instituto Nacional de Ciencias Neurológicas
Jr. Ancash 1271, Lima 1, Perú
Correo-e: mvmarca@yahoo.com













