Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.74 no.4 Lima Oct./Dec. 2013
ARTÍCULOS ORIGINALES
Efecto de los extractos acuoso e hidroetanólico de hojas de Bixa orellana (achiote) sobre los indicadores no enzimáticos de la hepatotoxicidad por paracetamol, en ratas
Effect of Bixa orellana (achiote) leaves aquous and hydroetanolic extracts on non-enzymatic indicators of paracetamol hepatoxicity in rats
Oscar Huamán1, Miguel Sandoval1, Elsa Béjar1, Zoraida Huamán2, Víctor Tarazona2
1 Centro de Investigación de Bioquímica y Nutrición.
2 Facultad de Ciencias Matemática.
Resumen
Objetivos: Determinar el efecto de los extractos acuoso e hidroetanólico de las hojas de Bixa orellana sobre los indicadores no enzimáticos de hepatotoxicidad, en ratas sometidas a paracetamol. Diseño: Experimental. Institución: Centro de Investigación de Bioquímica y Nutrición, Universidad Nacional Mayor de San Marcos, Lima, Perú. Material biológico: Ratas machos de 3 meses de edad. Intervenciones: Se distribuyó aleatoriamente 35 ratas machos de 3 meses de edad en 5 grupos, que recibieron vía peroral por 10 días: NaCl 0,9% los controles positivo y negativo, silimarina 300 mg/kg, extracto acuoso 500 mg/kg y extracto hidroetanólico 500 mg/kg. Previo ayuno de 24 horas, al quinto día se administró paracetamol (400 mg/kg) peroral, excepto al control negativo. Bajo anestesia con éter, se realizó punción cardiaca para extraer sangre. Principales medidas de resultados: Ratio hepático (peso hígado/peso animal x 100), bilirrubina total (BT), directa (BD) e indirecta (BI), hepatomegalia, especies reactivas al ácido tiobarbitúrico (TBARS) en hígado y suero. Resultados: El tratamiento con extracto acuoso solo disminuyó los indicadores BT y BI (p<0,01), TBARS en suero (p<0,05) y hubo disminución de la masa hepática de -13,2% (p<0,01). En el grupo que recibió el extracto hidroetanólico se redujo la BT, BI (p<0,01), BD (p<0,05), TBARS en hígado (p<0,01) y la masa hepática -9,37%. Conclusiones: Los extractos acuoso e hidroetanólico de hojas de Bixa orellana (achiote) presentarían efecto hepatoprotector frente al paracetamol a dosis tóxica, en ratas.
Palabras clave: Bixa orellana, TBARS, bilirrubina, índice hepático, hepatoprotector.
Abstract
Objectives: To determine the effect of Bixa orellana leaves aqueous and hydroethanolic extracts on non-enzymatic indicators of hepatotoxicity in rats subjected to acetaminophen. Design: Experimental. Setting: Research Center of Biochemistry and Nutrition, Universidad Nacional Mayor de San Marcos, Lima, Peru. Biologic material: Thirty-five male rats aged 3 months. Interventions: Rats were randomized into 5 groups that received orally and for 10 days: positive and negative controls NaCl 0.9%, silymarin 300 mg/kg, aqueous extract 500 mg/kg and hydroethanolic extract 500 mg/kg; after fasting 24 hours, paracetamol 400 mg/kg peroral was administered at the fifth day, except for the negative control. Under ether anesthesia cardiac puncture was performed to obtain blood. Main outcome measures: Liver ratio (liver weight/animal weight x 100), total bilirubin (TB), direct (BD) and indirect (BI) bilirubin, hepatomegaly, thiobarbituric acid reactive species (TBARS) in liver and serum. Results: Treatment with aqueous extract alone decreased the following indicators: BT and BI (p<0.01), serum TBARS (p<0.05), hepatomegaly -13.2% (p<0.01). The group receiving hydroethanolic extract reduced BT, BI (p<0.01), BD (p<0.05), TBARS in liver (p<0.01), hepatomegaly -9.37%. Conclusions: Bixa orellana (achiote) leaves aqueous and hydroethanolic extracts showed hepatoprotective effect against paracetamol in toxic doses in rats.
Keywords: Bixa orellana, TBARS, bilirubin, liver index, hepatoprotective.
INTRODUCCIÓN
Según el análisis de la situación de salud en nuestro país, las enfermedades hepáticas, como la cirrosis y otras enfermedades crónicas del hígado, tienen una tasa de mortalidad de 21,3 por 100 000 habitantes, ocupando el 9º lugar en orden de magnitud entre las defunciones generales y siendo la 2º causa de muerte entre las defunciones registradas para el grupo etario de 20 a 65 años (1,2).
Numerosos estudios epidemiológicos han demostrado una relación entre una menor incidencia de enfermedades crónicas degenerativas y un consumo alto de frutas y vegetales (3,4). Este efecto protector de los alimentos de origen vegetal se debe a diversos nutrientes y fitoquímicos con actividad antioxidante (5-6), los cuales pueden ser empleados como preventivos o coadyuvantes de tratamiento.
Las investigaciones sobre plantas medicinales en los últimos años han tenido por objetivo demostrar las propiedades que se les atribuye, en donde en culturas como la nuestra la falta de un lenguaje gráfico (escritura) ha permitido que parte de esta información ancestral se pierda o se altere con el transcurrir de los años.
La Bixa orellana (achiote) es una planta ampliamente utilizada en la zona de nuestra selva, a la cual se le atribuye propiedades benéficas. Solo algunas de ellas han sido demostradas científicamente, como su efecto antiinflamatorio, cicatrizante de quemaduras (7), antioxidante o antiulceroso (8,9). Estas propiedades están relacionadas con la composición química que presentan principalmente los órganos fotosintéticos (hojas). En estudios publicados se ha demostrado la presencia de flavonoides, como la quercetina (10), y de carotenoides (bixina y norbixina), cuya actividad biológica de hojas y semillas depende de varios factores, entre ellos del tipo de solvente empleado en el extracto, la edad de la planta y la estación al momento de la recolección (11).
En nuestro medio, el uso de la Bixa orellana se limita a las regiones de la selva y hoy se está observando su uso en zonas urbanas debido a las propiedades que se le atribuye. El presente estudio ha tenido la finalidad de demostrar con el rigor científico las propiedades hapatoprotectoras en indicadores no enzimáticos de los extractos acuoso y hidroetanólico de las hojas de Bixa orellana (achiote) en ratas.
MÉTODOS
Se realizó un estudio analítico, experimental, longitudinal. Las hojas de Bixa orellana fueron recolectadas en la localidad de la Peca, Provincia de Bagua, en la región de Amazonas, en los meses de enero de 2011, siendo seleccionadas, limpiadas con una escobilla para retirar el polvo. Las hojas fueron envueltas en papel y colocadas en una bolsa de yute, con la finalidad de evitar la acumulación de vapor, y enviadas a la ciudad de Lima.
Las hojas fueron secadas en una estufa a 37°C, con rotación de aire por 4 días; luego, fueron molidas en molino de cuchillas, en el laboratorio de Farmacognosia de la facultad de Farmacia y Bioquímica de la UNMSM.
Para la obtención del extracto acuoso, se hirvió 1 L de agua, se agregó 20 g de hojas molidas, dejando hervir por 10 minutos; se dejó enfriar y posteriormente se filtró en varias capas de gasa para retirar los sólidos de gran tamaño. Luego, se volvió a filtrar en papel filtro Whatman N° 3, en un sistema rápido al vacío. El filtrado presentó un aspecto pardo cristalino, el que fue colocado en recipiente de amplia superficie a 37°C en estufa con rotación de aire, para un secado rápido de tres días. El residuo sólido fue recolectado en un frasco de color ámbar para su protección de la luz solar.
Con la finalidad de obtener el extracto hidroetanólico, se preparó 1 L de solución de etanol al 50% y se colocó 50 gramos de hojas de Bixa orellana molida, en frasco de color caramelo por 7 días, con movimiento rotatorio por 15 minutos por día. Concluido el tiempo, se filtró siguiendo los pasos empleados para el extracto acuoso, descrito anteriormente.
Los extractos a suministrar fueron reconstituidos a las dosis de 500 mg/ kg en agua, para lo cual se empleó el propilenglicol a una concentración de 0,5% en volumen.
Se empleó 35 ratas machos de 3 meses, con un peso de 282 ± 30,2 g, los cuales fueron adquiridos del Centro de Producción de la Universidad Agraria la Molina y mantenidos en un ambiente con periodo de luz y sombra de 12 horas, alimentación balanceada y agua ad líbitum, por un tiempo de adaptación de 7 días.
Concluido el tiempo de acondicionamiento, los animales fueron distribuidos de forma aleatoria en los siguientes grupos y recibieron las sustancias indicadas, por 10 días:
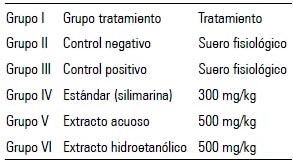
Al sexto día de tratamiento, se les administró paracetamol 400 mg/kg, una hora antes de recibir las dosis respectivas indicadas anteriormente, a excepción del control negativo, el cual recibió suero fisiológico.
Concluidos los 10 días de tratamiento, las ratas fueron sometidas a un ayuno sólido de 24 horas. A horas tempranas se les anestesió con vapor de éter, para la extracción de sangre por punción cardiaca, la cual fue centrifugada a 3 500 rpm por 15 minutos, para obtener el suero y realizar la determinación de los metabolitos no enzimáticos del daño hepático:
-
Bilirrubina directa, indirecta y total, según el método Walters MI y Gerarde HW, Micro J (12).
-
Especie reactivo al ácido tiobarbitúrico, según método de Buege y Aust, en tejido hepático y suero (13).
Ambos resultados fueron expresados en promedio, desviación estándar y porcentaje de inhibición, el cual fue determinado para cada indicador, respecto al control positivo (grupo II), mediante la siguiente fórmula:
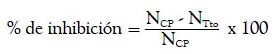
-
NCP: nivel del grupo control positivo.
-
NTto: nivel del grupo que recibió tratamiento de silimarina o extractos.
Posteriormente, los animales fueron sacrificados por dislocación cervical, para realizar laparotomía abdominal con la finalidad de extraer el hígado, el cual fue lavado con solución fisiológica y pesado en balanza analítica. Del lóbulo mayor se extrajo una porción para la determinación de especie reactiva del ácido tiobarbitúrico. Para determinar el índice hepático (% del tejido respecto al peso del animal) y porcentaje de incremento del tejido (hepatomegalia), se empleó la siguiente fórmula:
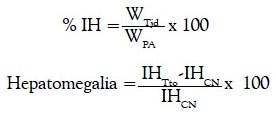
-
%IH: índice hepático.
-
WTjd: peso del tejido (hígado).
-
WPA: peso del animal.
-
IHTto: índice hepático del grupo: control negativo, silimarina o los extractos.
-
IHCN: índice hepático del control negativo.
RESULTADOS
La inducción a la hepatotoxicidad por paracetamol, a dosis de 400 mg/kg, en el grupo II dio como resultado un incremento en todas las fracciones de bilirrubina total, directa e indirecta, respecto al grupo I, de forma significativa.
Se observa en la tabla 1 que la bilirrubina directa se incrementó en el grupo IV (extracto acuoso + paracetamol) respecto al grupo II. Sin embargo, el grupo V (extracto hidroetanólico + paracetamol) presentó valores cercanos al grupo I, expresando una inhibición en los niveles de bilirrubina directa de 38,4%, siendo esta inhibición significativa (p<0,05) respecto al grupo II.
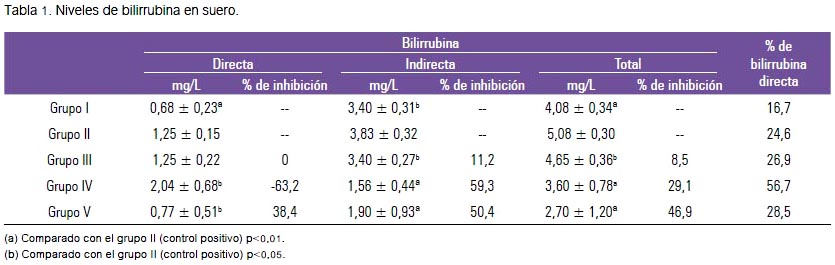
Los niveles de bilirrubina indirecta disminuyeron en el grupo III, mostrando una inhibición 11,2% (p<0,05); los grupos IV y V, respectivamente, mostraron inhibiciones por encima de 50% (p<0,01).
Los resultados presentados en la tabla 2 evidencian que tras los días de tratamiento el grupo II mostró un incremento de la lipoperoxidación expresados en los niveles de TBARS, tanto en tejido hepático y suero, de forma significativa, respecto al grupo I (p<0,01).
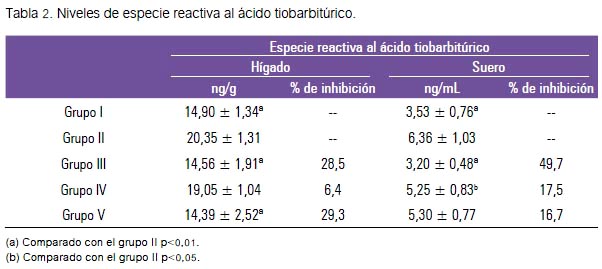
El tratamiento con silimarina 300 mg/kg y paracetamol, grupo III, expresó una inhibición de los niveles de TBARS tanto en tejido hepático y suero de 28,5% y 49,7%, respectivamente (p<0,01).
Respecto al grupo que recibió el extracto acuoso y paracetamol (IV) mostró niveles inferiores de TBARS tanto en tejido hepático como en suero, siendo la inhibición de 6,4% y 17,5%, respectivamente. Sin embargo, solo este último mostró una disminución significativa (p<0,05). Los animales que recibieron el extracto hidroetanólico más paracetamol (grupo V) disminuyeron los niveles de TBARS en ambos tejidos, presentando en el tejido hepático una inhibición de 29,3% (p<0,01).
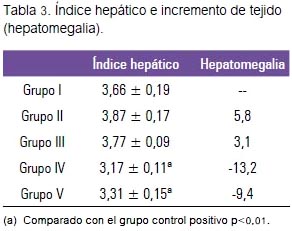
El tratamiento con paracetamol en el grupo II indujo al incremento del tejido hepático, tal como los demuestra al compararlo con el grupo I, sin llegar a ser significativo.
El grupo III (silimarina + paracetamol) presentó un incremento de tejido hepático de solo 3,1%, respecto al grupo I. Sin embargo, los grupos IV y V mostraron reducción de la masa hepática de -13,2% y -9,4%, respectivamente, tal como se muestra en la tabla 3, siendo esta disminución significativa (p<0,01).
DISCUSIÓN
El empleo de plantas medicinales es una práctica tan antigua como la civilización. Sin embargo, el uso y la efectividad no siempre han sido constantes en la práctica de la fitoterapia, debido a que parte de la información ha sido transmitida de forma oral, tendiendo a distorsionarse con el tiempo, lo cual nos obliga a demostrar su eficacia con el rigor científico.
El hígado es un órgano muy noble que realiza muchas funciones y su alteración como crecimiento (hepatomegalia) es un signo común que antecede principalmente a la cirrosis hepática, causada por el alcoholismo, hepatitis B y fármacos, pero que también puede estar asociada algún tipo de leucemia, parásitos, tumores, anemias, además de otros trastornos metabólicos (14,15).
El hígado compensa hasta cierto punto las acciones nocivas de diversos compuestos, entre ellos el paracetamol, capaz de generar lesiones hepáticas iníciales. Sin embargo, cuando la reserva funcional del hígado decae, se origina un daño hepático secundario, a menudo asociado a algunas enfermedades, pudiendo poner en peligro la vida (16). La producción de radicales ocurre como un subproducto del metabolismo oxidativo celular y, en el hígado, este metabolismo aumenta con la ingestión de alimentos, tóxicos (medicamentos, alcohol) o cualquier otro agente externo capaz de provocar estrés oxidativo (17).
El paracetamol es un medicamento que en condiciones normales es glucoronizado y sulfatado en 90% y luego eliminado por vía urinaria. Es utilizado como analgésico y antipirético y a dosis normal no produce efecto hepatotóxico; pero, en caso de sobredosis puede producir daño hepático (18); este daño involucra la generación de radicales libres de oxigeno (ROS), el cual ataca a los ácidos grasos poliinsaturados de membrana, generando la peroxidación lipídica y con ello la inestabilidad de la misma y después la lisis celular. Durante el proceso de agresión se generan dialdehidos, los cuales son considerados marcadores de la lipoperoxidación ocasionada por radicales libre (19). En nuestro estudio se evidenció que el paracetamol a dosis de 400 mg/kg de peso produjo un incremento de TBARS, los cuales se generarían principalmente de la lipoperoxidación.
Al administrar dosis altas de la droga (paracetamol), el citocromo P450 (CYP2E1, CYP1A2 y CYP3A) genera cantidades de NAPQI capaces de agotar las reservas hepáticas de glutatión.
Este metabolito ejerce su toxicidad al unirse de forma covalente a macro-moléculas y producir radicales libres, desarrollando necrosis hepática en tan solo 12 horas. En mucha menor medida, el mismo proceso puede ocurrir en el riñón y contribuir a la nefrotoxicidad (20,21).
Además, el paracetamol es peroxidado por la mieloperoxidasa y la COX-1, produciendo metabolitos hepatotóxicos y provocando daño hepático en pacientes con insuficiencia renal crónica y asma, en particular por la supuesta seguridad del paracetamol en estas enfermedades (22).
Por lo anteriormente descrito, se explicaría por qué el grupo que recibió paracetamol sin protección (grupo II) mostró niveles altos de TBARS tanto en el hígado como en suero, demostrando que la técnica de inducción a daño hepático es correcta, tal como lo describe Hiroshini (23). Estos resultados también fueron comunicados por Troncoso empleando una dosis menor de paracetamol 200 mg/kg de peso (24).
El grupo que recibió el tratamiento con extracto acuoso y paracetamol redujo los niveles de TBARS tanto en tejido hepático como en suero. En este último presentó una inhibición de los niveles en 17,5%, pero sin alcanzar los niveles que mostró el grupo I ni presentar la efectividad que se observó en el grupo de silimarina (49,7%). Y los animales que recibieron el extracto hidroetanólico mostraron una disminución de los niveles de TBARS, tanto en hígado como en suero. Sin embargo, solo en el primero la disminución fue significativa (p<0,01), con inhibición de 29,3%, siendo mayor a lo obtenido por el grupo que recibió silimarina (28,5%).
Frente a estos resultados se puede observar que los tratamientos con los diferentes extractos inducen a una reducción tanto en el tejido hepático como en suero. Estos resultados pueden ser atribuidos a la actividad de los metabolitos secundarios, como los flavonoides y los carotenoides presentes en los extractos acuoso e hidroetanólico. Muchos de estos metabolitos tienen actividad antioxidante, protegiendo a las macromoléculas, tales como el ADN, proteínas y los ácidos grasos poliinsaturados (19), siendo estos últimos una de las moléculas más susceptibles frente al ataque de los radicales libres que se generan por la biotransformación del paracetamol por acción del citocromo P450 (25).
En el estudio realizado por Sakuragui con los carotenoides bixina y norbixina en hepatomas humanos, se demostró la capacidad que tienen de promover el citocromo P450, en especial la bixina, como un promotor de CYP 1A1 y 1A2 in vitro. Sin embargo, dicha inducción ejercida por los carotenoides evidenciaron una toxicidad baja (26); esto nos indica que probablemente uno de los componentes carotenoides presentes en los extractos empleados en nuestro estudio podría promover la acción del P450 sin evidenciar grado de toxicidad significativo y con ello un menor daño frente al paracetamol.
El tratamiento con paracetamol en el grupo II causó un incremento de la bilirrubina total, directa (p<0,01) e indirecta (p<0,05), respecto al grupo I, lo cual nos indica daño hepatocelular. Este incremento del total y las fracciones de bilirrubina se observa en otros trabajos, en donde el agente inductor de la toxicidad genera también radicales libres, causando daño celular y con ello el aumento sérico de las fracciones de bilirrubina, tal como lo comunica Favari-Perozzi (27), quien empleó tetracloruro de carbono, el que es un generador de radicales de cloro.
En el grupo III (silimarina + paracetamol) se presentó un incremento de la bilirrubina directa. Sin embargo, la bilirrubina indirecta se mantuvo constante; ambos, comparados con el grupo I. Los niveles de bilirrubina total se redujeron respecto al grupo II, siendo esta disminución significativa (p<0,05), logrando una inhibición de 8,5%.
El grupo que recibió el extracto acuoso con paracetamol presentó una inhibición en los niveles de bilirrubina total de 29,1%, siendo esta reducción significativa. La bilirrubina directa por el contrario se incrementó, representando el 56,7% de la bilirrubina total; dicho incremento estaría relacionado con daño hepatocelular originado por sustancias tóxicas.
El tratamiento con extracto hidroetanólico más paracetamol disminuyó los niveles de bilirrubina total, directa e indirecta, expresando una inhibición de los niveles de 46,9%; 38,4% y 50,4%, respectivamente, siendo estos niveles más bajos que los encontrados en el grupo I. Sin embargo, el porcentaje de bilirrubina directa respecto al total fue 28,5%, lo cual nos indica también un probable daño celular, respecto al grupo I, que expresó solo 16,7% en bilirrubina directa.
El índice hepático se incrementó en los grupos II y III, con aumentos (hepatomegalia) de 5,8% y 3,1%, siendo estos incrementos no significativos. Estos resultados fueron contrarios a los encontrados por Troncoso (24), quien halló que a dosis de 200 mg/kg de paracetamol se produjo una reducción no significativa. Estos resultados pueden ser explicados por la dosis empleada.
Sin embargo, el tratamiento previo con extracto acuoso + paracetamol (grupo IV) e hidroetanólico + paracetamol (grupo V) expresaron una reducción del índice hepático de forma significativa (p<0,01), siendo los índices de hepatomegalia -13,2% y -9,4%, respectivamente.
Existen evidencias que nos permiten concluir que los extractos acuoso e hidroetanólico protegen del daño originado por la producción de radicales libres provenientes del metabolismo del paracetamol.
REFERENCIAS BIBLIOGRÁFICAS
1. Farfán G, Cabezas C. Mortalidad por enfermedades digestivas y hepatobiliares en el Perú, 1995-2000. Rev Gastroenterol. 2002;22(4):310-23. [ Links ]
2. Perú, Ministerio de Salud. Análisis de la situación de salud del Perú. Ministerio de Salud Dirección General de Epidemiología; 2010. Disponible en http://www.slideshare.net/consultoriauniversidad/analisis-de-situacion-de-salud-del-peru-ao-2010. [ Links ]
3. Coria-Cayupan Y, Ochoa M, Nazareno M. Healthpromoting substances and antioxidant properties of opuntia sp. fruits. Changes in bioactivecompound content during ripening process. Food Chem. 2011;126(2):514-9. [ Links ]
4. Butera D, Tesoriere L, Di Gaudio f, Bongiomo A, Allegra M, Pintaudi A, Kohen R, Livrea M. Antioxidant activities of sicilian pickly pear (opuntia ficus indica) fruit extractus and reducing properties of its betalains: betanin and indicathin. j Agric food Chem. 2002;50(23):6895-901. [ Links ]
5. Prior R. Fruits and vegetables in the prevention of cellular oxidative damage. Am j Clin Nutr. 2003;78:570-8. [ Links ]
6. Troncoso L, Guija E. Efecto antioxidante y hepatoprotector del Petroselinum sativum (perejil) en ratas, con intoxicación hepática inducida por paracetamol. An fac med. 2007;68(4):333-43. [ Links ]
7. Li FE. Actividad biológica del extracto acuoso atomizado de hojas de Bixa orellana L. (achiote) en animales de experimentación. Tesis de Maestría. Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú. 1999. [ Links ]
8. Huamán O, Sandoval M, Arnao I, Béjar E. Efecto antiulceroso del extracto hidroalcohólico liofilizado de hojas de Bixa orellana (achiote), en ratas. An fac med. 2009;70(2):97-102.
9. Huamán O, Arnao I, Béjar E, Sandoval M. Efecto del extracto hidroalcohólico liofilizado de hojas de Bixa orellana (achiote), en la secreción gástrica de ratas. An fac med. 2007;68(4):314-20. [ Links ]
10. Juárez S. Caracterização, extração e purificaçãopor cromatografia de compostos de urucum (Bixa orellana L.). Tesis de Maestría. Universidade Federal de Santa Catarina. Florianópolis. 2005. [ Links ]
11. Kasmuller S, Steinkellner HB, Majer EC, Nobis G, Scharf F, Kassie F. Search for dietary antimutagens and anticarcinogens: methodological aspect and extrapolation aspect problems. Food Chemical Toxicol. 2002;40:1051-62. [ Links ]
12. Wallters M, Gerarde H. An ultramicromethod for the determination of conjugated and total bilirrubin in serum on plasma. Microchem j. 1970;15:231-43. [ Links ]
13. Buege J, Aust S. Microsomal lipid peroxidation. Methods Enzymol. 1978;52;302-6. [ Links ]
14. Leighton F, Urquiaga I. Polifenoles del vino y salud humana. Antioxidantes y calidad de vida. 2000;7(27):5-13. [ Links ]
15. Hertog MGL, Feskens EJM, Hollman PCh, Katan MB, Kromhout D. Dietary antioxidant flavonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet. 1993;342:1007-11. [ Links ]
16. Hernando Y. Polifenoles del vino. La clave de su capacidad antioxidante. Boletín Ciencia, Vino y Salud. 1998;2(2):7-8. [ Links ]
17. Leighton F, Urquiaga I, Diez M. Propiedades antioxidantes del vino y sus componentes. 77ª Asamblea General de la OIV y XXII congreso de la Vid y del Vino. Buenos Aires, Argentina. 1997. [ Links ]
18. William L. Drug-induced hepatotoxicity. N Engl j Med. 2003;349:474-85. [ Links ]
19. Valko M, Leibfritz D, Moncol J, Cronin M, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int j Biochem Biol. 2007;39:44-84. [ Links ]
20. Sisamón IA. Acerca de la hepatotoxicidad del paracetamol. Rev Hosp Privado de Comunidad. 2003;6(2). [ Links ]
21. Takahashi T, Lasker JM, Rosman AS, Lieber CS. Induction of cytochrome P-4502 E1 in the human liver by ethanol is caused by a correspondingincrease in encoding messenger RNA. hepatology.1993;17(2):236-45. [ Links ]
22. Graham G, Scott K, Day R. Tolerability of paracetamol. Drugs. 2003;63 (Special Issue 2):39-42. [ Links ]
23. Hiroshini A, Toshiharu H, Masahiro H, Sholi. An alteration in live microsomal membrane of the rat following paracetamol overdose. J Pharm Phamacol. 1987;39:1047-9. [ Links ]
24. Troncoso L, Guija E. Efecto antioxidante y hepatoprotector del Petroselinum sativum (perejil) en ratas, con intoxicación hepática inducida por paracetamol. An fac med. 2007;68(4):333-43. [ Links ]
25. Rocha C, Bolognesi V, Gaspari J, Gomes O, Klocker O. Carotenoides bixina e norbixina extraídos do urucum (Bixa orellana L.) como antioxidantes em produtos cárneos. Ciência Rural, Santa Maria. 2012;42(8):1510-7. [ Links ]
26. Sakuragui M. Indução do sistema citocromo P450 em linhagens de hepatoma humano para utilizaçãocomo modelo in vitro no desenvolvimento de fármacos. [Tese para obtençãu do grau de Doctor] São Paulo 2011. [ Links ]
27. Favari-Perozzi L, Nava-Álvarez R, Meléndez-Camargo ME. Probable efecto hepatoprotector de la verbena en la hepatitis inducida con tetracloruro de carbono en la rata. Rev Mex cienc farm. 2007;38(3):19-25. [ Links ]
Artículo recibido el 15 de mayo de 2013 y aceptado para publicación el 30 de junio de 2013.
Fuente de Financiamiento: FEDU 2011 UNMSM.
Correspondencia:
Oscar Gustavo Huamán Gutiérrez
Celular: 998-553907
Correo electrónico: oscarhuaman@hotmail.com













