Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.75 no.2 Lima Apr. 2014
ARTÍCULO ORIGINAL
Respuesta al tratamiento de la Enfermedad de Graves-Basedow en pacientes pediátricos
Response to Graves-Basedow Disease treatment in pediatric patients
Martha Calagua Quispe1; Oswaldo Núñez Almache1,2; Juan Falen Boggio3; Carlos Del Águila Villar1,2; Rómulo Lu de Lama1; María Isabel Rojas Gabulli1,2; Eliana Chávez Tejada1; Oscar Espinoza Robles1; Paola Pinto Ibarcena1.
1 Servicio de Endocrinología del Instituto Nacional de Salud del Niño.
2 Facultad de Medicina Hipólito Unanue, Universidad Nacional Federico Villarreal.
3 Profesor Emérito de la Universidad Nacional Federico Villarreal.
Resumen
Objetivos: Describir la respuesta clínica y bioquímica al tratamiento del hipertiroidismo por enfermedad de Graves en pacientes pediátricos. Diseño: Estudio retrospectivo. Institución: Instituto Nacional de Salud del Niño, Lima, Perú. Participantes: Niños con enfermedad de Graves. Métodos: Se incluyó 32 pacientes con diagnóstico de hipertiroidismo por Enfermedad de Graves, entre 1996 a 2007. Se consideró remisión, cuando se encontraban asintomáticos y bioquímicamente eutiroideos, luego de 6 meses de suspendido el tratamiento; y recaída, si luego de este periodo de tiempo, se encontró valores hormonales alterados. Principales medidas de resultados: Remisión o recaída luego del tratamiento. Resultados: Al diagnóstico, la edad promedio fue 10,5 años (3,2 a 17,9 años); 26 pacientes (81,2%) fueron de sexo femenino, 13 (40,6%) púberes y 19 (59,3%) pre-púberes. Los síntomas y signos más frecuentes fueron bocio, sudoración, nerviosismo, pérdida de peso, taquicardia y exoftalmos. Se usó metimazol como primera opción terapéutica a una dosis inicial promedio de 0,78 mg/kg/ día (0,4 a 2 mg/kg/día). La TSH (57,1%) y el T4L (50%) alcanzaron valores normales entre los 6 y 8 meses. Se observó remisión en 11 pacientes (34,3%), 3 (9,3%) sufrieron recaída, 12 (37,5%) pasaron a tratamiento con radioyodo (I131) y 6 (18,7%) continuaron recibiendo metimazol. La remisión de la enfermedad se alcanzó a los 2,81± 0,91 años de tratamiento (rango de 1.5 a 4,8); 4,1% remitió luego del primer año, y 35,3%, 37,5% y 25% luego del segundo, tercer y cuarto año de tratamiento, respectivamente. La edad promedio de los que recibieron I131 fue 14,6 años (7,1 a 19,6 años), a una dosis alrededor de 7mCi. El 75% de ellos remitió a los 0,64± 0,60 años (rango de 0,16 a 1,5 años). Conclusiones: El hipertiroidismo por enfermedad de Graves es de relativa frecuencia en pediatría. Se obtuvo remisión en 34,3% de pacientes tratados con metimazol en un tiempo promedio de 2,81± 0,91 años y se alcanzó remisión en 75% de los tratados con I131, en un tiempo promedio de 0,64+/- 0,60 años.
Palabras clave: Hipertiroidismo, bocio, tratamiento.
Abstract
Objectives: To describe the clinical and biochemical response to treatment of hyperthyroidism. Design: Retrospective study. Setting: Instituto Nacional de Salud del Niño, Lima, Peru. Participants: Children. Methods: From 1996 to 2007 32 patients with diagnosis of hyperthyroidism were studied. Remission was defined when patients were asymptomatic and biochemically euthyroid 6 months after the end of treatment; relapse when altered hormone levels were found after this period of time. Main outcome measures: Remission or relapse following treatment. Results: Mean age at diagnosis was 10.5 years (3.2-17.9 years), 26 patients (81.2 %) were female; 13 (40.6 %) were pubertal and 19 (59.3%) prepubertal. The most frequent symptoms and signs were: goiter, sweating, nervousness, weight loss, tachycardia and exophthalmos. Methimazole was used as first therapeutic option. Initial dose was 0.78mg/kg/day (0.41-2mg/kg/day) average. TSH (57.1%) and FT4 (50%) reached normal values between 6 and 8 months. Remission was observed in 11 patients (34.3%), 3 (9.3%) relapsed, 12 (37.5%) then received treatment with radioiodine (I-131) and 6 (18.7%) continued receiving methimazole. Remission was achieved after 2.81 ± 0.91 years of treatment (range 1.5-4.8), 4.1% after the first year, and 35.3%, 37.5% and 25% respectively after the second, third and fourth year of treatment. Average age of those receiving I-131 was 14.6 years (7.1-19.6 years), at a dose about 7mCi; 75% of them showed remission after 0.64 ± 0.60 year (range 0.16-1.5 years). Conclusions: Hyperthyroidism due to Graves disease is relatively common in children. Remission was obtained in 34.3% of patients treated with methimazole in 2.81 ± 0.91 years average and remission was achieved in 75% of patients treated with I131, in 0.64 + / - 0.60 years average.
Keywords: Hyperthyroidism, goiter, treatment.
INTRODUCCIÓN
El hipertiroidismo es un estado de hipermetabolismo causado por el aumento de las hormonas tiroideas (HT) (tiroxina -T4- y/o triyodotironina -T3-), lo cual causa efectos sistémicos negativos (1). La enfermedad de Graves-Basedow (EGB) representa el 95% de las causas de hipertiroidismo en la niñez. Se trata de un trastorno autoinmune producido por autoanticuerpos estimuladores del receptor de tirotropina (TSI), que provoca hipersecreción de HT, hipertrofia e hiperplasia de la glándula e infiltración linfocítica de células T (2). Existe un 80% de susceptibilidad, con una herencia poligénica asociada al gen del antígeno leucocitario humano (HLA) y sus haplotipos Al, B8 y DR3 (2,3).
La EGB ocurre en 0,02% de niños (1/5 000); su frecuencia se incrementa con la edad, siendo mayor en la adolescencia. El cuadro clínico suele ser insidioso y progresivo. A menor edad los síntomas pueden ser inespecíficos, mientras que en adolescentes se describe un cuadro clásico (3,4). Se reporta la presencia de bocio como la manifestación clínica más frecuente, encontrado en más de 95% de niños, y taquicardia en más de 70% de pacientes (1,3-5). Se ha hallado predominio de síntomas neuropsiquiátricos, tales como hiperactividad e insomnio (4). Un estudio previo en el Instituto Nacional de Salud del Niño (INSN) muestra la presencia de nerviosismo en 55% de pacientes (5). Es característica patognomónica, pero excepcional en niños, la dermopatía infiltrativa o mixedema pretibial. Así mismo, el exoftalmos es poco frecuente en niños y suele ser menos severo (1-3).
El diagnóstico se confirma al constatar una TSH suprimida y/o la T3, T4 total o fracciones libres elevadas.
Entre las opciones de manejo se cuenta con las drogas antitiroideas (DAT), el I131 y la tiroidectomía. El tratamiento de elección son las DAT a dosis de 0,5 a 1 mg/kg/día (2). En la literatura se halla porcentajes de remisión menores al 30% y de recaídas en más de 70% de pacientes que reciben DAT (6); mientras que el uso de iodo radiactivo muestra mejores resultados; sin embargo, su uso no ha sido de primera elección por el riesgo de hipotiroidismo permanente y sus posibles efectos teratogénicos y carcinogénicos (6,7). Estas opciones terapéuticas han sido y son objeto de controversias, al no haber cura específica para la enfermedad y estar cada una de ellas asociada a complicaciones, lo cual hace necesario un mayor número de estudios que evalúen la eficacia y seguridad de los diferentes tratamientos.
El objetivo del presente estudio fue describir la respuesta clínica y bioquímica al tratamiento del hipertiroidismo por enfermedad de Graves en pacientes atendidos en el Instituto Nacional de Salud del Niño, entre 1996 y 2007.
MÉTODOS
En el presente estudio retrospectivo, se incluyó 32 historias clínicas de pacientes menores de 18 años, con diagnóstico de hipertiroidismo por Enfermedad de Graves, atendidos en el servicio de Endocrinología del INSN durante los años 1996 a 2007, que recibieron tratamiento con drogas antitiroideas, I131 o cirugía y tuvieron un seguimiento mínimo de 6 meses. En relación a las características clínicas, se incluyó edad, sexo, patología asociada, historia familiar de enfermedad tiroidea autoinmune en familiares de primer y/o segundo grado, tales como enfermedad de Graves Basedow (EGB) o tiroiditis de Hashimoto. En los datos antropométricos y el desarrollo puberal, se evaluó el peso y la talla utilizando una balanza mecánica calibrada y un estadiómetro de pared marca Perspective Enterprises. Se calculó el índice de masa corporal (IMC) dividiendo el peso (kg)/la talla al cuadrado (m2). Se determinó el puntaje Z para talla e IMC mediante la siguiente fórmula:
talla o IMC del paciente – talla o IMC para la edad y género/DE
en base a las referencias del National Center for Health Statistics (NCHS). Se consideró el desarrollo puberal en dos grupos según estadios de Tanner: prepúberes (Tanner 1) y púberes (Tanner 2 a 5). En relación a los síntomas y signos, se anotó la presencia de nerviosismo, sudoración, labilidad emocional, hiperdefecación, palpitaciones, fatiga, pérdida de peso, poliuria, bajo rendimiento escolar, tremor, taquicardia, hiperreflexia, bocio y oftalmopatía. Se clasificó el tamaño del bocio de acuerdo a Pérez y col. (8), siendo 1N el tamaño normal, cuando la glándula tiroides no era más grande que la falange terminal del dedo pulgar del paciente; 2N si era dos veces mayor, y 3N cuando era el triple (<2N leve, 2N a 3N moderado y >3N severo). La severidad de la oftalmopatía de Graves se valoró de acuerdo a la clasificación de Werner, con rango entre 0 a VI (9): Clase 0 – No síntomas o signos; Clase I – Solamente signos, no síntomas (ej, retracción de párpados, mirada fija); Clase II – Compromiso de tejido blando; Clase III – Proptosis; Clase IV – Compromiso de músculos extraoculares; Clase V – Compromiso corneal; Clase VI – Pérdida de vista (compromiso de nervio óptico).
En relación a las características bioquímicas, se consideró las determinaciones de tirotropina (TSH), T4 libre y T3 total, realizados por el método de ELISA o quimioluminiscencia y los anticuerpos anti-peroxidasa (TPO) y anti tiroglobulina (Tg) por enzimoinmunoensayo. En el tratamiento se consignó el tipo, dosis y duración del tratamiento con DAT, betabloqueadores o I131. La reacción adversa a medicamentos (RAM) se clasificó de acuerdo a Cooper y col (4): como RAM menor, si el paciente presentó el prurito generalizado, artralgia y síntomas gastrointestinales, y RAM mayor si presentó agranulocitosis, hepatotoxicidad o vasculitis. En la evolución de los pacientes se registró las evaluaciones clínicas y bioquímicas para el reajuste del tratamiento instaurado en los siguientes periodos: primera consulta; segunda consulta, dentro de los 2 primeros meses; tercera, cuarta y quinta cada 3 meses, durante el primer año; y, luego, cada 6 meses, hasta terminar el período de observación, totalizando 6 a 15 observaciones. Se consideró remisión si el paciente se encontraba asintomático y/o eutiroideo luego de 6 meses de suspendido el tratamiento; y recaída, cuando se encontró valores hormonales alterados luego de un periodo mayor a 6 meses de eutiroidismo sin tratamiento.
Para los análisis estadísticos, se utilizó los programas SPSS 16 para Windows y el programa Microsoft office Excel 2007 como base de datos, análisis estadístico y confección de gráficos. Se realizó medidas de posición (media y mediana) y dispersión (desviación estándar, mínimo, máximo y rango). Se construyó tablas univariadas y bivariadas con respecto a la evolución, expresadas en cantidades y porcentajes, así como, sus respectivos gráficos.
RESULTADOS
Se evaluó 32 pacientes, 26 (81,2%) de sexo femenino y 6 (18,8%) de sexo masculino, con una relación femenino/ masculino de 4,3:1. La edad promedio al momento del diagnóstico fue de 10,5 años (rango 3,1-17,8 años); tres niños (9,3%) eran menores de 6 años, once (34,3%) entre 6 y 10 años y 18 (56,2%) mayores de 10 años. Al momento del diagnóstico, 19 (59,3%) eran pre-púberes y 13 (40,6%) púberes, con una media de edad de 8,5 + 2,6 años para los pre-púberes y de 13,3 + 2,0 años para los púberes. Se encontró un paciente con síndrome de Down y otro con lupus eritematoso sistémico, ambos de sexo femenino. El antecedente familiar de patología tiroidea autoinmune se observó en 10 pacientes (35,7%).
El tiempo de enfermedad fue 7,04 + 6,5 meses. La distribución según los síntomas y signos se muestra en la tabla 1. En el 100% de pacientes se observó bocio de superficie regular e incrementado de consistencia, de grado moderado y severo en 59,4%; de los cuales fueron pre-púberes 68,4%. El tamaño se mantuvo en 48% y 33% de los pacientes luego del primer y segundo año de tratamiento, respectivamente. La pérdida de peso al diagnóstico, expresada en puntaje z de IMC (zIMC), fue de –1,02 (rango -3,2 a +1,3), con una media de -0,7 y -1,3 en pre-púberes y púberes, respectivamente. Durante los primeros 6 meses de evolución, la media del zIMC mostró un incremento de -1,02 a -0,18. La taquicardia disminuyó de manera progresiva a lo largo del tratamiento con DAT y beta-bloqueadores, evidenciando una disminución de las medias de 110 a 89 latidos x minuto dentro de los primeros 3 meses. La oftalmopatía, desde retracción palpebral (grado 1) a protrusión ocular (grado 3), estuvo presente en 75% de pacientes, pero no se pudo precisar su evolución. La media de la talla al diagnóstico, expresada en puntaje z de talla (z talla), fue -0,22 (rango -2,3 a +2.4), con solo 2 pacientes pre-púberes con talla >2DE.
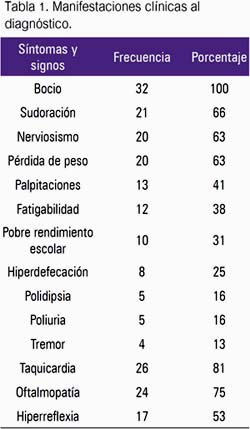
Al diagnóstico, la media de las hormonas tiroideas fueron TSH 0,089 uUI/ mL; T4-L 3,8 ng/dL, y T3 total 362,9 ng/dL. Al evaluar la función tiroidea de acuerdo a desarrollo puberal, se encontró que en pre-púberes la media de TSH era 0,05 uUI/mL, T4L 3,9 ng/dL, y T3t 291,6 ng/dL; mientras que en púberes la media de TSH era 0,15 uUI/mL, T4L 3,6 ng/dL, y T3t 462,4 ng/dL. Se evaluó la evolución de las hormonas tiroideas durante el tratamiento y se observó que TSH (57,1%) y T4L (50%) alcanzaron valores normales entre los 6 y 8 meses; mientras que a los 2 años lo hicieron 72,7% y 50%, respectivamente. La media de los anticuerpos anti-TPO fue 550,37 UI/mL (38,9 a 2246 UI/mL) y de anti Tg 715,44 UI/mL (133 a 1408 UI/mL), siendo positivos en 92,8% y 64,3% de pacientes, respectivamente.
El promedio de tiempo de seguimiento fue 3,6 ± 1,6 años (rango 0,5 a 7,1). El 100% inició tratamiento con drogas antitiroideas, utilizando metimazol a una dosis media de 0,78 mg/kg/ día (0,4 a 2 mg/kg/día). El 87,5% de los pacientes recibió propranolol a una dosis promedio de 1,97 mg/kg (0,25 a 3,4 mg/kg) por un promedio de 5,09 meses (1,06 a 10,7). El 34,3% de los pacientes requirió el uso de beta-bloqueadores en más de una oportunidad, por exacerbación de los síntomas adrenérgicos.
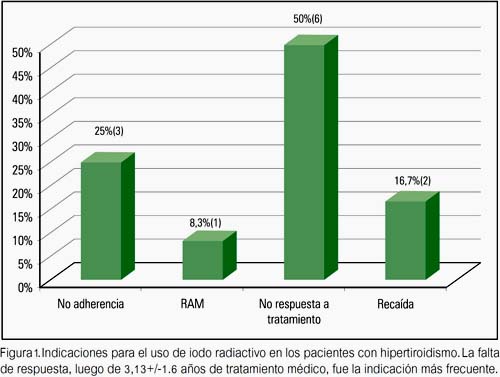
De los 32 pacientes que iniciaron tratamiento con antitiroideos, 11 (34,3%) remitieron; 12 (37,5%) pasaron a tratamiento con I131, 6 (18,7%) continuaron tratamiento al momento del corte del estudio y 3 (9,3%) abandonaron el tratamiento. Tres (9,3%) pacientes presentaron recaída, 2 de los cuales pasaron a recibir I131 y uno reinició DAT con el posterior abandono del tratamiento. Los pacientes que remitieron tuvieron un tiempo medio de tratamiento con DAT de 2,81± 0,91 años (1,5 a 4,8 años); el 4,1% remitió luego del primer año, 35,3%, 37,5% y 25% luego del segundo, tercer y cuarto año de tratamiento, respectivamente.
Los pacientes que recibieron I131, tenían una edad promedio de 14,6 años (7,0 a 19,6 años), la dosis promedio fue 7 mCi. En la figura 1 se muestra las indicaciones para el uso I131. De los 12 pacientes que recibieron iodo, 9 (75%) presentaron remisión en un tiempo promedio de 0,64 ± 0,60 años (0,16 a 1,58 años); en un solo caso (síndrome de Down) se requirió 3 dosis de I131. Durante el seguimiento, 2 (22,2%) pacientes cursaron eutiroideos, 7 (77,7%) presentaron hipotiroidismo, por lo cual recibieron tratamiento con levotiroxina. No se tuvo datos de la evolución de 3 pacientes.
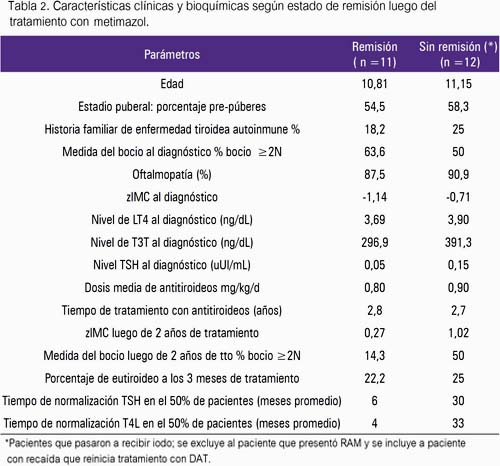
En la tabla 2, se describe las características clínicas y bioquímicas según estado de remisión luego del tratamiento con metimazol.
DISCUSIÓN
La EGB, causa más frecuente de hipertiroidismo, es una enfermedad rara en los niños; ocurre en 1/5 000 y con mayor frecuencia se observa en los adolescentes (10). Se describe un pico de incidencia entre los 11 y 15 años de edad (2,4,11) con una distribución de 80% de mayores de 10 años (3). En nuestro estudio, el promedio de edad de presentación fue de 10,5 años (3,17-19) con una distribución de edades similar a nuestra publicación anterior (5). En relación al estadio puberal al diagnóstico, Lazar (12) y Shulman (7) encuentran 17,5 y 32% de pre-púberes, respectivamente. Nosotros hallamos que 59,4% fueron prepúberes, similar a lo comunicado por Zanolli (4), probablemente como consecuencia de la disminución en la edad de presentación de la enfermedad.
En nuestro trabajo encontramos el antecedente de enfermedad tiroidea autoinmune en un 35%, diferente al 60% hallado en la literatura (10,11). Lo cual podría demostrar la diversa condición genética y ambiental de las poblaciones o podría estar asociada a un sub-registro o desconocimiento de tales enfermedades en nuestra población.
En pacientes con síndrome de Down se describe un bajo porcentaje de casos de hipertiroidismo (13,14). Filippo De Luca (14) halla una prevalencia más alta (6,5%) que la población general, con edad temprana de presentación, no predominancia del sexo, curso clínico menos severo y mayor frecuencia de antecedentes familiares de enfermedad tiroidea. Falen y del Águila encuentran una frecuencia de 2/42 casos (5), Zanolli y col 2/38 (6); nosotros hallamos una frecuencia similar 1/32, pero con un cuadro severo y pobre respuesta al tratamiento.
El cuadro clínico del hipertiroidismo suele ser de inicio insidioso y progresivo. El cuadro clásico tarda en instalarse entre 6 a 12 meses (2,10), lo cual concuerda con el tiempo de enfermedad de 7,04 meses encontrado en el presente trabajo. En niños pre-púberes la presentación suele ser atípica y el curso clínico más severo (12); sin embargo, estas características no se evidenciaron en el presente estudio, puesto que los niños pre-púberes cursaron con el cuadro clásico. Las manifestaciones clínicas observadas en el estudio fueron similares al de otras series reportadas (5,6,9,10). Se encontró bocio en 100% de pacientes, cuyo tamaño en 59% fue de moderado a severo. La pérdida de peso con una media de z score de IMC al diagnóstico de –1,02 fue mayor a lo reportado por otras series (10,11) y podría deberse a un estado nutricional previo menoscabado.
La literatura (15,16) describe que la severidad del compromiso oftalmológico parece ser menor en niños en comparación a los adultos, no encontrando lesión en músculo, córnea, ni pérdida de la agudeza visual. En nuestro estudio hallamos alteraciones oftálmicas leves, como eritema conjuntival, retracción palpebral y proptosis en 75% de pacientes.
El tratamiento de la EGB se basa en el uso de DAT como primera línea, el I 131 y la cirugía; estas terapias han sido usadas por más de 5 décadas (16). El objetivo de la terapia es alcanzar un estado eutiroideo, donde los beneficios del procedimiento superen los riesgos (15,16). El tipo apropiado de manejo es controversial y varía entre las instituciones y entre los médicos (16,17).
En el INSN se usa metimazol como primera opción terapéutica; la dosis media de inicio fue 0,78 mg/kg/día. Luego de iniciado el tratamiento se describe una disminución progresiva y sostenida de las manifestaciones clínicas y bioquímicas (15,18,19); esto también fue observado en el presente estudio, donde la taquicardia, el bocio y la pérdida de peso fueron los signos más destacados. Mientras que desde el punto de vista bioquímico, la normalización de T4L y TSH en 50% de pacientes que obtuvieron remisión fue alcanzada tempranamente (4 y 6 meses de tratamiento), similar a lo reportado por Glaser, quien asocia mejor pronóstico de remisión a más temprana normalización de la función tiroidea (6,9).
Las drogas antitiroideas no son curativas, por lo cual la duración óptima de la terapia es difícil de establecer (17). Cuando son usadas por 2 años, el porcentaje de remisión es menor del 30%, siendo menor en pre-púberes (15%) y de estos pacientes el 75% presenta recaída (2,16,18). El tratamiento por largos periodos tiene un porcentaje de remisión comparable al de 2 años (9,20); por lo que, actualmente, se ha recomendado un régimen de tratamiento individualizado con DAT por un tiempo mínimo de dos años y proceder a tratamiento definitivo si la remisión no ocurre (16,21). Nuestros hallazgos son similares a los comunicados; encontramos que con un tiempo promedio de tratamiento de 2,81± 0,91 años (1,5 a 4,8 años), obtuvieron remisión 4,1% luego del primer año de tratamiento, 35,3% luego del segundo, 37,5% luego del tercer y 25% luego del cuarto año de tratamiento.
Evaluando la función tiroidea de los pacientes al momento del diagnóstico como factor de riesgo para recaída, Kaguelidou propone un riesgo mayor si la enfermedad se presenta a una edad temprana y tiene un valor de T4L mayor de 50 pmol/L (3.88 ng/dl) al diagnóstico (2,21). En el presente estudio encontramos que los pacientes pre-púberes mostraron una media de T4L por encima de ese valor predictivo (3,9 ng/ dL), mientras que los púberes estuvieron discretamente por debajo (3,65 ng/ dL), hallazgos no tan disímiles con los informados por Lazar (12), quien señala medias de T4L de 4,65 ng/dL en prepúberes y 3,91 ng/dL en púberes, respectivamente; pero, significativamente menor al señalado por Glaser, con T4L 6 y 8,9 ng/dL, respectivamente (6,9). Por tales motivos, nuestros pacientes tendrían un alto riesgo de recaída; sin embargo, la predicción de recaída no ha sido evaluada debido al diseño del estudio, pero es un hecho a tener en cuenta en la evolución.
De otro lado, el uso de iodo ha sido comunicado en más de 1 200 niños. La meta de la terapia es la inducción de hipotiroidismo, con una remisión de más de 95% (22,23). McCormack (22) usó iodo a una edad media de 15,3 años, cuya indicación más importante de uso fue preferencia del paciente (50%). En dicho estudio, el 89% llegó a ser hipotiroideo después de la primera dosis. Un estudio (24) encontró un tiempo de remisión de 13,13 + 11,55 semanas con una sola dosis. Nuestros pacientes que recibieron iodo tenían una edad promedio de 14,6 años (7,08 a 19,6 años), siendo la indicación más importante la no respuesta al tratamiento con DAT (50%). Se presentó remisión con una sola dosis en un tiempo promedio de 0,64 ± 0,60 años; de lo cual se desprende un comportamiento similar a las poblaciones de otras series presentadas. Un hecho a resaltar es que encontramos que el único paciente que requirió más de una dosis de iodo fue un portador de síndrome de Down.
Se ha observado que los pacientes con EBG pueden tener mayor riesgo de presentar nódulos y cáncer tiroideo (25,26). Hasta el momento de corte del estudio no se ha hallado complicación derivada del uso de I131; no obstante, el tiempo de seguimiento es corto y es necesario un seguimiento permanente y a largo plazo de los pacientes que padecen esta enfermedad.
En conclusión, el hipertiroidismo por enfermedad de Graves es de relativa frecuencia en pediatría. Se obtuvo remisión en el 34,3% de pacientes tratados con metimazol en un tiempo promedio de 2,81± 0,91 años y se alcanzó remisión en 75% de los tratados con I131, en un tiempo promedio de 0,64+/- 0,60 años.
REFERENCIAS BIBLIOGRÁFICAS
1. Jara A, Andía V. Hipertiroidismo. Concepto. ClaJara A, Andía V. Hipertiroidismo. Concepto. Clasificación. Descripción de los principales tipos: patogenia, clínica y diagnóstico. Crisis tirotóxica. Hipertiroidismo subclínico. Tratamiento. Criterios de remisión. Medicine. 2008;10(14):914-21.
2. Kaguelidou F. Graves' Disease in Childhood: advances in management with antithyroid drug therapy. Hormone Research. 2009;71:310–7. doi: http://dx.doi.org/10.1159/000223414
3. Wilkins L. The diagnosis and treatment of endocrine disorders in children and adolescence. En: Hyperthyroidism. Springfield: Thomas; 1965:141-50.
4. Zanolli M, Araya A. Enfermedad de Basedow Graves en pacientes pediátricos. Rev Chilena pediatría. 2008;79(1):26-35.
5. Falen J, Del Aguila C. Características clínicas y evolución de la enfermedad de Graves-Basedow en niños. Diagnóstico. 2001;40(5):236-43.
6. Glaser N, Styne D. Predicting the likelihood of remission in children with Graves' Disease: a prospective, multicenter study. Pediatrics. 2008;121(3):481-8. doi: http://dx.doi.org/10.1542/peds.2007-1535
7. Shulman D, Muhar I. Jorgensen Y. Autoimmune hyperthyroidism in prepubertal children and adolescents: comparison of clinical and biochemical features at diagnosis and responses to medical therapy. Thyroid. 1997;7(5):755-60. doi: http://dx.doi.org/10.1089/thy.1997.7.755
8. Pérez C, Scrimshaw N. Mu-oz J., El Bocio Endémico: Técnica de las encuestas sobre el bocio endémico. Ginebra: OMS; 1961:399.
9. Werner S. Modification of the classification of the eye changes of Graves' Disease. Recommendations of the ad hoc Committee of the ATA. J Clin Endocrinol Metab. 1977;44:203. doi: http://dx.doi.org/10.1210/jcem-44-1-203
10. Glaser N, Styne D. Predictors of early remission of hyperthyroidism in children. J Clin Endocrinol Metab.1997;82:1719–26.
11. Rivkees S, Pediatric Graves Disease: controversies in management. Hormone Research. Paediatrics. 2010;74:305–11.
12. Lazar L, Kalter-Leibovici O, Pertzelan A, Weintrob N. Thyrotoxicosis in prepubertal children compared with pubertal and postpubertal patients. J Clin Endocrinol Metab. 2000;85(10):3678-82. doi: http://dx.doi.org/10.1210/jcem.85.10.6922
13. Eyzaguirre F, Unanue N. Hipertiroidismo y sindrome de Down: caso clínico. Rev Chilena Pediatría. 2008;19(3):290-4.
14. De Luca F, Corrias A, Salerno M. Peculiarities of Graves' disease in children and adolescents with Down's syndrome. Eur J Endocrinol. 2010;162(3):591–5. doi: http://dx.doi.org/10.1530/EJE-09-0751
15. Godoy C, Acevedo M. Hipertiroidismo en nios y adolescentes. Rev Chilena Pediatría. 2009;80(1):21-2. doi: http://dx.doi.org/10.4067/S0370-41062009000100003
16. Pombo Arias M. Tratado de Endocrinología Pediátrica: Hipertiroidismo. Cuarta edición. Madrid: Mc Graw–Hill Interamericana; 2009:385-90.
17. Rivkees S. The treatment of Graves' disease in children. J Pediatric Endocrinol Metab. 2006;19:1095–111. doi: http://dx.doi.org/10.1515/JPEM.2006.19.9.1095
18. Nakamura H, Noh J. Comparison of methimazole and propylthiouracil in patients with hyperthyroidism caused by Graves' disease. J Clin Endocrinol Metab. 2007;92:2157–62. doi: http://dx.doi.org/10.1210/jc.2006-2135
19. Abraham P, Avenell A. A systematic review of drug therapy for graves' hyperthyroidism. Eur J Endocrinol. 2005;153:489–98. doi: http://dx.doi.org/10.1530/eje.1.01993
20. Hamburger J. Management of hyperthyroidism in children and adolescents. J Clin Endocrinol Metab. 1985;60:1019–24. doi: http://dx.doi.org/10.1210/jcem-60-5-1019
21. Kaguelidou F, Alberti C. Predictors of autoimmune hyperthyroidism relapse in children after discontinuation of antithyroid drug treatment. J Clin Endocrinol Metab. 2009;5:74–5.
22. McCormack S, Mitchell D. Radioactive iodine for hyperthyroidism in children and adolescents: referral rate and response to treatment. Clin Endocrinol (Oxford). 2009;71(6):884-91. doi: http://dx.doi.org/10.1111/j.1365-2265.2009.03565.x
23. Nebesio T, Siddiqui A, Pescovitz, O. Time course to hypothyroidism after fixed-dose radioablation therapy of Graves' disease in children. J Pediatrics. 2002;141:99-103. doi: http://dx.doi.org/10.1067/mpd.2002.125494
24. Sánchez J, Sandoval J. Tratamiento de la Enfermedad de Graves con I131: primeros casos en la Unidad de Endocrinología Pediátrica del Hospital Nacional Cayetano Heredia, Lima-Perú. Rev Méd Herediana. 2006;17(1):8-14.
25. Dobyns B, Sheline G, Workman J. Malignant and benign neoplasms of the thyroid in patients treated for hyperthyroidism: a report of the cooperative thyro-toxicosis therapy follow-up study. J Clin Endocrinol Metab. 1974;38:976-98. doi: http://dx.doi.org/10.1210/jcem-38-6-976
26. Rivkees S, Dinauer C. Controversy in clinical endocrinology an optimal treatment for pediatric Graves' disease is radioiodine. J Clin Endocrinol Metab. 2007;92(3):797–800. doi: http://dx.doi.org/10.1210/jc.2006-1239
Financiamiento:
Propio de los autores
Conflictos de interés:
No existen
Correspondencia
Dra. Martha Rosario Calagua Quispe
Dirección: Calle Carlos Roldan 174 Int 101 Prol. Benavides- Surco
Correo electrónico: marthacalaguaq@hotmail.com
Artículo recibido el 9 de setiembre de 2013
Aceptado para publicación el 20 de febrero de 2014.













