Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.76 no.2 Lima Apr./Jun. 2015
http://dx.doi.org/dx.doi.org/10.15381/anales.v76i2.11143
ARTÍCULOS ORIGINALES
Caracterización de infecciones por bacterias productoras de BLEE en un hospital de referencia nacional
Characterization of ESBL-producing bacteria infections on a national referral hospital
Paul J Tejada-Llacsa1,2, Jury M Huarcaya1,2, Giannina C Melgarejo1,2, Lida F Gonzales1,2, Judith Cahuana1,2, Rosa M Pari1,2, Hector L Bohorquez1,2, Jesús Chacaltana3
1 Escuela de Medicina Humana, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Asociación para el Desarrollo de la Investigación Estudiantil en Ciencias de la Salud (ADIECS-UNMSM), Lima, Perú.
3 Médico Infectólogo. Enfermedades Infecciosas y Tropicales, Hospital Nacional Daniel Alcides Carrión, Callao, Perú.
Resumen
Introducción: La resistencia mediante la producción de betalactamasa de espectro extendido (BLEE) es la resistencia microbiana más común y de importancia en salud pública. Objetivos: Describir las características de las infecciones por bacterias productoras de BLEE en un hospital de referencia nacional. Diseño: Estudio transversal descriptivo. Lugar: Hospital Nacional Daniel Alcides Carrión, Callao, Perú. Materiales: Registros de los cultivos de secreciones realizados en el Laboratorio de Microbiología del HNDAC en el año 2012. Métodos: Se analizó datos del paciente (edad, sexo y servicio del cual se recibió la muestra) y datos de la muestra (fecha de obtención, el tipo de muestra, el microrganismo encontrado, el antibiograma detallado y su calificación como bacteria productora de BLEE). Principales medidas de resultados: Características de las infecciones por bacterias productoras de BLEE. Resultados: Se recolectó 3 149 muestras, 70,9% (2 235) fueron de mujeres; 29,4% fueron cultivos positivos para bacterias productoras de BLEE. Los servicios críticos obtuvieron la mayor prevalencia, y los meses donde se encontró mayor presencia fueron abril (34,7%) y julio (34,7%). Tanto E. coli (72,4%) como Klebsiella sp. (20%) fueron las prevalentes. No se encontró resistencia para imipinem, tanto para E. coli como para Klebsiella sp. Conclusiones: La prevalencia fue similar a la de América Latina (34,6%). Se presenta más evidencias de una alta presencia en consulta externa y en mayores de 46 años; siendo así un problema de salud pública.
Palabras clave: Resistencia a antibióticos, betalactamasas de espectro extendido, Escherichia coli, Klebsiella pneumoniae.
Abstract
Background: Resistance by extended-spectrum beta-lactamase (ESBL) is the most common antimicrobial resistance and of public health importance. Objectives: To describe ESBL producing bacteria characteristics in a national reference hospital. Design: Cross sectional, descriptive study. Setting: Hospital Nacional Daniel Alcides Carrión, Callao, Peru. Materials: Records of secretion cultures done in the hospital Laboratory of Microbiology during 2012. Methods: Patient data (age, sex and service from which the sample was received) and sample data (date of collection, sample type, microorganism found, sensitivity and detailed classification as ESBL producing bacteria) were analyzed. Main outcome measures: Characteristics of infections by ESBL-producing bacterias. Results: Study included 3 149 samples, 70.9% (2 235) from female patients; 29.4% were cultures positive for ESBL-producing bacteria. Critical services had the highest prevalence, and months with highest occurrence were April (34.7%) and July (34.7%). Both, E. coli (72.4%) and Klebsiella sp. (20.0%) were the most prevalent. No imipinem resistance was found for E. coli or Klebsiella sp. Conclusions: The prevalence was similar to that of Latin America (34.6%). More evidence of high prevalence in outpatients and patients over 46 year-old is presented, considering it a public health problem.
Keywords: Antibiotic resistance, extended spectrum betalactamases, Escherichia coli, Klebsiella pneumonia.
INTRODUCCIÓN
La resistencia mediante la producción de betalactamasa de espectro extendido (BLEE) es la resistencia microbiana más común y de importancia en salud pública (1). Los microorganismos pro-ductores de BLEE más frecuentes son los bacilos gram negativos (BGN). La mayoría pertenece a la familia de Enterobacteriae, tales como: Klebsiella pneumoniae y Escherichia coli; sin embargo, se asocian también bacterias como Proteus, Serratia, Salmonella sp., Pseudomona aeruginosa y Acinetobacter (2).
El estudio SMART (Study for Monitoring Antimicrobial Resistance Trends) encontró un incremento de infecciones por BLEE productores en los últimos años, además de un aumento en las tasas de mortalidad, morbilidad y costos de atención médica (3), teniendo América Latina las tasas más altas (4). Además, se sugiere que cada hospital tenga la descripción de estas bacterias para programar la terapia empírica, debido a la variabilidad entre hospitales, ciudades y países (5). A pesar de ello, en nuestro país existen muy pocos estudios sobre prevalencia de infecciones por estas bacterias (6). Por lo tanto, pro-ponemos describir las características de estas infecciones en el Hospital Nacional Daniel Alcides Carrión (HNDAC) atendidas en el año 2012.
MÉTODOS
El estudio fue transversal descriptivo. Utilizamos los registros de los cultivos de secreciones realizados en el Laboratorio de Microbiología del HNDAC entre enero y diciembre del año 2012. Los antibiogramas de todos los cultivos se realizaron mediante el método de disco-difusión y Agar Müller-Hinton, siguiendo las normas de control de calidad para la determinación de BLEE del Clinical and Laboratory Standards Institute (LCSI). Definimos la infección por bacterias productoras de BLEE como aquellos cultivos positivos que mostraron resistencia a los betalactámicos usados en el antibiograma.
Se excluyó un total de 28 registros, entre registros incompletos y muestras de un mismo paciente en el mismo periodo infeccioso y con un mismo patrón de resistencia, considerando el periodo infeccioso como 4 semanas posteriores a la primera muestra (7,8).
Entre los datos del paciente se consideró la edad, el sexo y el servicio del cual se recibió la muestra, según el organigrama estructural del HNDAC. Los servicios fueron catalogados como críticos (UCI, UCIN, UCI-neonatal, UCI-pediátrica), no críticos (medicina, pediatría, ginecología, obstetricia, neurocirugía, traumatología, unidad de quemados, urología, cirugía general), emergencia (emergencia pediátrica, emergencia obstétrica y emergencia general) y ambulatorio (consulta externa).
Con respecto a la información de la muestra, se consideró la fecha de obtención, el tipo de muestra según procedencia (secreción, secreción respiratoria, sangre, catéter, orina, otro o indeterminado, en caso no se hubiera registrado el origen de la muestra), el microrganismo encontrado (E. coli, Klebsiella sp., Pseudomona sp. u otros), el antibiograma detallado por resistencia (resistente, intermedio y sensible), y su calificación como bacteria productora de BLEE (positivo y negativo).
Los datos fueron analizados con el programa estadístico Stata 12 y Microsoft Excel versión 2010. El análisis descriptivo de las variables cuantitativas se expresó como medidas de resumen numérico; mientras que, las variables cualitativas, como porcentajes (%).
El estudio fue presentado al Comité de Ética de Investigación del HNDAC para su aprobación expedita. No fue necesario consentimiento informado, ya que los datos fueron recolectados de la base de datos del Laboratorio de Microbiología.
RESULTADOS
Se recolectó 3 149 muestras. La prevalencia de cultivos positivos para bacterias productoras de BLEE fue 29,4%. Se observó predominio de muestras del sexo femenino, con porcentaje mayor de 70%; no obstante, no hubo diferencia en la distribución del sexo entre las muestras BLEE positivas frente a las No BLEE (tabla 1).
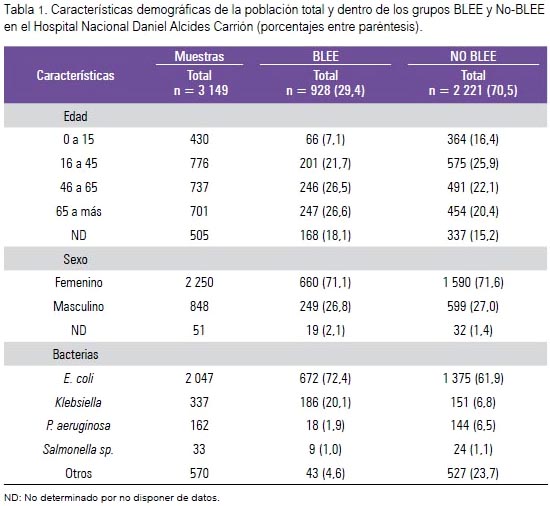
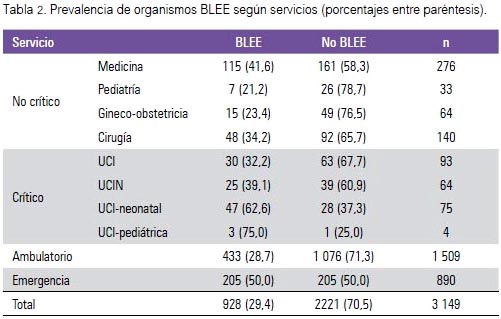
El tipo de servicio hospitalario que obtuvo mayor presencia fueron los servicios críticos, siendo los de menor y mayor ocurrencia el servicio de Emergencia y el de UCI-pediatría, respectivamente (tabla 2). Los meses en los que se encontró más presencia fueron abril (34,7%) y julio (34,7%) (figura 1).
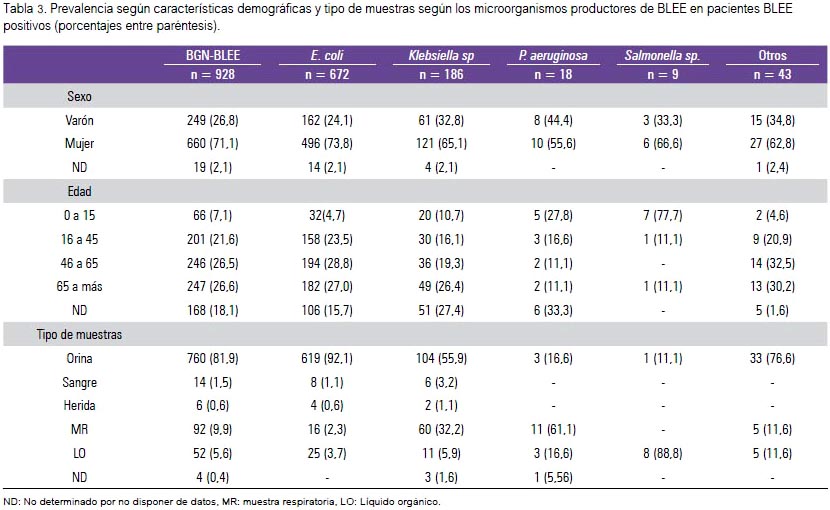
En el grupo de las BGN-BLEE, tanto E. coli (72,4%) como Klebsiella sp. (20%) fueron las más prevalentes. En relación a las características demográficas de los infectados por BGN-BLEE encontramos mayor proporción en mujeres (70,8%), a diferencia de Salmonella sp. y P. aeruginosa encontrados más en los grupos etarios menores de 15 años. Por otro lado, la edad con más proporción de BGN-BLEE fue mayor de 65 años (26,6%) (tabla 3). En los servicios críticos, Klebsiella sp. (54,2%) y P. aeruginosa (11,4%) aumentaron su presencia marcadamente a comparación de los demás servicios (tabla 4).
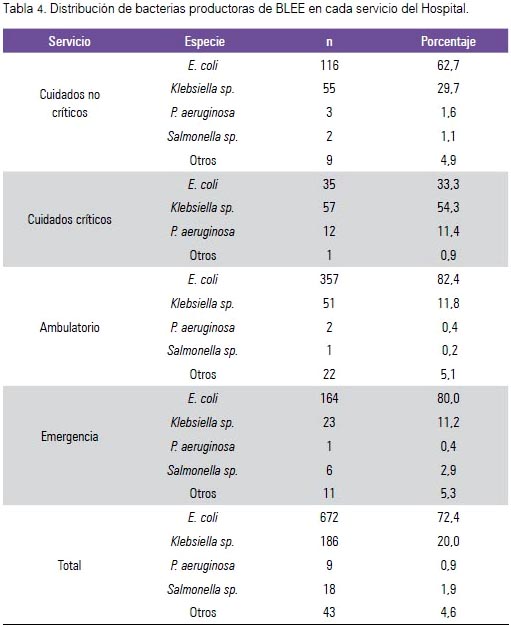
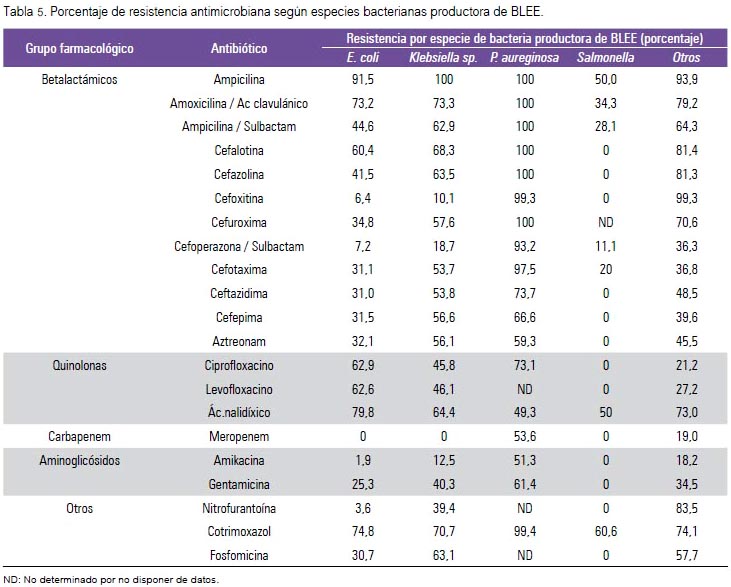
No se encontró resistencia para imipinem de E. coli y Klebsiella sp.; 17,4% de P. aureginosa no fue resistente a levofloxacino; Salmonella sp. no fue resistente a la mayoría de antibióticos estudiados (tabla 5).
DISCUSIÓN
Durante el periodo de estudio, la prevalencia de bacterias productoras de BLEE fue 29,5%, cifra aproximada a lo encontrado en otro hospital de referencia, donde 35,3% de las cepas estudiadas fueron productoras de BLEE (9). Estos valores circunscritos a nuestra región no difieren de lo encontrado en América Latina (34,6%) (10), siendo los valores de este continente los más altos a nivel mundial (11).
Al agrupar las muestras por edad, encontramos resultados similares a lo encontrado en nuestro país, con una mayor prevalencia en adultos mayores de 65 años (12), en contraste con el estudio de Arias León, donde predominó el grupo etario entre 18 y 49 años (13). En el estudio de Moor, los pacientes mayores de 75 años tuvieron más riesgo de ser infectados por bacterias productoras de BLEE, además de asociación con el sexo masculino hasta en 82% (14). Estas cifras son similares a las encontradas en otros trabajos donde se identificó a la edad por encima de 60 años como factor de riesgo (OR= 2,65) (15).
En nuestros resultados podemos apreciar una distribución de género similar a la hallada en estudios con metodologías similares (1,2,13). Además, entre las mujeres se presenta una distribución de infecciones por BGN-BLEE tipo E. coli en el grupo etario que comprende desde los 16 años hasta los 65 años, comparable con diversos estudios nacionales e internacionales (12,13). Sin embargo, no se ha hallado asociaciones concluyentes relativas al sexo en otros estudios (12,16). El sexo masculino ha sido encontrado como predictor independiente de un mal pronóstico clínico en un estudio realizado en Turquía en infecciones por Pseudomona (17). Rodríguez, por su parte, halló asociación con el sexo masculino (OR = 1,03) (18).
Así mismo, se ha descubierto que la epidemiología de estas infecciones difiere entre los tipos de bacterias (6,19), existiendo más infecciones por E. coli, Klebsiella sp. y Salmonella sp. en el sexo femenino, en comparación con P. aeruginosa y el grupo de otras bacterias, donde no se encontró diferencias entre géneros.
En relación al tipo de muestra, nuestros hallazgos concuerdan con los encontrados por Schoevaerdts y colaboradores, donde 57% del total de sus microorganismos productores de BLEE identificados correspondían a muestras de origen urinario (20), y el de Barrera y colaboradores, que en orina encontraron como más prevalente a E. coli y K. pneumoniae (21). Además, concordamos con Ikeda y colaboradores al hallar mayor prevalencia en muestras respiratorias, después de las urinarias (10%) (22). Sin embargo, esta aparente mayor afinidad por tipo de muestras solo expresaría la mayor existencia del diagnóstico de infecciones del tracto urinario y tracto respiratorio.
En relación a la bacteria encontrada según tipo de muestra, Mena y col hallaron 37,42% de casos en consultorio externo y 18,10% en UCI (23). En Italia, se señaló 18,10% de infecciones por bacterias productoras de BLEE en consultorios ambulatorios, entre bacterias en general (24). Sin embargo, en un estudio en un centro de salud particular en Perú, se aislaron enterobacterias productoras de BLEE predominantemente en las muestras de los pacientes ambulatorios (91,5%), frente a los bacilos aislados en muestras de pacientes hospitalizados (8,5%) (25). Por otro lado, Barrera evidenció que Klebsiella sp se presenta más en los servicios quirúrgicos, hasta en 27% de los casos (21). En un estudio similar realizado en un hospital infantil de México, la distribución de bacterias E. coli productoras de BLEE tuvo como servicios más afectados a la unidad de cuidados intensivos pediátricos (UCIP), urgencias y servicio de infectología, 16% cada uno; mientras que para K. peumoniae fue oncología el servicio más afectado (10,5%) (2). Mientras tanto, en España se encontró que la presencia de E. coli productora de BLEE en infecciones urinarias era más alta en los servicios de urología y medicina con 22,9% y 24,5% de los casos, respectivamente (7). Por otro lado, Ikeda halló que entre casos de infección por E. coli productora de BLEE, el servicio de consultorio era el más afectado (57,1%), siendo UCI el segundo más afectado (con 3 casos de 14), en comparación con otros estudios (22).
De esta manera, se observa que existen más evidencias de una alta prevalencia de este tipo de infecciones en consultas externas, lo que permitiría una mayor transferencia de material genético que amplía la prevalencia de BLEE entre microorganismos infecciosos. Es importante recalcar que la distribución se hizo de acuerdo a la distribución de servicios que se aplica en el HNDAC y, por lo tanto, no es comparable con estudios similares como el de Hernández (26).
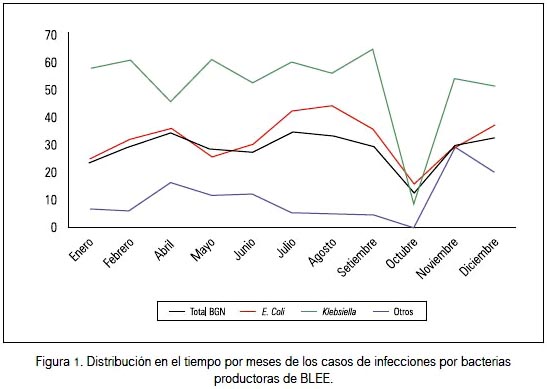
Con respecto a la distribución por meses, distintos estudios mostraron que la frecuencia de infección por microorganismos productores de BLEE no sigue una tendencia creciente; sin embargo, presenta dos momentos de mayor prevalencia, siendo el más importante el segundo semestre del año. La notoria inflexión vista en octubre concuerda con la falta de registros de ese mes. En relación a la distribución por meses, concordamos con González y col al mencionar que E. coli se encontró con más frecuencia entre los meses de julio y agosto, y Klebsiella, en setiembre (27).
Dentro de las limitaciones tenemos la ausencia de identificación de la fuente de inicio de la infección, sea comunitario u hospitalario. Además de la no identificación genotípica de los microorganismos productoras de BLEE. Sin embargo, usamos la identificación fenotípica más usada en los hospitales debido a su factibilidad. Consideramos que a pesar de estas limitaciones resulta importante comunicar estos datos para poder conocer las características de estos microorganismos productores de BLEE y evaluar su prevalencia y resistencia.
Recomendamos una ampliación del periodo de estudio con un mayor rango años a incluir, para observar una tendencia de la tasa de infección a través de tiempo, a la vez de asignar una recolección permanente de la información de los casos para evitar la pérdida de datos y poder determinar el verdadero origen de las infecciones; y, realizar estudios de mayor nivel de evidencia, debido a que este estudio solo nos permite describir las características de las infecciones por microorganismos BLEE productores, pero aún no podemos determinar cuáles son los factores de riesgo más importantes. A pesar de estas limitaciones, resulta importante comunicar esta alta prevalencia de infecciones por microrganismos productores de BLEE, lo cual denota un problema de salud pública que es necesario abordar.
AGRADECIMIENTOS
A la Universidad, a nuestras familias y al Laboratorio de Microbiología del HNDAC por su constante apoyo.
REFERENCIAS BIBLIOGRÁFICAS
1. Al-Assil B, Mahfoud M, Hamzeh AR. Resistance trends and risk factors of extended spectrum β-lactamases in Escherichia coli infections in Aleppo, Syria. Am J Infect Control. 2013;30:1–4. doi: 10.1016/j.ajic.2012.09.016.
2. Cano-Rangel MA, Pérez-Moya G, Cervantes-Velázquez V, Durazo-Arvizu MÁ, Dorame-Castillo R, Cano-Corella MA. Cepas de Escherichia coli y Klebsiella pneumoniae, sospechosas de producir β-lactamasas de espectro extendido en el Hospital Infantil del Estado de Sonora. Bol Clin Hosp Infant Edo Son. 2010;27:108-12.
3. Rossi F, Baquero F, Hsueh P-R, Paterson DL, Bochicchio GV, Snyder TA, et al. In vitro susceptibilities of aerobic and facultatively anaerobic Gram-negative bacilli isolated from patients with intra-abdominal infections worldwide: 2004 results from SMART (Study for Monitoring Antimicrobial Resistance Trends). J Antimicrob Chemother. 2006;58:205-10. doi: 10.1093/jac/dkl199.
4. Sader H, Jones R, Andrade-Baiocchi S, Bie-denbach D. Four-year evaluation of frequency of occurrence and antimicrobial susceptibility patterns of bacteria from bloodstream infections in Latin American medical centers. Diagn Microbiol Infect Dis. 2003;44:273–80. doi: 10.1016/S0732-8893(02)00469-8.
5. Pitout J, Laupland K. Extended-spectrum β-lactamase-producing Enterobacteriaceae: an emerging public-health concern. Lancet Infect Dis. 2008;8:159–66. doi:10.1016/S1473-3099-(08)70041-0.
6. Morales J, Reyes K, Monteghirfo M, Roque M, Irey J. Presencia de β-lactamasas de espectro extendido en dos hospitales de Lima , Perú. An Fac med. 2005;66:24–32.
7. Ena J, Arjona F, Martínez-Peinado C, López-Perezagua MDM, Amador C. Epidemiology of urinary tract infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Urology. 2006;68:1169–74. doi:10.1016/j.urology.2006.08.1075.
8. Wikler M, Cockerill F, Craig W, Dudley M, Elio-poulos G, Hecht D, et al. Performance standards for antimicrobial susceptibility testing: seventeenth informational supplement. NCCLS. 2007 Jan;27(1). Disponible en: http://www.microbiolab-bg.com/CLSI.pdf.
9. Adrianzén D, Arbizú Á, Ortiz J, Samalvides F. Mortalidad por bacteriemia casuada por Escherichia coli y Klebsiella spp. productoras de beta lactamasas de espectro extendido: cohorte retrospectiva en un hospital de Lima, Perú. Rev Peru Med Exp Salud Publica. 2013;30:18–25.
10. García C, Astocondro L, Banda C. Enterobacterias productoras de b-lactamasas de espectro extendido: Situación en América Latina y en el Perú. Acta Médica Peru. 2012;29:163–9.
11. Jacoby GA, Munoz-Price LS. The new B-lactamases. N Eng J Med. 2005;352:380–91. doi:10.1056/NEJMra041359.
12. Bueno GM. Factores asociados a la infección por Escherichia coli y Klebsiella sp productoras de betalactamasas de espectro extendido en pacientes hospitalizados del Hospital Nacional Daniel Alcides Carrión - Callao : setiembre 2008-diciembre 2009. 2010.
13. León A, Fitzgerald G. Características clínicas y frecuencia de betalactamasas de espectro extendido en aislamientos de enterobacterias causantes de infección de vías urinarias de origen comunitario en pacientes adultos de siete hospitales pertenecientes a la red grebo 2009-2010. Dsiponible en: http://www.bdigital.unal.edu.co/3826/.
14. Moor CT, Roberts S a, Simmons G, Briggs S, Morris a J, Smith J, et al. Extended-spectrum beta-lactamase (ESBL)-producing enterobacteria: factors associated with infection in the community setting, Auckland, New Zealand. J Hosp Infect. 2008;68:355–62. doi:10.1016/j.jhin.2008.02.003.
15. Colodner R, Rock W, Chazan B, Keller N, Guy N, Sakran W, et al. Risk factors for the development of extended-spectrum beta-lactamase-producing bacteria in nonhospitalized patients. Eur J Clin Microbiol Infect Dis. 2004;23:163–7. doi:10.1007/s10096-003-1084-2.
16. Calbo E, Romaní V, Xercavins M, Gómez L, Vidal CG, Quintana S, et al. Risk factors for community-onset urinary tract infections due to Escherichia coli harbouring extended-spectrum beta-lactamases. J Antimicrob Chemother. 2006;57:780–3. doi:10.1093/jac/dkl035.
17. Weldhagen GF, Poirel L, Nordmann P. Ambler class A extended-spectrum β -lactamases in Pseudomonas aeruginosa: novel developments and clinical impact. Antimicrob Agents Chemother. 2003 Aug;47(8):2385-92. doi:10.1128/AAC.47.8.2385.
18. Rodríguez-Baño J, Navarro MD, Martínez-Martínez L, Muniain MA, Perea J, Pérez-Cano R, Pascual A. Epidemiology and clinical features of infections caused by extended-spectrum beta-lactamase-producing Escherichia coli in nonhospitalized patients. J Clin Microbiol. 2004 MAr;42(3):1089-94. doi:10.1128/JCM.42.3.1089.
19. Sandrea-Toledo L, Paz-Montes A, Piña-Reyes E, Perozo-Mena A. Enterobacterias productoras de b-lactamasas de espectro extendido aisladas de hemocultivos en un Hospital Universitario de Venezuela. Kasmera. 2007;35(1):15–25.
20. Schoevaerdts D, Bogaerts P, Grimmelprez A, de Saint-Hubert M, Delaere B, Jamart J, et al. Clinical profiles of patients colonized or infected with extended-spectrum beta-lactamase producing Enterobacteriaceae isolates: a 20 month retrospective study at a Belgian University Hospital. BMC Infect Dis. 2011;11:12. doi:10.1186/1471-2334-11-12.
21. Barrera B, Canales A, Martínez P, Vidal M, Sakurada A, Vial M. Incidencia de B-lactamasas de espectro extendido en el Hospital Clínico de la Universidad de Chile. Rev Hosp Clin Univ Chile. 2005;16:101–6.
22. Ikeda Y, Mamiya T, Nishiyama H, Koseki T, Mouri A, Nabeshima T. Risk factors for extended-spectrum beta-lactamase-producing Escherichia coli infection in hospitalized patients. Nagoya J Med Sci. 2012;74:105–14.
23. Perozo J, Castellano M. Detección de Betalactamasas de Espectro Extendido en cepas de la familia Enterobacteriaceae. Kasmera. 2009;37:25–37.
24. Picozzi S, Ricci C, Gaeta M, Macchi A, Dinang E, Paola G, et al. Do we really know the prevalence of multidrug resistant Escherichia coli in the territorial and nosocomial population? Urol Ann. 2013;5:25–9. doi:10.4103/0974-7796.106962.
25. Paredes R. Prevalencia de enterobacteriáceas productoras de betalactamasas de espectro extendido ( Blee ) en la clínica Good Hope durante el periodo marzo – agosto del 2012. UNMSM, 2013.
26. Hernández JR, Pascual Á, Cantón R, Martínez-Martínez L, Estudio G De, Hospitalaria DI y col. Escherichia coli y Klebsiella pneumoniae productores de betalactamasas de espectro extendido en hospitales españoles (Proyecto GEIH-BLEE 2000). Enferm Infecc Microbiol Clin. 2003;21:77–82. doi:10.1016/S0213-005X(03)72887-0.
27. González-Vélez AE, Díaz-Agero Pérez C, Robustillo-Rodela A, Pita-López MJ, Cornejo-Gutiérrez AM, Pedrero-Pérez P, et al. [Trends in the prevalence of extended-spectrum beta-lactamase-producing gram-negative bacilli in a teaching hospital in Madrid, Spain]. Med Clin (Barc). 2012;141:8–12. doi:10.1016/j.medcli.2012.03.034.
Artículo recibido el 24 de setiembre de 2014 y aceptado para publicación el 15 de noviembre de 2014.
Fuente de financiación: Autofinanciado.
Conflictos de intereses: Ninguno.
Autor Corresponsal:
Paul Jesús Tejada-Llacsa
Av. Gonzales Prada 719, Comas, Lima-Perú
Teléfono: (511) 5412365
Correo electrónico: paultejada24@gmail.com














