Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.76 no.2 Lima abr./jun. 2015
http://dx.doi.org/dx.doi.org/10.15381/anales.v76i2.11145
ARTÍCULO DE REVISIÓN
Resistencia a la insulina y altura
Resistance to insulin and high altitude
Oscar Castillo Sayán1
1 Miembro Investigador Permanente, Instituto Nacional de Biología Andina, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
Resumen
En el presente artículo se describe las características iniciales que permitieron conocer la resistencia a la insulina. Así mismo, se muestra los estudios realizados en sujetos nativos de altura, o sea sometidos a hipoxia crónica, quienes presentan menor glicemia basal y posprandial, sin diferencias en la insulinemia en comparación con nativos de nivel del mar. Esta misma diferencia se aprecia en la menor incidencia de diabetes mellitus en la altura. Finalmente se presenta estudios realizados en sujetos nativos de nivel del mar sometidos a hipoxia aguda natural y en hipoxia intermitente en cámara hipobárica.
Palabras clave: Hipoxia, resistencia a la insulina, cámara hipobárica, altura.
Abstract
In this article initial characteristics allowing knowledge of insulin resistance are described. High altitude dwellers show lower basal and postprandial glycemia and no differences in insulinemia compared with sea level dwellers. Incidence of diabetes mellitus is lower at high altitude. Finally studies in sea level residents under both acute natural hypoxia and simulated hypobaric chamber-intermittent hypoxia are presented.
Keywords: Hypoxia, insulin resistance, hypobaric chamber, high altitude.
La descripción de resistencia a la insulina se remonta al año 1936, cuando Himsworth (1) observó la respuesta a la insulina en pacientes diabéticos y la clasificó en dos grupos: uno sensible a la insulina y otro insensible a la insulina, o sea con resistencia a la insulina.
Los pacientes con sobrepeso u obesidad suelen presentar hiperinsulinismo y resistencia a la insulina, mostrando signos clínicos tales como acantosis nigricans localizada a nivel cervical, axilar o en la región inguinal. Este hallazgo clínico nos permite sospechar la presencia de resistencia a la insulina.
A pesar de generarse niveles elevados de insulina, no se observa los efectos biológicos característicos en los órganos blanco, como el músculo, grasa, hígado. Actualmente, incluso se ha observado deficiencia del efecto biológico a nivel del sistema nervioso central (2).
El efecto biológico de la insulina más estudiado ha sido su acción en el metabolismo de la glucosa.
En los estudios iniciales de pacientes con obesidad se observó el incremento en las concentraciones de insulina (hiperinsulinismo) y disminución de los receptores celulares de insulina, tanto en cantidad como en su afinidad por la insulina. Cuando estos pacientes fueron sometidos a terapia con dieta, ejercicios, fármacos, y se lograba la reducción ponderal, los niveles de insulina disminuían y la cantidad de receptores se normalizaban; así también recuperaban su afinidad por la insulina (3,4).
En los pacientes diabéticos de tipo 1, la resistencia a la insulina no es un factor determinante, como sí lo es en los pacientes de diabetes mellitus de tipo 2, siendo el factor primordial en ellos la deficiencia severa de insulina (2).
La resistencia a la insulina se presenta en las etapas iniciales de las alteraciones del metabolismo de la glucosa. Desde el estadio de prediabetes, o sea en la etapa de glicemia alterada en ayunas e intolerancia a la glucosa, la hiperglicemia posprandial se presenta como manifestación inicial asociada al hiperinsulinismo. Lamentablemente, desde estas etapas previas al diagnóstico de diabetes mellitus ya se evidencian daños a nivel de los grandes vasos, la denominada macroangiopatía (5).
Cuando ocurre la deficiencia progresiva de insulina por el daño ya existente de la célula beta pancreática asociada a la resistencia a la insulina, se produce la hiperglicemia en ayunas manifiesta, diagnosticándose la diabetes mellitus de tipo 2, la cual puede presentarse con o sin sintomatología clínica (6).
A continuación vamos a desarrollar el tema revisando la literatura nacional e internacional, en primer lugar relacionada a estudios realizados en nativos de altura o sea expuestos a hipoxia crónica, luego diabetes mellitus y altura, sensibilidad a la insulina en hipoxia aguda y finalmente sensibilidad a la insulina en hipoxia simulada en cámara hipobárica.
GLICEMIA Y SENSIBILIDAD A LA INSULINA EN HIPOXIA CRÓNICA
Desde el año 1936 se ha comunicado que los sujetos normales nativos de altura presentan una glicemia basal menor que los sujetos normales nativos de nivel del mar (7-9); este hallazgo ha sido corroborado por otros investigadores (10-15). En 1970, Garmendia (15) realizó determinaciones de insulina utilizando el método radioimmunológico (RIA), no hallando diferencias significativas entre ambos grupos en las concentraciones basales o durante la prueba de tolerancia a la glucosa oral.
Estudios realizados usando la prueba de tolerancia oral a la glucosa en sujetos de altura han encontrado además de una glicemia menor que los sujetos de nivel del mar, una mayor utilización periférica de la glucosa. Con la finalidad de evitar el factor intestinal presente en la administración de la glucosa por vía oral, se realizó la prueba de tolerancia a la glucosa por vía intravenosa, observándose también un descenso más rápido de la glicemia en los sujetos de altura, lo cual fue interpretado como una mayor utilización periférica de la glucosa (12).
Picón Reateguí (13) estudió la respuesta a la prueba de tolerancia a la insulina. Utilizó 0,1 unidades de insulina libre de glucagón por kg de peso, hallando una mayor utilización de la glucosa en los sujetos nativos de altura.
En el año 2007 (16) publicamos el monitoreo continuo de la glucosa durante 12 horas utilizando el Glucosensor Unitec Ulm (fabricado en la Universidad de Ulm, Alemania, bajo la dirección del Prof. Ernst Pfeiffer). Se estudió 2 grupos: uno de altura (Huancayo 3 200 m.s.n.m) y el otro a nivel del mar (Lima, 150 m.s.n.m). El nivel promedio de glicemia en la altura fue 52,4 mg/ dL versus 73 mg/dL a nivel del mar. Los niveles de glicemia durante todo el monitoreo fueron siempre menores en la altura (figura 1). No se halló diferencias significativas en los niveles de insulinemia entre ambos grupos.
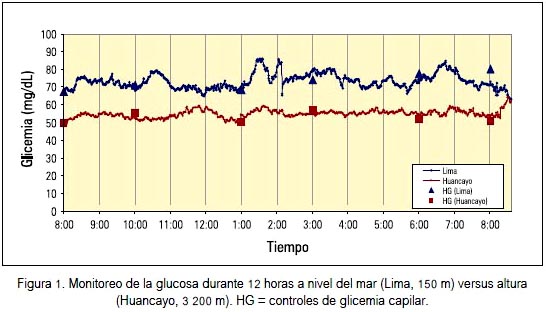
El hecho de encontrar una menor glicemia en los sujetos de altura y no diferencias en los niveles de insulina sugiere la existencia de una mayor sensibilidad a la insulina en la altura. Todos estos estudios mencionados han sido realizados en sujetos nativos o residentes en altura, o sea en sujetos sometidos a hipoxia hipobárica crónica.
Es importante recordar que existen otros factores que podrían estar influenciando estos efectos metabólicos, tales como el frío, los rayos ultravioleta, étnicos, genéticos. Hay reportes controversiales en relación a los cambios metabólicos antes mencionados en otros lugares de altura similares a la nuestra, los cuales ya han sido revisados (17).
Se conoce que la hipoxia y la actividad física (contracción muscular) incrementan la sensibilidad a la insulina. Hay comunicaciones de estudios in vitro que demuestran que cuando el tejido muscular es sometido a condiciones de hipoxia se genera una mayor producción de transportadores de glucosa (GLUT 4) y se estimula su translocación (18,19). Este efecto producido por la hipoxia se postula que sería realizado a través de un mecanismo mediado por la presencia de calcio y no por la insulina (20).
Gamboa (21) realizó estudios in vitro en tejido muscular de ratones sometidos a hipoxia crónica, demostrando incremento de la captación de glucosa por el tejido muscular, sin producción incrementada de los transportadores de glucosa GLUT 4.
En 1998 utilizamos el método del ‘clampeo de la glucosa’ descrito por De Fronzo (22), en la modalidad de clampeo hiperglicémico a 40 mg/dL. Estudiamos dos grupos de sujetos: 30 a nivel mar en Lima (150 m.s.n.m) y 18 en la altura, en Cusco (3 395 m.s.n.m). Los niveles basales de glicemia fueron menores en los sujetos de altura. La utilización de glucosa fue mayor en los sujetos de altura y el índice de sensibilidad insulínica fue 5,23 mg/kg/min en la altura y 3,93 mg/kg/min a nivel del mar. O sea, se apreció una menor resistencia a la insulina en la altura (23).
Villena (24) realizó un estudio en varones residentes en Cerro de Pasco (4 200 m.s.n.m). Usó la prueba de tolerancia a la glucosa por vía intravenosa utilizando el modelo mínimo simplificado de Bergman (25). Obtuvo un índice de sensibilidad a la insulina (ISI) mayor en los sujetos de altura en comparación con el nivel del mar (11,51 ± 5,5 x 10-4 min-1 (mU/L) versus 6,9 ± 3,5 x 10-4 min-1 (mU/L), respectivamente).
Torres (26), en 2002, utilizando el clampeo euglicémico hiperinsulinémico en 19 sujetos sanos de nivel de altura de Huancayo (3 200 m.s.n.m) y 10 a nivel del mar en Lima (150 m.s.n.m), edades entre 20 y 30 años, encontró menor glicemia basal y mayor utilización de la glucosa en los sujetos de altura.
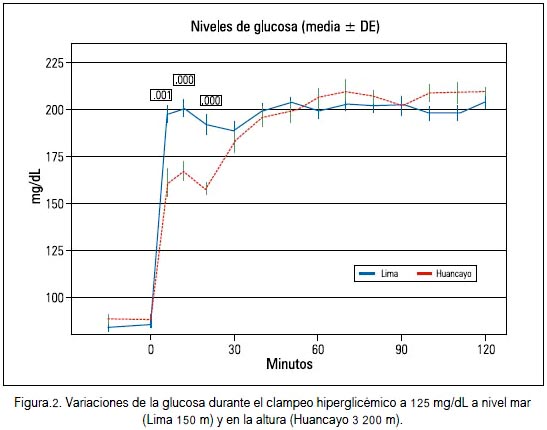
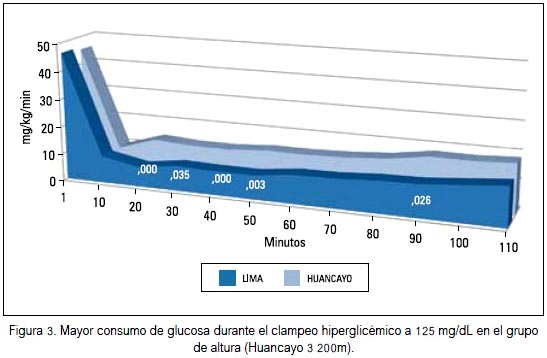
En 2010 (27) realizamos el clampeo hiperglicémico a 125 mg/dL en 6 sujetos de altura, en Huancayo (3 200 m.s.n.m), y 11 en Lima (150 m.s.n.m). El mayor consumo de glucosa se produjo a los 20, 30, 40 y 50 minutos y el índice de sensibilidad insulínica fue 15,3 mg/kg/min en la altura y 10,8 mg/kg/ min en Lima. En ese estudio observamos la respuesta rápida de insulina, la cual fue menor en los sujetos de altura a los 10, 15 y 20 minutos luego de la administración de glucosa. O sea que la mayor utilización de la glucosa se consiguió con menores niveles de insulina, lo cual podría interpretarse como una mayor sensibilidad a la insulina en los sujetos de altura. Ver figuras 2 y 3.
ALTURA Y DIABETES
Diversos estudios nacionales han encontrado una menor prevalencia de diabetes mellitus de tipo 2 en los pobladores de altura, siendo cada vez menor la prevalencia a medida que la altura es mayor. En 1966, Rutte (28), en su tesis de Bachiller, mostró una prevalencia de diabetes mellitus tipo 2 en Lima (150 m.s.n.m) de 0,49%, Tarma (3 100 m.s.n.m) 0,056%, Huancayo (3 300 m.s.n.m) 0,067% y Cerro de Pasco (4 200 m.s.n.m) 0,019%. Solís (29) halló en 1979 en Lima 0,9%, Huancayo (3 300 m.s.n.m) 0,21%, Puno (3 800 m.s.n.m) 0,09% y Cerro de Pasco (4 200 m.s.n.m) 0,05%. Seclén (30), en 1999, comunicó en Lima 7,6% y en Huaraz (3 052 m.s.n.m) 1,3%.
Datos acerca de la diabetes mellitus en Bolivia proporcionados por Barcelo (31) nos muestran la siguiente prevalencia realizada en 1998: Santa Cruz (437 m.s.n.m) 10,7%, Cochabamba (2 553 m.s.n.m) 9,4%, La Paz (3 649 m.s.n.m) 5,7% y El Alto (4 500 m.s.n.m) 2,7%. Aschner (32) presentó un informe brindado por Seclén (PERUdiab), el cual muestra que la prevalencia de diabetes en la población urbana de la costa del Perú era 8,2% y la población en la región suburbana de altura, 4,5%.
En 2014, Woolcott (33) encontró asociación inversa entre la diabetes y altitud en una población adulta de los Estados Unidos.
La menor glicemia hallada en los sujetos de altura y la mayor utilización de la glucosa parecería tener relación con esta menor prevalencia. La fisiopatología no está esclarecida hasta la actualidad. Un factor que podría intervenir se cree sería la hipoxia hipobárica, característica ambiental a la cual están sometidos los residentes de altura.
SENSIBILIDAD A LA INSULINA EN HIPOXIA AGUDA
Puchulú (34), en 1994, realizó un estudio de exposición aguda en altura natural. Ocho sujetos sanos normales residentes en alturas menores de 1 000 m, 4 varones y 4 mujeres, llevados a 3 750 m.s.n.m, en la provincia de Salta, Argentina, fueron sometidos a la prueba de tolerancia oral a la glucosa (100 g) y la prueba de tolerancia a la insulina, con 0,1 UI/kg de insulina regular, por vía intravenosa, en las primeras 48 horas de la llegada a la altura. Las determinaciones basales de glicemia y post sobrecarga de glucosa fueron menores en la altura. Los valores de insulina no mostraron diferencias significativas. La caída de la glicemia luego de la aplicación intravenosa de insulina fue más pronunciada en la altura. Concluyó que la altura indujo a una acción insulínica más eficiente y por lo tanto un descenso más marcado de la glicemia. Debido a ello se sugiere la disminución de la dosis de insulina cuando los pacientes diabéticos se desplacen a la altura para evitar el posible riesgo de hipoglicemia.
En 1997, Larsen (35) estudió 8 sujetos normales, de 27± 1 años, durante 7 días en la montaña Monte Rosa, Italia (4 559 m.s.n.m). Utilizó el clampeo euglicémico hiperinsulinémico basal, a los 2 y a los 7 días de permanencia en la altura. Obtuvo un incremento de la glicemia y de la insulinemia luego de 2 días de permanencia, y también una disminución de la acción insulínica en el día 2, lo cual interpretó como un fenómeno de resistencia insulínica periférica transitoria, ya que al día 7 los niveles de glicemia e insulinemia se normalizaron.
En el año 2010, Mackenzie (36) realizó un estudio con 8 pacientes diabéticos de tipo 2. Fueron sometidos a periodos de 60 minutos, en diferentes estados: normoxia en reposo, hipoxia en reposo, normoxia en ejercicio e hipoxia en ejercicio. Posteriormente, se les realizó una prueba intravenosa de tolerancia a la glucosa, para evaluar la sensibilidad a la insulina y la función de la célula beta. Demostró que la hipoxia indujo mejoría de la tolerancia a la glucosa, lo cual atribuyó a una mejor sensibilidad a la insulina y que el ejercicio tuvo un efecto aditivo a la sensibilidad a la insulina. Además, la respuesta aguda de insulina a la glucosa fue reducida durante la hipoxia versus el estado de normoxia (p=0,014). Estos resultados fueron muy similares a los hallados por nosotros en residentes habituales de altura (27).
En 2003, Wen-Chih Lee (37) evaluó un total de 28 sujetos sanos, de 18 a 43 años, los separó en 2 grupos: uno sedentario (9), de 36± 6,5 años, y uno no sedentario, montañistas profesionales (19) de 35± 5,9 años. Se realizó pruebas de tolerancia oral a la glucosa a nivel del mar y luego de 3 días de permanencia en la altura. El grupo sedentario, luego de 3 días de exposición a una altura de 2 400 m.s.n.m., presentó menores niveles de glicemia a los 50 y 80 minutos después de la toma de glucosa. El grupo no sedentario mostró menores niveles de glicemia que el grupo sedentario en el estudio a nivel del mar. Este mismo grupo tuvo menores niveles de glicemia luego de los 3 días de exposición a la altura a 3 200 y 4 000 m.s.n.m.
SENSIBILIDAD A LA INSULINA EN HIPOXIA SIMULADA INTERMITENTE EN CÁMARA HIPOBÁRICA
Se conoce que la prevalencia de la diabetes mellitus, enfermedad coronaria e hipertensión arterial es menor en los sujetos de altura (28-30,38,39). Desde el año 1990, E Marticorena (40-43) realizó estudios del efecto de la hipoxia natural, y posteriormente la hipoxia intermitente simulada en cámara hipobárica, en pacientes coronarios, los que ya habían sido sometidos a terapia quirúrgica habitual y no se les podía ofrecer otra opción terapéutica. En ellos utilizaba como terapia alternativa la hipoxia simulada.
Este programa de rehabilitación consistía en 12 sesiones semanales en cámara hipobárica. Desde las primeras semanas observó una elevación significativa de la concentración del óxido nítrico. Este factor vasodilatador se mantuvo elevado en relación al valor basal hasta 3 meses luego de haber concluido las 12 sesiones en cámara.
Analizando estos hallazgos obtenidos en el área cardiológica con esta metodología de hipoxia simulada y conociendo que la hipoxia estimula la generación y translocación de los transportadores de glucosa GLUT 4, en el año 2002 (44) desarrollamos un proyecto piloto, cuyo objetivo fue determinar si la hipoxia aguda en cámara hipobárica podría producir cambios en la glicemia y en la sensibilidad a la insulina en sujetos sanos, obesos y diabéticos de tipo 2.
Se estudiaron 13 varones residentes a nivel del mar, 5 normales, 4 obesos y 4 pacientes diabéticos de tipo 2. Fueron sometidos a 2 pruebas de tolerancia a la insulina (45) con 0,1 UI/kg de insulina cristalina. La primera a nivel del mar y la segunda en la cámara hipobárica, a una altura simulada de 3 200 m, en la cámara de la Fuerza Aérea del Perú, Hospital Las Palmas. Seguimos el siguiente protocolo: en las 2 primeras horas se hizo ascenso hasta la altura programada 3 200 m, donde se permaneció por 1 hora (en la cual se realizó la segunda prueba de tolerancia a la insulina) y finalmente el descenso en una hora. En los sujetos normales y obesos se obtuvo una menor glicemia basal en la altura simulada en cámara, 72 vs. 46,9 mg/dL y 75 vs. 59,5 mg/dL, respectivamente. En relación al índice de sensibilidad insulínica (ISI), se incrementó significativamente solo en el grupo de obesos, de 0,28 a 0,41.
Es importante recordar que en este piloto solamente realizamos una sesión en cámara, a diferencia del programa del Dr. Marticorena (12 sesiones).
En el año 2010, Kelly (46) estudió 8 jóvenes sanos (5 varones y 3 mujeres; 26 ± 2 años) a los que sometió a prueba de tolerancia oral a la glucosa 75 g, la primera a nivel del mar (362 m) y la segunda en cámara hipobárica (4 300 m). Los valores de glicemia durante la prueba fueron significativamente menores a los 30 y 60 minutos en la cámara hipobárica. La utilización de la glucosa fue mayor a nivel de la altura simulada. No hubo diferencia en los niveles de insulina y péptido C. La sensibilidad a la insulina evaluada por el método HOMA-IR no mostró diferencias entre ambos niveles de altura. El lactato y la epinefrina se incrementaron. Los niveles de leptina disminuyeron en la altura, hallazgo muy similar al encontrado por nuestro grupo. Al medir los niveles de leptina en sujetos residentes habituales de altura, mostraron una relación inversa con los niveles de altura (47).
Con estos resultados del piloto, en el año 2011 (48) diseñamos otro protocolo, el cual consideraba 4 sesiones en cámara hipobárica. Estudiamos 25 sujetos: sanos (8), obesos (5) y diabéticos de tipo 2 (12). Se programó 1 sesión semanal por 4 semanas; utilizamos la cámara hipobárica del Instituto Nacional de Biología Andina, Facultad de Medicina, Universidad Nacional Mayor de San Marcos (figura 4).

El protocolo incluía evaluación clínica y muestra de sangre venosa para determinaciones de glicemia, insulina, hemoglobina, colesterol, triglicéridos, HDLc, LDLc, HbA1c, antes del ingreso a la cámara y luego al final de la cuarta sesión de cámara. Se calculó la sensibilidad a la insulina utilizando el método HOMA-IR y QUICKI y la secreción de insulina con el HOMA %B. Los resultados mostraron incremento de la sensibilidad a la insulina en los sujetos sanos, al evaluarse el HOMA-IR y QUICKI:
-
HOMA-IR: 3,17 ± 0,49 a 1,64 ± 0,28, p = ,007
-
QUICKI: 0,55 ± 0,25 a 0,66 ± 0,28, p = ,008
En el grupo de obesos, la sensibilidad a la insulina mejoró con la prueba QUICKI.
-
QUICKI: 0,49 ± 0,38 a 0,59 ± 0,15, p = ,008
La secreción de insulina disminuyó significativamente en el grupo de sanos.
-
HOMA%B : 140,92 ± 22,30 a 77,80 ± 14,64, p = ,008
Conclusión: la hipoxia simulada intermitente en cámara hipobárica a 3 200 m durante 4 semanas produjo mejoría de la sensibilidad a la insulina en sujetos normales y obesos. Asimismo, ocasionó disminución de la secreción de insulina en los controles sanos. En el grupo de obesos y diabéticos de tipo 2 se apreció la tendencia a disminuir la secreción de insulina, sin llegar a ser significativa.
Los estudios iniciales realizados por nuestro grupo confirmaron el hallazgo de una menor glicemia y una mayor utilización de la glucosa en sujetos nativos residentes de altura mayor de 3 000 m, utilizando la metodología del clampeo de la glucosa.
En nuestro último estudio de clampeo hiperglicémico, nos llamó la atención el hecho de no encontrar diferencias en la glicemia basal entre ambos grupos nivel del mar y de altura. Lo que sí persistió fue la mayor utilización de la glucosa en los sujetos de altura.
Es importante hacer notar que la población estudiada por nosotros ha sido casi totalmente población urbana de Cusco y Huancayo. Esto en referencia a que en la actualidad los hábitos alimentarios en ellas han cambiado y se asemejan a los de la costa. Asimismo, la limitada actividad física hace posible que estos dos factores condicionen la progresión hacia el sobrepeso y obesidad. Lamentablemente, estos factores que están íntimamente relacionados con el desarrollo de la diabetes mellitus podrían en el futuro cambiar la prevalencia de diabetes en las poblaciones de altura.
En relación al uso de la hipoxia intermitente en cámara hipobárica para mejorar la sensibilidad a la insulina o disminuir la resistencia a la insulina en sujetos obesos y diabéticos de tipo 2, los resultados hasta el momento son alentadores, pero de ninguna manera concluyentes. Se requieren estudios con mayor número de sujetos y de sesiones de exposición a la hipoxia.
AGRADECIMIENTOS
A todos los colaboradores de los trabajos realizados cuyos nombres figuran en las publicaciones presentadas. Asimismo a la Fundación Alexander von Humboldt, Bonn, Alemania, Fundación Instituto Hipólito Unanue y Universidad Nacional Mayor de San Marcos, Lima, Perú, por su valioso apoyo en las investigaciones citadas.
REFERENCIAS BIBLIOGRÁFICAS
1. Himsworth HP. Diabetes mellitus. Its differentiation into insulin sensitivity and insulin insensitivity types. Lancet. 1936;1:127-30.
2. De Fronzo RA. From the triumvirate to the ominous octet: a new paradigm for the treatment of the type2 diabetes mellitus. Diabetes. 2009;58:773-95.
3. Garmendia F. Relación de la resistencia a la insulina con la obesidad, diabetes, hiperlipoproteiniemia e hipertensión arterial. Rev Med Peruana.1996;68:38-40.
4. Freidenberg GR, Reichart D, Olefsky JM, Henry RR. Reversibility of defective adipocyte insulin receptor kinase activity in non-insulin dependent diabetes mellitus: of effect loss. J Clin Invest. 1988;82:1398.
5. Beck-Nielsen H, Groop LC. Metabolic and genetic characterization of prediabetes states. J Clin Invest. 1994;5:1714-21.
6. Inzucchi S. Diagnosis of diabetes. N Engl J Med. 2012;367:542-50.
7. Forbes WH. Blood sugar and glucose tolerance at high altitudes. Am J Physiol. 1936;116(2):309-16.
8. San Martin MS. Distribución de la glucosa sanguínea y su variación con el cambio de altitud. An Fac Ciencias Médicas. 1940;23:312.
9. Monge CC. Glucosa, ácido láctico y acido pirúvico a nivel del mar y en la altura. An Fac med. 1949;32:1.
10. Picón-Reateguí E. Studies on the metabolism of carbohydrates at sea level and high altitudes. Metabolism. 1962;11:1148.
11. Calderón R, Llerena L. Carbohydrate metabolism in people living in chronic hypoxia. Diabetes.1965;14:100.
12. Picón-Reateguí E. Intravenous glucose tolerance test at sea level and at high altitudes. J Clin Endocrinol Metab. 1963;23:1256.
13. Picón-Reateguí E. Efecto de exposición crónica a la altura sobre el metabolismo de los hidratos de carbono. Arch Inst Biol Andina. 1966;I:255.
14. Picón-Reateguí E, Buskirk ER, Baker Pt. Blood glucose in high altitude natives and during acclimatization to altitude. J Appl Physiol. 1970;29:560.
15. Garmendia F, Torres J, Tamayo R, Urdanivia E. Aportes al conocimiento de la glicemia de altura. Arch Inst Biol Andina. 1972;5(1):51.
16. Castillo O, Woolcott O, Gonzales E, Tello V, Tello L, Villarreal C, Méndez N, Damas L, Florentini E. Residents at high altitude show a lower glucose profile than sea level residents throughout 12-hour blood continuous monitoring. High Alt Med Biol. 2007;8(3):307-11.
17. Woolcott O, Castillo O. Metabolismo de la glucosa en el habitante de la altura: replanteando evidencias. Arch Biol Andina. 2008;14(1):51-62.
18. Cartee GD, Douen AG, Ramlal T, Klip A, Holloszy JO. Stimulation of glucose transport in skeletal muscle by hipoxia. J Appl Physiol. 1991;70:1593-600.
19. Lund S, Holman GD, Schmitz O, Pedersen O. Contraction stimulates translocation of glucose transporter GLUT4 in skeletal muscle through a mechanism distinct from that of insulin. Proc Natl Acad Sci. 1995;92:5817-21.
20. Zierath JR, Tsao T, Stenbit AE, Ryder JW, Galuska D, Charron MJ. Restoration of hypoxia-stimulated glucose uptake in GLUT4-deficient muscles by muscle-specific GLUT4 transgenic complementation. J Biol Chem. 1998;273(33):20910-5.
21. Gamboa JL, Garcia-Cazarin ML, Andrade FH. Chronic hypoxia increases insulin-stimulated glucose uptake in mouse soleus muscle. Am J Physiol Integr Comp Physiol. 2011;300(1):R85-R91.
22. De Fronzo RA, Tobin JD, Andres R. Glucose clamp technique. A method for quantifying insulin secretion and resistance. Am J Physiol. 1979;237:E214-E23.
23. Castillo O, Alzamora J, Capatinta C, Ugarte N, Tello L. Insulin sensitivity at high altitude. IV European Congress of Endocrinology. Sevilla, España, del 9 al 13 de mayo, 1998.
24. Villena J. Cambios metabólicos en la hipoxia crónica. Acta Andina. 1998;7(2):95-103.
25. Bergman RN, Ider YZ, Bowden CR, Cobelli C. Quantitative estimation of insulin sensitivity. Am J Physiol. 1979;236(6):E667-77.
26. Torres J, Castillo O, Woolcott O, Iturrizaga R, Florentini E, Damas L. Sensibilidad a la insulina en altura y a nivel del mar. V World Congress on Mountain Medicine and High Altitude Physiology, Barcelona, España, April 18-22, 2002.
27. Castillo O, Oré R, Sandoval M, Oriondo R, Valdivieso R, Durand J, Woolcott O, Tello L, Florentini E. Insulin response in healthy residents in high altitude. VIII World Congress on High Altitude Medicine and Physiology. Arequipa, August 8-12, 2010.
28. Rutte CA. Contribución al aspecto clínico y epidemiológico de la diabetes mellitus. Tesis de Bachiller, Universidad Nacional Mayor de San Marcos, Lima 1966.
29. Solís J, Guerra-García R. Prevalencia de diabetes mellitus en hospitalizados de las grandes alturas. Arch Biol Andina. 1979;9:21.
30. Seclén S, Leey J, Villena A, Herrera B, Menacho J, Carrasco A, Vargas R. Prevalencia de obesidad, diabetes, hipertensión arterial e hipercolesterolemia como factores de riesgo coronario y cerebrovascular en población adulta de la costa, sierra y selva del Perú. Acta Médica Peruana. 1999;16:8-12.
31. Barceló A, Daroca M, Ribera R, Duarte E, Zapata A, Vohra M. Diabetes in Bolivia. Rev Panam Salud Publica/Pan Am/Public Health. 2001;10(5):318-22.
32. Aschner P, Aguilar-Salinas C, Aguirre L, Franco L, Gagliardino J, Gorban de Lapertosa S, Seclén S, Vinocour M on behalf of the IDF Atlas. Diabetes in south and central America: an update. Diabetes Res Clin Practice. 2014;103:238-43.
33. Woolcott O, Castillo O, Gutierrez C, Elasthoff R, Stefanovski D, Bergman R. Inverse association between diabetes and altitude: A cross sectional study in the adult population of the United States. Obesity. 2014;22:2080-90.
34. Puchulú Jr F, Cercowitz C, Regueiro F, Figueroa R, Saavedra S, Sammillan J, Puchulú FF. Effects of high altitude (HA) on glucose tolerance and insulin sensitivity in healthy subjects. 15th International Diabetes Federation Congress, Kobe, Japan, November 1994:6-11.
35. Larsen JJ, Hansen JM, Olsen NV, Galbo H, De la F. The effect of altitude hypoxia on glucose homeostasis in men. J Physiol. 1997;504:241-9.
36. Mackenzie R, Maxwell N, Castle P, Brickley G, Watt P. Acute hypoxia and exercise improve insulin sensitivity (Si2*) in individuals with type 2 diabetes. Diabetes Metab Res Rev. 2011;27:94-101.
37. Lee WCH, Chen JJ, Ho HY, Hou CW, Liang MP, Shen YW, Kuo CH. Short-term altitude mountain living improves glycemic control. High Alt Med Biol. 2003;4(1):81-91.
38. Ruiz L. Epidemiología de la hipertensión arterial. Diagnostico. 1977;1:19-26.
39. Ruiz L, Figueroa M, Horna C, Peñaloza D. Prevalencia de la hipetensión arterial y cardiopatía isquémica en las grandes alturas. Arch Instituto Cardiol México. 1969;4:474.
40. Marticorena EA, Marticorena JM. Prevención y rehabilitación coronaria utilizando las grandes alturas 1990, Lima, UNMSM, CONCYTEC.
41. Marticorena EA, Marticorena JM, Contreras A, Alva J, Fernández-Dávila L, Oyola L. Rehabilitación cardíaca con altura simulada (cámara hipobárica) en coronarios con infarto de miocardio y by pass. Rev Per Cardiol. 1995;21(I):7-15.
42. Marticorena EA. Bases moleculares hipóxicas en rehabilitación cardíaca coronaria con altura natural y simulada. Rev Per Cardiol. 1998;24(2):77-86.
43. Marticorena EA, Marticorena JM, Oyola L, Rodríguez V, García F, Alfaro D, et al. Impact and midterm assessment of coronary patients rehabilitated with intermittent simulated technique. Acta Andina.1999-2000;8:39-45.
44. Woolcott O, Castillo O, Torres J, Marticorena E, Florentin E. Acute exposure to simulated moderate altitude improves insulin sensitivity in obese subjects but not in healthy subjects. International Workshop on Insulin Resistance. San Diego, California, February, 2002:11-13.
45. Bonora E, Moghetti P, Zancanaro C, et al. Estimates of in vitro insulin action in man: comparison of insulin tolerance tests with euglycemic and hyperglycemic glucose clamp studies. Clin Endocrinol Metab. 1989;68:374-8.
46. Kelly KR, Williamson DL, Fealy CE, Kriz DA, Krishman RK, Huang H, Ahn J, Loomis JL, Kirwan JP. Acute altitude-induced hypoxia suppresses plasma glucose and leptin in healthy humans. Metabolism Clinical and Experimental. 2010;59:200-5.
47. Woolcott O, Castillo O, Torres J, Damas L, Florentini E. Serum leptin in dwellers from high altitude lands. High Alt Med Biol. 2002;3(2):245-6.
48. Castillo O, Gonzales E, Tello L, Cárdenas Ch, Roncal A, Florentini E. Insulin sensitivity under intermittent hypoxia in hypobaric chamber. IX World Congress of the International Society for Mountain Medicine. November 3-6, 2012, Taipei, Taiwan.
Artículo recibido el 10 de enero de 2015 y aceptado para publicación el 16 de marzo de 2015.
Financiamiento:
Fundación Alexander von Humboldt, Bonn, Alemania. Fundación Instituto Hipólito Unánue, Lima, Perú.
Universidad Nacional Mayor de San Marcos, Lima, Perú.
Conflicto de interés: Ninguno.
Correspondencia:
Dr. Oscar Alejandro Castillo Sayán
Dirección: Instituto Nacional de Biología Andina (Hospital Arzobispo Loayza) Av. Alfonso Ugarte 848, Lima, Perú
Teléfono: 431-3355 (Institucional)
Correo electrónico: oscar.oculm@gmail.com














