Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.76 no.3 Lima July/set. 2015
ARTÍCULOS ORIGINALES
Aceite esencial de Thymus vulgaris L (tomillo), su combinación con EDTA contra Cándida albicans y formulación de una crema
Thymus vulgaris L (thyme) essential oil and its combination with EDTA against Gandida albicans; formulation of a cream
Juan Rojas Armas1,a; José Ortiz Sanchez1,b; José Jáuregui Maldonado2,c; Julio Ruiz Ouiroz2,c; Robert Almonacid Roman2,d
1 Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
a Profesor Asociado, Ciencias Dinámicas; Instituto de Investigaciones Clínicas.
b Profesor Principal, Ciencias Dinámicas; Instituto de Biología Andina.
2 Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos, Lima, Perú.
c Profesor Asociado.
d Profesor Auxiliar.
Resumen
Introducción. El patógeno Cándida albicans puede causar infecciones invasivas graves y frecuentes lesiones superficiales. Los fármacos usados en el tratamiento presentan inconvenientes y es necesario buscar alternativas. Objetivos. Determinar la actividad del aceite esencial (AE) de Thymus vulgaris y de su combinación con EDTA sobre Cándida albicans, y formular una crema con el AE suplementado con derivados terpénicos naturales. Diseño. Estudio experimental in vitro y toxicidad in vivo. Lugar. Facultad de Medicina y Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos, Lima, Perú. Material biológico. Cepa de Cándida albicans para las pruebas in vitro y conejos para la toxicidad dérmica. Métodos. La actividad antifúngica se determinó por el método de difusión en pozo de agar; la concentración inhibitoria mínima (CIM), por el método de microdilución en caldo. La crema se formuló con el AE al 1 % Y otra suplementada con carvacrol, timol, citral y EDTA. La toxicidad dérmica se determinó en conejos. Principales medidas de resultados. Halos de inhibición, CIM, signos de toxicidad. Resultados. El AE a 100 mg/mL inhibió el crecimiento de Cándida albicans con halos de inhibición de 30,33 ± 0,58 mm, mientras que la adición de EDTA produjo halos de 35,33 ± 0,58 mm. La CIM para el AE y AE + EDTA lue de 8 mg/mL y 0,5 mg/mL, respectivamente. La crema con AE 1% produjo halos de inhibición de 13,33 ± 0,58 mm, mientras que la adición de EDTA, timol, carvacrol y citral aumentó el halo hasta 24,33 ± 0,58 mm. No se evidenció signos de toxicidad dérmica en conejos. Conclusiones. El AE de Thymus vulgaris presentó actividad inhibitoria sobre Cándida albicans y el EDTA incrementó dicha actividad; asimismo, el aceite esencial, EDTA, carvacrol, timol y citral formulados en una crema mostraron electo sinérgico y sin signos de toxicidad dérmica.
Palabras clave. Thymus; Tomillo; Cándida albicans; EDTA; Crema; Conejos.
Abstract
Introduction: Candida albicans may cause severe invasive inlections and Irequently superficiallesions. Drugs used in treatment present drawbacks and search of alternatives becomes necessary. Objectives: To determine the activity of Thymus vulgaris essential oil (EO) alone and combined with EDTA on Candida albicans, and lormulate a cream with EO supplemented with natural terpenes. Design: In vitro experimental and in vivo toxicity study. Setling: Faculty of Medicine and Faculty 01 Pharmacy, Universidad Nacional Mayor de San Marcos, Lima, Peru. Biological material: Candida albicans strain for in vitro study and rabbits for dermal toxicity tests. Methods: Antifungal activity was determined by agar well diffusion method, and minimum inhibitory concentration (MIC) by broth microdilution method. A cream was formulated with EO 1% and another supplemented with carvacrol, thymol, citral and EDTA. Dermal toxicity in rabbits was determined. Main outcome measures: Inhibition halos, MIC, signs 01 toxicity. Results: EO at 100 mg/mL inhibited Candida albicans growth with 30.33 ± 0.58 mm inhibition halos; adding EDTA produced 35.33 ± 0.58 mm halos. MIC for EO and EO + EDTA was respectively 8 mg/mL and 0.5 mg/mL. EO 1 % cream originated 13.33 ± 0.58 mm inhibition halos, and addition of EDTA, thymol, carvacrol and citral increased halos to 24.33 ± 0.58 mm. No signs of dermal toxicity in rabbits were observed. Conclusions: Thymus vulgaris EO showed inhibitory activity against Candida albicans and EDTA increased this activity; essential oil, EDTA, carvacrol, thymol and citral lormulated in cream al so showed synergistic effect without evidence of dermal toxicity.
Keywords: Thymus; Thyme; Candida albicans; EDTA; Cream; Rabbits.
INTRODUCCIÓN
La frecuencia de infecciones fúngicas invasivas se ha incrementado con el aumento del número de pacientes de riesgo, siendo las especies de cándida las causantes de infecciones fúngicas más comunes (1). Entre los pacientes de la unidad de cuidados intensivos (UCI) , las especies de cándida son la tercera causa más común de infección sanguínea nosocomial, y la mortalidad atribuible a candidemia es cerca del 40%, siendo Cándida albicans el patógeno humano más común (2). Asimismo, las infecciones superficiales de la piel están entre las enfermedades más comunes observadas en la práctica diaria, y son causadas principalmente por dermatofitos, levaduras y mohos. Cándida albicans es la más virulenta de las levaduras y puede causar enfermedades de la piel, uñas y membranas mucosas (3).
Los fármacos antifúngicos actualmente disponibles presentan problemas de toxicidad, resistencia, interacciones farmacológicas y elevado precio; además del precio de la droga, el costo de la terapia antifúngica incluye los costos asociados a la mortalidad por el fracaso del tratamiento, hospitalización prolongada y tratamiento de las complicaciones, y tratamiento antifúngico adicional para compensar el tratamiento primario (1,4). Por esto es necesario la búsqueda de nuevos agentes terapéuticos. En este contexto, las plantas medicinales representan una potencial alternativa.
Thymus vulgaris L. es un subarbusto de la familia Lamiaceae, que es perenne y aromática, rica en aceite esencial, cuyo principal componente es el timol (5). Es una planta introducida de Europa y en la medicina tradicional peruana se conoce como 'tomillo' y se utiliza el aceite esencial como antiséptico (6). Se ha demostrado que el extracto de esta planta tiene efecto antiviral contra HSV-l, HSV- 2 y HSV-l resistente a aciclovir (7) y efecto relajante sobre anillos traqueales de cobayo comparable a teofilina (8); mientras que el aceite esencial de Thymus vulgaris ha mostrado actividad antibateriana contra Staphylococcus aureus, Escherichia colí, Bacillus cereus, Proteus vulgaris, Vibrio spp, Listeria monocytogenes, Propionibacterium acnes (9,10, 11); además, actividad cito tóxica contra 3 líneas celulares de cáncer humano -células de carcinoma de próstata humano (PC-3), carcinoma pulmonar humano (A549) y cáncer de mama humano (MCF-7) (11), y significativa actividad antoxidante (12).
En Francia, Giordani y col (13) demostraron que el aceite esencial de Thymus vulgaris potencia la acción de la anfotericina B contra Cándida albicans; sin embargo, muchos factores mediambientales alteran la composición química tanto cualitativa como cuantitativa de los metabolitos secundarios, lo cual influye directamente en sus propiedades farmacológicas. También se ha demostrado actividad contra cándida de derivados terpenoides, como carvacrol y timol (14, 15), del citral (16), así como del quelante etilendiaminotetraacetato (EDTA) (17). Por lo que, basados en es tos antecedentes y teniendo en cuenta que no se ha reportado ningún estudio realizado en el Perú sobre actividad antifúngica de Thymus vulgaris, nos propusimos determinar la actividad sobre Cándida albicans del aceite esencial de Thymus vulgaris y de su combinación con EDTA en un modelo in vitro, así como formulación de una crema con este aceite esencial suplementado con carvacrol, timol y citral.
MÉTODOS
La planta Thymus vulgaris L fue colectada en Lima, Perú. Una muestra fue llevada al museo de Historia Natural de la UNMSM para su identificación taxonómica (constancia N° 078-HSMUSM-2012). El aceite esencial (AE) fue obtenido por arrastre con vapor de agua en un aparato tipo clevenger (18), para lo cual se utilizó las hojas frescas de la planta; el aceite esencial fue se parado y deshidratado con Na2S04 anhidro, se filtró y guardó en un frasco de vidrio color ámbar bajo refrigeración a una temperatura de 4 ºC, hasta su uso.
La cepa de Cándida albicans ATCC 10231 fue proporcionada por el laboratorio de Microbiología del Instituto en Química Biológica, Microbiología y Biotecnología "Marco Antonio Garrido Malo" Facultad de Farmacia y Bioquímica, UNMSM.
En la preparación del inóculo de Cándida albicans, para el método de difusión en pozo de agar se utilizó Cándida albicans crecida en agar dextrosa Sabouraud de 48 h a 28°C, para la preparación de la suspensión del inóculo. La levadura se suspendió en solución salina 0,85% estéril y se ajustó la turbidez equivalente al tubo 0,5 de la escala de McFarland (1 x 106 ufc/mL).
Para el método de microdilución en caldo, se preparó por turbidimetría un inóculo de Cándida albicans de 1 - 5 X 103 ufc/mL. El inóculo stock fue preparado con Cándida albicans crecida en agar dextrosa Sabouraud al 4% (Merck'") en el día 2 a 28°C. El microorganismo fue suspendido en solución salina 0,85% estéril y se ajustó la turbidez equivalente al tubo 0,5 de la escala de McFarland; en seguida se realizó una doble dilución, de 1:50 y de 1:20, con el medio RPMI 1640 con L-glutamina y sin bicarbonato de sodio (SigmaAldrich"), para obtener un inóculo de 1 - 5 X 103 ufc/mL (inóculo 2x).
Para la determinación de la actividad antifúngiva in vitro se utilizó el método de difusión en pozo de agar (19). Placas petri de 90 mm de diámetro fueron preparadas con agar dextrosa Sabouraud y sembradas con Cándida albicans. Se agregó 1 mL de suspensión del inóculo (1 x 106 ufc/mL) por cada 100 mL de medio de cultivo, se mezcló asépticamente y se agitó suavemente; luego se repartió en las placas a razón de 20 mL por placa y se dejó solidificar. Final mente, se hizo pozos en el agar con un sacabocado de acero de 11 mm de diámetro externo; en cada placa se hizo 5 pozos equidistantes. El AE fue pesado y disuelto en dimetilsulfóxido (DMSO) al 1% para obtener concentraciones de prueba de 25, 50, 75 y 100 mg/mL, de las cuales se virtió 50 μL en cada pozo.
El EDTA se adicionó al aceite esencial en una concentración de 4 mg/mL. También se determinó la actividad antifúngica de la crema preparada, agregando 50 p,L en los pozos. Las placas se dejaron reposar por un periodo de 60 minutos a temperatura ambiente y luego se incubaron a 37°C por 48 horas. Se utilizó DMSO al 1 % como control negativo y fluconazol (0,2 mg/mL) como control positivo. Las pruebas se realizaron por triplicado. La lectura e interpretación de los resultados se realizó con la observación de las zonas claras de inhibición del crecimiento, mediante el registro de los diámetros en mm de estas zonas. Se consideró tener una actividad antifúngica significativa a un halo de inhibición mayor a 18 mm (20).
Para determinar la concentración inhibitoria mínima (CIM), se tomó como base los protocolos del Instituto de Estándares Clínicos y de Laboratorio (Clínical and Laboratory Standards Institute: CLSI), protocolo M27-A3 (21) estandarizado por Ruiz JR., 2012 (22). El AE de Thymus vulgaris L disuelto en DMSO 1 % fue sometido a diluciones dobles seriadas en el medio Roswell Park Memorial Institute (RPMI) 1640 con rojo de fenal y sin bicarbonato (Sigrna-Aldrich'"), obteniendo 10 diluciones doblemente concentradas fina les, en el rango de 31,25 - 16000 μg/ mL. Se utilizó fluconazol como control positivo, en un rango de concentraciones de 0,125 - 64 μg/mL. El control negativo fue el medio RPMI 1640 con resazurina. Para la prueba de microdilución se procedió teniendo en cuenta que por cada 20 mL de la suspensión del inóculo 2x se agregó 0,1 mL de la solución de resazurina 20 mg/mL. La prueba de microdilución fue realizada en microplacas (Brand'") estériles de 96 pozos; se colocó 100 p,L/pozo de cada dilución 2x de la muestra y del fluconazol; luego se adicionó a cada pozo 100 p,L del inóculo 2x con indicador resazurina. En otra fila también se colocó 200 p,L del medio RPMI 1640 con resazurina, sirviendo estos como control de esterilidad, y 100 p,L del medio RPMI más 100 p,L del inóculo 2x con indicador rezasurina, sirviendo estos pozos como control de crecimiento. Las microplacas se incubaron a 37ºC por 24 h. La lectura de resultados se hizo visualmente. Cualquier cambio de color de púrpura a rosado o incoloro fueron registrados como positivos. La concentración más baja a la que no se produjo el cambio de color se tomó como el valor de la CIM. Todas las pruebas fueron realizadas por triplicado.
En la formulación de la crema, el AE de Thymus vulgaris se adicionó en una concentración de 1 %. También se formuló una crema a la que además se añadió EDTA en concentración de 4 mg/mL (0,4%), y otra con AE 1% + EDTA 0,4% + carvacrol 1% + timol 1 % y citral 1 %. Como control se utilizó una crema sin AE, y otra con fluconazol 0,2 mg/mL. Fueron formuladas en una base hidrosoluble.
Para la prueba de irritabilidad/corrosión dérmica aguda, se procedió según la directriz 404 de la Organisation for Economic Cooperaiion and Development (OECD) (23). Se utilizó 25 conejos albinos Nueva Zelandia machos, jóvenes adultos, procedentes de la Facultad de Medicina veterinaria de la Universidad Nacional Mayor de San Marcos, con una masa corporal de 1,8-2,5 kg. Fueron mantenidos durante el ensayo a temperatura y humedad controladas y un ciclo de luz-oscuridad de 12/12 h. Un día antes de la prueba, se tomó varios animales al azar, se les depiló y rasuró en la superficie de la región dorsal del lomo en un área de 10x18 cm2, distancia equidistante de la columna vertebral, y se seleccionó aquellos que mostraron la piel intacta. Los anima les fueron asignados aleatoriamente a 5 grupos (n = 5): crema sin AE (control), crema con AE 1 %, crema con AE 1 % + EDTA 0,4%, crema con AE 1 % + EDTA 0,4% + carvacrol 1 % + timol 1 % + citral 1 %, y crema con fluconazol 0,2 mg/mL. Para el ensayo se aplicó 0,5 g de la crema en un área de 6 cm-, cubierta con gasa y adherida a la piel con un esparadrapo hipoalérgico. Una vez transcurridas 4 h, se retiró los parches y la muestra fue removida empleando agua. Las observaciones de la zona de aplicación se realizó a las 0,5, 1, 24, 48 y n h. En caso de presencia de signos clínicos de toxicidad en ese periodo, la observación se prolongó hasta los 14 días. Las reacciones en la piel para el eritema y edema se establecieron según el sistema descrito para la evaluación de la irritación de la piel. Para dar los resultados de la prueba, se comparó los valores obtenidos con los del sistema de clasificación para irritabilidad/corrosión dérmica.
Los datos obtenidos de la prueba de susceptibilidad fueron expresados como media ± desviación estándar y las comparaciones entre los grupos experimentales fueron realizadas por ANOVA de una vía seguido por una prueba posthoc de Scheffé. Las medias fueron consideradas significativamente diferentes cuando p < 0,05. Se utilizó el software SPSS versión 19.
RESULTADOS
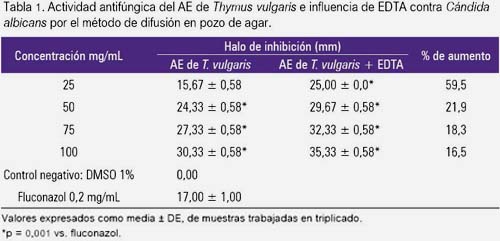
El aceite esencial de Thymus vulgaris L. inhibió el crecimiento de Cándida albicans de manera dependiente de la concentración, produciendo halos de inhibición de 30,33 ± 0,58 mm a la concentración de 100 mg/mL. Comparando con el control fluconazol, hubo diferencia significativa con las concentraciones de 50, 75 y 100 mg/mL (p = 0,001). La adición de EDTA 4 mg/mL al AE aumentó el tamaño de los halos de inhibición en las diferentes concentraciones, siendo mayor con 25 mg/mL (59,5% de aumento), mientras que con 100 mg/mL se observó halos de 35,33 ± 0,58 mm con aumento de 16,5% (tabla 1).
La crema formulada con AE de Thymus vulgaris al 1% + EDTA produjo halos de inhibición de 21,00 ± 1,00 mm, mientras que la adición de timol, carvacrol y citral aumentó significativamente el halo de inhibición hasta 24,33 ± 0,58 mm (p < 0,05) (tabla 2).

La concentración inhibitoria mínima (CIM) para el AE de Thymus vulgaris y AE + EDTA fue de 8 mg/mL y 0,5 mg/mL, respectivamente. El fluconazol usado como control positivo mostró una CIM de 0.25 p,g/mL.
La crema formulada con AE 1 % y en la que además se adicionó EDT A, timol, carvacrol y citral no presentaron alguna evidencia de toxicidad dérmica en conejos.
DISCUSIÓN
En la presente investigación, el AE de Thymus vulgaris L. mostró actividad anti-Cándida albicans de manera dependiente de la concentración, alcanzando halos de inhibición de 30,33 ± 0,58 mm con la concentración de 100 mg/mL (tabla 2), lo cual fue significativo. La adición de EDTA al aceite esencial produjo un efecto sinérgico, evidenciándose un mejor incremento de la actividad con la menor dosis de 25 mg/mL, con una variación del halo de inhibición de 15,67 ± 0,58 a 25,00 ± 0,00 mm, lo cual representó el 59,5% de aumento.
En la búsqueda de nuevos agentes antifúngicos, de fuentes naturales, se ha encontrado que los aceites esenciales de otras plantas medicinales tienen actividad contra Cándida albicans. Así se ha evidenciado en estudios in vitro con los aceites esenciales de Coriandrum sativum L. (Z4), Cymbopogon citratus y Syzygium aromaticum (Z5), Pimpinella anisum L. (Z6), Minthostachys mollis (27), Salvia officinalis (28), Lippia sidoides (19), Aloysia triphylla (29), también el aceite del árbol de té y sus componentes derivados -específicamente el terpinen-4-ol-, exhibieron fuerte actividad antimicrobiana contra biofilms de Cándida albicans (30). En modelos experimentales in vivo, el aceite esencial de Melaleuca alternifolia (árbol de te) y su principal componente terpinen-4-ol protegió a ratones con candidiasis oral experimental (31), Y el aceite esencial de geranio y su componente geraniol protegió la candidiasis vaginal experimental en ratones (32).
La concentración inhibitoria mínima (CIM) determinada en este estudio para el AE de Thymus vulgaris fue 8 mg/mL, la cual varió a 0,5 mg/mL con la adición de EDT A al AE. Teniendo en cuenta la definición propuesta por Duarte y col., 2005, que considera fuerte actividad una MIC hasta 0,5 mg/mL, moderada actividad MIC entre 0,51 y 1 mg/mL, y débil actividad MIC superior a1,1 mg/mL (33), la combinación de AE y EDTA produjo una fuerte actividad antifúngica con un evidente sinergismo. Se ha demostrado que EDTA, un anticoagulante quelante de metales, posee actividad antimicrobiana de amplio espectro en cultivos planctónicos y biofilm, sugiriéndose que su efecto fue debido a su capacidad de secuestrar los iones divalentes esenciales para la matriz extracelular polimérica de la estructura del biofilm (34). Ramage y col., 2007, encontraron que la expresión genética de la proteína 1 de la pared de las hifas de Cándida albicans fue reducida en muestras planctónicas y biofilm tratadas con EDTA, por lo que la inhibición del biofilm sería probablemente a través de su efecto inhibitorio sobre la filamentación, lo cual es relevante porque C. albicans fácilmente forma biofilm en superficies tanto inanimadas como biológicas (17). Además, EDTA mostró actividad bactericida contra patógenos periodontales y no tuvo toxicidad en células mamíferas (35).
El AE de Thymus vulgaris también ha demostrado eficacia terapéutica antifúngica en solución al 1% cuando se evaluó contra dermatomicosis experimentalmente inducida en ratas, usando dermatomicetos más frecuentes, Trichophyton mentagrophytes, T. rubrum, and T. tonsurans, donde los animales tratados fueron curados, durante un periodo de observación de 37 días (36).
Los monoterpenos, como timol, carvacrol y citral, también han mostrado actividad contra Cándida albicans. Timol y carvacrol, a diferencia de la naturaleza fungistática del fluconazol, presentaron fuerte efecto fungicida contra aislados de Cándida, dañaron significativamente la biosíntesis de ergosterol y rompieron la integridad de la membrana (15). El tratamiento profiláctico con carvacrol erradicó la carga vaginal de Cándida albicans de ratas infectadas y podría ser considerado como un producto prometedor en el tratamiento de candidiasis vaginal (37). El citral fue efectivo contra aislados de Cándida sp., deteniendo el ciclo celular de Cándida albicans en fase S y causó más del 50% de inhibición de inducción del tubo germinal, exhibiendo excelente actividad contra la forma levadura e hifas de Cándida albicans a concentraciones que no son tóxicas para las células He La (38).
En este estudio, la crema preparada con el AE de Thymus vulgaris L. mostró actividad contra Cándida albicans y la adición de EDTA incrementó el tamaño de los halos de inhibición en 57,5%, mientras que la adición de carvacrol, timol y citral produjo efecto sinérgico (tabla 2), aumentando la actividad en 82,5%; por lo tanto, el efecto atribuido a los terpenoides representó el 24,9%, lo cual fue significativo (p < 0,05). Por otra parte, en la prueba de irritabilidad/ corrosión dérmica en conejos, la crema no mostró algún signo de toxicidad. Esto podría convertir a este preparado en un potencial producto para el trata miento de candidiasis cutánea y de mucosas. Se sugiere continuar los estudios de eficacia in vivo.
Se concluye que, en las condiciones experimentales, el AE de Thymus vulgaris fue eficaz in vitro contra Cándida albicans y el EDTA incrementó la actividad. Asimismo, el aceite esencial, EDTA, carvacrol, timol y citral formulados en una crema mostraron efecto sinérgico contra Cándida albicans, sin signos de toxicidad dérmica.
REFERENCIAS BIBLIOGRÁFICAS
1. Rapp RP. Changing strategies for the manage ment of invasive fungal infections. Pharmacother. 2004;(2):4S-28S.
2. Kauffman C. Fungal infections. Proc Am Thorac. 2006;3:35-40.
3. Ho K, Cheng T. Common superficial fungal infections - a short review. Med Bull. 2010;15(11):23-7.
4. Badiee P, Alborzi A, Shakiba E, Farshad S, Japoni A, Susceptibility of Candida species isolated from immunocompromised patients to antifungal agents. Eastern Mediterranean Health J. 2011 ;17(5):425 30.
5. Sartoratto A, Machado A, Delarmelina C, Figueira G, Duarte M, Rehder V. Composition and antimicrobial activity of essential oils from aromatic plants used in Brazil. Brazilian J Microbiol. 2004;35:275-80.
6. Brack A, Diccionario Enciclopédico de Plantas Útiles del Perú. Cuzco: Centro de Estudios Regionales Andinos "Bartolomé de las Casas"/PNUD, 1999.
7. Nolkemper S, Reichling J, Stintzing FC, Carie R, Schnitzler P. Antiviral effect of aqueous extracts from species of the Lamiaceae family against Herpes simplex virus type 1 and type 2 in vitro. Planta Med. 2006;72(15):1378-82.
8. Boskabady M, Aslani M, Kiani S. Relaxant effect of Thymus vulgaris on guinea-pig tracheal chains and its possible mechanism(s). Phytother Res. 2006;20:28-33.
9. Mohsenzadeh M. Evaluation of antibacterial activity of selected Iranian essential oils against Staphylococcus aureus and Escherichia coli in nutrient broth medium. Pak J Biol Sci. 2007;10(20):3693-7.
10. Snoussi M, Hajlaoui H, Noumi E, Usai D, Sechi L, Zanetti S, Bakhroul A, In-vitro anti-Vibrio spp. activity and chemical composition of some Tunisian aromatic plants. World J Microbiol Biotechnol. 2008;24:3071-6.
11. Zu Y, Yu H, Liang L, Fu Y, Efferth T, Liu X, Wu N. Activities of ten essential oils towards Propionibacterium acnes and PC-3, A-549 and MCF-7 cancer cells. Molecules. 2010;15(5):3200-10.
12. Chizzola R, Michitsch H, Franz C. Antioxidative properties of Thymus vulgaris leaves: comparison of different extracts and essential oil chemotypes. J Agric Food Chem. 2008;56(16):6897-904.
13. Giordani R, Regli P, Kaloustian J, Mikafl C, Abou L, Portugal H. Antilungal Effectolvarious essential oils against Candida albicans. Potentiation of antifungal action of amphotericin B by essential oil from Thymus vulgaris. Phytother Res. 2004;18:990-5.
14. Marcos-Arias C, Eraso E, Madariaga L, Ouindós G. In vitro activities of natural products against oral Candida isolates from denture wearers. BMC Complementary and Alternative Med. 2011 ;11 :119. Disponible en internet en http://www.biomedcentral.com/1472-6882/11/119
15. Ahmad A, Khan A, Akhtar F, Yousul S, Xess 1, Khan LA, et al. Fungicidal activity of thymol and carvacrol by disrupting ergosterol biosynthesis and membrane integrity against Candida. Eur J Clin Microbiollnlect Dis. 2011; 30:41-50.
16. Mesa-Arango A, Montiel-Ramos J, Zapata B, Durán C, Betancur-Galvis C, Stashenko E. Citral and carvone chemotypes from the essential oils of Colombia n Lippia alba (Mill.) N.E. Brown: composition, cytotoxicity and antilungal activity. Mem Inst Oswaldo Cruz. 2009;104(6):878-84.
17. Ramage G, Wickes BL, López-Ribot JL. Inhibition on Candida albicans biofilm formation using divalent cation chelators (EDTA). Mycopathologia. 2007;164(6):301-6.
18. Lahlou M. Methods to study the phytochemistry and bioactivity of essential oils. J Phytother Res. 2004;18:435-48.
19. Fontenelle R, Morais S, Brito E, Kerntopl M, Brilhante R, Cordeiro R, et al. Chemical composition, toxicological aspects and antilungal activity of essential oil from Lippia sidoides Cham. J Antimicrob Chemother. 2007;59:934-40.
20. Rojas R, Bustamante B, Bauer J, Fernández 1, Albán J, Lock O. Antimicrobial activity of selected Peruvian medicinal plants. J Ethnopharmacol. 2003;88:199-204.
21. Clinical and Laboratory Standards Institute: Reference method for broth dilution antifungal susceptibility testing 01 yeasts; approved standard. 3 edition. CLSI document M27-A3 and Supplement S3. Wayne, PA, USA, 2010.
22. Ruiz JR. Estandarización del método de microdilución de placa para determinar la actividad antilúngica in vitro de extractos de plantas medicinales peruanas. Tesis de Maestría en microbiología. Lima: Universidad Nacional Mayor de San Marcos. 2012.
23. OECD. Guideline lor the testing of chemicals. 404. Acute Dermal Irritation/corrosion. 2002.
24. Soares BV, Morais SM, dos Santos Fontenelle RO, Oueiroz VA, Vila-Nova NS, Pereira CM, et al. Antifungal activity, toxicity and chemical composition of the essential oil of Coriandrum sativum L. Iruits. Molecules. 2012;17(7):8439-48.
25. Khan MS, Ahmad 1. Biolilm inhibition by Cymbopogon citratus and Syzygium aromaticum essential oils in the strains 01 Candida albicans. J Ethnopharmacol. 2012;140(2):416-23.
26. Kosalec 1, Pepeljnjak S, Kustrac D. Antilungal activity of fluid extract and essential oil from anise fruits (Pimpinella anisum L., Apiaceae). Acta Pharm. 2005;55:377-85.
27. Cano C, Bonilla P, Roque M, Ruiz J. Actividad antimicótica in vitro y metabolitos del aceite esencial de las hojas de Minthostachys mollis (muña). Rev Peru Med Exp Salud Publica. 2008;25(3):298-301.
28. Badiee P, Nasirzadeh AR, Motaffaf M. Comparison of Salvia officinalis L. essential oil and antiungal agents against candida species. J Pharmaceutical Technol Drug Res. 2012, disponible en interne!, http://www.hoajonline.com/journals/pdf/2050120X-1-7.pdl
29. Oliva M de L, Carezzano ME, Gallucci MN, Demo MS. Antimycotic effect of the essential oil of Aloysia triphylla against Candida species obtained from human pathologies. Nat Prod Commun. 2011 ;6(7):1 039-43.
30. Ramage G, Milligan S, Lappin DF, Sherry L, Sweeney P, Williams C, et al. Antilungal, cytotoxic, and immunomodulatory properties of tea tree oil and its derivative components: potential role in management of oral candidosis in cancer patients. Frontiers in Microbiology. Antimicrobials, Resistance and Chemotherapy. 2012;3:1-8.
31. Ninomiya K, Maruyama N, Inoue S, Ishibashi H, Takizawa T, Oshima H, et al. The essential oil of Melaleuca altemifolia (Tea Tree Oil) and its main componen!, terplnen-4-ol protect mice lrom experimental oral candidiasis. Biol Pharm Bull. 2012;35(6):861-5.
32. Maruyama N, Takizawa T, Ishibashi H, Hisajima T, Inouye T, Yamaguchi H, et al. Protective activity of geranium oil and its component, geraniol, in combination with vaginal washing against vaginal candidiasis in mice. Biol. Pharm Bull. 2008;31 (8):1501-6.
33. Duarte MC, Figueira GM, Sartoratto A, Rehder VL, Delarmelina C. Anti-Candida activity of Brazilian medicinal plants. J Ethnopharmacol. 2005;97(2):305-11.
34. AI-Bakri AG, Othman G, Bustanji Y. The assessment of the antibacterial and antilungal activities of aspirin, EDTA and aspirin-EDTA combination and their effectiveness as antibiolilm agents. J Applied Microbiol. 2009;107;280-6.
35. Miura T, Tanabe K, Yoshinari M. Ca (II)-EDTA shows antimicrobial activity against periodontopathic bacteria. J. Biomedical Science and Engineering. 2012;5;10-4.
36. Sokovic M, Glamoclija J, Círic A, Kataranovski D, Marin PD, Vukojevic J, et al. Antifungal activity of the essential oil of Thymus vulgaris L. and thymol on experimentally induced dermatomycoses. Drug Development and Industrial Pharmacy. 2008;34;1388-93.
37. Chami F, Chami N, Bennis S, Trouillas J, Remmal A. Evaluation of carvacrol and eugenol as prophylaxis and treatment of vaginal candidiasis in an immunosuppressed rat model. J Antimicrobial Chemother 2004;54;909-14.
38. Zore GB, Thakre AD, Jadhav S, Karuppayil SM. Terpenoids inhibit Candida albicans growth by affecting membrane integrity and arrest of cell cycle. Phytomed. 2011 ;18;1181-90.
Articulo recibido para publicación el 13 de febrero de 2015 y aceptado para publicación el 14 de marzo de 2015.
Estudio realizado como Investigación 2013 Con Asignación a la Investigación y Con Incentivo al Investigador (CON/CON), del Vicerrectorado de Investigación, Universidad Nacional Mayor de San Marcos, Código 130103151.
Los autores declaran no tener ningún conflicto de interés para la publicación de este articulo.
Correspondencia:
Dr. Juan Rajas Armas
Correo electrónico: jprojasarmas@yahoo.com













