Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.76 no.3 Lima jul./set. 2015
ARTÍCULOS ORIGINALES
Seguimiento mediante prueba de ELlSA para anticuerpos IgE de pacientes con equinococosis quística tratados con albendazol
Follow-up of human cystic echinococcosis by IgE antibodies after albendazole treatment
Herman Vildózola Gonzales1; Irma Espinoza Blanco1; Willy Roldán Gonzales1; Susana Jiménez Ramirez1; Minorka Nicho Póvez2; Grobert Mendoza2; Edgardo Meza Astuvilca2
1 Instituto de Medicina Tropical «Daniel A. Carrión», Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Departamento Académico de Medicina, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
Resumen
Antecedentes. En un estudio previo, los autores estandarizaron una prueba de ELlSA IgE para hidatidosis con alta sensibilidad (95,6%) y especificidad (100%) para el diagnóstico y seguimiento de pacientes tratados con albendazol, con resultados alentadores. Objetivo. Confirmar la utilidad de la medición de los niveles de los anticuerpos IgE en pacientes con equinococosis quística tratados con albendazol y considerados curados clínica y ecográficamente y en pacientes mejorados o curados que recurrieron. Diseño. Estudio retrospectivo-prospectivo, de tipo cuasi experimental, corte longitudinal, con pre prueba y post prueba en un solo grupo para evaluar el diagnóstico y seguimiento en los casos prospectivos y el seguimiento y recurrencia en ambos grupos. Institución. Instituto de Medicina Tropical "Daniel A. Carrión", Universidad Nacional Mayor de San Marcos, Lima, Perú. Participantes. Pacientes con equinococosis quística. Métodos. Se incluyó 17 pacientes, 15 mujeres y 2 hombres, entre 25 y 80 años de edad (promedio 58 años), con uno más quistes hepáticos y en uno además quistes pulmonares; 16 fueron tratados con albendazol a la dosis de 12-15 mg/kg, en 3 a 5 ciclos de 28 días y uno recibió tratamiento con albendazol y cirugía por una complicación. Todos fueron seguidos entre dos y 12 años postratamiento, con evaluación clínica y ecográfica en 2 a 7 oportunidades y cuantificación de los niveles de anticuerpos IgE para equinococosis en muestras de sangre. La técnica utilizada para la detección de anticuerpos IgE mediante prueba de ELlSA para IgE fue estandarizada por los autores. Principales medidas de resultados. Relación de niveles de anticuerpos IgE en sangre y comportamiento de la enfermedad. Resultados. En 10 de los 17 pacientes se mantuvieron los niveles de IgE por debajo del punto de corte, lo que se consideró como evidencia de curación, lo que además coincidía con los cambios en la ecoestructura que iba de CE1 y CE2 a CE4 y CE5, según la clasificación de la OMS para las imágenes ultrasonográficas, y que significan en los primeros alta actividad y en los últimos actividad baja o nula. Siete pacientes que al final del tratamiento mostraron evidencia de curación o gran mejoría clínica y ultrasonográfica y cuyos niveles de IgE descendieron de manera significativa, en algunos por debajo de los niveles de corte, presentaron incremento sostenido de estos niveles como expresión de recurrencia o de aparición de nuevos quistes. Conclusiones. La prueba de ELlSA para la detección de anticuerpos IgE de equinococosis quística estandarizada por los autores demostró ser una prueba útil para el seguimiento del tratamiento con albendazol, de manera de confirmar la curación clínica y ultrasonográfica de la equinococosis quística hepática. También aparece útil para la detección temprana de las recurrencias de los pacientes curados o con marcada mejoría.
Palabras clave. Anticuerpos IgE; Prueba ELlSA; Equinococosis; Albendazol.
Abstract
Background: In a previous study an IgE ELlSA test for hydatidosis was standardized and evidenced high sensitivity (95.6%) and specificity (100%) and encouraging results for the diagnosis and follow up of patients treated with albendazole. Objectives: To confirm efficacy of IgE antibody level determination in patients with cystic echinococcosis treated with albendazole and considered clinically cured and ultrasonographically improved, or recurrence in patients considered improved or cured. Design: Longitudinal, retrospective-prospective, quasi-experimental study, longitudinal study, with pre- and post-test for assessing diagnosis and monitoring in the prospective group, and follow-up and recurrence in both groups. Setling: Instituto de Medicina Tropical "Daniel A. Carrión", Universidad Nacional Mayor de San Marcos, Lima, Peru. Participants: Patients with cystic echinococcosis. Methods: Seventeen patients, 15 female and 2 male, 25-80 years old (average 58 years) carrying one or more hepatic cysts and one also lung cysts were treated with albendazole 12-15 mg/kg in 3 or 5 28-day cycles. One had also surgical treatment for a complication. They were followed for 2 to 12 years alter treatment, with clinical and ultrasound evaluation 2-7 times and serum quantification of echinococcosis IgE antibody levels. IgE antibody detection method was Ig8 ELlSA test standardized by the authors. Main outcome measures: Relation of serum IgE antibodies and disease outcome. Results: Out of the 17 patients, 10 had serum IgE below cutoff levels considered as evidence of healing. This coincided with eco structural changes from CE1 and CE2 to CE4 and CE5, according to the ultrasound imaging WHO classification, indicating high activity in the firsts and low or no recent activity in the lalter. Seven patients evidencing cure or clinical and ultrasound improvement and significant decrease of IgE some below de cut-off level showed sustained increase of these levels expressing recurrence or appearance of new cysts. Conclusions: ELlSA test for cystic echinococcosis IgE antibodies detection standardized by the authors appears as a useful tool for albendazole treatment follow-up in order to confirm clinical and ultrasound cure of liver cystic echinococcosis. It seems also useful for early detection of recurrences in patients cured or markedly improved.
Keywords: IgE antibodies; Enzyme-linked immunosorbent assay; Echinococcosis; Albendazole.
INTRODUCCIÓN
La equinococosis quística (EQ) , causada por larvas de Echinococcus granulosus, es una zoonosis parasitaria que constituye un serio problema de salud pública en muchas regiones del mundo (1). En Sudamérica existe en varios países, entre los cuales se encuentra nuestro país, especialmente en zonas de la sierra (2A).
Esta enfermedad es usualmente diagnosticada mediante exámenes clínicos utilizando diferentes técnicas de imágenes y pruebas inmunológicas para la detección de anticuerpos séricos específicos contra el parásito. La sensibilidad y especificidad de las diferentes pruebas inmunoserológicas dependen de la etapa de la enfermedad, la localización de los parásitos, los antígenos y las técnicas utilizadas (5-7).
La terapia de la equinococosis quística es primariamente quirúrgica. En nuestros días además se cuenta con alternativas terapéuticas como el tratamiento no convencional percutáneo guiado ultrasonográficamente (PAIR: punción, aspiración, inyección de sustancia escolicida y re aspiración) y el tratamiento farmacológico con benzoimidazol carbamatos y la termo ablación con radiofrecuencia como alternativas eficaces (8,9).
En las tres últimas décadas, el tratamiento de la equinococosis quística ha mejorado marcadamente, gracias a la introducción del albendazol y el mebendazol; estos dos benzimidazoles han facilitado el manejo efectivo de pacientes que no hubiesen podido ser fácilmente curados por la cirugía, como aquellos con quistes múltiples, compromiso multiorgánico, quistes secundariamente diseminados o rotos intraoperatoriamente y aquellos con contraindicaciones para la cirugía (10,11).
Una serie de informes recientes demuestran el valor potencial que posee el análisis de anticuerpos de las subclases del IgG para el serodiagnóstico específico de la equinococosis quística (EQ) o para estudios de seguimiento después de la cirugía o después de la quimioterapia (1,12-16). Uno de los problemas con las subclases de IgG es su limitación para correlacionarse en forma positiva con la evolución postoperatoria del paciente o la respuesta al tratamiento médico con albendazol (5,13-15), constituyendo un obstáculo para afirmar la curación en aquellos casos en que la respuesta aparente al tratamiento con albendazol ha sido catalogada como éxito terapéutico. Al respecto, ha sido muy importante la clasificación de la OMS (17) de los quistes hidatídicos, que permite estandarizar los diferentes momentos de su evolución y correlacionar estos hallazgos con su actividad clínica, la cual decrece desde los tipos CE1 CE2 -que son los más activos- al CES, que representa la lesión parasitaria más inactiva; sin embargo, en la práctica no siempre es posible encontrar esta concordancia entre la imagen ultrasonográfica y el grado de actividad. En estos casos, el estudio inmunoserológico podría representar el complemento ideal para aclarar si la imagen quística está activa o no.
En ese sentido, algunos autores han encontrado que el dosaje de IgE sérica total o la detección de anticuerpos IgE parecen correlacionarse con la evolución postoperatoria o con la respuesta al tratamiento médico (18-22).
En un estudio reciente (23) comunicamos la estandarización de una prueba de ELISA para anticuerpos IgE de equinococosis, donde comprobamos su sensibilidad (95,6%) y especificidad (100%) para el diagnóstico, seguimiento y detección temprana de la recurrencia en equinococosis quística. En esa pequeña muestra de pacientes se encontró que el dosaje de IgE total sérica o la detección de anticuerpos IgE parecen correlacionarse con la evolución postoperatoria o con la respuesta al tratamiento médico, como se demostró en otros estudios (24,25).
El objetivo del presente estudio fue confirmar la utilidad de la medición de los niveles de los anticuerpos IgE en pacientes con equinococosis quística tratados con albendazol y que se consideraron curados clínica y ultrasonográficamente, así como detectar precozmente las recurrencias postratamiento.
METODOLOGÍA Y TÉCNICAS DE INVESTIGACIÓN UTILIZADAS
En el presente estudio se incluyó 17 pacientes -15 mujeres y 2 hombres- con edades entre 25 y 80 años (promedio 58 años), tratados con albendazol en 16 casos y uno con albendazol y cirugía por una complicación. Todos fueron seguidos entre dos y 12 años después del tratamiento. Se les evaluó clínica y ultrasonográficamente 2 a 7 veces postratamiento y se tomó una muestra de sangre para la cuantificación de los niveles de anticuerpos IgE para equinococosis.
Todos los pacientes fueron tratados con albendazol a la dosis de 12-15 mg/ kg de peso por día, en tres ciclos de 28 días, con intervalos de 14 días sin tratamiento entre cada ciclo; recibieron como mínimo tres ciclos y máximo cinco ciclos.
El estudio fue retrospectivo-prospectivo, de tipo cuasi experimental, de corte longitudinal, con pre prueba y post prueba en un solo grupo para evaluar el diagnóstico y seguimiento en los casos prospectivos y seguimiento y recurrencia en ambos grupos.
Doce pacientes fueron diagnosticados con Western blot bandas 8, 16, 21 y seguidas postratamiento con ELISA IgE; 5 pacientes fueron diagnosticados y seguidos postratamiento con ELISA IgE.
La técnica utilizada en la detección de los anticuerpos IgE fue descrita en otro estudio de los autores publicado recientemente (23) y que consta de los pasos presentados a continuación.
El contenido proteico de los antígenos fue realizado según el método de Lowry y colaboradores (22). Para la semipurificación del antígeno B, el líquido hidatídico de quistes (HCF) de E. granulosus fue obtenido a partir de quistes hidatídicos pulmonares o hepáticos de origen ovino procedentes de un camal local. Estos líquidos fueron dejados sedimentar y el sobrenadan te fue centrifugado a 4 000 rpm durante 10 minutos. Posteriormente, el líquido fue concentrado y luego el antígeno B (AgB) fue purificado, siguiendo la metodología descrita por Oriol y colaboradores (26). El contenido proteico del AgB fue realizado según el método de Lowry y colaboradores (22).
Las microplacas de poliestireno fueron sensibilizadas con AgB a una concentración de 2 p,g/mL en buffer carbonato, pH 9,6, durante 18 horas a 4°C. Las microplacas fueron lavadas brevemente con buffer fosfato salino (PBS, pH 7,2) y luego bloqueadas con una solución de albúmina sérica bovina al 1 % en PBS conteniendo T ween20 al 0,05% (PBS-T), durante 2 horas a 37 "C. A continuación, las microplacas fueron lavadas, secadas y guardadas a -20°C hasta su posterior uso.
Con el objetivo de incrementar la detección de los anticuerpos IgE, cada muestra de suero a ser testado fue previamente tratado con anticuerpos de carnero anti-IgG humano (RF Absorbent, Siemens Healthcare, USA) a una dilución de 1/20 para la eliminación de los anticuerpos IgG; la mezcla fue incubada a 4°C durante toda una noche y luego centrifugada a 10 000 rpm por 10 minutos. El sobrenadan te resultante fue utilizado para la detección de anticuerpos IgE.
Se adicionó un volumen de 100 p,L en cada pocillo de las muestras tratadas y de los controles positivos y negativos, y luego se incubó toda una noche a 37°C. Al día siguiente, las placas fueron lavadas 3 veces por 5 minutos con PBS-T y luego incubadas con una solución de anticuerpo anti-Igf humano conjugado con peroxidasa (Sigma Aldrich, USA), diluido 1/4 000 duran te 1 hora a 37°C. A continuación, las placas fueron lavadas como ya fue descrito anteriormente y luego se adicionó una solución de substrato-cromógeno (OPD-Fast, Sigma-Aldrich, USA) y se incubó durante 30 minutos a 37°C. Finalmente, la reacción enzimática fue detenida por adición de ácido sulfúrico 2,5N. Las placas fueron analizadas en un lector de ELISA a una longitud de onda de 490 nm. El valor del punto de corte (cut-off) para la prueba de ELISA fue determinado como el promedio de 5 controles negativos más 3 veces el valor de la desviación estándar de los mismos. Toda muestra que había obtenido un valor mayor al cut-off fue considerada como positiva.
RESULTADOS
De un total de 17 pacientes, 16 con equinococosis quística hepática y uno equinococosis quística hepática y pulmonar, quince del sexo femenino y 2 del sexo masculino, con edades entre 25 y 80 años (promedio 58 años), 6 pacientes presentaron quiste único, un paciente dos quistes, dos pacientes tres quistes, dos con cuatro quistes, uno con seis, uno con siete, tres con masas quísticas conteniendo numerosos quistes (más de 10) y una paciente además de los seis quistes hepáticos presentaba ocho quistes pulmonares. Por otra parte el número de muestras tomadas postratamiento fluctuó entre dos y siete. Todos estos pacientes fueron atendidos en los consultorios externos del Instituto de Medicina Tropical Daniel A Carrión de la Universidad Nacional Mayor de San Marcos, entre los años 2003 y 2011 (tabla 1).
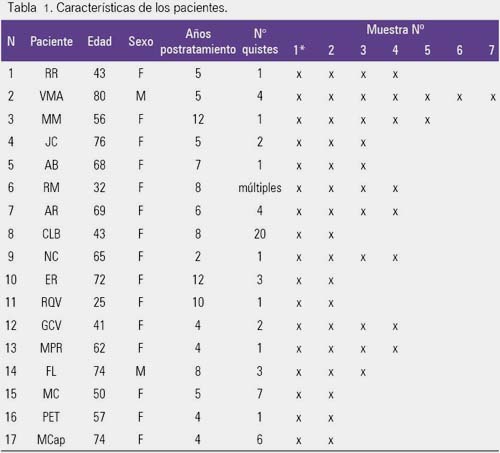
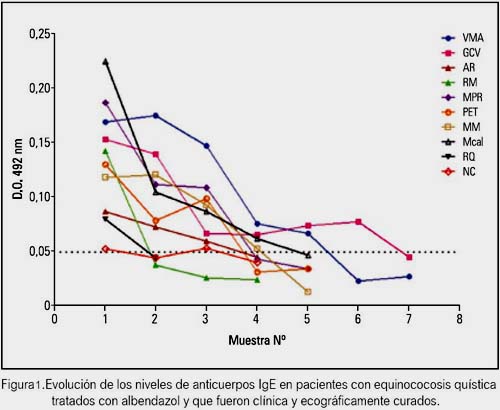
Los 17 pacientes fueron calificados como curados o con una mejoría mayor al 50% desde el punto de vista clínico y ultrasonográfico. Además, en 5 pacientes el diagnóstico se hizo utilizando la prueba de ELISA para IgE de hidatidosis y en el resto western blot con tres bandas 8,16 y 21 KDa. Pero a todos se les hizo el seguimiento con la determinación de IgE. De los 17 pacientes, en 10 se mantuvieron los niveles de IgE en sangre por debajo del punto de corte, lo que se consideró como evidencia de curación, lo que además coincidía con los cambios en la ecoestructura que iba de CE1 y CE2 a CE4 y CES, según la clasificación de la OMS para las imágenes ultrasonográficas y que significan en los primeros alta actividad y en los últimos actividad baja o nula (figura 1).
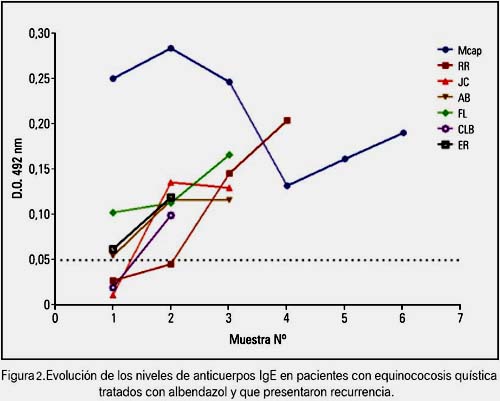
También se pudo evidenciar que aquellos pacientes que al final del tratamiento mostraron evidencia de curación o gran mejoría clínica y ultrasonográfica y cuyos niveles de IgE descendieron de manera significativa, en algunos casos por debajo de los niveles de corte, presentaron incremento sostenido de estos niveles como expresión de recurrencia o de aparición de nuevos quistes (figura 2).
DISCUSIÓN
En un estudio previo de los autores (23) se logró evidenciar la correlación entre la curación clínica y ultrasonográfica y la caída en los niveles de la IgE, en seis pacientes, y en otros cinco se pudo observar que los incrementos de los niveles de IgE también coincidían con el retorno de los síntomas clínicos y los cambios en la ecoestructura de los quistes o la aparición de nuevos quistes y que se consideraba como recurrencia. En este sentido, fue muy útil la clasificación de la OMS de los quistes hepáticos, que correlacionaba la apariencia eco gráfica de los quistes y su grado de actividad (17). En el presente estudio, se aporta cuatro nuevos casos de pacientes curados y dos pacientes más en los que luego de una respuesta muy evidente se produjo una elevación de los niveles de IgE, considerándose como una recurrencia (27-30) (ver figura 2). Como en el estudio anterior, se ha podido compro bar en dos pacientes nuevos la negatividad antes del inicio del tratamiento y su posterior positividad al segundo ciclo de tratamiento, lo que tiene una explicación en el mecanismo de acción de albendazol, que inhibe el ensamblaje de la tubulina en los microtúbulos, de modo que altera la absorción de glucosa a través de la capa genninativa de la pared del quiste. Esto causa depleción de glicógeno y degeneración del retículo endoplásmico y de las mitocondrias de las células de la capa germinal, que resulta en aumento de los lisosomas y subsecuente muerte celular (31) y aumento de la permeabilidad de la membrana quística (32). Ello permite el paso de antígenos hidatídicos al torrente sanguíneo, con la consecuente positivización de las pruebas inmunológicas con la prueba de IgE. Es indudable que este nuevo aporte de cuatro pacientes, si bien todavía no es un número importante desde el punto de vista estadístico, representa una clara tendencia de la utilidad de la prueba, que por otra parte tiene su correlación en otros estudios publicados en diferentes revistas internacionales, como son los casos de Manterola y colaboradores (20) y de Rigano y col (12,20).
Las pruebas serológicas, como un método para el seguimiento clínico, también tienen la desventaja de que los anticuerpos específicos pueden persistir en el paciente por varios años después de la recuperación (33). Entre las nuevas pruebas serológicas para evaluar si una infección progresará o regresará, las pruebas de iso tipos de inmunoglobulinas con el uso de diferentes antígenos del parásito parece un avance razonable (13,34).
También es interesante que se pudo confirmar los resultados obtenidos por otros sobre la eficacia de albendazol en el tratamiento del quiste hidatídico hepático, en porcentajes importantes, considerando las curaciones y mejorías, que incluyen cambios degenerativos en más del 50% y con 40 a 70% menor riesgo que el tratamiento quirúrgico y una tasa de recurrencia similar (35.37).
Es evidente que estos resultados contribuyen al objetivo de hacer un seguimiento no solo para comprobar la curación clínica, imagenológica e inmunológica, sino para detectar la recurrencia en una etapa muy temprana, lo que permitirá iniciar un nuevo tratamiento ya sea médico o si las condiciones del paciente y la localización del quiste lo permiten tratamiento quirúrgico, que finalmente es el tratamiento definitivo.
Por otra parte, una exitosa remoción del quiste no es garantía contra la recurrencia, activación de quistes silentes o reinfección. Las tasas de reinfección o recurrencia entre los pacientes tratados quirúrgicamente tiende a ser alto en comunidades donde la infección por Equinococcus granulosus es endémica, estando en el rango de 30%, y los casos recurrentes son frecuentemente inoperables (38). Estas limitaciones al tratamiento quirúrgico en cuanto a la recurrencia o reinfección han motivado que se expanda cada vez más el tratamiento médico con benzimidazoles carbamatos, principalmente albendazol. En ambos casos, uno de los problemas es la dificultad de contar con una herramienta de fácil procesamiento y bajo costo para confirmar en primer lugar la curación de los quistes, especialmente en los casos tratados médicamente, y de mucha importancia el detectar precozmente la recurrencia o la reinfección.
Finalmente, estamos empeñados en continuar realizando esta prueba a todos los nuevos pacientes que padecen de equinococosis quística hepática, con el fin de consolidar este importante método de diagnóstico inmunológico y seguimiento postratamíento, que por otra parte es relativamente sencillo, rápido y de bajo costo, ideal para los pacientes que en general padecen estos problemas médicos, y que son de escasa condición económica.
CONCLUSIONES Y RECOMENDACIONES
La prueba de ELISA para la detección de anticuerpos IgE de equinococosis quística estandarizada por los autores es una prueba útil para el seguimiento pre y post tratamiento con albendazol, para confirmar la curación clínica y ultrasonográfica de la equinococosis quística hepática. También es útil para la detección temprana de las recurrencias de los pacientes curados o con marcada mejoría.
A la luz de la presente investigación se puede recomendar que esta prueba con excelente sensibilidad y especificidad (95,7 % y 100%, respectivamente) demostradas en un estudio anterior es la mejor opción para el seguimiento y detección de las recurrencias en los pacientes tratados con albendazol y que se consideran clínica y ultrasonográficamente curados o mejorados.
REFERENCIAS BIBLIOGRÁFICAS
1. Eckert J, Deplazes P. Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern. Clin Microbiol Rev. 2004;17(1);107-35.
2. Moro PL, Gilman RH, Verastegui M, Bern C, Silva B, Bonilla JJ. Human hydatidosis in Central Andes of Peru: evolution of disease over 3 years. Clinical Infectious dis. 1999 Oct;29(4);807-12.
3. Larrieu E, Belloto A, Arambulu III P, Tamayo H. Echinococcosis quística; epidemiologia y control en América del Sur. Parasitol Latinoam. 2004;59;82-9.
4. Salgado S, Suárez-Ognio L, Cabrera R. Características clínicas y epidemiológicas de la equinococcosis quística registrada en un área endémica en los andes centrales del Perú (1991-2002). Ncootrop Helminthol. 2007;1 (2);9-83.
5. Brunetti E, Junghanss T. Update on cystic hydatid disease. Curr Opin Inlect Dis. 2009;22(5);497-502.
6. Dziri C, Haouet K, Fingerhut A, Zaouche A. Management 01 cystic echinococcosis complications and dissemination; where is the evidence? World J Surg. 2009;33(6);1266-73.
7. Stojkovic M, Zwahlen M, Teggi A, Vutova K, Cretu CM, Virdone R, Nicolaidou P, Cobanoglu N, Junghanss T. Treatment response of cystic echinococcosis to benzimidazoles: a systematic review. PLoS Negl Trop Dis. 2009;3(9);e524.
8. Teggi A, Lastillo MG, De Rosa F. Therapy 01 human hydatid disease with mebendazole and albendazole. Antimicrob Agents Chemother. 1993;37;1679 84.
9. Brunetti E, Maiocchi L, Garlaschelli AL, Gulizia R, Filice C. [Overview of therapeutic options lar cystic echinococcosis]. Parassitologia. 2004 Jun;46(1-2);53-5.
10. Warld Health Organization Guidelines for the treatment of cystic and alveolar echinococcosis in humans. Bull WHO. 1996;74;231-42.
11. Todorov T, Geargiev, P, Handjiev S, Vutova K. Potentials of benzimidazole compounds in treatment of human echinococcosis. Arch Intern hidatidosis. 1997;32;164-7. Tropical Medicine & Parasitology 2005, Vol 99, No 7,649-65
12. Aceti A, Pennica A, Teggi A, Fondacaro LM, Calerro M, Leri O, Tacchi G, Celestino D, Quaranta G, De Rosa F, et al. IgG subclasses in human hydatid cisease: prominence of the IgG4 response. IntArch Allergy Immunol. 1993;102(4);347-51.
13. Riganó R, Prolumo E, loppolo S, Notargiacomo S, Ortona E, Teggi A, Siracusano A. Immunological markers indicating the effectiveness of pharmacological treatment in human hydatid disease. Clin Exp Immunol. 1995;102(2);281-5.
14 Dreweck CM, Lúder CG, Soboslay PT, Kern P. Subclass-specilic serological reactivity and IgG4specilic antigen recognition in human echinococcosis. Trop Med Int Health. 1997; 2(8);779-87.
15. McVie A, Ersleld K, Rogan MT, Craig PS. Expression and immunological characterization of Echinococcus granulosus recombinant antigen B lar IgG4 subclass detection in human cystic echinococcosis. Acta Trop. 1997;67(1-2);19-35.
16. Daeki Aa, Craig PS, Shambesh MK. IgG-subclass antibody responses and the natural histary of hepatic cystic echinococcosis in asymptomatic patients. Ann Trop Med Parasitol. 2000;94(4);319-28.
17. WHO Inlarmal Warking Group. International classilicationol ultrasound images in cystic echinococcosis lar application inclinical and field epidemiological setting. Acta Tropica. 2003;85;253-61.
18. Lawn SD, Bligh J, Craig PS, Chiodini PL. Human cystic echinococcosis; evaluation of post-treatment serologic follow-up by IgG subclass antibody detection. Am J Trop Med Hyg. 2004;70(3);329-35.
19. Riganó R, loppolo S, Ortona E, Margutti P, Prolumo E, Ali MD, Di Vico B, Teggi A, Siracusano A. Longterm serological evaluation of patients with cystic echinococcosis treated with benzimidazole carbamates. Clin Exp Immunol. 2002 Sep;129(3);48592.
20. Khabiri AR, Bagheri F, Assmar M, Siavashi MR. Analysis of specilic IgE and IgG subclass antibodies for diagnosis of Echinococcus granulosus. Parasite Immunol. 2006;28(8);357-66.
21. Manterala C, Vial M, Schneeberger P, Peña JL, Hinostraza J, Sanhueza A. Precision of ELlSA-lgE and ELlSA-lgG determination in the postoperative follow-up of patients with hepatic echinococcosis. Cir Esp. 2007;81 (1);23-7.
22. Lowry OH, Rosebraugh NJ, Farr AL, Randall RJ. Pratein measurement with the Folin phenol reagent. J Biol Chem. 1951 Nov;193(1);265-75.
23. Vildozola H, Espinoza I, Roldan W. H Estandarización de una prueba de ELlSA para detectar anticuerpos IgE en pacientes con equinococosis quística y su utilidad en el diagnóstico y seguimiento de pacientes tratados con albendazol: reporte preliminar. An Fac rned. 2012;73(1);36-41.
24. Türkyilrnaz Z, Sonrnez K, Karabulut R, Derniragullari B, Gol H, Basaklar AC, Kale N. Conservative surgery for treatrnent of hydatyd cysts in children. Warld J Surg. 2004 Jun;28(6);597-601.
25. Schipper HG, Kager PA. Diagnosis and treatrnent of hepatic echinococcosis; an overview. Scand J Gastraenteral Suppl. 2004;241 ;50-5.
26. Oriol R, Williarns JF, Perez Esandi MV, Oriol C. Purilication of lipopratein antigens of Echinococcus granulosus frorn sheep hydatd Iluid. Arn J Trap Med Hyg. 1971 ;20(4);569-74.
27. Atrnatzidis KS, Pavlidis TE, Papaziogas BT, Mirelis C, Papaziogas TB. Recurrence and long-term outcome after open cystectomy with ornentoplasty for hepatic hydatid disease in an endemic area. Acta Chir Belg. 2005 Apr;105(2);198-202.
28. Smego RA Jr, Sebanego P. Treatment options for hepatic cystic echinococcosis. Int J Inlect Dis. 2005;9;69-76.
29. Teggi A. An up-to-date on clinical management of human cystic echinococcosis. Parasitologia. 2004;46;405-7.
30. Nahmias J, Goldsmith RS, Soibelman M, el-On J. Three- to 7-year lollow-up after albendazole treatment of 68 patients with cystic echinococcosis (hydatid disease). Ann Trap Med Parasitol. 1994 Jun ;88(3) ;295-304.
31. Kern P. Medical treatrnent of echinococcosis under the guidance of good clinical practice (GCP/ICH). Parasitol Internat. 2006;55273 S282.
32. Marris DL, Chinnery JB, Geargiou G, Stamatakis G, Golematis B. Penetration of albendazol sulphoxide into hydatid cysts. Gut. 1987 Jan;28(1);75-80.
33. Pawlowski ZS. Critical points in the clinical management of cystic echinococcosis: a revised review. En: Andersen FL, Ouhelli H, Kachani M, eds. Compendiurn on cystic Echinococcosis. Pravo; Brigharn Young University Print Services. 1997;199-235.
34. Wen H, Craig PS. Irnrnunoglobulin G subclass response in hurnan cystic and alveolar echinococcosis. Arn J Trap Med Hyg. 1994;51;741-8.
35. Todorav T, Vutova K, Mechkov G, Petkov D, Nedelkov G, Tonchev Z. Evaluation of response to chemotherapy of human cystic echinococcosis. Br J Radiol. 1990 Jul;63(751);523-31.
36. French CM. Mebendazol and surgery for human hydatid disease in Turkana. East Alrican Med J. 1984;61;113-9.
37. Todorav T, Vutova K, Donev S, Ivanov A, Katzarov K, Takov D. The types and tirning of the degenerative changes seen in the cysts during and alter benzidazole treatrnent of cystic echinococcosis. Ann Trap Med Parasitol. 2005 Oct.99(7);649-59.
38. Bezzi M, Teggi A, De Rosa F, Capozzi A, Tucci G, Bonilacino A, Angelini L. Abdorninal hydatid disease: US lindings during rnedical treatrnent. Radiology. 1987 Jan;162(1 Pt 1);91-5.
Articulo recibido el 12 de junio de 2015 y aprobado para publicación el 10 de julio de 2015.
Conflicto de Intereses: Los autores declaran que no existen conflictos de Intereses.
Financiamiento: Propio de los autores.
Correspondencia:
Dr. Herman Vildózola Gonzales
Correo electrónico: hvildozolag@unmsm.edu.pe













