Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.76 no.3 Lima jul./set. 2015
ARTÍCULOS ORIGINALES
Uso de marcadores genotoxicológicos para la evaluación de agricultores expuestos a plaguicldas organofosforados
Use of genotoxíc markers for the evaluation of farmers exposed to organophosphorous pesticides
Jaime Rosales1,a,b
1 Centro Nacional de Salud Ocupacional y Protección del Ambiente para la Salud, Instituto Nacional de Salud, Lima, Perú.
a Tecnólogo Médico, b Magíster en Salud Ocupacional.
Resumen
Introducción. Los plaguicidas organofosforado son compuestos utilizados para el control de plagas en actividades agrícolas; genera exposición ocupacional asociada a posibles intoxicaciones agudas y crónicas que se manifiestan por alteraciones a nivel bioquímico, molecular y genético, los cuales pueden ser evaluados mediante el uso de marcadores genotoxicológicos. Objetivo. Determinar el uso de marcadores genotoxicológicos para la evaluación de agricultores expuestos a plaguicidas organofosforados. Diseño. Observacional, analítico, transversal con grupo control. Lugar. Empresa de agroexportación de espárragos en el Distrito de Virú, La Libertad. Intervenciones. Se determinó la actividad enzimática de la colinesterasa sérica (BChE) y eritrocitaria (AChE), y se hizo ensayos de genotoxicidad (aberraciones cromosómicas, ensayo cometa y micronúcleos) en 59 trabajadores expuestos a plaguicidas (grupo expuesto) y 50 personas sin exposición a plaguicidas (grupo control). Principales medidas de resultados. Actividad enzimática de la colinesterasa sérica (BChE) y eritrocitaria (AChE), y ensayos de genotoxicidad (aberraciones cromosómicas, ensayo cometa y micronúcleos). Resultados. Las edades promedio del grupo expuesto y control fueron de 39,6±1 0,8 Y 34,0±11 ,5 años, respectivamente. En referencia a la actividad BChE, se encontró diferencia significativa (p<0,001) entre el grupo expuesto (4 733.0±1 350.1 U/L) y control (7 075.0±1 674.0 U/L). Caso contrario se presentó en la actividad AChE entre el grupo expuesto (4 867,0±632,2 U/L) y control (5 051 ,0±505,5 U/L). Además, se evidenció la inhibición de ambas enzimas en 9 trabajadores expuestos por debajo del valor de referencia. No se evidenció diferencias significativas en los marcadores genotoxicológicos, a excepción del recuento de micronúcleos, puentes nucleoplásmicos, gemaciones, binucleaciones celulares y cariorexis de células de epitelio bucal; yen la evaluación del daño al ADN mediante el ensayo cometa (p<0,05) se obtuvo promedios de intensidad de cola de 8,28±1 ,85 (Rango: 6,06-15,75) y 7,30±1 ,25 (Rango. 4,04-9,41) para el grupo expuesto y control, respectivamente. Conclusiones. El uso de marcadores genotoxicológicos aportó información relevante como herramienta que permite predecir el riesgo asociado a cáncer, considerando que el evento inicial es el daño al ácido desoxiribonucléico (ADN) en cualquier etapa del ciclo celular; además, existió asociación significativa entre el efecto genotóxico y la exposición a plaguicidas organofosforados evidenciada por la inhibición de la BChE.
Palabras clave. Insecticidas organofosforados; Colinesterasa sérica; Colinesterasa eritrocitaria; Ensayo cometa; Micronúcleos; Aberraciones cromosómicas.
Abstract
Introduction: Organophosphorous pesticides are compounds used to control pests in agricultural activities. They generate potential occupational exposure associated with acute and chronic poisoning manifested by biochemical, molecular and genetic alterations that may be assessed using genotoxic markers. Objective: To evaluate genotoxicologic markers use for assessing farmers exposed to organophosphate pesticides. Design: Observational, analytical, cross-sectional study with control group. Institution: Asparagus Agro Exportation Company in District of Virú, La Libertad. Interventions: Enzyme activity of serum (BChE) and erythrocyte cholinesterase (AChE), and genotoxicity assays (chromosome aberrations, comet assay and micronucleus) were assessed in 59 workers exposed to pesticides (exposed group) and 50 individuals not exposed to pesticides (control group). Main outcome measures: Enzyme activity of serum (BChE) and erythrocyte cholinesterase (AChE), and genotoxicity assays (chromosome aberrations, comet assay and micronucleus). Results: Average age of the exposed and control groups were respectively 39.6 ± 10.8 and 34.0 ± 11.5 years. Referring to BChE activity, significant difference (p <0.001) was found between the exposed group (4733.0 ± 1350.1 U/L) and control group (7075.0 ± 1674.0 U/L). The contrary occurred in the AChE activity between the exposed (4867.0 ± 632.2 U/L) and control group (5051.0 ± 505.5 U/L). Furthermore, there was evident inhibition of both enzymes below the reference value in 9 workers. No significant difference was observed in genotoxic markers, except for buccal epithelium cells micronuclei count, nucleoplasmic bridges, buddings, binucleation and karyorrhexis. In comet assay DNA damage evaluation (p <0.05) mean queue intensity was 8.28 ± 1.85 (range: 6.06 15.75) and 7.30 ± 1.25 (range: 4.04-9.41) for the exposed and control groups, respectively. Conclusions: Use of genotoxicologic markers provided relevant information to predict cnacer-associated risk considering the initial event is damage to deoxyribonucleic acid (DNA) at any stage of the cell cycle. Significant association between genotoxic effects and exposure to organophosphorous pesticides was demonstrated by BChE inhibition.
Keywords: Insecticides, Organophosphate; Serum cholinesterase; Erythrocyte cholinesterase; Comet assay; Micronuclei; Chromosomal aberrations.
INTRODUCCIÓN
En el Perú, el auge de la exportación agrícola y el uso deficiente de medidas de protección en trabajadores agrícolas han incrementado los casos de intoxicación a plaguicidas. La Dirección General de Epidemiología del Ministerio de Salud (DGE-MINSA) registró 48 730 casos de intoxicación aguda por plaguicidas en el periodo 2000- 20 13 (1).
La exposición laboral a plaguicidas puede generar intoxicaciones agudas con manifestaciones neurológicas tales como el síndrome clásico, intermedio y de neurotoxicidad retardada; e intoxicaciones crónicas con alteraciones neuropsicológicas.
Los agricultores se exponen a plaguicidas, sobre todo de la clase organofosforados, durante su preparación, aplicación, almacenaje o trabajo en el campo. Cuando ingresa el plaguicida organofosforado, este inhibe la actividad enzimática de la colinesterasa, alterando la función del sistema nervioso periférico y autónomo y en consecuencia, a los órganos que dependen de ellos, afectando finalmente al sistema nervioso central. La mayoría de plaguicidas son absorbidos por vía respiratoria, digestiva, dérmica y ocular lo cual determina su alta capacidad de ingreso al organismo, produciendo diferentes alteraciones fisiológicas con distinto grado de toxicidad según el tipo de plaguicida (2).
La evaluación precoz de la toxicidad asociada a la exposición por plaguicidas es una actividad que comprende la implementación de un programa de vigilancia sanitaria específica, siendo importantes las acciones de monitoreo biológico por el laboratorio (mediante el uso de marcadores de exposición, efecto y susceptibilidad en el trabajador expuesto) (3). Precisamente, una característica de la epidemiología molecular constituye el uso de marcadores biológicos que permitan medir la exposición a diversos agentes de riesgo, así como aquellos que protegen o favorecen el desarrollo de la enfermedad en estadios subclínicos (4). Incluso en algunos plaguicidas que son clasificados como carcinógenos según la IARC (International Agency for Research on Cancer) (5) es relevante caracterizar el riesgo por la exposición a estos agentes, utilizando métodos que evalúen el efecto genotóxico producido. La vigilancia epidemiológica es una actividad fundamental en el control de riesgos asociados a la exposición ocupacional a plaguicidas en el sector agrícola; y en Perú, únicamente ha estado basada en la evaluación clínica orientada al hallazgo de síntomas y signos típicos de intoxicación aguda. Sin embargo, existe un grupo mayoritario de trabajadores que presentan exposición crónica a plaguicidas y que no son identificados debido a que las manifestaciones clínicas suelen presentar se a largo plazo, afectando la capacidad cognitiva, incluso asociándose a enfermedades neurodegenerativas y psiquiátricas, así como procesos de mutagénesis, carcinogénesis y teratogénesis (10).
En nuestro país, la determinación de la actividad colinesterasa sérica representa el único marcador de efecto de uso conocido e incluso limitado ante la exposición a plaguicidas; por ende el objetivo del presente trabajo fue utilizar marcadores genotoxicológicos que estén orientados a evaluar el efecto temprano y tardío producido por la exposición a plaguicidas, mediante el ensayo cometa y el estudio de micronúcleos y aberraciones cromosómicas, respectivamente, además de los marcadores clásicos como las enzimas colinesterasas.
MÉTODOS
Se diseñó un estudio observacional, analítico de corte transversal con grupo control.
La población de estudio estuvo constituida por agricultores expuestos a plaguicidas organofosforados de una empresa de agroexportación de espárragos del Distrito de Virú, Departamento La Libertad; y personas sin exposición a plaguicidas del Hospital Provincial de Virú. Se estimó el tamaño de la muestra comparando proporciones de prevalencia en ambos grupos de estudio, basado en una proporción esperada en el grupo de expuestos del 30%, con un nivel de confianza de 95% y poder de prueba de 80%. La muestra obtenida fue de 59 y 50 personas para el grupo de expuestos y no expuestos, respectivamente. Se consideró un tiempo de exposición mínima de 2 años para enrolar participantes al grupo de expuestos y además fueron divididos según actividades de fumigación (fumigadores y no fumigadores). Los criterios de exclusión del estudio fueron personas con enfermedades degenerativas, hepáticas, anemia, cáncer, o que hubieran estado expuestas a rayos X durante el último mes. Estos datos fueron obtenidos mediante la aplicación de una ficha epidemiológica y evaluación médica.
Se colectaron muestras de sangre por punción venosa (4 mL en tubo de extracción al vacío sin anticoagulante, para la obtención de suero) para el análisis de la actividad de butirilcolinesterasa (BChE), acetilcolinesterasa (AChE) y los ensayos de geno toxicidad (4 mL en tubo de extracción al vacío con heparina sódica). También se obtuvieron células epiteliales por hisopado bucal, las cuales fueron usadas para el ensayo de micronúcleos. Para el caso de los fumigadores, estos fueron evaluados 24 horas después de haber culminado su actividad.
La actividad enzimática de la BChE fue medida usando un kit comercial (Wiener Lab) y las lecturas fueron realizadas en un auto analizador bioquímico CM250-WienerLab con un método cinético enzimático. La actividad enzimática de la AChE fue medida según lo descrito por Ellman y col (6). Se utilizó un espectro fotómetro Thermo Scientific modelo Genesys 300 para las lecturas de absorbancia a una longitud de onda de 405 nm.
Se realizó el cultivo de linfocitos para la obtención de células en metafase. Se añadió 500 uL de sangre heparinizada aS mL de RPMI 1640 tratado con 200 uL de fitohemaglutinina y enriquecido con 20% de suero bovino fetal y glutamina. Los tubos fueron homogenizados y puestos a incubación a 37° a 5% CO2 por 48 horas; 90 minutos antes de la cosecha, se añadió Colcemid 0,2 ug/mL. La cosecha, fijación, tinción y lectura se procedieron de acuerdo a lo indicado por la IAEA (International Atomic Energy Agency) (7).
Las células obtenidas por hisopado bucal fueron fijadas en Carnoy y sometidas a 3 lavados consecutivos, previa centrifugación a 1 200 rpm por 10 minutos. Se realizó preparados en láminas portaobjetos limpios con alcohol absoluto y secados al aire. Las células fueron teñidas con Giemsa al 2% diluido en buffer fosfato de Sorensen pH 7,2 (El buffer se preparó mezclando 49 mL de 0,06 M Na2HP04 (8,52 gIL) con 51 mL de KH2P04 0,06 M (8,16 gIL)). Se realizó un recuento de 2 000 células epiteliales en un microscopio de luz visible a 100X. Se empleó los criterios para el reconocimiento de micronúcleos según lo descrito por Tolbert y col (8).
Se usó el ensayo cometa para evaluar daño del ADN según lo descrito por Rojas y col (9). Se prepararon láminas embebidas en 150 uL de agarosa regular 0,5% y secadas a 60°C por 1 hora. Luego se mezcló 10 uL de sangre con 75 uL de agarosa bajo punto de fusión (LMPA) 0,5 % a 37°C y se añadió a la lámina previamente preparada; se cubrió con una laminilla, para que se solidificara, entre 4-8°C por 5 minutos. Posteriormente, se retiró la laminilla cuidadosamente y se añadió 75 uL de LMPA 0,5 % para cubrirse y solidificarse nuevamente a 4°C por 5 minutos. Una vez que la lámina estuvo preparada, fue sumergida en un buffer de lisis, pH = 10 (40 mL stock de lisis (146,1 g NaC12,5 M, 37,2 g EDTA disódico 100 mM y 1,2 g Tris Base 10 mM, csp 1 L de agua ultrapura), 4 mL de DMSO y 400 uL de tritón X-100), por 1 hora a 4°C. Luego se ubicó las láminas en el tanque de ensayo cometa para realizar el desenrrollamiento del ADN en el buffer de electroforesis por 20 minutos. Dicho buffer se preparó con 30 mL NaOH lON y 5 mL EDTA di sódico 200 mM csp, 1 L de agua ultrapura y ajustado con gotas de NaOH 10 N a un pH=13,l. Los parámetros de electroforesis fueron a 25 V y 300 mAmp por 20 minutos. El tanque de ensayo cometa estuvo conectado a un chiller para asegurar la corrida a 4°C. Terminada la electroforesis, las láminas fueron trasladadas a un buffer de neutralización (48,5 g Tris base 0.4 M en 1 L de agua ultrapura, ajustado a un pH=7,5) por dos veces a 5 minutos; y fueron deshidratadas en etanol absolu to por 5 minutos, retiradas y puestas en posición vertical hasta su completo se cado. Finalmente, se realizó la tinción con 20 uL de bromuro de etidio 20 gIL diluido 1: 10. La lectura se realizó en un microscopio de epifluorescencia marca Meiji. La medición del parámetro del ensayo cometa (intensidad de cola) fue obtenida con el software Comet Assay IV de Perceptive Instrument Ltda. sobre los nucleoides obtenidos de células mo nonucleares de sangre periférica.
El análisis estadístico se realizó usando el software IBM SPSS v 19,0 año 2013. Se calculó la frecuencia y medidas de tendencia central presentados en tablas de doble entrada, prueba de chi cuadrado, t-student y prueba no paramétrica U de Mann-Whitney, previo análisis de normalidad con la prueba de Shapiro-Wilk. Se consideró como diferencia significativa un valor de p<0,05.
Los participantes del estudio fueron informados de los procedimientos a realizar, riesgos, beneficios y confidencialidad de los resultados. Los participantes otorgaron y firmaron el consentimiento voluntariamente.
RESULTADOS
Las características sociodemográficas más relevantes en los grupos de estudio se muestran en la tabla 1, donde las personas que no fueron fumigadores se dedicaban a actividades de sembrío, cosecha y envasado de vegetales para su exportación. También se incluyó el tiempo laboral y la presencia de hábitos usuales, como el consumo de alcohol y cigarrillos.
La tabla 2 resume las características laborales del grupo expuesto a plaguicidas, donde se muestra que la mayoría de fumigadores realizaban su labor con distintos sistemas de fumigación y además no utilizaban los equipos de protección personal de modo integral.

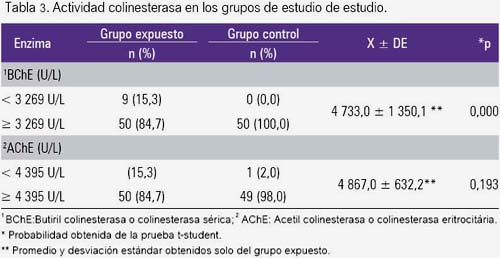
La tabla 3 muestra la actividad colinesterasa sérica y eritrocitaria, hallándose diferencia significativa entre los grupos de estudio (p<0,001) para el primer caso, mas no para el segundo. Sin embargo, tomando como referencia los valores normales para ambos marcadores, se observa que 15,3 % de los evaluados en el grupo expuesto presentó valores por debajo de dicho rango.
El uso de los marcadores geno toxicológicos se muestra en la tabla 4, y se aprecia diferencias significativas entre los grupos de estudio para el ensayo de aberraciones cromosómicas y micronúcleos, mas no para el ensayo cometa.
DISCUSIÓN
La colinesterasa sérica (BChE, E.C. 3.1.1.8) y eritrocitaria (AChE, E.C. 3.1.1. 7) son un grupo de enzimas con elevada tasa de variabilidad interindividual debido a factores como el peso, talla, sexo, edad y además por los polimorfismos genéticos asociados (11). La variabilidad intraindividual puede condicionar sesgos de lectura; por ejemplo, las anemias hemolítícas, policitemias y en general trastornos eritropoyéticos afectan considerablemente la actividad colinesterasa eritrocitaria (12). Es importante mencionar que este último parámetro según investigaciones anteriormente realizadas es considerado el mejor biomarcador de exposición a plaguicidas debido a su superior sensibilidad y especificidad sobre la colinesterasa sérica, pero bajo condiciones fisiológicas y bioquímicas similares en las personas (13). Sin embargo es crucial establecer modelos adecuados que permitan establecer y caracterizar correctamente la inhibición enzimática de las colinesterasas (14). A pesar de lo descrito, nuestros hallazgos muestran que la inhibición de la colinesterasa sérica fue más significativa que la eritrocitaria, la cual presenta una elevada correlación con las manifestaciones clínicas presentadas en personas con exposición aguda, como es el caso de las intoxicaciones (15). Cabe señalar que en el presente estudio no se incluyó a mujeres gestantes ni personas con trastornos hepáticos y anemia previo análisis de transaminasas y hemograma; para asegurar que los datos obtenidos no estén sesgados por variables fisiológicas que afectan la actividad colinesterasa sérica (16).
Las actividades de monitoreo biológico deben contar con información de la actividad basal de colinesterasa a fin de determinar el porcentaje de inhibición enzimática, el cual no debe sobrepasar el 30 %, después de haber realizado actividades que se asocien a la exposición a plaguicidas organofosforados y carbamatos, después de un periodo mínimo de 30 días (15).
Una de las medidas de control de riesgos por exposición a los plaguicidas es el uso adecuado de los equipos de protección personal además de las buenas prácticas durante la jornada laboral. Nuestro estudio refleja en líneas generales que el personal expuesto no cumplía ninguna de las dos medidas señaladas; siendo precisamente los principales factores de riesgo que determinan el estado de salud en personal expuesto a plaguicidas (17). El efecto temprano producido por la exposición a plaguicidas es variada, sin embargo una de las moléculas diana que interaccionan con los plaguicidas y sus metabolitos es el ADN, el cual es susceptible de sufrir rupturas en hebra simple o doble, que se puede manifestar a largo plazo con la presencia de aberraciones cromosómicas.
Los hallazgos que asocian exposición a plaguicidas y el efecto geno tóxico son variables; incluso algunos autores no encontraron asociación significativa entre el daño genético estudiado a través del ensayo cometa, aberraciones cromosómicas y recuento de micronúcleos en células de epitelio bucal y su relación con la exposición a plaguicidas (18). Otros evidenciaron que la reparación del ADN de personas expuestas a plaguicidas no genera mayor alteración en comparación a un grupo control (19). El recuento de micronúcleos en células binucleadas tampoco ha evidenciado diferencias significativas en el mismo grupo de expuestos evaluados bajo diseño longitudinal (20).
El daño al ADN es un evento que se ha reportado en muchos estudios de investigación, habiéndose encontrado asociación significativa entre la exposición a plaguicidas y el daño al ADN usando el ensayo cometa aplicado a linfocitos obtenidos de sangre total de grupo expuesto y control (21). Otros estudios de corte longitudinal también hallaron daño genético y cromosómica en personas expuestas a plaguicidas usando el ensayo cometa y el índice de aberraciones cromosómicas, respectivamente; sin embargo es importante mencionar que el daño basal encontrado disminuyó considerablemente en la etapa final del estudio, de tal modo que se puede inferir que el daño al ADN es un evento que de acuerdo factores externos como el uso correcto de equipos de protección personal, y factores internos como la condición fisiológica de cada persona puede activar sistemas de reparación del ADN que permiten revertir el daño (22). Nuestros hallazgos son similares a otras investigaciones ya publicadas, en el cual se encontró daño al ADN evidenciado como un incremento de la intensidad de cola en personas expuestas a plaguicidas con diferencia significativa al grupo control. Dicho daño geno tóxico incluso se evidencia usando otros parámetros del ensayo cometa como la longitud de cola (23).
Sin embargo, es importante definir los criterios de exclusión en diseños que impliquen el uso de métodos geno toxicológicos, ya que el daño al ADN y su expresión a nivel cromosómico puede ser de origen multifactorial, incluso debido a condiciones como la edad, género, dieta, exposición médica a rayos X, entre otros (24).
La mayoría de estudios que han evaluado el efecto genotóxico por exposición a plaguicidas encontraron aumentos muy pequeños respecto a los grupos controles, y además la ausencia de marcadores de exposición hacen que las asociaciones no sean consistentes (25).
La manifestación del efecto genotóxico puede estar condicionada por factores intrínsecos como la variabilidad de algunas enzimas que participan en los procesos de detoxificación y metabolismo de algunos plaguicidas. Por ejemplo, está comprobado que los polimorfismos genéticos de las enzimas GSTM1, GSTT1, GSTP1, CYP2E1 y EPHX1 están asociados a un incremento en el daño citogenético manifestado como aberraciones cromosómicas, micronúcleos e intercambio de cromátides hermanas aumentada (26). En nuestro estudio, se evidencia una clara diferencia en el recuento de micronúcleos de células de epitelio bucal en los grupos de estudio; sobre todo en aquellos que se dedican a actividades de fumigación, como ya se ha reportado en diversos estudios realizados (27,28).
En conclusión, el uso de marcadores geno toxicológicos aporta información relevante como herramienta que permite predecir el riesgo asociado a cáncer, considerando que el evento inicial es el daño al ADN en cualquier etapa del ciclo celular; además, existe asociación significativa entre el efecto genotóxico y la exposición a plaguicidas evidenciada por la inhibición de la enzima colinesterasa sérica.
Como aspecto a considerar a futuro, es necesario evidenciar y caracterizar el deterioro cognitivo asociado a la exposición crónica a plaguicidas organofosforados a bajas dosis, aspecto que se presenta de modo muy usual en los trabajadores agrícolas; por lo que es importante se puedan aplicar pruebas neuropsicológicas que permitan la evaluación de la función sensorial, motora y sobre todo cognitiva de la persona; ya que el uso de colinesterasas no necesariamente pudieran estar inhibidas y correlacionar con exposiciones crónicas (29).
Una alternativa de investigación a posteriori es la implementación de nuevos marcadores que evalúen el efecto por exposición crónica a bajas concentraciones de plaguicidas y su asociación con las manifestaciones clínicas a nivel neuropsicológico (30).
REFERENCIAS BIBLIOGRAFICAS
1. Nayhua L. Situación epidemiológica de las intoxicaciones agudas por plaguicidas en Perú, 2012. Bol. Epidemiol (Lima). 2013;22(15);274-80.
2. Soreq H, Zakut H. Human cholinesterases and anticholinesterases. San Diego; Academic Press; 1993;14;314. Doi; 10.1046/j.1471-4159.1994.to11-63010390.x.
3. Lockridge O. Structure of human serum cholinesterase. BioEssays: news and reviews in molecular, cellular and developmental biology. 1988;9(4);125-8. Doi; 10.1002/bies.950090406
4. Collins AR. Molecular epidemiology in cancer research. Molec Aspects Med. 1998;(19);359-432.
5. International Agency lor Research on Cancer. Occupational exposure in insecticide application and sorne pesticides. IARC Monographs on the Evaluation of Carcinogenic Risk to Hurnans (IARC, Lyon). 1991 ;53;179-250.
6. Ellrnan GL, Courtney DK, Andreas V, Featherstone RM. A new and rapid colorirnetric deterrnination of acetylcholinesterase activity. Biochern Pharrnacol. 1961 ;(7);88-95. doi: 10.1016/0006-2952(61)90145-9.
7. International Atornic Energy Agency. cytogenetic dosimetry; applications in preparedness for and response to radiation emergencies. 2011 ;53-9,
8. Tolbert PE, Shy CM, Allen JW. Micronuclei and other nuclear anomalies in buceal smears: a reid test in snuff users. Am J Epidemiol. 1991 ;134(8);840-50.
9. Rojas E, López MC, Valverde M. Single cell gel electrophoresis assay: rnethodology and applications. J Chrornatography B. 1999;722;225-54. Doi; 10.1016/S0378-4347(98)00313-2.
10. Ntzani EE, Chondrogiorgi M, Ntritsos G, Evangelou E, Tzoulaki I. Literature review on epiderniological studies linking exposure to pesticides and health effects. EFSA supporting publication. 2013;EN 497.
11. Brock A, Brock V. Factor affecting inter-individual variation in hurnan plasrna cholinesterase activity; Body weight, height, sex, genetic polymorphism and age. Arch Envirorn Contarn Toxicol. 1993;(24);93-9.
12. Maroto IM., Ramírez F, Zúñiga CM. Vega S. Variabilidad intraindividual de la actividad de las colinesterasas sanguíneas en una muestra humana costarricense. Rev Cost Cienc Méd. 1984;5(2);150-7.
13. Wilson BW, Arrieta DE, Henderson JD. Monitoring cholinesterases to detect pesticide exposure. Chemico-Biological Interactions. 2005;(15-158); 253-6. Doi; 10.1016/j.cbi.2005.1 0.043.
14. Furrnan J. Cholinesterase monitoring for agricultural pesticide handlers. Guidelines for health care providers in Washington state. Departrnent of Labor & Industries. WISHA Policy & Technical Services. January 2006.
15. Richter ED, Rosenvald Z, Kaspi L, Levy S, Gruener N. Sequential cholinesterase tests and syrnptorns for rnonitoring organophosphate absorption in field workers and in persons exposed to pesticide spray drilt. Toxicol Lett. 1986;33(1-3);25-35. Doi: 10.1016/0378-427 4(86)90068-8.
16. Costa LG. Biornarker research in neurotoxicology: the role of rnechanistic studies to bridge the gap between the laboratory and epiderniological investigations. Environrnental Health Perspectives. 1996, Vol 104. Doi; 10.2307/3432696.
17. Quandt SA, Hernández-Valero MA, Grzywacz JG, Hovey JD, Gonzales M, Arcury TA. Workplace, household, and personal predictors of pesticide exposure for farmworkers. Environ Health Perspect. 2006;114(6);943-52. Doi; 10.1289/ehp.8529.
18. Larnadrid Boada Al, Rornero Aguilera I, González Mesa III JE, Mandina Cardoso T. Biomonitoreo de trabajadores expuestos a plaguicidas. Rev Cubana Invest Bioméd. 2011 ;30(2);235-44.
19. Piperakis SM, Kontogianni K, Piperakis MM, Marcos R, Tsilirnigaki S. effects of pesticides on occupationally exposed hurnans. Scientific World J. 2006;(6);1211-20. Doi; 10.11 00/tsw.2006.207.
20. Pastor S, Lucero L, Gutiérrez S, Durbán R, Górnez C, Parrón T, Creus A, Marcos R. A follow-up study on rnicronucleus frequency in Spanish agricultural workers exposed to pesticides. Mutagenesis. 2002;17(1);79-82. Doi; 10.1093/rnutage/17.1.79.
21. Undeger U, Basaran N. Assessment of DNA damage in workers occupationally exposed to pesticide rnixtures by the alkaline comet assay. Arch Toxicol. 2002;76;430-36. Doi: 10.1007/s00204-002-0355-5.
22. Zeljezic O, Garaj-Vrhovac V. Chrornosornal aberration and single cell gel electrophoresis (Cornel) assay in the longitudinal risk assessrnent 01 occupational exposure to pesticides. Mutagenesis. 2001;16(4);359-63. Doi; 10.1093/mutage/16.4.359.
23. Grover P, Danadevi K, Mahboob M, Rozati R, Saleha Banu B, Rahrnan MF. Evaluation of genetic darnage in workers ernployed in pesticide production utilizing the Cornet assay. Mutagenesis. 2003;18(2);201-5. Doi; 10.1093/mutage/18.2.201.
24. Pastor S, Gutiérrez S, Creus A, Xarnena N, Piperakis S, Marcos R. Cytogenetic analysis of Greek farmers using the rnicronucleus assay in peripheral lyrnphocytes and buccal cells. Mutagenesis. 2001 ;16(6);539-45. Doi; 10.1093/mutage/16.6.539.
25. Bull S, Fletcher K, Boobis AR, Battershill JM. Evidence for genotoxicity of pesticides in pesticide applicators: a review. Mutagenesis. 2006;21 (2);93103. Doi; 10.1093/mutage/gel011.
26. Costa C, Teixeira JP, Silva S, Rorna-Torres J, Coelho P, Gaspar J, Alves M, Laffón B, Rueff J, Mayan O. Cytogenetic and rnolecular biornonitoring of a Portuguese population exposed to pesticides. Mutagenesis. 2006;21 (5);343-50.
27. Bolognesi C. Genotoxicity of pesticides; a review of hurnan biornonitoring studies. Mutation Res. 2003(543);251-72. Doi; 10.1 016/S1383-5742(03)00015-2.
28. Bolognesi C, Creus A, Ostrosky-Wegrnan P, Marcos R. Micronuclei and pesticide exposure. Mutagenesis. 2011;26(1);19-26. Doi: 10.10931mutage/geq070.
29. Floria Pancetti Vaccari. Noncholinesterase Effects Induced by Organophosphate Pesticides and their Relationship to Cognitive Processes; Irnplication for the Action of Acylpeptide Hydrolase. Journal of Toxicology and Environrnental Health, Part B. 2007;(10);623-30. Citado en PubMed PMID; 18049927
30. Judit Marsillach, Lucio G. Costab, Clernent E. Furlong. Protein adducts as biornarkers of exposure to organophosphorus cornpounds. Toxicology. 2013;(307);46-54. Doi; 10.1 016/j.tox.2012.12.007
Fuente de financiamiento:
Esta Investigación fue financiada por el Centro Nacional de Salud Ocupacional y Protección del Ambiente para la Salud del Instituto Nacional de Salud, como parte de la cartera de proyectos Institucionales.
Conflictos de Interés:
El autor declara no tener conflictos de Interés en la elaboración ni publicación de este articulo.
Correspondencia:
Mg. T.M. Jaime Alonso Rosales Rimache
¡rosales@ins.gob,pe; ¡aimerosale@gmail.com
Celular: (51 1) 944457898
Teléfono: (51 1) 7480000 anexo 7706 y 7725