Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.76 no.4 Lima oct./dic. 2015
ARTÍCULO DE REVISIÓN
Manejo actual de las intoxicaciones agudas por inhibidores de la colinesterasa: conceptos erróneos y necesidad de guías peruanas actualizadas
Current treatment of cholinesterase inhibitors poisoning: misconceptions and need for updated Peruvian guidelines
Manuel André Virú Loza1,2,a
1 Servicio de Pediatría. Hospital Nacional Daniel Alcides Carrión del Callao, Perú.
2 Asociación para el Desarrollo de la Investigación Estudiantil en Ciencias de la Salud (ADIECS-UNMSM), Lima, Perú.
a Médico Residente de Pediatría.
Resumen
En el mundo existen millones de casos de intoxicaciones por inhibidores de la colinesterasa y miles de muertes por estas sustancias. Nuestro país no es escenario diferente. Actualmente se sigue estudiando cuáles son los regímenes más útiles y se debate algunas medidas de manejo hasta ahora muy utilizadas. La tendencia actual apunta a un tratamiento agresivo en vista que son muy raros los casos de eventos adversos severos que ponen en riesgo la vida producto del uso de fármacos como la atropina. En el Perú no hay investigación activa al respecto y solo se cuenta con una guía de manejo de intoxicaciones por organofosforados y carbamatos en niños elaborada por el Ministerio de Salud en el año 2005. Urge actualizar esta guía, ya que contiene conceptos que han cambiado en algunos casos de forma radical. El propósito de esta revisión es exponer brevemente la información actualizada más relevante sobre el manejo de estas intoxicaciones y finalmente sugerir recomendaciones para hacer modificaciones en la guía mencionada y a su vez hacer un llamado a las autoridades del Ministerio de Salud peruano para el desarrollo de una guía en adultos.
Palabras clave. Compuestos Organofosforados; Carbamatos; Colinesterasa; Envenenamiento por Organofosforados; Atropina; Compuestos de Pralidoxima; Pesticidas.
Abstract
Millions of cases of cholinesterase inhibitors poisonings occur in the world and thousands of deaths by these substances are reported. Our country is not different scenario. The most useful treatment regimen is currently under research and some extensively used measures are on debate. The current trend is aggressive treatment as severe life-threatening adverse effects by drugs like atropine are very rare. In Peru there is no active research on this issue and only an organophosphate and carbamate poisoning in children treatment guide by the Ministry of Health in 2005 is available. It is urgent to update these guidelines, since they contain concepts that in some cases have radically changed due to current knowledge. The aim of this review is to briefly expose the most relevant updated information on treatment of these poisonings, to suggest evaluation of the mentioned guidelines, and to call attention of the Peruvian Ministry of Health authorities to develop guidelines for adults.
Keywords. Organophosphorus Compounds; Carbamates; Cholinesterase; Organophophorus Poisoning; Atropine; Pralidoxime Compounds; Pesticides.
INTRODUCCIÓN
Los inhibidores de la acetilcolinesterasa actúan principalmente bloqueando la degradación de la acetilcolina (1,2). Entre estos inhibidores se incluye a los organofosforados, los carbamatos y los agentes nerviosos, utilizados estos últimos con fines bélicos (1).
A nivel mundial aproximadamente 3 millones de envenenamientos y 200 000 muertes por organofosforados son causados por pesticidas (3). Lamentablemente en el Perú no se han hecho guías oficiales con aval del Ministerio de Salud (MINSA) sobre intoxicaciones por organofosforados y carbamatos en adultos (4). Por otro lado, la guía pediátrica del MINSA para el manejo de estas intoxicaciones está muy desactualizada, ya que es del año 2005 (5). Además, la mencionada guía contiene algunos conceptos y recomendaciones erróneas (ej.: recomendación de inducir la emesis) que pueden dar lugar a desenlaces fatales de ser aplicadas tal y como son descritas. Las principales modificaciones a realizar por el MINSA se encuentran en la sección 6 de la presente revisión, y las referencias sobre el motivo de estas correcciones son presentadas a lo largo de la revisión. En vista de la importancia de estas intoxicaciones desde el punto de vista epidemiológico y clínico es necesario en nuestro medio revisar la información actual y hacer un llamado al Ministerio de Salud para elaborar una nueva guía oficial actualizada.
1. Vías de exposición y velocidad de aparición del cuadro
la vía inhalada constituye la vía de exposición más veloz (segundos a minutos). La vía oral (ingestión accidental o premeditada del tóxico) produce efectos usualmente entre los 30 a 90 minutos. La vía dérmica es la más lenta, generando manifestaciones hasta aproximadamente 18 horas después. Cabe resaltar que cuando se trata de agentes nerviosos (ej.: gas sarín), dosis muy altas pueden producir efectos en minutos sin importar la vía de exposición (6).
2. Manifestaciones clínicas
2.1 Síndromes clínicos
a. Toxidromo colinérgico (2) (parálisis post intoxicación con inhibidores de la acetilcolinesterasa tipo I (7))
Hallazgos debidos a la síntesis excesiva de acetilcolina (2).
b. Síndrome intermedio (2) (parálisis postintoxicación con inhibidores de la acetilcolinesterasa tipo II (7))
Se define como un cuadro neuromuscular retardado que puede ir desde 24 hasta 96 horas (2,7-12) luego de un envenenamiento severo. Ocurre en aproximadamente 40% de los casos (2). Existen dos etiologías posibles; la primera consiste en la inhibición misma de la acetilcolinesterasa; la segunda, según otros autores, se relaciona con una terapia subóptima (7) y una inhibición sostenida de la enzima que básicamente se da en el caso del uso inadecuado de oximas (8). Se caracteriza por la ausencia de síntomas muscarínicos pero con inhibición continua severa de la acetilcolinesterasa (12), lo cual se expresa en signos como debilidad a la flexión del cuello, reflejos tendinosos profundos disminuidos, anormalidades de nervios craneales, debilidad muscular proximal e insuficiencia respiratoria (9-11). Generalmente se resuelve de forma espontánea en 1 a 2 semanas (2). No hay otra terapia que no sea los cuidados de soporte (8). Puede requerir ventilación mecánica (7). La exposición a un organofosforado altamente soluble en lípidos constituye un factor de riesgo y raramente ha sido descrito luego de una intoxicación por carbamatos (13).
c. Neuropatía retardada inducida por organofosforado (2) (parálisis postintoxicación con inhibidores de la acetilcolinesterasa tipo III (7))
Típicamente producto de la ingestión de unos pocos organofosforados específicos como el clorpirifos y raramente asociada a carbamatos (13). Puede iniciarse entre 1 a 6 semanas (7,13,14) luego de la recuperación de un toxidromo agudo. Los casos leves presentan recuperación completa (2) que puede tomar hasta 12 meses (7), pero los severos pueden terminar en discapacidad permanente (2,14,15). Existen parestesias seguidas por polineuropatía motora simétrica caracterizada por debilidad flácida en las extremidades inferiores, la cual asciende hasta involucrar las extremidades superiores. Los trastornos sensoriales generalmente son leves. Afecta principalmente los músculos distales, pero si es severa también a los proximales e incluso puede producirse un síndrome de neurona motora superior con espasticidad en las extremidades inferiores, que termine en una discapacidad permanente (13).
d. Neurotoxicidad crónica y secuelas neuropsiquiátricas inducidas por éster organofosforado (2)
Existen efectos a largo plazo como pérdida de la memoria a corto plazo, fatiga, confusión, depresión, psicosis, parkinsonismo y otros hallazgos extra-piramidales, algunos de los cuales se pueden resolver en el tiempo (8,16-18). Puede durar por semanas a años luego de la exposición aguda (2).
2.2 Signos y síntomas en la intoxicación aguda (toxidrome colinérgico)
En la tabla 1 se resume los signos y síntomas generales que se pueden encontrar en múltiples bibliografías y guías de manejo (5-7,8,13).
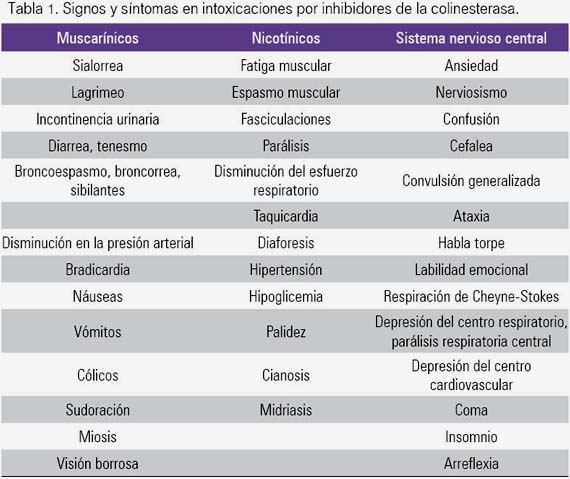
2.3 Frecuencia de presentación de ciertos síntomas y signos: algunas acotaciones importantes
la estimulación de receptores nicotínicos y muscarínicos resulta en una mezcla de efectos tanto simpáticos como parasimpáticos. A pesar que la signología muscarínica parasimpática se señala generalmente como más frecuente, hay que tener presente que en muchos casos los signos simpáticos pueden predominar en algunos tejidos. Puntos a resaltar:
a. No es raro encontrar simultáneamente síntomas y signos tanto muscarínicos como nicotínicos (8).
b. Los síntomas gastrointestinales son los más frecuentes poco tiempo después de la ingestión de organofosforados (8).
c. Puede haber midriasis, miosis e incluso pupilas normales (19,20). La midriasis está presente hasta en 13% de casos (20); por tanto, la miosis no es una característica indispensable para el diagnóstico.
d. La taquicardia sinusal es más común que la bradicardia (7,20).
e. Las fasciculaciones y la debilidad son consideradas por algunos como los hallazgos más confiables en este tipo de intoxicaciones (21).
f. Clásicamente se menciona que las mnemotecnias DUMBELLS (Diarrhea, Urination, Miosis, Bradycardia, Emesis, Lacrimation, Lethargy and Salivation) y SLUDGE (Salivation, Lacrimation, Urination, Defecation, Gastrointestinal upset, Emesis) representan los signos más comunes. Sin embargo, si bien las náuseas y vómitos son comunes, la diarrea y la relajación del esfínter urinario son infrecuentes. Además, el lagrimeo tampoco es un hallazgo común (22).
2.4 Diferencias entre manifestaciones clínicas en niños y adultos
Algunas características difieren en ambos grupos, las más saltantes son las siguientes:
a. En niños son menos frecuentes la bradicardia, fasciculaciones, lagrimeo y sudoración (23).
b. En niños es frecuente la letargia, coma, convulsiones, debilidad muscular flácida, miosis, taquicardia y salivación excesiva (23).
c. En niños pueden ser más frecuentes las manifestaciones nicotínicas en lugar de las muscarínicas, manifestándose como debilidad neuromuscular y efectos en el sistema nervioso central (23).
d. En adultos no son frecuentes las convulsiones generalizadas, excepto en el envenenamiento por agentes nerviosos o dosis masivas de organofosforados, mientras que en niños sí lo son (23).
2.5 Signos de severidad
Hallazgos clínicos sugerentes de severidad son: cambios en el estado mental, coma, convulsiones, broncorrea, broncoconstricción, dificultad respiratoria severa, fasciculaciones, debilidad generalizada severa, defecación involuntaria, inestabilidad autonómica y parálisis (8,24). La broncorrea puede progresar a edema pulmonar y falla respiratoria (7).
3. Criterio diagnóstico
El diagnóstico está fundamentado en el cuadro clínico teniendo en cuenta la signología muscarínica y nicotínica (5,8,13), sobretodo en ausencia de una historia conocida de ingesta o exposición, ya que a veces no está disponible (13,8). Si la evaluación clínica es sugerente, se decide este diagnóstico como un hecho hasta demostrar lo contrario (5). A veces los testimonios de exposición pueden ser engañosos, como se evidenció en un estudio en el que 88% de padres de pacientes con envenenamiento por organofosforados negaron cualquier historia de exposición (3). Por otro lado, el olor no constituye un criterio de diagnóstico, aunque puede sugerirlo.
3.1 Características que refuerzan el diagnóstico
Además del examen clínico, existen situaciones que de evidenciarse refuerzan el diagnóstico:
a. Historia de exposición previa, sobre todo si existen varias víctimas con síntomas y signos similares (21).
b. Respuesta al reto de atropina: Cuando no ocurren los cambios fisiológicos propios de los efectos de la atropina al administrar solo 1 mg (13) o 2 mg (20) de atropina.
c. Presencia simultánea de signos y síntomas nicotínicos y muscarínicos (8).
3.2 Pruebas de laboratorio
• Pruebas de laboratorio de rutina
Los exámenes de laboratorio generalmente son normales. Sin embargo, hay hallazgos que pueden confundir el diagnóstico, por lo que el examen y la historia clínica deben prevalecer (25).
En el electrocardiograma podemos encontrar taquicardia o bradicardia, bloqueo AV, QT prolongado, onda T en pico y torsades de pointes. En la analítica sanguínea se puede encontrar cetoacidosis, amilasa sérica elevada, creatinaquinasa sérica elevada, glucosa sérica elevada, lípidos séricos disminuidos, potasio sérico disminuido o incrementado y leucocitosis con desviación izquierda. En la analítica de orina puede haber glucosa urinaria elevada y proteínas urinarias elevadas (25).
• Niveles de colinesterasa
La medición directa de la actividad de esta enzima provee una medida del grado de toxicidad. La medición secuencial de la misma (si está disponible rápidamente) puede también ser utilizada para determinar la efectividad de la terapia con oximas. Sin embargo, la mayoría de hospitales no puede realizar esta prueba (13).
El ensayo de la actividad en plasma de la colinesterasa o pseudocolinesterasa es realizado con mayor facilidad, pero no se correlacionan bien con la severidad, por lo que no deben ser utilizadas para guiar el tratamiento (13).
Los niveles de colinesterasa eritrocitaria y sérica en general se relacionan bien con la toxicidad (7) y son utilizados para tener una aproximación de los niveles en el tejido nervioso, ya que estos últimos son imprácticos de obtener (26). Los resultados deben ser interpretados con cuidado debido a las diferencias interindividuales e intraindividuales en los niveles normales de colinesterasa (7,27), a otras condiciones médicas y sustancias que puedan alterar los niveles de colinesterasa, y a la posibilidad de errores de laboratorio (26). Un paciente puede tener una disminución considerable en la actividad de la enzima pero estar dentro del rango ‘normal’. Esto hace que las mediciones de colinesterasa tengan valor limitado en el diagnóstico inicial. Pueden ayudar a confirmar el diagnóstico solo si son extremadamente bajos o indetectables al momento de la presentación (26).
• Medición de inhibidores de colinesterasa y sus subproductos
Para estas mediciones se realizan pruebas químicas en el residuo gástrico, sangre y orina (5). Estas mediciones son muy precisas, pero raramente están disponibles para guiar el tratamiento. Estas pruebas son útiles para fines forenses y de salud pública (26).
4. Tratamiento
Si existen hallazgos clínicos sugestivos, se debe iniciar tratamiento empírico. En ninguna circunstancia se debe esperar los resultados de laboratorio (3,8,24). El tratamiento debe ser inmediato si existen signos de severidad (8).
4.1 Medidas iniciales de soporte
Atención inmediata de la vía aérea. La administración de oxígeno no es una condición previa para utilizar atropina, como sugieren muchos textos. En caso se use oxígeno, se debe administrar concomitantemente a la atropina en pacientes con cianosis u otra evidencia de hipoxia, rales, secreciones orales excesivas o broncorrea. La administración de oxígeno y atropina simultáneamente no ha demostrado un aumento de la toxicidad cardiovascular (8,28).
Durante la atropinización rápida, se deben manejar la parálisis respiratoria o las secreciones excesivas con intubación, ventilación y succión continua (8). Se recomienda oxígeno al 100% e inmediata intubación endotraqueal en pacientes con intoxicación moderada a severa con un estado mental marcadamente deprimido (13). Cuando es necesaria la secuencia de intubación rápida para controlar la vía aérea, el uso de un paralítico depolarizante como la succinilcolina, aunque no está contraindicado, no es recomendado, debido a que puede resultar en una parálisis exagerada y prolongada porque es metabolizada a través de la butirilcolinesterasa (8,13). No existen datos del efecto de la parálisis química prolongada con un agente no depolarizante en estos pacientes. Por tanto, el uso de rocuronium, vecuronium u otro agente no depolarizante de acción rápida es preferible (7,8), aunque pueden ser menos efectivos a dosis estándar debido a inhibición competitiva en la unión neuromuscular; por ende, pueden ser necesarias dosis mayores (13).
Concomitantemente, los pacientes deben ser resucitados con fluidos intravenosos, ya que existe una pérdida significativa de fluidos gastrointestinales y probablemente vasodilatación inducida por óxido nítrico. Este manejo de fluidos debe incluir también el uso de agentes vasoactivos, dependiendo del caso (8).
Las convulsiones deben controlarse rápidamente con benzodiacepinas. El uso agresivo de estas puede mejorar la supervivencia y prevenir la injuria cardiaca y del sistema nervioso central. Varios regímenes han sido sugeridos. Las recomendaciones incluyen el uso de al menos 10 mg EV de diazepam o 5 a 10 mg IM de midazolam en adultos (dosis pediátrica: diazepam 0,1 a 0,2 mg/kg EV o midazolam 0,1 a 0,3 mg/ kg IM) y luego aumentar conforme sea necesario. Hay evidencia que sugiere que las convulsiones por organofosforados involucran también receptores NMDA-glutamato, por lo que el propofol puede ser útil también (8).
4.2 Descontaminación
La descontaminación es una prioridad, siendo para algunos el primer paso a realizar (7). Los pacientes con contaminación líquida de piel y prendas pueden tener absorción percutánea en curso. Además, pueden significar un riesgo para el personal de salud al contacto. Inmediatamente se debe retirar toda la ropa al paciente y lavar concienzudamente la piel con jabón alcalino y agua (8). Las prendas y pertenencias del paciente deben ser descartadas, debido a que absorben organofosforados y la reexposición puede ocurrir incluso luego del lavado (13). La descontaminación no debe retrasar el tratamiento. La remoción de la ropa elimina 85 a 90% el riesgo de contaminación. El personal que participa en la descontaminación debe tener equipamiento protector personal y entrenamiento adecuado (29), además de desenvolverse en un área bien ventilada (13).
4.3 Medidas que no han demostradoser efectivas o están contraindicadas
a. La emesis forzada está contraindicada debido al riesgo de aspiración y convulsiones (13).
b. Se ha sugerido la alcalinización de la orina, pero no hay evidencia clara de que esta intervención mejore el resultado (30).
c. La utilidad de la descontaminación gastrointestinal es controversial. Los organofosforados son altamente emetogénicos; la mayoría de pacientes ha vomitado antes de la presentación. Muchos organofosforados son disueltos en solventes hidrocarbonados que pueden resultar en neumonitis significativa cuando son aspirados (8). El lavado involucra riesgo elevado de aspiración en pacientes con secreciones aumentadas y estado mental disminuido (13). La evidencia muestra que este procedimiento nunca ha disminuido la morbilidad o mortalidad (13). Algunos plantean que si un paciente se presenta temprano (menos de 30 a 60 minutos) luego de la ingestión, la aspiración empírica nasogástrica parece apropiada (8); es así que algunos eligen realizarla en pacientes que presentan menos de una hora luego de la ingestión y luego de realizar intubación endotraqueal e iniciar terapia con atropina y una oxima (13).
d. Algunos organofosforados se sabe que se unen al carbón activado. La eficacia del carbón activado no ha sido estudiado adecuadamente (8). Hallazgos de estudios observacionales sugieren que el carbón activado administrado luego de la primera hora no provee beneficios a los pacientes con estas ingestas (31). La dosis estándar es de 1g/kg (dosis máxima 50 g) (13).
4.4 Medidas farmacológicas
4.5 Atropina
a. Regímenes de uso en adultos y niños
Como se puede observar en la tabla 2, existen varios regímenes recomendados, pero varían muy poco entre ellos. En casos de ingestiones suicidas, a veces se ha necesitado cientos de miligramos al día, llegando a cantidades mayores a mil y puede ser necesaria infusión continua en el curso de varios días (7,13,34-38). En general, es mejor dar mucha atropina que dar muy poca (20).

Es difícil encontrar información sobre el uso de atropina para intoxicaciones específicamente por carbamatos. Sin embargo, algo generalmente aceptado es que la severidad de la intoxicación por carbamatos tiende a ser menor que por organofosforados, al igual que la duración de la toxicidad, la cual va de 6 a 12 horas (20). Algo a tener en cuenta es que es común el envenenamiento mixto por organofosforados y carbamatos (20).
b. Indicaciones para suspender la administración de atropina
La meta más importante del uso de atropina es el control de la broncorrea clínicamente significativa, broncoconstricción (reversión de sibilantes) y bradiarritmias o bloqueos aurículo-ventriculares peligrosos (8,20,33). La sequedad de las secreciones bronquiales puede ser alcanzada prematuramente si el paciente está deshidratado (33).
Existen conceptos actuales a tener en cuenta, sobre cuándo dejar de administrar atropina:
-
En general, es errado pensar que la atropina debe suspenderse cuando aparecen signos de atropinización: taquicardia, midriasis y boca seca (20).
-
La taquicardia no es contraindicación para administrar atropina (7).
-
La taquicardia y la midriasis no deben ser utilizadas como indicaciones de suspender el tratamiento, debido a que algunas veces son manifestaciones de toxicidad nicotínica (20), hipoxia, hipovolemia o estimulación simpática (13).
-
La resolución de la miosis no es indicación de suspender el tratamiento debido a que puede ser un hallazgo tardío; puede ser resistente a la terapia con atropina sistémica o puede reflejar solo una exposición oftálmica localizada a vapor sin efectos sistémicos. Recordar que las pupilas en estos pacientes pueden presentarse midriáticas o normales (20).
c. Efectos adversos del uso de atropina
No son frecuentes efectos adversos fatales. En un reporte de 286 niños que se autoinyectaron accidentalmente dosis elevadas (hasta 17 veces más altas que las recomendadas) durante la crisis del Golfo Pérsico, no se registró fatalidades, convulsiones o arritmias que pusieran en peligro la vida de estos niños (39).
Las dosis excesivas de atropina pueden causar síntomas mayormente leves, siendo tal vez una excepción el delirio, que dura normalmente de 24 a 48 horas (20). Los ejemplos incluyen visión borrosa, boca seca, inhabilidad para transpirar, midriasis, aumento de la temperatura, taquicardia y retención urinaria (20).
La atropinización rápida (tabla 2) puede causar delirio. Cuando esto sucede, se suspende y observa (40). Si vuelven a aparecer signos de intoxicación, se vuelve a administrar atropina (40).
No utilizar fisostigmina para los efectos causados por atropina en estos pacientes (20).
4.6 Pralidoxima
Las oximas (ej.: pralidoxima y obidoxima, las más comunes) son utilizadas inmediatamente luego del envenenamiento por organofosforados para regenerar acetilcolinesterasa activa. Múltiples textos sugieren que las oximas deben ser reservadas para los signos y síntomas nicotínicos. Realmente las oximas regenerarán acetilcolinesterasa tanto en receptores muscarínicos como nicotínicos (8), por lo que son efectivas para tratar tanto síntomas muscarínicos como nicotínicos (13). Actualmente, las oximas están recomendadas para todos los envenenamientos con carbamatos, a excepción del carbaril (8).
La pralidoxima no debe ser administrada sin al mismo tiempo utilizar atropina para prevenir el empeoramiento de los síntomas debido a una inhibición transitoria de la acetilcolinesterasa inducida por oximas (13).
La mayor parte de la controversia con el uso de las oximas se relaciona a la dosis apropiada. La mayoría de textos de los EE UU sugieren una dosis de pralidoxima de 1 a2gEVo IM seguida de 1 g cada 6 a 12 horas (8). La OMS ha recomendado una dosis inicial de 30 mg/kg de pralidoxima EV seguida de infusión EV de 8 mg/kg/h (8) o de 500 mg/h (7); y de 20 a 50 mg/kg en bolo inicial para niños, de acuerdo a la severidad de los síntomas, seguido de una infusión EV de 10 a 20 mg/kg/h (13). Alternativamente, si una infusión continua no es posible, 30 mg/kg de pralidoxima deben ser administrados IM o EV cada 4 horas (8).
La pralidoxima debe ser administrada lentamente durante 30 minutos, ya que la administración rápida ocasionalmente ha sido asociada con paro cardiaco, y la administración lenta previene la debilidad muscular que resulta de la inhibición transitoria de la acetilcolinesterasa conforme la pralidoxima se une a esta enzima (13).
a. Efectos adversos del uso de pralidoxima
Las reacciones adversas del uso de oximas incluyen hipertensión, incrementos transitorios en el bloqueo neuromuscular y vómito en proyectil luego de la administración en bolo de pralidoxima (8).
4.7 Glicopirrolato
Se ha sugerido al glicopirrolato como alternativa a la atropina. Sin embargo, debido a que no cruza la barrera hematoencefálica debe ser reservado para pacientes con un síndrome puramente muscarínico periférico (8).
Se ha sugerido al glicopirrolato a dosis de 1 a 2 mg (8) o de 0,5 a 2 mg (33)EV (0,025 mg/kg en niños) como alternativa a la atropina (20), pudiendo duplicar-se la dosis cada 5 min al igual que con la atropina, hasta que se hayan logrado los efectos antimuscarínicos satisfactorios (33), y se dice que tiene menores efectos colaterales en el sistema nervioso central (7,20). Sin embargo, su uso no ha sido extensivamente evaluado (20).
4.8 Benzodiacepinas
Las convulsiones deben ser tratadas con una benzodiacepina. El uso profiláctico de diazepam disminuye la disfunción neurocognitiva luego de la intoxicación por organofosforados. No existe evidencia de que la fenitoína tenga algún efecto en las convulsiones inducidas por organofosforados, y este agente no está recomendado (13).
4.9 Otros medicamentos
Mientras otros fármacos antimuscarínicos (ej.: escopolamina) pueden contrarrestar los efectos de los inhibidores de la colinesterasa, su toxicidad en pacientes que no tienen envenenamiento por estos inhibidores ha conllevado a su desuso en favor de la atropina (20).
4.10 Manejo en gestantes: atropina y pralidoxima
La atropina y la pralidoxima son fármacos clase C para la gestación y lactancia según la FDA (8,24,33). Clase C significa que se debe usar con cautela, ya que los estudios de reproducción animal han mostrado un efecto adverso en el feto o no hay estudios adecuados y bien controlados en humanos, o los beneficios del uso de una droga en gestantes pueden ser aceptables a pesar de sus potenciales riesgos (41).
Por otro lado, el Sistema de Teratología del Reino Unido refiere que los datos son limitados pero no indican un riesgo incrementado de malformaciones fetales u otro resultado adverso en la gestación. Refiere que la atropina no debe ser retenida en una gestante si hay la necesidad real de utilizarla (42).
5. Puntos a corregir en la guía minsa pediátrica vigente
a. Proscribir la emesis forzada (5).
b. No recomendar realizar lavado gástrico y señalar las condiciones en que podría realizarse para evitar complicaciones (5).
c. No considerar a los síndromes postintoxicación como complicaciones del uso de la atropina (5).
d. Reconsiderar continuar usando el término ‘intoxicación atropínica’ (5), ya que son muy raras las fatalidades por el uso de este fármaco y el término en la literatura internacional está en desuso.
CONCLUSIONES
Es necesario elaborar una guía oficial de manejo de intoxicaciones por inhibidores de la colinesterasa por parte del Ministerio de Salud, en base a información actualizada para adultos, así como actualizar la guía vigente para el manejo de estas intoxicaciones en niños.
REFERENCIAS BIBLIOGRÁFICAS
1. King AM, Aaron CK. Organophosphate and carbamate poisoning. Emerg Med Clin North Am. 2015 Feb;33(1):133-51. doi: 10.1016/j.emc.2014.09.010.
2. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 3: What types of pathology do cholinesterase inhibitors cause? 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=6
3. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: TheCholinergic Toxidrome. Section 9: Importance of the Exposure History. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=15
4. Guías de Prácticas Clínicas. Observatorio de Calidad en Salud. Ministerio de Salud. [Sede Web]. Disponible en: http://www.minsa.gob.pe/dgsp/observatorio/index.asp?pg=7
5. Ministerio de Salud. guía de Práctica Clínica de Intoxicación por Organofosforados y Carbamatos en Pediatría. 2005. Disponible en: http://www.minsa.gob.pe/dgsp/documentos/guias/rM5112005%20Emergencia%20Pediatria.pdf
6. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: The Cholinergic Toxidrome. Section 5: Signs and Symptoms by route of Exposure and Chemical Structure of the Involved Cholinesterase Inhibitor (Optional reading). 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=11
7. Cannon r, ruha A. Chapter 140: Insecticides, Herbicides and rodenticides. En: Adams: Emergency Medicine. 1era edición. Saunders Elsevier; 2008:1533-46.
8. Aaron CK, Section H. Pesticides, Chapter 76: Organophosphates and Carbamates. En: Shannon: Haddad and Winchester's Clinical Management of Poisoning and Drug Overdose. 4ta edición. Saunders Elsevier; 2007:1171-84.
9. Senanayake N, Karalliedde L. Neurotoxic effects of organophosphorus insecticides. An intermediate syndrome. N Engl j Med. 1987;316(13):761-3.
10. Karalliedde L, baker D, Marrs TC. Organophosphate-induced intermediate syndrome: aetiology and relationships with myopathy. Toxicol rev. 2006;25(1):1-14.
11. Indira M, Andrews MA, rakesh TP. Incidence, predictors, and outcome of intermediate syndrome in cholinergic insecticide poisoning: a prospective observational cohort study. Clin Toxicol (Phila). 2013;51(9):838-45. doi: 10.3109/15563650.2013.837915.
12. Massachusetts Department of Public Health Office of Emergency Medical Services: Nerve agent exposure protocol. En: Emergency Medical Services Pre-Hospital Treatment Protocols, version 12.3, Setiembre 6, 2014, http://www.mass.gov/eohhs/docs/dph/emergency-services/treatmentprotocols-12-03.pdf.
13. UpToDate. Organophosphate and carbamatepoisoning. Wolters Kluwer Health. Actualizado a Mayo de 2015. [Sede Web]. Disponible en: http://www.uptodate.com/contents/organophosphate-and-carbamate-poisoning?source=search_result&search=organofosforados+y+carbamatos+envenenamiento&selectedTitle=1~15
14. Lotti M, Moretto A. Organophosphate-induced delayed polyneuropathy. Toxicol rev. 2005;24(1):37-49.
15. Abou-Donia Mb. Organophosphorus ester-induced chronic neurotoxicity. Arch Environ Health. 2003;58(8):484-97.
16. Steenland K, jenkins b, Ames rg, O’Malley M, Chrislip D, russo j. Chronic neurological sequelae to organophosphate pesticide poisoning. Am J Public Health. 1994;84(5):731-6.
17. Shahar E1, bentur Y, bar-joseph g, CahanaA, Hershman E. Extrapyramidal parkinsonism complicating acute organophosphate insecticide poisoning. Pediatr Neurol. 2005;33(5):378-82.
18. Senanayake N, Sanmuganathan PS. Extrapyramidal manifestations complicating organophosphorus insecticide poisoning. Hum Exp Toxicol. 1995;14(7):600-4.
19. Sungur M, Güven M. Intensive care management of organophosphate insecticide poisoning. Critical Care. 2001;5(4):211-5.
20. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4 - Section 11. Management Strategy 3: Medications. Atropine. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=22
21. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: The Cholinergic Toxidrome. Section 7: Differential Diagnosis of the Cholinergic Toxidrome. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=13
22. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: The Cholinergic Toxidrome. Section 4: Clinical Findings in Cholinesterase Inhibitor Toxicity Are Due to a Mixture of Nicotinic and Muscarinic Effects. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=10
23. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: The Cholinergic Toxidrome. Section 8: Signs and Symptoms: Differences in Pediatric Cases. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=14
24. UpToDate. Atropine: Drug information. Wolters Kluwer Health. Lexicomp, Inc. 2015. [Sede Web]. Disponible en: http://www.uptodate.com/contents/atropine-drug-information?source=search_result&search=atropine&selectedTitle=1~150
25. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: The Cholinergic Toxidrome. Section 6: Effects on routine Laboratory Tests. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=12
26. Agency for Toxic Substances and Disease registry. Environmental Health and Medicine Education. Cholinesterase Inhibitors: Including Insecticides and Chemical Warfare Nerve Agents. Part 4: The Cholinergic Toxidrome. Section 10: Laboratory Assessment of the Cholinergic Toxidrome red blood Cell (rbC) and Serum Cholinesterase. 2012. [Sede Web]. Disponible en: http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=16
27. Wessels D, barr Db, Mendola P. Use of biomarkers to indicate exposure of children to organophosphate pesticides: implications for a longitudinal study of children's environmental health. Environ Health Perspect. 2003;111(16):1939-46.
28. Konickx LA, bingham K, Eddleston M. Is oxygen required beforeatropineadministration inorganophosphorus or carbamate pesticide poisoning? A cohort study. Clin Toxicol (Phila). 2014 jun;52(5):531-7. doi: 10.3109/15563650.2014.915411.
29. Kales SN, Christiani DC. Acute chemical emergencies. N Engl j Med. 2004;350(8):800-8.
30. Roberts D, Buckley NA. Alkalinisation for organophosphorus pesticide poisoning. Cochrane Database Syst rev. 2005;(1):CD004897.
31. Eddleston M, juszczak E, buckley NA, Senarathna L, Mohamed F, Dissanayake W, et al. Multiple-dose activated charcoal in acute self-poisoning: a randomised controlled trial. Lancet. 2008;371(9612):579-87. doi: 10.1016/S0140-6736(08)60270-6.
32. Gold Standard Inc 2014. Atropine. [Sede Web]. Disponible en: http://www.mdconsult.com/das/pharm/body/473350588-7/0/full/49
33. Geller RJ. Chapter 165: Atropine and glycopyrrolate. En: Olson Kr. Poisoning and Drug Overdose. 6ta edición. Mcgraw-Hill; 2011.
34. Roberts DM, Aaron CK. Management of acute organophosphorus pesticide poisoning. bMj. 2007;334(7594):629-634. doi: 10.1136/ bmj.39134.566979.BE
35. Vale jA, Meredith Tj, Heath A. High dose atropinein organophosphorus poisoning. Postgrad Med j. 1990;66(780):878.
36. Singh S, batra YK, Singh SM, Wig N, Sharma BK. Is atropine alone sufficient in acute severe organophosphorus poisoning?: experience of a NorthWest Indian Hospital. Int j Clin Pharmacol Ther. 1995;33(11):628-30.
37. Karakus A, Celik MM, Karcioglu M, Tuzcu K, Erden ES, Zeren C. Cases of organophosphatepoisoning treated with high-dose of atropine in an intensive care unit and the novel treatment approaches. Toxicol Ind Health. 2014;30(5):421-5. doi: 10.1177/0748233712462478.
38. Singh S, Chaudhry D, Behera D, Gupta D, Jindal SK. Aggressive atropinisation and continuous pralidoxime (2-PAM) infusion in patients with severe organophosphate poisoning: experience of a northwest Indian hospital. Hum Exp Toxicol. 2001;20(1):15-8.
39. Amitai Y, Almog S, Singer r, Hammer r, bentur Y, Danon YL. Atropine poisoning in children during the Persian gulf crisis. jAMA. 1992;268(5):630-2.
40. Eddleston M, Dawson A, Karalliedde L, Dissanayake W, Hittarage A, Azher S, buckley NA. Early management after self-poisoning with an organophosphorus or carbamate pesticide – a treatment protocol for junior doctors. Crit Care, 2004;8(6):R391-7.
41. US Food and Drug Administration. Summary of Proposed rule on Pregnancy and Lactation Labelling. The Proposed rule. [Sede Web]. Disponible en: http://www.gpo.gov/fdsys/pkg/Fr-2008-05-29/pdf/E8-11806.pdf
42. United Kingdom Teratology Information Service. Use of Atropine in Pregnancy. Version: 1.1, 2012[Sede Web]. Disponible en: http://www.uktis.org/docs/Atropine.pdf.
Artículo recibido el 5 de mayo de 2015 y aceptado para publicación el 22 de junio de 2015.
Conflictos de interés:
Declaro no tener algún conflicto de interés.
Correspondencia:
Manuel André Virú Loza
Correo electronico: m.andre.viru@hotmail.com













