Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.77 no.3 Lima jul./set. 2016
ARTÍCULOS ORIGINALES
Evaluación de la inocuidad del sulfuro de hidrógeno en tejido cardiaco de Cavia porcellus (cobayas) normales
Assessment of hydrogen sulfide innocuousness on Cavia porcellus (guinea pigs) cardiac tissue
César Gómez-Herreros1,a; Jorge Arroyo-Acevedo2,3,a; César Rojas-Maturano4,b; Flor Cruz-Chavez4,c; Luis Sifuentes-Gava4,b
1 Unidad de Posgrado, Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
3 Laboratorio de Farmacología, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
4 Unidad de Cirugía Experimental del Instituto Nacional de Salud del Niño, Lima, Perú.
a Químico Farmacéutico;
b Médico Cirujano;
c Médico Veterinario.
Resumen
Introducción. El sulfuro de hidrógeno (H2S) es tóxico y mortal para los mamíferos a elevadas concentraciones, pero a bajas concentraciones puede resultar beneficiosa. Objetivos. Evaluar la inocuidad del H2S a 80 ppm en el corazón de Cavia porcellus in vivo. Diseño. Estudio experimental. Instituciones. Laboratorio de Farmacología Facultad de Medicina Universidad Nacional Mayor de San Marcos, Lima, Perú, y Unidad de Cirugía Experimental del Instituto Nacional de Salud del Niño, Lima, Perú. Material biológico. Veintiún Cavia porcellus (cobayas). Intervenciones. El diseño experimental consideró 3 grupos (n = 7): 1) Control (exposición a aire limpio); 2) Experimental (exposición gaseosa de H2S a 80 ± 20 ppm); 3) Referente (exposición a sevoflurano 1,5%). Los animales fueron colocados en una campana, donde fueron nebulizados por veinte minutos; al final del experimento se les retiró el corazón para estudio histopatológico. Principales medidas de resultados. Porcentaje de lesión en células cardiacas. Resultados. Los tejidos cardiacos de los grupos control y experimental no mostraron alteraciones, lo contrario al grupo expuesto a sevoflurano que mostraron moderada alteración en 3 muestras de 7, pero el resultado no fue significativo (p > 0,05) para este grupo. Conclusión. El H2S a 80 ± 20 ppm fue inocuo para el tejido cardiaco de Cavia porcellus.
Palabras clave: Sulfuro de Hidrógeno; Sevoflurano; Cobayas; Inocuidad.
Abctract
Introduction. Hydrogen sulfide (H2S) is toxic and lethal to mammals at high concentrations, but at low concentrations may be beneficiai. Objective. Assessment of hydrogen sulfide harmlessness on Cavia porcellus (guinea pigs) cardiac tissue in vivo. Design. Experimental study. Setting. School of Medicine Pharmacology Laboratory, Universidad Nacional Mayor de San Marcos, Lima, Peru, and Experimental Surgery Unit at Instituto Nacional de Salud del Niño, Lima, Peru. Biological material: Twenty one Cavia porcellus (guinea pigs). Interventions. The experimental design considered three groups: 1) Clean air (control); 2) H2S at 80 ± 20 ppm (experimental, gaseous exposure); 3) Sevoflurane 1.5% (gold standard). Animals were placed in a hood where they were nebulized for twenty minutes; at the end of the exposure, the heart was withdrawn for histopathological study. Main outcome measures. Cardiac cell injury. Results. H S exposure did not induce abnormalities; otherwise, exposure to sevoflurane showed moderate impairment in 3 of 7 heart tissues, but tRe result was not significant (p > 0.05) for this group. Conclusion. H2S at 80 ± 20 ppm was innocuous on Cavia porcellus tissue cardiaco
Keywords. Hydrogen Sulfide; Sevoflurane; Guinea Pigs; Innocuousness.
INTRODUCCIÓN
El sulfuro de hidrógeno (H2S) ha sido conocido durante mucho tiempo como un gas nocivo con amplios efectos citotóxicos(1,2). Se sabe también que es producido endógenamente a partir de cisteína por cistationina-γ-liasa (CSE) , cistationina-β-sintetasa (CBS) y 3-mercaptopirurato sulfurtransferasa (3-MT) (3.5). Estas enzimas específicas se expresan en diversos sistemas de órganos y la CSE es la enzima predo minantemente productora de H2S en el sistema cardiovascular(6). El mecanismo de acción principal del H2S es la inhibición del complejo IV de la cadena de la fosforilación oxidativa en las mitocondrias(7). Otro mecanismo importante a nivel cardiovascular es la apertura de los canales de potasio dependientes de ATP (KATP), que puede implicar la sulfhidración de residuos de cisteína dentro de la subunidad Kir6.1 de este canal por H2S(8). Se ha observado que la producción de H2S está desregulada en muchas condiciones patológicas como en aterosclerosis, hipertensión, insuficiencia cardíaca, diabetes, cirrosis, inflamación, sepsis, enfermedad neurodegenerativa, disfunción eréctil y asma(9). Pero, en condiciones regulares actúa como un vasodilatador e inotrópico negativo y ha demostrado que alivia la hipertensión así como el daño a un órgano asociado(10).
El interés en el campo de la investigación de H2S ha crecido notablemente en los últimos años(11). Por ejemplo, la administración exógena de H2S redujo el tamaño del infarto en un modelo de arteria coronaria ligada en ratas(12). Dado que el H2S es importante en la homeostasis y la patogénesis cardiovascular, los donantes de H2S tienen potencial para ser desarrollados como efectivos agentes terapéuticos(13,14). El objetivo del presente trabajo fue evaluar la inocuidad del H2S exógeno a 80 ppm en el tejido cardiaco de cobayas normales.
MÉTODOS
El material químico consistió en sulfuro de fierro (FeS), ácido clorhídrico (HCl) 5 M, sevoflurano (Ultano®, ABBVIE). Se utilizó los equipos vaporizador Sigma Delta, Penlon, y analizador de H2S (MultiRAE Systems) y O2, (MAXO2me).
El material biológico incluyó veintiún cobayas del tipo Cavia porcellus de 250 ± 20 g de peso corporal y 10 semanas de edad, adquiridas del Instituto Nacional de Salud, Lima, Perú. Fueron instaladas en el Bioterio de la Facultad de Medicina Humana de la Universidad Nacional Mayor de San Marcos, aclimatándose por 5 días con libre acceso a alimentos yagua, con ciclo de luz/oscuridad de 12/12 horas.
Se respetó los protocolos establecidos por el Comité de Ética de la Universidad Nacional Mayor de San Marcos, para lograr el buen trato del animal de experimentación, además de tener en consideración la "Ley de protección a los animales domésticos y a los animales silvestres mantenidos en cautiverio" (Ley Nº 27265)(15).
Para la obtención de H2S, se introdujo 5 gramos de FeS y 40 mL de HClS 5 M en un matraz, se calentó ligeramente esta mezcla mediante un mechero(16) y el gas desprendido fue almacenado en un matraz kitazato modificado para la experimentación.
Las cobayas fueron distribuidas aleatoriamente en tres grupos de siete animales cada uno (n = 7): control (exposición a aire limpio), experimental (exposición de H2S a 80 ppm) y fármaco referente (exposición de sevoflurano 1,5%).
Un matraz kitazato, que almacenaba H2S, se conectó a una cámara herméticamente cerrada de 38,5 litros que contenía las 7 cobayas del grupo experimental. Una cánula conectada al analizador de gases estuvo en contacto con el medio interno de la cámara para medir la concentración de H2S (80 ± 20 ppm). La exposición al gas fue por un tiempo de 20 minutos, el mismo tiempo de exposición a sevoflurano (1,5%). Ambas pruebas fueron realizadas a temperatura promedio (2S-26 ºC) y en el mismo horario. Para el estudio anatomopatológico se siguió lo señalado por Devi y col. (2007)(17).
Los datos de las lesiones cardiacas fueron analizados mediante las pruebas no paramétricas de Kruskal-Wallis. Los resultados se expresan en valores medios y desviación típica. Se analizó los puntajes del estudio anatomopatológica en base a las alteraciones encontradas en el tejido cardiaco. Para evaluar la significancia estadística se consideró un valor p≤0,05; el análisis estadístico se llevó a cabo mediante el software SPSS versión 21.
RESULTADOS
El tejido cardiaco de las cobayas expuestas al sulfuro de hidrógeno no presentaron alteración alguna al estudio anatomopatológico. Solo se encontró alteraciones en el grupo de cobayas expuestas al fármaco referente, sevoílurano (tabla 1 y 2). En el cuadrante A de la figura 1, se observa que el tejido presentó discreta alteración del miocardio y moderada congestión en pericardio. En el cuadrante B, otro tejido mostró moderada congestión en el pericardio. En el cuadrante C, un tercer tejido presentó leve alteración en el pericardio. Y en los cuadrantes D, E, F y G, el tejido no mostró alteración alguna.


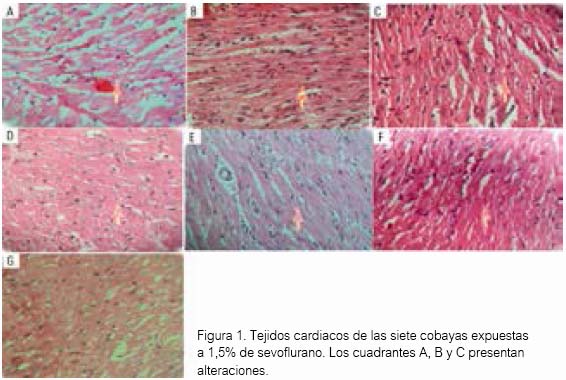
Al análisis mediante Kruskal-Wallis, para datos no paramétricos, las medias resultantes fueron a nivel de endocardio 0,3 ± 0,8, miocardio 0,1 ± 0,4 y a nivel de pericardio 0,4 ± 0,8 (tabla 1). Los daños encontrados en el grupo del fármaco referente no fueron significativos (P>0,05).
DISCUSIÓN
De acuerdo al estudio anatomopatológico, se estaría demostrando la inocuidad del H2S a 80 ± 20 ppm en tejido cardiaco de cobayas, resultados previsibles por ser cardioprotector, tal como lo afirman Sun y col. (2015)(12). El H2S y el sevoflurano tienen básicamente el mismo mecanismo de acción, deprimen la función mitocondrial(6), pero el último produce el 'síndrome de robo coronario'. Esto podría haber contribuido a que presentase las leves alteraciones observadas al estudio anatomopatológica en tres muestras de tejido.
Una meta importante es encontrar hasta qué nivel de concentración de H2S resultase inocuo o no produjera daños en el tejido cardiaco. Los estudios piloto de nuestro trabajo han determinado que este gas es mortal a 300 ppm en cobayas.
Durante la exposición a H2S y sevoflurano, las cobayas respondían a estímulos audiovisuales, pero aminoraban la locomoción, contrario a lo experimentado por Volpato y col. (2008)(19) en ratones, donde sí mantenían locomoción espontánea a la exposición de H2S a 80 ppm. El sevoflurano a 1,5%, una de las concentraciones utilizadas por Li y col. (2012)(6), no causaba depresión de la vigilia en cobayas, al igual que no había locomoción espontánea. Durante el ensayo con sevoflurano se establecieron hasta tres rangos de concentración en una cámara de 38,5 litros: 1%, 1,5% y 2%. Las cobayas expuestas a 1% de sevoflurano conservaban la misma locomoción, no aparentaban depresión muscular ni de los sentidos; a 2% de sevoflurano presentaban sedación manifestada por el cierre total de sus párpados y la inclinación total de sus cuerpos hacia la base de la cámara; a 1,5% de sevoflurano, las cobayas permanecían despiertas, sin locomoción, pero mostraban reflejos ante estímulos sonoros.
De acuerdo a estudios primigenios que realizaron Blackstone y col. (2007)(18), en ratones, se estableció un tiempo de exposición de H2S de 20 minutos para el presente trabajo. La exposición a 80 ppm fue igual al trabajo realizados por Volpato y col. (2008)(19). Las concentraciones a 80 ppm en otros estudios realizados tuvieron variaciones de tan solo ± 2,5 ppm de H2S; nuestras variaciones fueron de ± 20 ppm. Se podría mejorar este aspecto para futuros experimentos.
Estudios realizados a concentraciones de 10% de O2, y 60 ppm de H2S presentaron menores lesiones en comparación a los realizados con 20,9% de O2, a la misma concentración de H2S. Estas lesiones se presentaron en bronquios de ratones y consistían en descamaciones(20). Durante el estudio anatomopatológico, los tejidos cardiacos que fueron expuestos a H2S no mostraban el más mínimo daño. Esto es similar al modelo de isquemia/reperfusión realizada por Elrod y col. (2007), en el que se establece que el H2S, administrado en el momento del evento limita el grado de infarto demostrado por la disminución sustancial en la hemorragia y necrosis, así como una disminución de leucocitos dentro de la zona isquémica.
El sevoflurano a 1,5 % causó cierta congestión en tejido celular del pericardio en tres cobayas (ver figuras 2 y 3). Sería interesante un estudio previo tratamiento con H2S antes de exponer a algún animal de experimentación al sevoflurano.
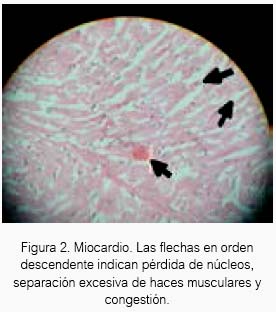
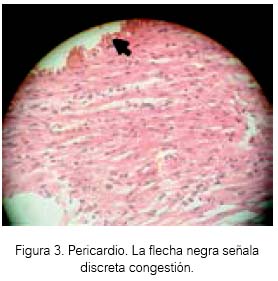
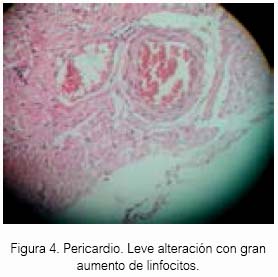
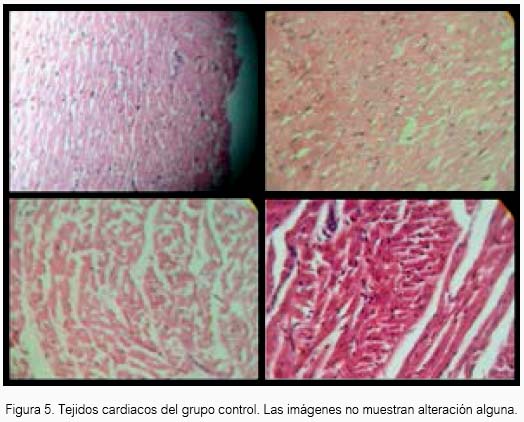
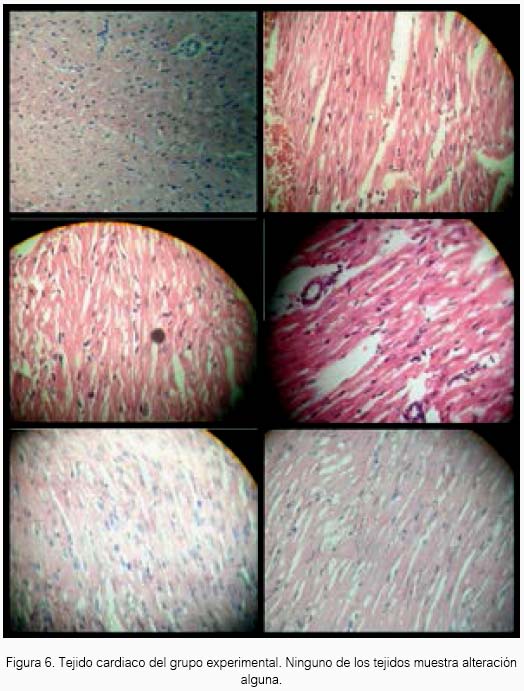
El H2S a 80 ± 20 ppm logró un inmejorable aspecto del tejido cardiaco en el grupo experimental de acuerdo al estudio anatomopatológico, lo cual estaría demostrando inocuidad en su uso a nivel de ese tejido en Cavia porcellus de la línea peruana. El sevoflurano produjo cierto daño en tejido cardiaco a las concentraciones de la experimentación, aunque para el resultado estadístico no existan diferencias entre los tres grupos.
AGRADECIMIENTOS
Al Dr. José Ernesto Ráez Gonzales, médico patólogo, profesor principal de la Facultad de Medicina Humana de la Universidad Nacional Mayor de San Marcos.
REFERENCIAS BIBLIOGRÁFICAS
1. Tamizhselvi R, Moore PK, Bhatia M. Hydrogen sulfide acts as a mediator of inflammation in acute pancreatitis: in vitro studies using isolated mouse pancreatic acinarcells. J Cell Mol Med. 2007;2:315-26. doi:10.1111/j.1582-4934.2007.00024.x. [ Links ]
2. Elrod J, Calvert J, Morrison J, Doeller J, Kraus D, Tao L, Jiao X, et al. Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function. PNAS. 2007;104(39):15560-5. [ Links ]
3. Zhenga D, Donga S, Lia T, Yanga F, Yub X, Wua J, et al. Exogenous hydrogen sulfide attenuates cardiac fibrosis through reactive oxygen species signal pathways in experimental diabetes mellitus models. Cell Physiol Biochem. 2015;36:917-29. doi: 10.1159/000430266. [ Links ]
4. Kolluru G, Shen X, Bir S, Kevil C. Hydrogen sulfide chemical biology: Pathophysiological roles and detection. Nitric Oxide. 2013;35:5-20. doi:10.1016/j. niox.2013.07.002. [ Links ]
5. Perry M, Hui C, Whiteman M, Wood M, Adcock I, Kirkham P, et al. Hydrogen sulfide inhibits proliferation and release of IL-8 from human airway smooth muscle cells. Am J Respir Cell Mol Biol. 2011 ;45(4):746-52. doi: 10.1165/rcmb.2010-03040C. [ Links ]
6. Huang S, Li H, Ge J. A cardioprotective insight of the cystathionine γ-Iyase/hydrogen sullide pathway. IJC Heart Vasculature. 2015;7:51-7. doi:10.1016/j.ijcha.2015.01.010. [ Links ]
7. Li R, McKinstry A, Moore J, Caltagarone B, Eckenhoff M, Eckenhoff R, Kelz M. Is hydrogen sullide-induced suspended animation general anesthesia? JPET. 2012;341 :735-42. doi: 10.1124/jpet.111.187237. [ Links ]
8. Bos E, Goor H, Joles J, Whiteman M, Leuvenink H. Hydrogen sullide: physiological properties and therapeutic potential in ischaemia. Brit J Pharmacol. 2014;172:1479-93. doi: 10.1111/bph. [ Links ]
9. Bibli S, Yang G, Zhou Z, Wang R, Topouzis S, Papapetropoulos A. Role of cGMP in hydrogen sulfide signaling. Nitric Oxide. 2015;46:7-13. doi: 10.1016/j.niox. [ Links ]
10. Jin Z, Chan H, Ning J, Lu K, Ma D. The role of hydrogen sulfide in pathologies of the vital organs and its clinical application. J Physiol Pharmacol. 2015;66(2):169-79. [ Links ]
11. Bos E, Goor H, Joles J, Whiteman M, Leuvenink H. Hydrogen sulfide: physiological properties and therapeutic potential in ischaemia. Brit J Pharmacol. 2014;172:1479-93. doi: 10.1111/bph. [ Links ]
12. Sun Y, Wang X, Chen X, Shen C, Li Y. Hydrogen sulfide improves cardiomyocytes electrical remodeling post ischemia/reperfusion injury in rats. Int J Clin Exp Pathol. 2015;8(1):474-81. [ Links ]
13. Tomasova L, Pavlovicova M, Malekova L, Misak A, Kristek F, Grman M. Effects of AP39, a novel triphenylphosphonium derivatised anethole dithiolethione hydrogen sullide donor, on rat haemodynamic parameters and chloride and calcium Cav3 and RyR2 channels. Nitric Oxide. 2015;46: 131-44. doi: 10.1 016/j.niox. [ Links ]
14. Lambert J, Nicholson C, Amin H, Amin S, Calvert J. Hydrogen sulfide provides cardioprotection against myocardial/ischemia reperfusion injury in the diabetic state through the activation of the RISK pathway. Med Gas Res. 2014;4:20. doi: 10.1186/s13618-014-0020-0. [ Links ]
15. Perú. Congreso de la República. Ley N° 27265: Ley de protección a los animales domésticos y a los animales silvestres mantenidos en cautiverio. Lima: Congreso de la República; 2000. Disponible en: http://www.ins.gob.pe/repositorioaps/0/2/jer/cia/Peru%20Ley%20protecc%20animales%20cautiverio%2027265%20del%202000.pdf. [ Links ]
16. Universidad de Buenos Aires. Facultad de Ingeniería. Guía de prácticas número 6. [Actualizado 2012-13; citada 2015 Agosto 18]. Disponible desde: http://materias.fi.uba.ar/6303/TPN6.pdf [ Links ]
17. Devi R, Narayan S, Vani G, Shyamala C. Gastroprotective effect of Terminalia arjuna bark on diclofenac sodium induced gastric ulcer. Chem Biol Interact. 2007;167(1):71-83. [ Links ]
18. Blackstone E, Roth, M. Suspended animation-like state protects mice from lethal hypoxia. Shock. 2007; 27(4):370-2. [ Links ]
19. Volpato G, Searles R, Yu B, Scherrer-Crosbie, M., Bloch K, Ichinose F, et al. Inhaled hydrogen sulfide: a rapidly reversible inhibitor of cardiac and metabolic function in the mouse. Anesthesiol. 2008;108(4):659-68. doi: 10.1097/ALN.0b013e318167af0d. [ Links ]
20. Stein A, Mao Z, Morrison J, Fanucchi M, Postlethwait E, Patel R, Kraus D. Metabolic and cardiac signaling effects of inhaled hydrogen sulfide and low oxygen in male rats. J Appl Physiol. 2012;112:1659-69. doi: 10.1152/japplphysiol.01598.2011. [ Links ]
El presente articulo se presenta de manera exclusiva, no se envió a otra revista científica.
El costo del presente articulo fue asumido en su totalidad por los autores y colaboradores.
El presente articulo no presenta conflicto de Intereses, es enviado con aprobación de los autores y colaboradores.
Correspondencia:
Q.F. César Gonzalo Gómez Herreros
Dirección: Laboratorio de Farmacología y Bioterio de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos, Lima, Perú.
Teléfono: 947 766 011
Correo electrónico: cg_gh@hotmail.com
Articulo recibido el 30 de octubre de 2015 y
Aceptado para publicación el 20 de marzo de 2016.













