Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.77 no.4 Lima Oct./dic. 2016
ARTÍCULO DE REVISIÓN
Actualización en el diagnóstico de la enfermedad celiaca
An update on diagnosis of coeliac disease
Raúl Emilio Real Delor1
1 Jefe del Departamento de Medicina Interna, Hospital Nacional, Itauguá, Paraguay.
Resumen
La enfermedad celiaca (EC) es una afección autoinmune multisistémica inducida por el gluten en personas genéticamente susceptibles. La presentación clínica clásica es con un síndrome diarreico crónico, aunque existen formas atípicas y silentes, lo cual dificulta el diagnóstico. El mismo se basa en la detección de diversos autoanticuerpos, sobre todo la IgA contra la transglutaminasa tisular, aunque la prueba de oro es el estudio anatomopatológico de biopsias duodenales obtenidas por endoscopia digestiva alta. La ausencia del gen HLA es una prueba que se utiliza para descartar la EC. La respuesta a la dieta sin gluten confirma esta afección, que de no diagnosticarse oportunamente y tratarse en forma adecuada puede llevar a complicaciones graves.
Palabras clave. Enfermedad Celiaca; Anticuerpo IgA Antitransglutaminasa Tisular; Endoscopia Digestiva Alta; Antígeno Mayor de Histocompatibilidad; Gluten.
Abstract
Celiac disease (CD) is a multisystem autoimmune condition induced by gluten in genetically susceptible individuals. The classical clinical presentation is the chronic diarrhea syndrome although there are atypical and silent forms, which rnay lead to diagnostic problems. Diagnosis is based on the detection of various autoantibodies, especially against tissue transglutaminase IgA, although the gold standard is the pathological examination of duodenal biopsies obtained by upper endoscopy. The absence of the HLA gene is a test used to rule CD. The response to gluten-free diet confirms this condition, which if not promptly diagnosed and properly treated can lead to serious complications.
Keywords. Celiac Disease; IgA Tissue Transglutaminase Antibody; Upper Gastrointestinal Endoscopy; Major Histocompatibility Antigen; Gluten.
INTRODUCCIÓN
En 2012 se propuso la última definición de enfermedad celiaca (EC): trastorno sistémico mediado inmunológicamente por el gluten y las prolaminas del gluten en sujetos susceptibles, caracterizada por la presencia de manifestaciones clínicas dependientes del gluten, por anticuerpos específicos, por el gen HLA DQ2 y DQ8, y una enteropatía (1-3).
La prevalencia es 1,7% de la población con síntomas y 0,7 a 1,2% en sujetos asintomáticos (4). La expresión clínica de la enfermedad celíaca es extremadamente variada (5). El tratamiento se basa en la dieta libre de gluten, lo que permite la prevención de las complicaciones: trastornos nutricionales y del crecimiento, osteopenia, enfermedades autoinmunes y neoplasias malignas (6,7).
La EC no es una afección trivial y el diagnóstico debe tomarse con mucha seriedad pues el tratamiento exige una dieta sin gluten que se caracteriza por ser estricta, a menudo costosa, que debe realizarse durante toda la vida, alterando la calidad de vida de sus porta dores y del entorno familiar (7).
Los criterios diagnósticos han variado con el tiempo por diversos motivos: se comprende ahora que la EC no es solo una enteropatía sino una afección sistémica, se han detectado nuevos auto anticuerpos y la tecnología ha avanzado con reactivos más sensibles y específicos (1). Es más, recientemente se han identificado dos trastornos más relacionados al gluten: la alergia mediada por IgE y la enteropatía inducida por el gluten por mecanismo no inmune ni alérgico (8). Esta revisión no se centrará en estas condiciones.
¿A QUIÉNES APLICAR LAS PRUEBAS DIAGNÓSTICAS?
Las formas de presentación clínica de la EC son muy variadas. La forma clásica de diarreas crónicas se presenta solo en dos tercios de los pacientes. Las manifestaciones atípicas y las formas clínicas silentes constituyen la parte sumergida de la EC, que amerita el ingenio del médico para su identificación y diagnóstico (7,9,10).
Las tasas de diagnóstico de la EC han aumentado exponencialmente. No obstante, sigue infradiagnosticada, pues cerca de 75% de los casos permanecen todavía sin diagnosticar. De ahí el dicho que solo estamos observando la punta del iceberg. El retraso en el diagnóstico es común aún en países desarrollados y se estima en 5 a 10 años (5).
Los grupos de riesgo de EC incluyen a (4,7,9,11):
-
Familiares consanguíneos de celiacos.
-
Pacientes con síntomas del sistema digestivo: diarreas crónicas, aftas bucales a repetición, intolerancia a lactosa, síndrome del colon irritable, transaminitis, constipación, vómitos recurrentes.
-
Portadores de enfermedades autoinmunes: tiroiditis crónica, diabetes mellitus tipo 1, hepatitis autoinmune.
-
Sujetos con otras patologías: dermatitis herpetiforme, fatiga crónica, hipoplasia del esmalte dental, anemia ferropénica, osteopenia y osteoporosis, síndrome de Down y de Turner, neuropatía periférica, deficiencia de IgA, pérdida inexplicable de peso, menarca tardía, talla baja. Estudios recientes han demostrado que la lengua geográfica se asocia significativamente a la EC (12).
Dada la gran asociación de EC con otras enfermedades autoinmunes, se recomienda el dosaje de autoanticuerpos tiroideos y hepáticos cada 2 años (7).
El diagnóstico de EC depende esencialmente del cuadro clínico, la serología y la histología (13,14). Se han desarrollado diversos esquemas diagnósticos de variada validez y aceptabilidad, pero muchas de estas combinaciones de pruebas o algoritmos diagnósticos son controversiales. Aun así existen algoritmos secuenciales que buscan incrementar la sensibilidad y especificidad. Todas, excepto la detección del HLA, requieren que los pacientes estén con dieta conteniendo gluten (15).
SEROLOGÍA
La prueba serológica actualmente recomendada tanto en niños como en adultos es la detección del anticuerpo IgA contra la transglutaminasa tisular (ATG IgA), junto a la determinación del nivel sérico de IgA (1,3,7,9,11,14,16). Es una prueba rápida, objetiva, de fácil interpretación, de elevada sensibilidad y especificidad (tabla 1). Es además más económica que un perfilo panel de diversos autoanticuerpos (7,14).
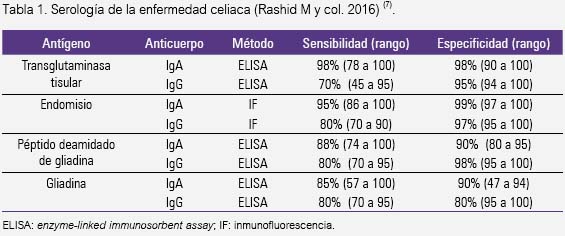
Otra prueba de utilidad es la detección del anticuerpo IgA contra el endomisio (EMA IgA) , aunque es de técnica más engorrosa, mayor costo y de interpretación subjetiva (16). Los niveles elevados de EMA se correlacionan con la gravedad de la lesión intestinal (5).
La detección de anticuerpos IgA contra la gliadina (AGA IgA) es obsoleta y ya no se utiliza en adultos por su baja sensibilidad y especificidad (2,10,14). Son útiles en niños menores de 18 meses, ya que los niveles de AGA IgA suelen ser negativos en dicho grupo de edad, y para el seguimiento, puesto que se elevan precozmente tras la ingesta de gluten (5,17).
Los anticuerpos contra la reticulina se determinan por ELISA, son más sensibles que EMA IgA y presentan una especificidad similar a ATG IgA (7,15).
Últimamente se ha detectado otro antígeno, el péptido deamidado de la gliadina, cuyo anticuerpo IgA (DOP IgA) no ha demostrado ser de mayor efectividad diagnóstica. Sin embargo, se utiliza cuando cualquiera de los marcadores antes citados es negativo y existe alta sospecha de EC (1,14).
Las fracciones IgG de todos estos autoanticuerpos son útiles cuando existe deficiencia de IgA y en los niños menores de 2 años (7,10,15).
Hay casos de falsos positivos para ATG IgA en la artritis reumatoide, enfermedad inflamatoria intestinal, cardiopatías. Entre las causas de falsos negativos están la deficiencia de IgA (5 a 10% de los celiacos), niños menores de 2 años, eliminación del gluten de la dieta, uso de corticosteroides e inmunomoduladores (7,11,18). Otra etiología de falsos negativos se halla a la calidad de los reactivos y a la falta de estandarización de los mismos (14).
Los marcadores serológicos se normalizan luego de 6 a 12 meses de la dieta sin gluten, por lo que pueden utilizarse, junto a la mejoría clínica, como parámetros de control de la enfermedad. La persistencia de ambos pasado este tiempo indica consumición, inadvertida o voluntaria, de gluten o la posibilidad de EC refractaria (5). A la inversa, la desaparición de niveles detectables de auto anticuerpos en sangre en los celiacos tratados no descarta la ingesta de gluten, pues puede haber daño intestinal sin correlación serológica. De ahí la importancia de realizar la dieta de la manera más estricta posible (7).
ENDOSCOPIA DIGESTIVA ALTA
Es el método considerado hasta la fecha como el patrón de oro. Está recomendada para todos los adultos, aún con cuadro clínico compatible con EC y serología positiva (3,7,15,19,20).
Los signos macroscópicos más específicos de EC son el aspecto festonea do de la mucosa duodenal (98,77%), el patrón en mosaico (99,38%) y las fisuras en la misma (98,77%), mien tras que la atrofia del bulbo duodenal y la reducción de los pliegues tienen muy baja sensibilidad (55%) (21,22). Las alteraciones de la mucosa intestinal se presentan en parches (14). Por eso se recomienda al menos una biopsia del bulbo y cuatro de la segunda o tercera porción duodenal. La biopsia duodenal rutinaria en sujetos con baja probabilidad clínica de EC detecta anormalidades histopatológicas en 2% (23).
La endoscopia de gran definición, con o sin la cromoendoscopia virtual, aumenta la sensibilidad del diagnóstico en relación a la atrofia duodenal: 85,7% versus 41,6% (p<0,01) (24). Otras técnicas como la cromoendoscopia digital, tomografía de coherencia óptica, endocitoscopia y endomicroscopia confocal podrían ser útiles para predecir la existencia de atrofia de las vellosidades y algunas de ellas incluso podrían asistir el endoscopista para reconocer grados más leves de la EC. Pero todas estas técnicas requieren personal entrenado y disponibilidad tecnológica (4,5,14,24).
El uso de la cápsula endoscópica de Crosby se reserva para sujetos adultos con contraindicación de la endoscopia digestiva alta, en EC refractaria o cuando se sospechan complicaciones en intestino delgado (yeyunitis ulcerativa, neoplasias) (3). A pesar de su aceptación por los pacientes, su principal desventaja es la incapacidad para realizar biopsias (14,15).
La rebiopsia no se recomienda en pacientes con mejoría clínica con la dieta sin gluten y no presentan síntomas sugestivos de complicaciones ni riesgo de linfoma. La mejoría de los parámetros clínicos es evidencia de la res puesta adecuada a la dieta en la mucosa intestinal (7,25).
HISTOLOGÍA
El informe anatomopatológico siempre debe incluir estos criterios: la orientación de la biopsia, el estado de las microvellosidades (normales o atrofiadas y el grado de atrofia), la elongación de las glándulas submucosas, la relación vellosidad/cripta submucosa y el número de linfocitos intraepiteliales (1,26,27). Se informa de 13 a 46% de errores diagnósticos (subdiagnóstico o sobrediagnóstico) por mala interpretación anatomopatológica (14). Por eso es importante la correlación clinicopatológica.
Los grados de lesión han sido clasificados con diversos criterios, desde Marsh hasta Oberhuber y Ensari (28), pero ninguna ha demostrado ser mejor que la otra (tabla 2) (13,29). Es más, dado que no existe una perfecta correlación entre grado de lesión mucosa y severidad de la sintomatología, los hallazgos histopatológicos tienden a ser poco útiles para el clínico. Por eso, es mejor una descripción detallada de los hallazgos más que encasillarse en una clasificación (29).
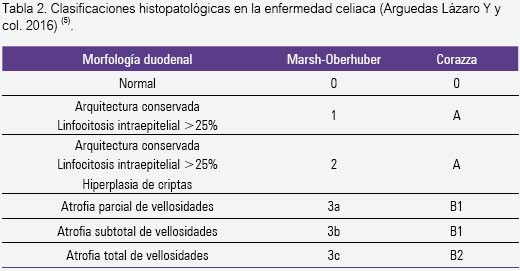
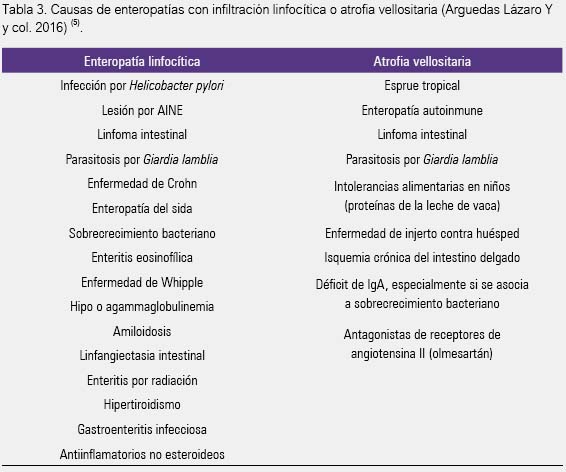
Ninguna de estas anomalías histológicas es patognomónica de la EC, pues existen muchos diagnósticos diferenciales (tabla 3) (4,13,14,23). Recientemente, la enteropatía inducida por olmesartán debe agregarse a la lista de atrofia duodenal (30,31).
ANTÍGENO LEUCOCITARIO HUMANO
El antígeno leucocitario humano (HLA) DQ2 se halla presente en 95% de los celiacos y el HLA DQ8 en el restante 5% (7,15). Aún así, no forma parte de la rutina diagnóstica de la EC, pues un tercio de la población caucásica es portadora de estos genes pero solo 4% de ella presentará el cuadro clínico de la EC (7,10,14,20). Por ello, la característica de su determinación es su elevado valor predictivo negativo (99%) (4,5,14,25). Su detección se utiliza solo para excluir la EC en casos dudosos o para sugerir EC en caso de sujetos con serología negativa y pocos cambios histopatológicos en la mucosa duodenal (1,3,7,9,32). También podrá utilizarse en caso de dificultad para la realización de una endoscopia digestiva alta, por ej. en gestantes y en pacientes con severas discrasias sanguíneas (25). Otra indicación también sería en sujetos de riesgo de padecer EC como los familiares consanguíneos, pero se hallan asintomáticos y tienen serología dudosa o negativa (1).
DIETA SIN GLUTEN
Solo debe realizarse como tratamiento al confirmarse la EC (3,9). No es un método diagnóstico y no debe utilizarse como prueba terapéutica (7,33). La respuesta a la dieta en sujetos sintomáticos intestinales es bastante rápida, una a cuatro semanas, y nunca más de 12 meses. En caso de falta de respuesta pasado el mes de tratamiento debe evaluarse estrictamente el cumplimiento de la dieta. El diagnóstico de EC refractaria, entidad muy rara, debe plantearse tras el año de dieta bien llevada (3).
La prueba de provocación con gluten (15 g/día] se utiliza en sujetos con serología negativa, HLA también negativo pero con la histología y sintomatología compatibles con EC (5).
ESTRATEGIAS DIAGNÓSTICAS
En 1970, ESPGHAN estableció por primera vez los criterios diagnósticos de la EC, que requería 3 biopsias: antes de la dieta sin gluten, luego de la misma y la última tras una prueba de provocación con gluten (18). Estos criterios evolucionaron hasta que en 1990 se estableció una nueva guía que eliminó las biopsias seriadas y la prueba de provocación. La última guía europea (2012) reconoce la correlación entre los niveles de marcadores serológicos y el grado de lesión duodenal (1). En ella, los niños y adolescentes que presenten valores de ATO IgA 10 veces mayores del normal no requieren confirmación histológica, siempre que tengan EMA positivo y HLA presente (1,18,34). Recientes estudios prospectivos realizados en niños celiacos de Italia han validado esta estrategia (35). No obstante, debe tenerse en cuenta como criterios adicionales una alta probabilidad diagnóstica pretest y un apropiado punto de corte (19). Sin embargo, esta recomendación no está aceptada en los EE UU (15).
Según Di Tola M y col, en sujetos adultos sintomáticos el punto de corte del nivel de ATO IgA para el diagnóstico serológico de la EC en relación a la histopatología es > 3,6 lo que proporciona con sensibilidad 76,8%, especificidad 63,8% y valor predictivo positivo 97,2% (18). Pero dado que 3% de los sujetos con valores de ATO IgA superiores a este punto de corte serán considerados falsamente como portadores de EC, se requieren más estudios para validar este criterio diagnóstico en los adultos (18,19).
Finalmente, según Catassi, el diagnóstico de EC puede establecerse con presencia de al menos 4 de 5 criterios diagnósticos: cuadro clínico típico, serología positiva, presencia de haplotipo HLA DQ2-DQ8, enteropatía en la biopsia duodenal, respuesta a la dieta sin gluten (36). El antecedente familiar de EC añade más evidencia al diagnóstico (5).
Entre las perspectivas para el diagnóstico en el futuro se encuentran las pruebas de detección de ATO IgA en sangre capilar (14). Su ventaja es la rapidez y aceptabilidad de los pacientes (37). Sin embargo, a pesar de su utilidad para uso en consultorio, esta prueba no re emplaza a los estudios serológicos ni endoscópicos. Estos métodos rápidos de detección han mostrado excelente sensibilidad (97,4%) y especificidad (100%) y son, además, muy económicos. Lastimosamente, ninguna guía la incluyó aún en un algoritmo diagnóstico de EC. Otra nueva técnica rápida se basa en los biosensores, que consisten en transductores fisicoquímicos y un biosensor (14,38). Estos pueden ser de tipo amperométrico, voltamétrico o espectroscopio de impedancia electroquímica. Esta nueva tecnología, basada en la utilización de nuevos materiales como las nano partículas y puntos cuánticos, disminuye el tiempo del laboratorista, menor uso de reactivos, son baratos, de fácil interpretación y portabilidad (2). Los anticuerpos que detectan la IgA ATG tienen sensibilidad 100%, especificidad 84% y excelente correlación con las pruebas de ELISA (39,49). Se es pera en un futuro próximo la desaparición de las pruebas de ELISA.
CONCLUSIONES
La EC sigue siendo una afección esquiva a muchos médicos por su presentación atípica o silente. Afortunadamente existen criterios diagnósticos bastante accesibles y científicamente validados. A pesar del retraso que aún persiste en la detección de la EC, la incidencia en aumento de la EC sugiere mayor atención de la comunidad médica al hacer los diagnósticos diferenciales y mayor disponibilidad de los recursos diagnósticos. Se recomienda hacer uso adecuado de los métodos diagnósticos reconociendo sus limitaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Husby S, Koletzko S, Karponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Miiki M, Ribes-Koninckx C, Ventura A, Zimmer KP; ESPGHAN Warking Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr. 2012 Jan;54(1):136-60. doi: 10.1097/MPG.0b013e31821a23d0.
2. Scherf KA, Ciccocioppo R, Pohanka M, Rimarova K, Opatrilova R, Rodrigo L, Kruzliak P. Biosensors for the diagnosis of celiac disease: current status and future perspectives. Mol Biotechnol. 2016 Apr 29. doi: 10.1016/j.jbiosc.2016.03.ü11.
3. Kochhar GS, Singh T, Gill A, Kirby DF. Celiac disease: Managing a multisystem disorder. Cleve Clin J Med. 2016 Mar;83(3):217-27. doi: 10.3949/ccjm.83a.14158.
4. Moscoso JF, Quera PR. Update on celiac disease. Rev Med Chil. 2016 Feb;144(2):211-21. doi: 10 .4067/S0034-98872016000200010.
5. Arguedas Lázaro Y, Santolaria Piedralita S. Enfermedad celíaca. Medicine. 2016;12(4):168-77. doi: 10.1016/j.med.2016.02.010.
6. Han Y, Chen W, Li P, Ye J. Association between coeliac disease and risk of any malignancy and gastrointestinal malignancy: a meta-analysis. Medicine (Baltimore). 2015 Sep;94(38):e1612. doi: 10.1097/MD.0000000000001612.
7. Rashid M, Lee J. Serologic testing in celiac disease: Practical guide for clinicians. Can Fam Physician. 2016 Jan;62(1):38-43.
8. Elli L, Branchi F, Tomba C, Villalta D, Narsa L, Ferretti F, Roncoroni L, Bardella MT. Diagnosis of gluten related disarders: Celiac disease, wheat allergy and non-celiac gluten sensitivity. World J Gastroenterol. 2015 Jun 21 ;21 (23):711 0-9. doi: 10.3748/wjg.v21.i23.7110.
9. Downey L, Houten R, Murch S, Longson D; Guideline Development Group. Recognition, assessment, and management of coeliac disease: summary of updated NICE guidance. BMJ. 2015 Sep 2;351:h4513. doi: 10.1136/bmj.h4513.
10. Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA, American College of Gastroenterology. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol. 2013 May;108(5):656-76. doi: 10.1038/ajg.2013.79.
11. Lebwohl B, Green PH. Antitissue transglutaminase IgA for celiac disease testing. JAMA. 2016 Jan 5;315(1):81-2. doi: 10.1001/jama.2015.15283.
12. Cigic L, Galic T, Kero D, Simunic M, Medvedec Mikic I, Kalibovic Govarko D, Biocina Lukenda D. The prevalence of celiac disease in patients with geographic tongue. J Oral Pathol Med. 2016 May 1. doi: 10.1111/jop.12450.
13. Srivastava A. Oberhuber versus Marsh: much ado about nothing? Gastroenterol Hepatol Bed Bench. 2015 Fall;8(4):244-6. PMCID: PMC4600513
14. Kelly CP, Bai JC, Liu E, Leffler DA. Advances in diagnosis and management of celiac disease. Gastroenterology. 2015 May;148(6):1175-86. doi: 10.1053/j.gastro.2015.01.044.
15. Maglione MA, Okunogbe A, Ewing B, Grant S, Newberry SJ, Motala A, Shanman R, Mejia N, Arilkhanova A, Shekelle P, Harmon G. Diagnosis of Celiac Disease [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2016 Jan. Repart No.: 15(16)-EHC032-EF.
16. Aldaghi MA, Dehghani SM, Haghighat M. Evaluation of the carrelation between ttg-iga titer and duodenal biopsy lindings in children with suspected celiac disease. Iran J Pediatr. 2016 Feb;26(1):e3615. doi: 10.5812/ijp.3615.
17. Khangura J, Van den Bruel A, Perera R, Heneghan C, Price CP, Wolstenholme J, Thompson M, Plüddemann A. Point-of-care testing for coeliac disease: primary care diagnostic technology update. Br J Gen Pract. 2013 Jun;63(611):e426-8. doi: 10.3399/bjgp13X668401.
18. Di Tola M, Marino M, Goetze S, Casale R, Di Nardi S, Barghini R, Donato G, Tiberti A, Picarelli A. Identilication of a serum transglutaminase threshold value for the noninvasive diagnosis of symptomatic adult celiac disease patients: a retrospective study. J Gastroenterol. 2016 Feb 29. doi 10.10071 s00535-016-1188-y.
19. Milis JR, Murray JA. Contemparary celiac disease diagnosis: is a biopsy avoidable? Curr Opin Gastroenterol. 2016 Mar;32(2):80-5. doi: 10.1097/MOG.0000000000000245.
20. Snyder MR, Murray JA. Celiac disease: advances in diagnosis. Expert Rev Clin Immunol. 2016 Apr;12(4):449-63. doi. 10.1586/1744666X.2016.1130625.
21. Penny HA, Mooney PD, Burden M, Patel N, Johnston AJ, Wong SH, Teare J, Sanders DS. High definition endoscopy with or without I-Scan increases the detection of celiac disease during routine endoscopy. Dig Liver Dis. 2016 Feb 26. pii: S1590 8658(16)00059-1. doi: 10.1016/j.dld.2016.02.009.
22. Balaban DV, Popp A, Vasilescu F, Haidautu D, Purcarea RM, Jinga M. Diagnostic yield of endoscopic markers for celiac disease. J Med Life. 2015 Oct-Dec;8(4).452-7.
23. Stoven SA, Choung RS, Rubio-Tapia A, Absah I, Lam-Himlin DM, Harris LA, Ngamruengphong S, Vazquez Roque MI, Wu TT, Murray JA. Analysis of biopsies from duodenal bulbs of all endoscopy patients increases detection of abnarmalities but has a minimal effect on diagnosis of celiac disease. Clin Gastroenterol Hepatol. 2016 Mar 7. pii: S15423565(16)00227-5. doi: 10.1016/j.cgh.2016.02.026.
24. Penny HA, Mooney PD, Burden M, Patel N, Johnston AJ, Wong SH, Teare J, Sanders DS. High definition endoscopy with or without I-Scan increases the detection of celiac disease during routine endoscopy. Dig Liver Dis. 2016 Feb 26. pii: S15908658(16)00059-1. doi: 10.1016/j.dld.2016.02.009.
25. Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014 Aug;63(8):1210-28. doi: 10.1136/gutjnl-2013-306578.
26. Marsh MN. Coeliac disease, mucosal change and IEL: doing what counts the best. Gastroenterol Hepatol Bed Bench. 2016 Winter;9(1 ):1-5. PMID: 26744607.
27. Biagi F, Vattiato C, Burrone M, Schiepatti A, Agazzi S, Maiarano G, Luinetti O, Alvisi C, Klersy C, Corazza GR. Is a detailed grading of villous atrophy necessary lar the diagnosis 01 enteropathy? J Clin Pathol. 2016 May4. pii: jclinpath-2016-203711. doi: 10.1136/jclinpath-2016-203711.
28. Ensari A. Gluten-sensitive enteropathy (celiac disease): controversies in diagnosis and classilication. Arch Pathol Lab Med. 2010 Jun;134(6):826-36.
29. Ensari A. Coeliac disease: to classily ar not to classily - that is the question! Gastroenterol Hepatol Bed Bench. 2016 Spring;9(2):73-4. doi: 10.1043/1543-2165-134.6.826.
30. Campos Ruiz A, Urtasun Arlegui L, Marra-López Valenciano C. Sprue-like enteropathy linked to olmesartan. Rev Esp Enlerm Dig. 2016 Feb 29. doi: 10.17235/reed.2016.4140/2015.
31. laniro G, Gasbarrini A, Cammarota G. Olmesartanassociated sprue-like enteropathy: know your enemy. Scand J Gastroenterol. 2016 Mar 22:1. doi:10.3109/00365521.2016.1153139.
32. Rostom A, Murray JA, Kagnoff MF. American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease. Gastroenterology. 2006 Dec; 131(6): 1981-2002. doi: 10.1053/j.gastro.2006.10.004.
33. Dias JA. In time: celiac disease: sorne current aspects of epidemiology and research. Rev Paul Pediatr. 2016 Mar28. pii: S01 03-0582(16)00028-9. doi: 10.1016/j.rpped.2016.03.002.
34. Szymańska E, Szymańska S, Pawlowska J, Orlowska E, Konopka E, Cukrowska B. The impartance of anti-transglutaminase IgA antibody detection in the diagnosis of celiac disease - case repart of an inappropriate diagnostic approach. Prz Gastroenterol. 2015;10(4):250-3. doi: 10.51141 pg.2015.52415.
35. Benelli E, Carrato V, Martelossi S, Ronlani L, Not T, Ventura A. Coeliac disease in the ERA of the new ESPGHAN and BSPGHAN guidelines: a prospective cohort study. Arch Dis Child. 2016 Feb;101(2):172-6. doi: 10.1136/archdischild-2015-309259.
36. Catassi C, Fasano A. Celiac disease diagnosis: simple rules are better than complicated algorithms. Am J Med. 2010 Aug;123(8):691-3.
37. Hariz MB, Laadhar L, Kallel-Sellami M, Siala N, Bouraoui S, Bouziri S, Bargi A, Karouia F, Maherzi A, Makni S. Celiac disease in Tunisian children: a second screening study using a "new generation" rapid test. Immunol lnvest. 2013;42(4):356-68. doi: 10.3109/08820139.2013.770012.
38. Couto RA, Lima JL, Quinaz MB. Recent developments, characteristics and potential applications of screen-printed electrodes in pharmaceutical and biological analysis. Talanta. 2016 Jan 1;146:80114. doi: 10.1016/j.talanta.2015.06.011.
39. Kergaravat SV, Beltramino L, Garnero N, Trotta L, Wagener M, Isabel Pividari M, Hernandez SR. Electrochemical magneto immunosensar lar the detection 01 anti-TG2 antibody in celiac disease. Biosens Bioelectron. 2013 Oct 15;48:203-9. doi: 10.1016/j.bios.2013.04.012.
40. Martín-Yerga D, González-García MB, CostaGarcía A. Electrochemical immunosensar for anti-tissue transglutaminase antibodies based on the in situ detection of quantum dots. Talanta. 2014 Dec;130:598-602. doi: 10.1016/j.talanta.2014.07.010.
Fuente financiamiento: Recursos del autor.
Conflicto de interés: El autor señala que no existe conflicto de interés con el presente manuscrito.
Correspondencia:
Dr. Raúl Emilio Real Delor.
Dirección: calle R.I. 4 Curupayty N' 978 (Asunción, Paraguay).
Teléfono: +595.981261084
Correo electrónico: raulemilioreal@gmail.com
Articulo recibido el 14 de mayo de 2016
Aceptado para publicación el 6 de julio de 2016.













