Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.78 no.2 Lima abr./jun. 2017
http://dx.doi.org/10.15381/anales.v78i2.13216
SIMPOSIO OBESIDAD
Obesidad y genética
Obesity and genetics
Maria Isabel Quiroga-de Michelena1
1 Instituto de Medicina Genética, Lima, Perú
Resumen
La obesidad se convierte en epidemia en muchos países, e incluye las zonas urbanas del Perú. Diversos estudios buscan dilucidar los factores que contribuyen a esta peligrosa epidemia, que tiene un evidente componente genético. En este artículo se trata de resumir lo que se conoce hasta el momento respecto a la genética de la obesidad.
Palabras clave: Obesidad; Genética.
Abstract
Obesity is becoming epidemic in many countries, and includes urban areas of Peru. Various studies try to elucidate the factors that contribute to this dangerous epidemic that has an evident genetic component. In this review we try to summarize what is currently known with respect to genetics in obesity.
Keywords: Obesity; Genetics.
FACTORES GENÉTICOS EN OBESIDAD
La obesidad se está convirtiendo en epidemia en muchos países, incluyendo las zonas urbanas del Perú. Diversos estudios buscan dilucidar los factores que contribuyen a esta peligrosa epidemia, que tiene un evidente componente genético. Aquí tratamos de resumir lo que se conoce hasta el momento respecto a la genética de la obesidad.
Para ello resulta didáctico considerar tres tipos de obesidad, según su etiología:
La obesidad común o multifactorial. La obesidad monogénica no sindrómica. La obesidad sindrómica.
1. El primer grupo de obesidad, y largamente el más frecuente, es la llamada obesidad común, en la que la mayoría de los miembros de una familia tienden a ser obesos, unos más que otros, y comparten, además de los genes, malos hábitos alimenticios, sedentarismo y una dieta inadecuada, muchas veces propiciada por circunstancias familiares, sociales o laborales que impulsan la compra de la llamada ‘comida chatarra’.
Por otra parte, tener parientes obesos aumenta el riesgo de desarrollar obesidad, aun si no viven juntos o no comparten los mismos hábitos. Esto demuestra la importancia del factor genético en esta patología. Lyon y Hirshhorn (1), en estudios poblacionales y de gemelos, estiman el rango de heredabilidad en 50%, es decir que la mitad de la contribución en la obesidad común está dada por los genes. Estos casos, son los llamados de herencia multifactorial, que, como su nombre lo indica, son el resultado de la convergencia de múltiples factores, tanto genéticos como ambientales. En ellos, los genes que intervienen no presentan propiamente mutaciones o errores, sino que tienen variaciones relativamente benignas y comunes en la población, usualmente un polimorfismo de nucleótido único o SNP por sus siglas en inglés; ninguno de estos genes por sí solo es causa de obesidad. Es la suma o combinación de estas variantes lo que da la propensión genética que, interactuando con los factores ambientales mencionados, determina el fenotipo. En eso consiste la herencia multifactorial. Esto ha sido corroborado con estudios de gemelos uni y bivitelinos y otros estudios que comparan la contribución genética y los factores ambientales (2,3).
Ignatieva y col en el año 2016 (4), con estudios amplios del genoma (GWAS) logró identificar 578 genes humanos que intervienen en el control de los hábitos alimenticios y en la regulación del peso corporal. Nuevamente, en ninguna de las variantes de estos se encontró que su presencia individual tenga poder predictivo significativo.
Estos genes podrían haber sido seleccionados naturalmente con la evolución al permitir, en tiempos de hambruna, la supervivencia de quienes poseen genes ‘ahorradores’ (5).
La complejidad de los mecanismos que intervienen en la regulación del peso corporal y hábitos alimentarios se refleja también en la influencia de ‘factores epigenéticos’, elementos regulatorios que, sin alterar el ADN, influyen en la expresión de los genes, como son la metilación del ADN, acetilación de las histonas y, como descubrimiento más reciente, los microRNA o miR y otros mecanismos epigenéticos (6,7). Los miR son pequeñísimas moléculas de ARN no codificante, que tienen generalmente unos 20 a 30 nucleótidos, que suelen unirse al ARN mensajero (mARN) y bloquear su acción impidiendo que se forme el producto final a que estaba destinado.
El grupo español de Corella, Coltell y Ordovás (7) mencionan evidencias que relacionan los procesos epigenéticos con la ingesta dietética. Sabido es también que la dieta materna durante el embarazo influye en el desarrollo del embrión. Por ejemplo, en un feto con propensión genética a tener defecto del tubo neural se puede minimizar este riesgo si la madre ingiere una dosis adecuada de ácido fólico: los genes no cambian, pero la expresión de los mismos sí. Otro ejemplo común es que en los gemelos idénticos el fenotipo suele ir diferenciándose conforme pasan los años, lo que se debería a cambios epigenéticos influenciados por factores ambientales: genes idénticos, con variabilidad en su expresión. Las marcas epigenéticas son reversibles, hasta cierto punto, con la modificación de estilos de vida (8).
El conocimiento de la influencia de la dieta en el fenotipo ha dado lugar a una nueva disciplina: la nutrigenómica. El grupo español mencionado (7) estudió la relación entre las variantes del gen PLIN4 y la obesidad. Una de estas variantes (rs8887), que era debida a que favorecía un sitio de unión con un miR, se asoció con obesidad en los portadores; lo interesante fue el hallazgo de una relación gen-dieta, ya que la obesidad asociada a dicha variante desaparecía con el consumo elevado de ácidos grasos omega-3. La nutrigenómica, entonces, es la disciplina que relaciona el papel de los nutrientes en la expresión génica; probablemente pronto se podría hacer estudios, tal como se hace actualmente con la farmacogenómica, para indicar a cada individuo la dieta que le conviene de acuerdo a sus genes. Esto podría incluso ser aplicable a la mujer gestante, quien podría introducir variantes en su dieta y en su estilo de vida, actividad física, y otros, para favorecer la expresión de genes benéficos para el desarrollo del embrión (9).
Se está experimentando también inducir modificaciones epigenéticas utilizando medicamentos como ácido valproico para silenciar o potenciar la actividad de determinados genes, pero los resultados aun no son concluyentes. Igualmente se experimenta en ratones la posibilidad de bloquear la formación de adipocitos mediante miR (9), cuyos resultados, de confirmarse, podrían ser útiles en el tratamiento de la obesidad severa. Aun queda mucho por descubrir en el campo de la epigenética.
2. La obesidad monogénica no sindrómica es causa de aproximadamente el 5% de casos de obesidad severa. Es importante en la investigación porque permite identificar genes que se heredan en forma mendeliana y determinan formas extremas de obesidad, los cuales abren la puerta para la comprensión de los mecanismos involucrados en el comportamiento alimentario.
El complejo sistema que controla este comportamiento está formado por dos tipos de neuronas en el núcleo arcuato hipotalámico, que secretan respectivamente el neuropéptido Y (NPY) y el péptido relacionado a Agouti (AgRP) u hormona estimulante de alfa melanocitos, que se produce a partir de la proopiomelanocortina. La función de las neuronas del núcleo arcuato es controlada por diversas hormonas: leptina, insulina, ghrelina, polipéptido YY (PYY), glucocorticoides, adrenocorticotrofina y la hormona liberadora de corticotrofina, así como los sistemas neurotransmisores del cerebro: serotoninérgico, dopaminérgico, adrenérgico y GABAérgico.
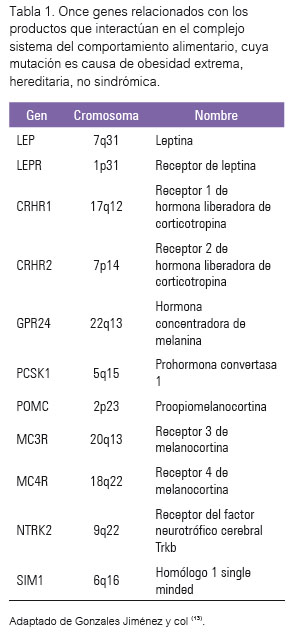
Hasta el momento se han identificado 11 genes relacionados con los productos que interactúan en este complejo sistema, cuya mutación es causa de obesidad extrema, hereditaria, no sindrómica, la mayoría de los cuales fueron reconocidos previamente en el ratón y se muestran en la tabla 1. Se trata de genes involucrados en el sistema hipotalámico de regulación del apetito, algunos de los cuales, como la leptina, cumplen además otras funciones (4,10). La leptina y su receptor se expresan también en el sistema inmune, influyendo en el estado inflamatorio que se encuentra en la obesidad y que predispone no solo a la diabetes, enfermedad cardiovascular y al síndrome metabólico, sino también a enfermedades alérgicas y autoinmunes (10). Se han descrito varios casos de deficiencia congénita de leptina por mutaciones en el gen LEP en pacientes con inicio temprano de obesidad severa, hiperfagia extrema, ausencia de sensación de saciedad, todo esto acompañado de trastornos metabólicos, hormonales e inmunológicos. La mayoría de los casos descritos han sido en familias con alta consanguinidad, donde los afectados son homocigotos para la mutación causante, demostrando herencia autosómica recesiva (11). El tratamiento con leptina revierte los síntomas (12,13).
Un cuadro similar, también de herencia recesiva, pero menos severo, descrito por Farooqi y colaboradores en el 2007, se da en casos de mutaciones en el gen LEPR, receptor de leptina (14). La deficiencia del gen receptor 4 de melanocortina (MC4R) parece ser una de las más frecuentes causas –entre lo infrecuente que es la obesidad monogénica- de este tipo de obesidad, habiéndose descrito familias con herencia dominante y otras con herencia recesiva (15).
Como se puede observar, los genes relacionados con las formas severas de obesidad monogénica son parte del sistema leptina-melanocortina en el hipotálamo, y las investigaciones hechas en los últimos años sobre la genética de la obesidad en humanos se basa en los experimentos previos en ratones, ya que algunos aspectos del genoma murino son bastante similares al humano y pueden orientar los principales puntos a investigar en el tema de la obesidad (16).
3. Obesidad sindrómica. El término se refiere a aquellos casos en los que la obesidad moderada o extrema es una característica más dentro del conjunto que conforma el síndrome. La causa es siempre genética, puede ser monogénica, puede ser una alteración cromosómica u otras formas más complejas de herencia, y todas cursan con retardo mental. Se han identificado más de 25 causas sindrómicas de obesidad (17). Como ejemplo nos ocuparemos brevemente de las siguientes:
-
Síndrome de Prader-Willi (omim 176270). Es el más frecuente de los síndromes de obesidad, con una frecuencia de 1 en 10 000 a 1 en 30 000 nacimientos. El recién nacido presenta hipotonía severa, dificultad para alimentarse, genitales poco desarrollados y ojos almendrados. Posteriormente, entre los 6 meses y los 3 años la hipotonía comienza a mejorar, el niño empieza a comer vorazmente y se desarrolla una conducta adictiva por la comida, ya que las personas con este síndrome no presentan sensación de saciedad. El fenotipo de las personas con SPW incluye talla corta, obesidad mórbida, manos y pies pequeños, genitales pequeños, conducta obsesiva, rechazo a la actividad física y retardo mental de grado generalmente leve a moderado (18). La intervención con terapia conductual intensa y otras estrategias han dado buenos resultados para mejorar las conductas inadecuadas y moderar la obesidad.
Estudios recientes han investigado la relación de esta ausencia de saciedad con la leptina (que es la hormona que normalmente contribuye a moderar la ingesta provocando la sensación de saciedad), encontrándose que, contrariamente a lo que se esperaría, la leptina en personas con SPW está elevada, sugiriendo mas bien una posible resistencia a la leptina, que aun no está demostrada (19); otra vía terapéutica podría ser la oxitocina (20).
La causa de este síndrome es la pérdida o inactivación (por mecanismos epigenéticos) de una pequeña región del cromosoma 15 de origen paterno. -
El Síndrome de Cohen (omim 216550) cursa igualmente con obesidad y retardo mental. Hay microcefalia y una facies característica, con ojos levemente inclinados hacia abajo, incisivos superiores prominentes, paladar angosto, orejas grandes, problemas visuales diversos. La causa es la presencia de mutaciones en ambos alelos del gen COH1, situado en el cromosoma 8p. Herencia autosómica recesiva.
-
En el Síndrome de Bardet-Biedl (omim 209900) se presenta distrofia de la retina y otros graves problemas oculares que llevan a la ceguera a partir de los 20 años a la mayoría de los afectados. Hay además polidactilia de manos y/o pies y trastornos anatómicos renales. La herencia es compleja, se conocen 8 loci independientes relacionados con el síndrome de Bardet-Biedl, y si bien la mayoría sigue un patrón de herencia autosómico recesivo, hay también casos de herencia trialélica, con más de un locus involucrado.
En general, en estos síndromes la obesidad se da por aumento de la ingesta calórica, la cual se debe a la falta de sensación de saciedad y esta se relaciona con la alteración de alguno de los múltiples factores que actúan en el hipotálamo regulando la ingesta. Se espera que los adelantos en la identificación de genes y mecanismos para regular su actividad colaboren al manejo de estas raras pero importantes condiciones relacionadas con obesidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Lyon H, Hirschhorn J. Genetics of common forms of obesity: a brief overview. Am J Clin Nutrition. 2005;82(suppl):215S-7S. [ Links ]
2. Dubois L, Ohm Kivik K, Girard M, Tatone-Tokuda F, Pérusse D, Hjelmbrg J, et. al. Genetic and environmental contributions to weight, heightand BMI from birth and 19 years of age: anInternational study of over 12000 twin pairs. PloS One. 2012;7(2):e30153. doi:1371/Journal. pone.0030153. [ Links ]
3. Oelsner KT, Guo Y, To SB, Non AL, Barkin SL. Maternal BMI as a predictor of methylation of obesity-related genes in saliva samples frompre-school age Hispanic children at-risk for obesity. BMC genomics. 2017 Jan 9;18(1):57. doi: 10.1186/s12864 016 3473 9. [ Links ]
4. Ignatieva E, Afonnikov D, Saik O, Rogaev E, Kolchanov N. A compendium of human genes regulating feeding behavior and body weight, its functional characterization and identification of GWAS genes involved in brain-specific PPI network- The Author(s) BMC Genetics. 2016;17(Suppl 3):158. DOI 10.1186/s12863-016-0466-2. [ Links ]
5. Albuquerque D, Stice E, Rodríguez-López R,Manco L, Nóbrega C. Current review of genetics of human obesity: from molecular mechanisms to an evolutionary perspective. Mol Genet Genomics. 2015 Aug;290(4):1191-221. doi: 10.1007/s00438015-1015-9. [ Links ]
6. Brandao B, Guerra B, Mori M. Shortcuts to afunctional adipose tissue: The role of small noncoding RNAs. Redox Biology. (2017);12:82–102. [ Links ]
7. Corella D, Coltell O, Ordovás M. Genetics and epigenetics of obesity. An Real Acad Farm. 2016;82 Special Issue:129-36. [ Links ]
8. Casanello P, Krause B, Castro-Rodriguez J,Uauy R. Epigenética y obesidad. Rev Chil Pediat. 2016;87(5):335-42. [ Links ]
9. Dhasarathy A, Roemmich J, Claycombe K.Influence of maternal obesity, diet and exercise on epigenetic regulation of adipocytes. Mol Aspects Med. 2017 April;54:37–49. doi:10.1016/j. mam.2016.10.003. [ Links ]
10. Pérez-Pérez A, Vilariño-García T, Fernández-Riejos P, Martín-González J, Segura-Egea JJ,Sánchez-Margalet V. Role of leptin as a linkbetween metabolism and the immune system. Cytokine Growth Factor Rev. 2017 Mar 4. pii: S1359-6101(16)30163-0. doi: 10.1016/j.cytogfr.2017.03.001. [ Links ]
11. Saed S, Butt T, Anwer M, Arsian M, Froget P. High prevalence of leptin and melanocortin-4 receptor gene mutations in children with severe obesity from Pakistani consanguineousfamilies - Molecular Genetics and Metabolism. May 2012;106(1):121–6. DOI: http://dx.doi.org/10.1016/j.ymgme.2012.03.001. [ Links ]/
12. Funcke JB, von Schnurbein J, Lennerz B, Lahr G, l Debatin KM, Fischer-Posovszky P, et al. Monogenic forms of childhood obesity due to mutations in the leptin gene. Molecular and Cellular Pediatrics. 2014, http://www.molcellped.com/content/1/1/3. [ Links ]
13. González Jiménez E, MJ. Aguilar Cordero MJ, Padilla López CA, García García I. Obesidad monogénica humana: papel del sistema leptinamelanocortina en la regulación de la ingesta de alimentos y el peso corporal en humanos. An Sist Sanit Navar. 2012;35(2):285-93. [ Links ]
14. Sadaf Farooqi I, Wangensteen T, Collins, S,Kimber W, Matarese G, Keogh JM, et al. Clinical and molecular genetic spectrum of congenital deficiency of the leptin receptor. N Engl J Med. 2007;356:237-47. [ Links ]
15. van der Klaauw AA, von dem Hagen EA, Keogh JM, Henning E, O’Rahilly S, Lawrence AD, et al. Obesity-associated melanocortin-4 receptormutations are associated with changes in thebrain response to food cues. J Clin Endocrinol Metab. 2014 Oct;99(10):E2101-6. doi: 10.1210/ jc.2014-1651.
16. Yazdi FT, Clee SM, Meyre D. Obesity genetics in mouse and human: back and forth, and back again. PeerJ. 2015 Mar 24;3:e856; DOI 10.7717/peerj.856. [ Links ]
17. Parente DJ, Garriga C, Baskin B, Douglas G, Cho MT, Araujo GC, et al. Neuroligin 2 nonsense variant associated with anxiety, autism, intellectualdisability, hyperphagia, and obesity. Am J Med Genet A. 2017 Jan;173(1):213-6. [ Links ]
18. Angulo MA, Butler MG, Cataletto ME. Prader-Willi syndrome: a review of clinical, genetic, and endocrine findings. J Endocrinol Invest. 2015Dec;38(12):1249-63. [ Links ]
19. Bueno M, Esteba-Castillo S, Novell R, Giménez-Palop O, Coronas R, Gabau E, et al. Lack of postprandial peak in brain-derived neurotrophic factor in adults with Prader- Willi Syndrome. PloS One. 2016 Sep 29;11(9):e0163468. doi: 10.1371/journal.pone.0163468. [ Links ]
20. Miller JL, Tamura R, Butler MG, Kimonis V, Sulsona C, Gold JA, et al. Oxytocin treatment in children with Prader-Willi syndrome: A double-blind,placebo-controlled, crossover study. Am J Med Genet A. 2017 May;173(5):1243-50. [ Links ]
Conflictos de interés: Ninguno.
Correspondencia:
María Isabel Quiroga-de Michelena
Recibido: 26 febrero 2017
Aprobado: 22 abril 2017