Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.78 no.2 Lima Apr./Jun. 2017
http://dx.doi.org/10.15381/anales.v78i2.13222
CASO CLÍNICO
Trasplante renal grupo sanguíneo ABO incompatible. Experiencia colaborativa inédita España y Perú
Incompatible ABO blood group renal transplant. Unprecedented collaborative experience between Spain and Peru
Pedro Méndez-Chacón1,2, Fernando Bardales 2, Ausberto Chunga3, Carla Méndez Chacón4, ArmandoVidalón Fernández1,2, Fritz Diekmann5, Federico Oppenheimer5, Josep María Campistol5
1 Profesor Principal, Facultad de Medicina Humana, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Médico Asistente, Departamento de Nefrología, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
3 Médico Asistente, Laboratorio de Histocompatibilidad, Hospital Nacional Edgardo Rebagliati Martins, Lima, Perú
4 Médico Asistente, Servicio de Patología Clínica, Instituto Nacional de Salud del Niño, Lima, Perú
5 Médico Asistente, Servicio de Nefrología y Trasplante renal, Hospital Clínic, Universidad de Barcelona, España
Resumen
La incompatibilidad de grupo sanguíneo ABO y la sensibilización al HLA constituyen grandes barreras a vencer en pro de la óptima utilización de riñones de donante vivo. Describimos en nuestro medio el primer trasplante renal exitoso ABO incompatible en un paciente de 24 años, retrasplantado renal, altamente sensibilizado (PRA: 89%) y sin opción alguna en disponer de donantes cadavéricos ni familiares. Sin embargo, su único donante vivo HLA compatible era de grupo sanguíneo A incompatible con el grupo O del receptor. El paciente requirió de un régimen precondicionante consistente en recambios plasmáticos, rituximab, imunoglobulina y terapia inmunosupresora cuádruple, a fin de reducir los títulos elevados de isoaglutininas anti A de 1:128 a niveles de seguridad de 1:8, para el éxito del trasplante. Este fue realizado en Coordinación con la Unidad de Trasplante Renal del Hospital Clínic de Barcelona España (HCB). La ausencia de rechazo mediado por isoaglutininas muestra el potencial beneficio del protocolo al remover los anticuerpos anti grupo sanguíneo. A los dos años del trasplante, la función renal se mantiene estable con niveles de creatinina 1,5 mg%. Concluimos que el trasplante renal ABO incompatible (ABOi) es opción viable para pacientes cuyo único donante sea grupo sanguíneo incompatible, y entre nosotros representa esperanzadora fuente de órganos.
Palabras clave: ABO Incompatible; Trasplante Renal; Acomodación; Anticuerpos anti HLA; Riesgo Inmuno lógico.
Abstract
ABO blood group incompatibility and HLA sensitization are major barriers that need to be overcome in order to make optimum use of kidneys from living donors possible. We report the first successful ABO- incompatible kidney transplant in a 24-year old, highly sensitized (panel reactive antibodies (PRA) 89% kidney retransplantation patient, who lacked any option to get a cadaveric or family donor. However, the patient’s sole HLA-compatible living donor had group A blood incompatible with the recipient’s O blood group. The < patient required a pre-conditioning regime that consisted of plasma exchange, rituximab, immunoglobulin, and quadruple immunosuppressive therapy in order to reduce high titers of anti-A isoagglutinins from 1:128 to a safe level of 1:8, for successful transplant. This was performed in coordination with the Renal Transplant Unit of Hospital Clinic de Barcelona (HCB), Spain. Absence of rejection mediated by isoagglutinins shows the potential benefit of a protocol consisting in removing antibodies from the anti-blood group. Two yearsafter transplantation, the kidney function remains stable, with creatinine levels of 1.5 mg%. We conclude that an ABO-incompatible kidney transplant is a viable option for patients whose only donor has blood of an incompatible blood group and for us this represents a hope-inspiring source of organs .
Keywords: ABO Incompatibility; Kidney Transplantation; Accommodation; HLA antibodies; Immunological Risk.
INTRODUCCIÓN
A pesar de los esfuerzos en incrementar la conciencia de la población acerca de la donación de órganos en el Perú, la brecha entre pacientes que esperan trasplante renal versus órganos disponibles se encuentra en continuo aumento (1). El número de donantes cadavéricos por año no ha cambiado apreciablemente en la última década y los intentos por disminuir esta brecha justifican la necesidad de impulsar programas con donante vivo (DV), siendo la principal barrera encontrada en estos la incompatibilidad de grupo sanguíneo ABO (2). Históricamente, esta incompatibilidad ha sido considerada contraindicación absoluta para trasplante renal (Tx) (3) y cuando era realizado inadvertidamente, se observaba la rápida y temprana pérdida del injerto, debido a rechazo mediado por anticuerpos anti grupo sanguíneo (4-6). Esto requirió la necesidad de impulsar protocolos consistentes en remover los anticuerpos anti grupo ABO previos al trasplante renal (7,8), promoviendo minimizar e individualizar éstas terapias (9,10). En las dos últimas décadas, el Tx renal ABO incompatible (ABOi) alcanza remarcable éxito clínico en los grupos de trasplante. Los estudios revelan que la tasa de sobrevida de injertos de Tx renal ABO compatible (ABOc) y ABOi a 5 años son equivalentes (5,11-13). La continua inhabilitación de potenciales donantes vivos ABOi constituye preocupación en nuestro medio; un tercio 1,128de potenciales DV son descartados por presentar grupo sanguíneo incompatible 1,64 (14,15)
En este estudio reportamos el caso de un paciente que recibió un retrasplante renal exitoso de donante con alto grado de compatibilidad HLA, pero con incom- patibilidad de grupo sanguíneo ABO, de otra manera improbable el trasplante dada su condición de altamente sensibilizado.
CASO CLÍNICO
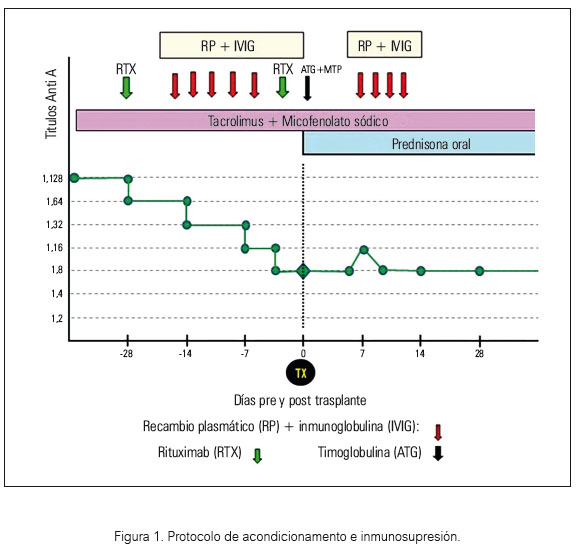
Paciente de 24 años con antecedente de enfermedad renal crónica terminal por uropatía obstructiva congénita, grupo sanguíneo O. Recibió hemodiálisis (2009) y luego diálisis peritoneal (2010). Sometido a binefrectomía laparoscópica y paratiroidectomía secuencial en evaluación pretrasplante. En enero 2011 accedió a primer trasplante renal con donante cadavérico, cursando con disfunción primaria del injerto por trombosis a rechazo vascular agudo. Requirió de transfusiones múltiples durante la injertectomía. Los estudios panel reactive antibodies (PRA) por técnica de fase sólida (luminex) revelaron anti HLA clase I 84% y anti HLA clase II 89%. Con estudios de crossmatch citotoxicidad dependiente de complemento (CDC) y citometría de flujo positivos más presencia de anticuerpos donante específico en test luminex single antigen, se descartaron donantes cadavéricos y 7 donantes vivos relacionados. Similares estudios realizados con su progenitora fueron negativos, excepto incompatibilidad del grupo sanguíneo ABO (receptor grupo O y donante grupo A2), expresado por altos niveles de isoaglutininas anti A (Ig M 128 e Ig G 128). El tipaje de antígenos leucocitarios humanos (HLA ) de la donante (48 años de edad) A 2, 31, B 39, 64, DR4/-, DQ8 y el tipaje HLA del receptor A 1, 2, B35, 39, DR 4, DR 9, DQ 8, DQ 9 mostraron alta compatibilidad. El protocolo de acondicionamiento / quirúrgico fue llevado a cabo en el H ospital Clínic de Barcelona (HCB).
La terapia de desensibilización pretrasplante renal consistió en nueve recambios plasmáticos más inmunoglobulina endovenosa y doble dosis de rituximab previo a la cirugía. El esquema inmunosupresor se inició un mes anterior a la cirugía e incluía micofenolato sódico, tacrolimus y dosis baja de esteroides. Los títulos basales de isoaglutininas anti A2 (IgM 128 e IgG 128) descendieron a niveles de seguridad en el día del trasplante (anti A2: IgG 4 e IgM 8). Hubo requerimiento de 4 recambios plasmáticos en el postoperatorio inmediato por presentar rebote de isoaglutininas y disfunción leve del injerto renal (figura 1).
La timoglobulina fue usada como terapia inmunosupresora inductiva y como mantenimiento: tacrolimus, micofenolato sódico y prednisona.
Después de discutir los riesgos y beneficios del trasplante ABO incompatible, la donante (madre) dio consentimiento a los estudios pretrasplante y demás, pro-cediéndose a la nefrectomía izquierda vía laparoscópica transvaginal. El postoperatorio fue correcto, siendo dada de alta al cuarto día con valor de creatinina sérica 0,93 mg%.
La cirugía en el intraoperatorio del receptor no tuvo incidencias. En el postoperatorio inmediato presentó oligoanuria asociada a uretero-hidronefrosis, por lo que requirió reimplante ureteral y además transfusión de hemoconcentrados por hematoma perirrenal. En el monitoreo de isoaglutininas durante las primeras dos semanas del postrasplante, se detectó leve rebote de los niveles de isoaglutininas (IgG 16, IgM 8) asociado a disfunción renal (creatinina 1,4 a 1,7 mg%). Se ajustó la dosis de tacrolimus y se realizaron 4 recambios plasmáticos con resultado exitoso. Los parámetros funcionales del injerto se llevaron a cabo mediante dosajes de la creatinina sérica, depuración de creatinina corregida y proteinuria de 24 horas. Durante el segundo año postrasplante, la creatinina se mantuvo en 1,50 mg%, depuración de creatinina 75 mL/min y proteinuria 68 mg/24 h. Los anticuerpos antigrupo sanguíneo fueron regularmente monitorizados durante esta etapa y los niveles fueron equivalentes al pretrasplante. No hubo eventos infecciosos ni inmunológicos. La profilaxis antiinfecciosa fue en base a sulfametoxazol (6 meses) y valganciclovir (3 meses).
DISCUSIÓN
En los últimos años se están utilizando nuevas fuentes de órganos para poder paliar la falta de donantes cadavéricos y minimizar el incesante incremento de pacientes en lista de espera (16). La significante carencia de órganos prolonga el tiempo de espera, sobre todo en pacientes altamente sensibilizados a antígenos HLA como el presente caso y peor aun si es de grupo sanguíneo O. Estos pacientes con PRA mayor de 80%, no encontrarán fácilmente riñón HLA compatible y estarán por tanto mayor tiempo en lista de espera (17-19). No obstante los protocolos de desensibilización, no parecen aumentar las posibilidades de encontrar donantes idóneos (20). La mayoría de los centros de trasplante de órganos en el mundo desarrollan protocolos de desensibilización y programas de trasplante renal cruzado como una alternativa para estos casos (17,18,21). Nuestro paciente de 24 años con PRA 89%, consecuencia de eventos sensibilizantes vía transfusiones sanguíneas recibidas (22) y trasplante renal previo (23), lo ubicaron en situación biológica desventajosa, obligando a permanecer más de cinco años en espera de un riñón HLA compatible. El pronóstico durante el tiempo de espera se agravó aun más por tasa deficiente de donantes cadavéricos en Perú (2,9 pmp/a) (18), con donantes cada vez más añosos (30% con edad > de 50 años) (24,25) no recomendables para receptores jóvenes como el nuestro. Revisando nuestra actividad trasplantadora, solo tres (0,89%) con PRA>80% de 304 pacientes accedieron al trasplante renal en el período 20022011, contrastando (38 de 430, 9%) con el número de pacientes hiperinmunizados en nuestra lista de espera. Datos de united network for organ sharing (UNOS) de EE UU (2001-2008) reportan tasas de trasplante renal según valores de PRA, 16% para pacientes con PRA 10% a 80% y 8% para aquellos con PRA >80% (18). Si comparamos con nuestra serie, es evidente que el porcentaje de nuestros pacientes altamente sensibilizados están destinados a permanecer en lista de espera por periodos más prolongados (18). Los sujetos con cualquier nivel de sensibilización son difíciles de acceder con éxito a un trasplante renal (26-28). Por ello reciben puntos adicionales en los sistemas de asignación en algunos centros de trasplante, para compensar su desventaja biológica (27,44,45), priorizando el acceso al trasplante.
Cuando se genera un donante cadavérico de órganos, nuestra Institución refiere los riñones en base a un sistema de puntaje, que incluye edades del donante-receptor, histocompatibilidad (sistema HLA), tiempo de espera y grado de sensibilidad del receptor (PRA >80%), ponderado en porcentajes de 25%, 25%, 25% y 10%, respectivamente, puntaje injusto para nuestros casos hipersensibilizados. La carencia de donantes idóneos para nuestro paciente se hizo evidente en los potenciales donantes ABO compatibles (donantes cadavéricos y 7 de familiares) que cursaban con antígenos HLA inaceptables, crossmatch CDC positivos y variados anticuerpos HLA donante especifico presentes; biomarcadores considerados históricamente como contraindicación absoluta para el Tx renal (19). La madre, de 48 años de edad, era la única que presentaba antígenos HLA aceptables, con crossmatch CDC y citometría de flujo negativos. Por tanto, no había serio problema de HLA incompatible para este paciente hiperinmunizado, pero cursaba con la barrera inmunológica de incompatibilidad del grupo sanguíneo ABO. Desde hace 30 años esta barrera ha dejado de ser contraindicación absoluta en los centros trasplantadores(16), para convertirse en realidad posible. Los investigadores continúan reportando estrategias a fin de remover los anticuerpos preformados anti grupo sanguíneo previniendo resíntesis o rebote de anticuerpos (29), logrando con ello derribar la barrera de la incompatibilidad de grupo sanguíneo. Desde Alexandre y colaboradores (año 1987) hasta la experiencia del grupo japonés de Tanabe e Ichumua (38) , la americana de Montgomery y Gloor, la sueca de Tyden y la experiencia española de Oppenheimer(30), reportan resultados exitosos en sus respectivos programas de Tx renales ABO incompatibles, comparables a los trasplantes renales ABO compatibles. Sus protocolos han ido variando a lo largo de la historia (16), involucrando recambios plasmáticos en vez de inmunoadsorción, rituximab en sustitución de la esplenectomía (31), uso de inmunoglobulinas, que aunado a las drogas inmunosupresoras logran que los niveles de títulos de isoaglutininas desciendan a niveles de seguridad (16). Los centros evalúan diversas técnicas de determinación de isoaglutininas, dado que su exacta medición es determinante para el monitoreo de la desensibilización (32). Los títulos iníciales de anticuerpos naturales anti-A2 (Ig G 1/128, Ig M 1/128) presentes en el paciente, requerían un número mayor de sesiones de recambio plasmático para alcanzar niveles de seguridad aceptables previo al trasplante (menor de 1/8) (33). La mayoría de centros identifica un nivel de título de corte para exclusión de candidatos potenciales (9) y eligen por ejemplo como 1/8 el límite superior aceptable para el día del trasplante. Se observa que los receptores grupo sanguíneo O que reciben órgano de grupo sanguíneo A2, característicamente son los que tienen mayores niveles de anticuerpos anti A2. Por ello son considerados receptores de alto riesgo inmunológico(5), requiriendo acondicionamiento intensivo (34). El mantenimiento de niveles bajos de isoaglutininas durante el periodo temprano del postras-plante es crítico para la seguridad del injerto y en el caso del paciente se evidenció leve rebote de isoaglutininas en el día 4 (IgG 4 a 16) asociado a incremento de niveles de creatinina (1,2 a 1,7 mg%) (36). La mayoría de pérdidas de injertos por rechazo mediado por anticuerpos ocurre en los tres primeros meses del post-Tx; por tanto es importante estar atentos al rebote de títulos de anticuerpos anti-ABO en esta etapa (7,13,23,35). En nuestro caso, no se desarrolló rechazo mediado por anticuerpos a pesar del rebote (36), y gracias a la aféresis postrasplante instaurada prontamente de tres recambios plasmáticos fue beneficiosa la evolución. La individualización de los protocolos de desensibilización minimizando el número de sesiones de recambios plasmáticos es la tendencia recomendable (9). Actualmente, evitar la esplenectomía es relevante en los protocolos, por las complicaciones que conlleva, y solo se reserva para un pequeño número de pacientes como terapia de rescate en rechazos mediados por anticuerpos de intensidad severa (5,33). La plasmaféresis más que la inmunoadsorción es recomendada sobre todo para pacientes sensibilizados a fin de remover los anticuerpos anti-HLA y los anticuerpos anti-ABO, como en nuestro caso (13,26,32,37).
La timoglobulina fue la droga utilizada en la terapia de inducción del paciente, indicada mayormente por ser receptor retrasplantado e hiperinmunizado (39). Con el advenimiento del micofenolato sódico y tacrolimus administrados semanas previas al trasplante (29), se logró alcanzar mayor efectividad en la prevención del rechazo agudo humoral (5) y es preciso notar que anterior a la utilización de estas drogas ningún paciente alcanzó el estado de acomodación en injertos ABOi. Esto a la postre constituye la base para el éxito total del trasplante renal ABOi, no resuelto anteriormente con la combinación de ciclosporina y azatioprina (30,40). En el reporte de seguimiento más prolongado de casos publicados por Japón, no se encontró diferencia alguna en la sobrevida de pacientes e injertos entre receptores de DV ABOi y ABOc (33). La tasa actual de sobrevida para injertos ABO-I de DV sobrepasa el 90% a 10 años del trasplante (36), atribuible a la aparente resistencia del injerto al rechazo humoral, no obstante la presencia permanente de anticuerpos circulantes, estado llamado de acomodación (40,41). Los títulos de anticuerpos anti A2 en el paciente permanecieron estables a niveles bajos (<1:8) durante el primer año del pos Tx, similares a los previos a la intervención y sin evidencia de compromiso renal (20,39).
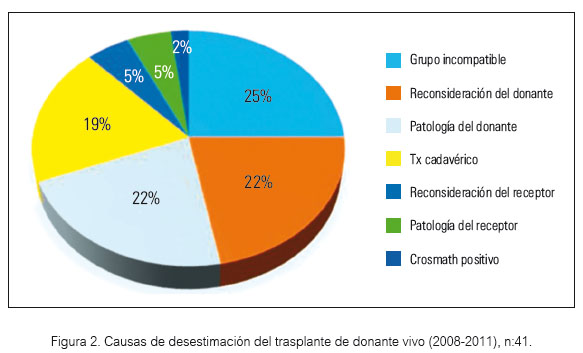
Frente a la carencia de donantes cadavéricos jóvenes para receptores jóvenes como el presente caso (21), desarrollamos un programa de trasplante renal con donante vivo (DV) relacionado, logrando realizar 44 (20%) de 215 Tx renales en el período 2008-2011 (figura 2). Llama la atención que exista una no despreciable cantidad de potenciales DV incompatibles con el receptor, siendo la principal causa la incompatibilidad del grupo sanguíneo (23,33). En varias ocasiones los miembros de la familia estuvieron llanos a donar, pero debido a los grupos sanguíneos diferentes fueron descartados para el receptor (42). El mayor obstáculo en Tx renal de DV es el grupo sanguíneo ABO, tal como se reporta en la literatura; 30 a 35% de los donantes vivos no acceden debido a la incompatibilidad ABO (42). En el mismo período desestimamos 41 potenciales DV, de los cuales el 25% correspondió a incompatibilidad de grupo sanguíneo con el receptor (figura 2).
En la distribución de grupos sanguíneos de nuestros pacientes en hemodiálisis, 74% correspondieron al grupo sanguíneo O, 17% al grupo A, 8% al grupo B y 1% al grupo sanguíneo AB. Está demostrado estadísticamente con un 35% de probabilidad que cualquiera de dos individuos en una población son ABO incompatibles (23); por tanto es previsible en nuestro programa de Tx con DV, la presencia constante de pares donante-receptor con incompatibilidad de grupo sanguíneo (mayoritariamente grupo O versus A) y que de superar esta barrera se contribuiría a mitigar la escasez de órganos (21). Este reporte describe la experiencia inicial, en colaboración con el HCB, de un paciente cuyo estado de sensibilización constituía barrera significante en nuestro medio para acceder al Tx renal(18), que luego de explorar otras opciones sin encontrar el donante adecuado, se trasplanta exitosamente con donante incompatible del grupo ABO. Con esta experiencia colaborativa internacional e inédita entre nosotros, consideramos que el Tx renal ABO incompatible puede incorporarse al arsenal de nuestras técnicas de Tx (16,23,43), paliando la carencia de órganos y venciendo prejuicios en nuestro personal médico con este novísimo procedimiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Méndez P, Camacho M, Vidalón A. Trasplante y comercio de órganos en Perú. Nefrología. 2006;26(5):527-37. [ Links ]
2. Montgomery RA, Simpkins CE, Segev DL. New options for patients with donor incompatibilities.Transplantation. 2006;(2):164-5. doi:10.1097/01. tp.0000226105.42713.37. [ Links ]
3. Genberg H, Kumlien G, Wennberg L, Tydén G. Long-term results of ABO-incompatiblekidney transplantation with antigen-specificimmunoadsorption and rituximab. Transplantation. 2007;84(12s):s44-s47. doi: 10.1097/01. tp.0000296031.41424.f8. [ Links ]
4. Fidler ME, Gloor JM, Lager DJ, Larson TS, GriffinMD, Textor SC, et al. Histologic findings of antibody-mediated rejection in ABO blood-groupincompatible living-donor kidney transplantation. AJT. 2004;4(1):101–7. Doi:10.1046/j16006135.2003.00278.x. [ Links ]
5. Koo TY, Yang J. Current progress in ABO-incompatible kidney transplantation. Kidney Res clin practice. 2015;34(3):170–9. doi:10.1016/j.krcp.2015.08.005 [ Links ]
6. Yung GP, Valli PV, Starke A, Mueller RJ, Fehr T, Cesar-Ozpamir M, et al. Flow cytometric measurement of abo antibodies in abo-incompatibleliving donor kidney transplantation. Transplantation. 2007;84(12s):s20-s23. doi: 10.1097/01. tp.0000296646.17845.12. [ Links ]
7. Haas M, Segev DL, Racusen LC, BagnascoSM, Locke JE, Warren DS, et al. C4d deposition without rejection correlates with reduced earlyscarring in ABO-incompatible renal allografts. JASN. 2009;20(1):197-204. doi: 10.1681/asn.2008030279. [ Links ]
8. Geyer M, Donauer J, Pisarski P, Drognitz O, Schulz-Huotari C, Wisniewski U, et al. Preemptive postoperative antigen-specific immunoadsorptionin abo-incompatible kidney transplantation: necessary or not?. Transplantation. 2007;84(12s):s40 - s43. doi: 10.1097/01.tp.0000296021.72977.3b. [ Links ]
9. Gelpi R, Cid J, Lozano M, Revuelta I, Sanchez-Escuredo A, Blasco M, et al. Desensitization inABO- Incompatible kidney transplantation withlow ABO isso –agglutinin titers. Transplantationproceedings.2015;47:2340-3. Doi: 10.1016/j. transproceed.2015.08.021. [ Links ]
10. De Weers AE, Aqteren MV, Leebeek FW, IjzermansJN, Weimar W, Betjes M. ABO incompatible kidneytransplant recipients have a higher bleeding risk after antigen-specific immunoadsorption. Transplant internat. 2015;28:25-33. doi: 10.1111/tri.12412. [ Links ]
11. Kenmochi T, Saigo K, Maruyama M, Akutsu N, Iwashita C, Otsuki K, et al. Results of kidney transplantation from abo-incompatible living donors in a single institution. Transplantation proceedings.2008;40(7):2289–91. doi:10.1016/j.transproceed.2008.06.039. [ Links ]
12. Barnett N, Nightingale A, Maggs T, Needs M, Williams E, Curran D, et al. High anti-a titres may not preclude ABO-incompatible renal transplantation: an autoantibody could be the culprit. Nephroldial transplant. 2010;25(11):3794-6. doi: 10.1093/ndt/gfq451. [ Links ]
13. Sonnenday CJ, Warren DS, Cooper M, Samaniego M, Haas M, King KE, et al. Plasmapheresis, cmv hyperimmune globulin, and anti-cd20 allow abo-incompatible renal transplantation withoutsplenectomy. Am J Transplant. 2004;4(8):1315-22.doi: 10.1111/j.1600-6143.2004.00507.x. [ Links ]
14. Muramatsu M, Gonzales HD, Cacciola R, Aikawa A, Yaqoob MM, Pullatti C. ABO incompatible renal transplants: Good or bad? World J Transplant.2014;4(1):18-29. Doi: 10.5500/wjt.v4.i1.18. [ Links ]
15. Yabu JM, Fontaine MJ. ABO incompatible living donor kidney transplantation without post transplant therapeutic plasma Exchange. J Clinl Apheresis. 2015;30:340-6. Doi: 10.1002/jca.21390. [ Links ]
16. Oppenheimer F, Revuelta I, Serra N, Lozano M, Gutiérrez-Dalmau A, Esforzado N, et al. Trasplanterenal ABO incompatible: de un sueño a una realidad. Experiencia del hospital clínic de Barcelona. Nefrología. 2010;30(1):54-63. [ Links ]
17. Del Bello A, Congy N, Sallusto F, Cardeau- Desangles I, Fort M, Esposito L, et al. Anti humanleukocyte antigen immunization after early allograftnephrectomy. Transplantation. 2012;93 (9):936-41. [ Links ]
18. Jordan SC, Vo AA, Peng A, Toyoda M, Tyan D. Intravenous gammaglobulin (IVIG): a novel approachto improve transplant rates and outcomes in highlyhla-sensitized patients. AJT. 2006;6(3):459–66.doi: 10.1111/j.1600-6143.2005.01214.x. [ Links ]
19. Marfo K, Lu A, Ling M, Akalin E. Desensitization protocols and their outcome. CJASN. 2011;6(4):922 36. doi: 10.2215/cjn.08140910. [ Links ]
20. Rostaing L, Kamar N. Can we prevent donorspecific antibodies from developing after ABO-incompatible kidney transplantation? Kidneyint. 2014;85(2):245-7. doi: 10.1038/ki.2013.425. [ Links ]
21. Domínguez-Gil B, De La Oliva M, Escobar EM,García M, Cruzado JM, Pascual J, et al. Situación actual del trasplante renal de donante vivo enEspaña y otros países: pasado, presente y futurode una excelente opción terapéutica. Revista nefrología. 2010;30(2):3-13. Doi: 10.3265/nefrología. pre2010-nov-10686. [ Links ]
22. Scornik JC, Meier-Kriesche HU. Blood transfusions in organ transplant patients: mechanisms of sensitization and implications for prevention.AJT. 2011;11(9):1785–91. doi: 10.1111/j.16006143.2011.03705.x. [ Links ]
23. Magee CC, Mah H, Tinckam K, Wood I, Fang JI , Powelson J. Successful living donor kidney transplantation across hla and abo incompatibilities.NDT. 2007;22 (2):602-4. Doi:10.1093/ndt/gf1696. [ Links ]
24. Noppakun K, Cosio FG, Dean PG, Taler SJ, Wauters R, Grande JP. Living donor age and kidney transplant outcomes. AJT. 2011;11(6);1279-86.doi: 10.1111/j.1600-6143.2011.03552.x. [ Links ]
25. Ferrari P, Lim W, Dent H, Mcdonald SP. Effect of donor–recipient age difference on graft functionand survival in live-donor kidney transplantation. Nephrol dial transplant. 2011;26:702-8.doi: 10.1093/ndt/gfq383. [ Links ]
26. Won D, Choe W, Kim HJ, Kwon SW, Han DJ, Park SK. Significance of isoagglutinin titer in abo incompatible kidney transplantation. Journal CLin apheresis. 2014;29(5):243-50. DOI: 10.1002/jca.21312. [ Links ]
27. Cecka JM. Calculated PRA (CPRA): the newmeasure of sensitization for transplant candidates. AJT. 2010;10 (1):26–9. doi: 10.1111/j.16006143.2009.02927.x. [ Links ]
28. Santos C, Costa R, Malheiro J, Pedroso S, Almeida M, Martins LS, et al. Kidney transplantation across a positive crossmatch: a single center experience. Transplantation Proceedings. 2014;46 (6):1705-9. doi: http://dx.doi.org/10.1016/j.transproceed.2014.05.012. [ Links ]
29. Galliford J, Charif R, Chan KK, Loucaidou M, Cairns T, Cook HT, et al. ABO incompatible living renal transplantation with a steroid sparing protocol. Transplantation. 2008;86(7):901-6. doi: 10.1097/ tp.0b013e3181880c0f. [ Links ]
30. Wennberg L, Genberg H, Tyden G. Preapheresis immunosuppressive induction: necessary or harmful. Transplantation. 2007;84(12):37-9. doi: 10.1097/01.tp.0000296020.08129.51. [ Links ]
31. Tydén G, Donauer J, Wadström J, Kumlien G, Wilpert J, Nilsson T, et al. Implementation of a protocolfor ABO-incompatible kidney transplantation--athree-center experience with 60 consecutive transplantations. Transplantation. 2007;83(9):1153-5. [ Links ]
32. Kim HJ, Jung HY, Choi JY, Cho JH, Park SH, Kim YL, et al. Application of flow cytometry to measureanti-A/B antibody in ABO-incompatible kidneytransplantation. Transplantation proceedings.2015;47(3):591-5. doi:10.1016/j.transproceed.2014.11.046. [ Links ]
33. Flint SM, Walker RG, Hogan C, Haeusler MN, Robertson A, Francis DM, et al. Successful ABO-incompatible kidney transplantation with antibody removal and standard immunosuppression.AJT. 2011; 11(5):1016–24. doi:10.1111/j.16006143.2011.03464.x. [ Links ]
34. Oettl T, Halter J, Bachmann A, Guerke L, Infanti L, Oertli D, et al. ABO blood group-incompatible living donor kidney transplantation: a prospective, single-centre analysis including serial protocol biopsies. NDT. 2009;24(1):298-303. doi: 10.1093/ ndt/gfn478. [ Links ]
35. Sawada T, Fuchinoue S, Teraoka S. Successful A1-to-O ABO-incompatible kidney transplantationafter a preconditioning regimen consisting of anticd20 monoclonal antibody infusions, splenectomy,and double-filtration plasmapheresis. Transplantation. 2002;74(9):1207-10. Doi: 10.1097/01.tp.0000040990.15896.76. [ Links ]
36. Ishida H, Kondo T, Shimizu T, Nozaki T, Tanabe K. Postoperative rebound of antiblood type antibodiesand antibody-mediated rejection after ABO-incompatible living-related kidney transplantation. Transpl Int. 2015;28(3):286-96. doi: 10.1111/tri.12482. [ Links ]
37. Warren DS, Zachary AA, Sonnenday CJ, KingKE, Cooper M, Ratner LLE, et al. Successfulrenal transplantation across simultaneous ABOincompatible and positive crossmatch barriers. AJT. 2004;4(4):561–8. Doi:10.1111/j.16006143.2004.00364.x. [ Links ]
38. Kazunari T. Japanese experience of ABO-incompatible living kidney transplantation. Transplantation. 2007;84(12s):s4-s7. doi: 10.1097/01.tp.0000296008.08452.4c. [ Links ]
39. Silvestre C, Furian L, Marson P, TisonT, Valente M, Marchini F, et al. Desensitizationwith plasmapheresis and anti-Cd20 for ABO incompatible kidney transplantation from livingdonor: experience of a single center in Italy. [ Links ]
40. Ishida H, Miyamoto N, Shirakawa H, ShimizuT, Tokumoto T, Ishikawa N, et al. Evaluation ofimmunosuppressive regimens in abo-incompatibleliving kidney transplantation - single center analysis. AJT. 2007;7(4):825–31. doi: 10.1111/j.16006143.2006.01676.x. [ Links ]
41. Tanabe T, Ishida H, Horita S, Yamaguchi Y, TomaH, Tanabe K. Decrease of blood type antigenicityover the long-term after abo-incompatible kidney transplantation. Transpl immunol. 2011;25(1):1-6. doi: 10.1016/j.trim.2011.05.002. [ Links ]
42. Pandey P, Tiwari AK, Sharma J, Dixit S, Raina V. Plasmapheresis as preconditioning protocol in an extremely high titer ABO incompatible renal transplant (ABOiRTx) case: A new prospect forchronic kidney disease patients in India. Transfus Apher Sci. 2013;49(1):84-6. doi: 10.1016/j.transci.2012.09.010. [ Links ]
43. Schwartz Jason, Stegall MD, Kremers WK,Gloor J. Complications, resource utilization, and cost of abo-incompatible livingdonor kidney transplantation. Transplantation. 2006:82(2):155-63. doi: 10.1097/01. tp.0000226152.13584.ae. [ Links ]
44 . Gebel HM, Kasiske BL, Gustafson SK, Pyke J,Shteyn E, Israni AK, et al. Allocating deceased donor kidneys to candidates with high panel – reactiveantibodies. Clin J Am Soc Nephrol. 2016;11(3):50511. doi: 10.2215/CJN.07720715. [ Links ]
45. Israni AK, Salkowski N, Gustafson S, Snyder JJ, Friedewald JJ4 Formica RN. New national allocation policy for deceased donor kidneys in the United States and possible effect on patient outcomes. J Am Soc Nephrol. 2014;25(8):1842-8. doi: 10.1681/ASN.2013070784. [ Links ]
Correspondencia:
Pedro Méndez-Chacón
Dirección: Av. Caminos de Inca N 2439. Santiago de Surco. Lima
Conflictos de interés: Ninguno.
Fuente de financiamiento: Propio.
Recibido: 6 octubre 2016
Aceptado: 23 noviembre 2016