Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.78 no.3 Lima July/Sep 2017
http://dx.doi.org/10.15381/anales.v78i3.13762
ARTÍCULO ORIGINAL
Desarrollo embrionario preimplantacional, en ciclos de fecundación in vitro con ovodonación y estudio genético
Preimplantational embryo development in in vitro fertilization cycles with oocyte donation and genetic studies
Pamela Villanueva1,2,a, Jimmy Portella1,2,b, Rosmary López1,2,3,b, Nathaly Chávez1,2,b, Amalia Villalobos2,c, Luis Noriega-Hoces1,2,a, Luis Guzmán1,2,3,b
1 PRANOR, Grupo de Reproducción Asistida, Calle los Olivos 364, San Isidro, Lima, Perú
2 Clínica de Fertilidad Asistida Concebir, Calle los Olivos 364, San Isidro, Lima, Perú
3 Reprogenetics Latinoamérica, Av. Encalada 305, Santiago de Surco, Lima, Perú
a Médico
b Biólogo; c Obstetriz
Resumen
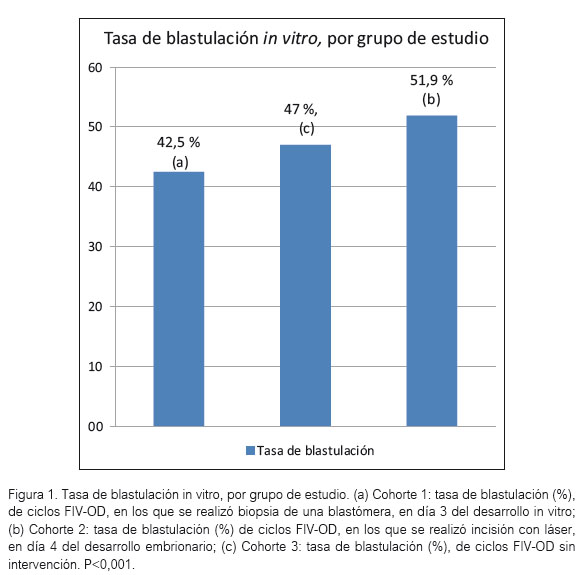
Introducción. Los estudios genéticos preimplantacionales son cada vez más utilizados con la esperanza de conseguir mejores tasas de implantación y nacido vivo, así como una disminución en la tasa de abortos; por ello resulta necesario analizar estos procedimientos. Objetivo. Evaluar el desarrollo preimplantacional in vitro con ovodonación y estudio genético Diseño. Cohortes retrospectivas. Lugar. Laboratorio Pranor, 20082013. Material. Ciclos de fecundación in vitro con ovodonación (FIV-OD). Intervenciones. Se evaluaron 2 077 ciclos de FIV-OD, los cuales fueron clasificados en tres cohortes: 1) ciclos con biopsia embrionaria en día 3, mediante una incisión en la zona pelúcida (ZP) embrionaria, para exéresis de una blastómera (n=527); 2) ciclos con incisión láser en día 4 del desarrollo embrionario, como parte del procedimiento para la biopsia de trofoblasto (n=131); y, 3) ciclos sin intervención (n=1 419). Principales medidas de resultado. Tasa de fecundación, tasa de blastulación. Resultados. No existió diferencia significativa en la tasa de fecundación de las 3 cohortes (75,0%, 74,6% y 75,9%, respectivamente, p=0,31). La tasa de blastulación en la cohorte 1 fue 42,5%, mientras que en la cohorte 3 fue 47% (RR=1,085; IC=1,051 a 1,120; p<0,0001). Adicionalmente, la cohorte 2 tuvo 51,9%, con una diferencia estadísticamente significativa de prevención del riesgo de no blastular con respecto a la cohorte 3 (RR=0,906; IC=0,851 a -0,965; p=0,0017). Conclusiones. El desarrollo preimplantacional hasta blastocisto puede mejorar cuando se utiliza el láser embrionario en día cuatro. Es necesario realizar más estudios para confirmar nuestros resultados.
Palabras clave: Desarrollo embrionario; Genética; Fertilización In vitro; Estudio Genético Preimplantacional.
Abstract
Introduction: Preimplantational genetic studies are used to achieve a better implantation rate and live birth, as well as to decrease the abortion rate; these techniques should be evaluated. Objective: To evaluate preimplantational embryo development in in vitro fertilization cycles with oocyte donation and genetic studies.. Design: Retrospective cohort study. Setting: Pranor Laboratory, 2008-2013. Material: In vitro fertilization with oocyte donation (IVF-OD) cycles. Interventions: 2 077 cycles of IVF-OD were evaluated, separated in 3 cohorts: Cohort 1, cycles with embryo biopsy on day 3, by means of an incision in the zona pellucida (ZP), for excision of a blastomer (n = 527); Cohort 2, cycles with a laser incision at day 4 of embryo development, for biopsy of the trophoblast in the blastocyst stage (n = 131) and; cohort 3, FIV-OD cycles without any intervention (n = 1 419). Main outcome measures: Fertilization rate, blastulation rate. Results: There was no difference in the fertilization rate among the three groups studied (75.0%, 74.6% and 75.9% respectively, p = 0.31). Blastulation rate in cohort 1, was 42.5%, whereas, in cohort 3, it was 47% (RR = 1.085, CI = 1.0511.120; p <0.0001). In addition, the rate for cohort 2 was 51.9%, with statistical significance, which prevents from non-blastulation risk compared with cohort 3 (RR = 0.906; IC = 0.851-0.965; p = 0.0017). Conclusions: Preimplantational embryo development would improve blastocyst formation when laser is performed on day 4. Further studies are needed to confirm our results.
Keywords: Embryo development; Genetics; In vitro Fertilization; Preimplantational Genetic Study.
INTRODUCCIÓN
Los tratamientos de reproducción asistida (TRA) han demostrado que la frecuencia de anomalías cromosómicas es alta en los embriones humanos (1-5), las que van desde 60% de embriones anormales en las mujeres menores de 35 años a 80% en las mujeres de 41 años a más (3,5). Esto no depende necesariamente de la fertilización in vitro (FIV), sino de nuestra especie tan selectiva para la reproducción. Debido a este motivo, se incluye cada vez con mayor frecuencia estudios de PGS (del inglés, preimplantati on geneti c screening) y PGD (del inglés, preimplantati onal genetic diagnosis), para aumentar la oportunidad de lograr un embarazo.
A nivel mundial, la primera técnica enser ampliamente utilizada para el PGS fue la biopsia en tercer día de desarrollo embrionario, para estudio mediante hibridación fluorescente in situ (FISH, de fl uorescence in situ hybridizati on). La principal limitante de esta técnica es que solo permite el estudio de 5 a 12 cromosomas y existen investigaciones actuales que identifican una disminución de la blastulación y del desarrollo embrionario (6,7).
Posteriormente, con el adelanto de la tecnología, se ha implementado el uso del láser embrionario, el cual parece no ser perjudicial para el embrión, lo que ha generado un interés en utilizar el PGS no solo para casos puntuales con un claro beneficio-como son la FIV en mujeres mayores y aquellas con pérdida recurrente del embarazo debido a aneuploidíassino que sea empleado de manera universal, para todas las FIV (7).
En el laboratorio PRANOR, la biopsia en día 3, para posterior PGS mediante FISH, fue abandonada hace muchos años, a la par de la mayoría de centros de fertilidad a nivel mundial, y en la actualidad se realiza una incisión en la zona pelúcida en día 4, con láser, para favorecer la realización de la biopsia en estadio de blastocisto; por lo que es de gran interés conocer los resultados de esta técnica.
En el presente trabajo, evaluamos los resultados del desarrollo embrionario a blastocisto utilizando ambas técnicas de biopsia para PGS, en el modelo de ovodonación, para anular el factor de edad materna.
MÉTODOS
El presente estudio de cohortes retrospectivas, fue realizado en el Laboratorio de Reproducción Asistida PRANOR, donde se evaluaron un total de 2 077 ciclos de FIV-OD, realizados entre enero de 2008 y diciembre de 2013. Se utilizó solo este periodo de estudio porque después cambiaron algunos medios y técnicas de cultivo embrionario, que constituirían un sesgo en la evaluación. Se incluyó todos los casos de FIV-OD que cumplieron con los criterios de inclusión y exclusión. Para anular el factor de la edad materna, todos los ciclos correspondieron a tratamientos de ovodonación (OD) anónima, con ovocitos frescos de mujeres cuya edad fluctuaba entre 24±4 años, exámenes de reserva ovárica normales y ciclos regulares, cariotipo normal, sin ningún antecedente de patologías ni exposición a sustancias tóxicas. Se excluyó los ciclos de pacientes donantes con ovocitos vitrificados.
Con respecto al varón, se excluyó los casos con antecedente de patología espermática severa y/o biopsia testicular, así como los ciclos de varones con antecedente de patología genética personal o familiar. No se incluyó los ciclos de varones cuya pareja hubiere tenido un embarazo previo que resultó en aborto por causa genética o nacimiento de un hijo con patología genética. Estos criterios tuvieron la finalidad de anular factores genéticos relacionados al varón, que podrían influenciar en el desarrollo embrionario.
Asimismo, el presente estudio solo incluyó el desarrollo preimplantacional hasta blastocisto, ya que por ser casos de ovodonación los resultados estarían influenciados por factores maternos del embarazo y no necesariamente por los procedimientos o por el embrión.
Las pacientes fueron clasificadas en 3 grupos: Grupo 1, ciclos de FIV-OD, en los que se había realizado biopsia de una blastómera, en día 3 del desarrollo in vitro (n=527); Grupo 2, ciclos de FIV-OD, en los que se realizó incisión con láser en día 4 del desarrollo embrionario, como parte del procedimiento para la biopsia de trofoblasto en estadio de blastocisto (n=131); y, Grupo 3, los ciclos FIV-OD sin ninguna intervención (n=1 419).
Con respecto al procedimiento, luego de la estimulación hormonal se procedió a la aspiración folicular y los ovocitos eran colectados en medio Global® w/HEPES (IVF online, Canadá) suplementado al 10% con suero sintético sustituto (SSS) (Irvine Scientific, USA). Posteriormente, fueron transferidos y cultivados en medio Global® for Ferti lizati on (IVF online, Canadá) suplementado al 10% SSS, bajo aceite mineral, a 37°C, en una atmósfera de 6,5% de CO2, 5% de O2 y 88,5% de N2. La inseminación se realizó de acuerdo a protocolos descritos previamente (8,9).
La biopsia en el grupo 1 se realizó en el día tres de desarrollo embrionario, en medio de biopsia PGD Biopsy Medium, IVF online, Canadá. Se utilizó una incisión en la zona pelúcida, con una solución de ácido Tyrode (IVF online, Canadá), y se retiró una célula con micropipeta. La blastómera fue expuesta a una solución hipotónica [0,075 mol/L KCl suplementada con 0,6% BSA (p/v)] y luego fijada con solución Carnoy sobre una lámina portaobjeto, para después ser sometida al análisis de PGS por hibridación fluorescente in situ (FISH), por un laboratorio de genética de referencia (9). Los embriones continuaron su cultivo a blastocisto.
El procedimiento para la biopsia en el grupo 2 se llevó a cabo en estadio de blastocisto, realizando en el día 4 de desarrollo in vitro una incisión de la zona pelúcida embrionaria con láser (Lykos; Hamilton Thorne, Beverly, ME, USA), en función multipulso (pulso / segundo = 7, duración del pulso = 150 μs), y posterior cultivo hasta el estadio de blastocisto, momento en el cual se realizó la biopsia del trofoblasto (10) para su posterior análisis de PGS por aCGH (11). Actualmente, se utiliza en el Laboratorio PRANOR este procedimiento para realizar PGS por secuenciamiento de última generación (NGS, de NextGenerati on Sequencing).
En los ciclos del Grupo 3 no se realizó PGS y, por lo tanto, ningún procedimiento de biopsia.
Los datos fueron recolectados de las historias clínicas físicas y corroborados mediante la base de datos computarizados ferencia a Microsoft Excel, para luego ser procesados estadísticamente con el software SPSS 21. El análisis estadístico fue realizado mediante el riesgo relativo (nivel de confianza 95%) y la prueba chicuadrado, con un valor de significancia estadística de p< 0,05. En el análisis se incluyó la tasa de fecundación para anular la presencia de un factor intrínseco embrionario previo a la biopsia para PGS.
No se registran conflictos éticos, ya que los datos fueron recolectados con formato anónimo para mantener la confidencialidad de los pacientes. Al ser un estudio de tipo retrospectivo, no se realizó intervención alguna en la población de estudio. Este estudio contó con la aprobación del Comité Institucional PRANOR. Los autores no registran conflicto de intereses; el estudio fue autofinanciado.
RESULTADOS
En cuanto a la tasa de fecundación normal, en la cohorte 1, de un total de 5 485 ovocitos en metafase II, 4 113 tuvieron fecundación normal 2PN (75%), mientras que en la cohorte 3, la tasa referida fue 75,9% (10 388/13 694), sin diferencia significativa entre ambas (RR= 1,036; IC 0,981 a 1,094; p=0,21). Tampoco se registró una diferencia significativa la tasa de fecundación de la cohorte 3 y la cohorte 2 (1 130/1 514), cuya tasa de fecundación fue 74,6% (RR=1,051; IC=0,958 a 1,151), ni en la tasa de fecundación de los 3 grupos de estudio (X2 = 2,328, p = 0,31).
En cuanto a la tasa de blastulación, en la figura 1 evaluamos que la cohorte 1 tuvo una tasa de blastulación de 42,5%, la cual fue significativamente menor que la determinada en la cohorte 3, sin intervención, que fue 47% (RR=1,085; IC=1,051 a 1,120; p<0,0001). En contra parte, la cohorte 2 presentó una tasa de blastulación de 51,9%, con una diferencia estadísticamente significativa de prevención de riesgo de no llegar a blastocisto (RR=0,906; IC=0,851 a 0,965; p=0,0017).
DISCUSIÓN
La medicina reproductiva está en un continuo avance, pero ya se ha demostrado por múltiples estudios que las anomalías cromosómicas son comunes en los embriones humanos(1-5), que van desde el entre 60% de embriones anormales en las mujeres menores de 35 años a 80% en las mujeres de 41 años a más (3,5,12); esta sería la principal causa de falla de la implantación. Para aumentar la oportunidad de que las parejas cumplan el objetivo de concebir un hijo sano, la medicina reproductiva realiza con mayor frecuencia estudios de PGS, ya que las aneuploidías son la principal causa de falla de implantación y pérdidas gestacionales tempranas (13).
Se ha generado una gran controversia, en torno a si el PGS debe convertirse en una estrategia de rutina, dado que estas técnicas son invasivas y podrían alterar el desarrollo embrionario y además se presenta la desventaja del potencial mosaicismo embrionario(14).
En el presente estudio, se identificó que los ciclos con PGS, que incluían biopsia de una blastómera en tercer día de desarrollo embrionario, presentaron una tasa de blastulación significativamente menor, lo cual coincide con lo reportado por Stevens y col (15) quienes también evaluaron que la biopsia en día 3, con ácido tyrodes, presentaba disminución de la tasa de implantación. Pero, cuando utilizaban láser, la disminución del tiempo utilizado para la exéresis de la blastómera o la ausencia de exposición al ácido contribuyeron a mejorar los resultados de la técnica. En contraparte, autores como Treff y col. (6), quienes realizaron un estudio por pares, concluyeron que la biopsia de blastómera realizada con láser en el día 3 por embriólogos con amplia experiencia en biopsias, presentó una reducción del 22% en la tasa de implantación y que, por el contrario, la biopsia de blastocisto con láser resultaría beneficioso para optimizar los resultados clínicos después de PGD.
Por su parte, Dahdouh y col (16) realizaron en el 2015 una revisión sistemática en la que también sugieren que el uso del PGS con FISH después de biopsia en día 3 presenta una disminución significativa en la tasa de nacido vivo y no recomienda su uso. Además coinciden en que la biopsia de blastocisto se asocia con mayores tasas de implantación y embarazo en curso y mejora la selección de embriones para trasferencia de embrión único, manteniendo la misma tasa de embarazo en curso entre PGS y grupos de control y disminución de la tasa de embarazo múltiple.
Scott y col (17), utilizando el fi ngerprinti ng DNA -técnica mediante la cual es posible colocar simultáneamente dos embriones en la cavidad uterina, en la misma transferencia y luego saber qué
Por otro lado, en la actualidad el láser facilita el procedimiento de biopsia embrionaria para el PGS y es ampliamente utilizado, pero existe una preocupación con respecto a si el calor generado sería perjudicial para el desarrollo embrionario. En nuestra investigación se utilizó el láser en día 4 para hacer una incisión en la zona pelúcida, con la finalidad de facilitar la biopsia de trofoectodermo, como parte de la técnica rutinaria empleada para el PGS; este procedimiento resultó en un incremento de la tasa de blastulación con respecto al grupo en el cual no se realizó ninguna intervención y más aun en comparación con el grupo en el que se realizó biopsia de blastómera en día 3 con tyrodes. Carter y col. (18) realizaron un interesante embrión ha implantado- realizaron un importante ensayo controlado aleatorizado, en el cual se realizó la transferencia de dos embriones que tenían como única diferencia que uno fue biopsiado en día 3 con láser y el otro era el control; y ambos embriones fueron transferidos inmediatamente después. El estudio fue realizado solo para evaluar el efecto de la biopsia, por lo que no se utilizó el material para estudio genético. Los embriones en los que se realizó biopsia de blastómera en el día 3 presentó una disminución de la tasa de implantación del 50% al 30%, en coincidencia con nuestro estudio, en el que reportamos una disminución de la blastulación en los embriones biopsiados en tercer día de desarrollo embrionario. Existen muchas explicaciones potencia les de por qué la biopsia de blastómera es perjudicial, pero son especulativos. Actualmente, la biopsia con escisión en día 3 es nociva, mientras que la biopsia de trofoectodermo parece ser segura (7), resultados que coinciden con nuestros hallazgos.
Actualmente, el inconveniente de sincronización para la transferencia embrionaria motivo por el cual era muy uti lizada la biopsia de blastómera ha sido superado por la amplia disponibilidad de vitrificación de buena calidad, que ha reducido la importancia de la transferencia en fresco; pero aun es considerada para el PGS en centros de fertilidad que no confían en la eficacia de la vitrificación para la preservación embrionaria.
Por otro lado, en la actualidad el láser facilita el procedimiento de biopsia embrionaria para el PGS y es ampliamente uti lizado, pero existe una preocupación con respecto a si el calor generado sería perjudicial para el desarrollo embrionario. En nuestra investi gación se utilizó el láser en día 4 para hacer una incisión en la zona pelúcida, con la finalidad de facilitar la biopsia de trofoectodermo, como parte de la técnica ruti naria empleada para el PGS; este procedimiento resultó en un incremento de la tasa de blastulación con respecto al grupo en el cual no se realizó ninguna intervención y más aun en comparación con el grupo en el que se realizó biopsia de blastómera en día 3 con tyrodes. Carter y col. (18) realizaron un interesante estudio en el cual compararon, en los mismos pacientes, un ciclo con y otro sin biopsia con láser y concluyeron que el análisis realizado teniendo al paciente como su mismo control no reveló diferencias en el desarrollo embrionario entre los embriones con y sin biopsia láser en día 3, lo cual sugiere que el procedimiento de biopsia con láser no reduce significativamente el potencial de desarrollo de los embriones humanos. Asimismo, Herrero y col (19), reportaron en el 2016 un estudio en el que también concluyeron que el uso del láser en el día 3 sería beneficioso para la formación de blastocistos y podría mejorar la tasa de implantación. No encontramos investigaciones previas en las que se haya utilizado láser en día 4 de desarrollo embrionario.
Como limitaciones del estudio, señalamos que el presente es un estudio de tipo retrospectivo; es necesario evaluar el efecto del láser embrionario en estudios prospectivos para obtener conclusiones más fehacientes sobre este tema. Debido a los múltiples estudios acerca del efecto negativo de la biopsia embrionaria en día 3, no se sugiere realizar estudios prospectivos acerca de esta técnica.
En conclusión, el desarrollo embrionario preimplantacional es significativamente mayor cuando se utiliza el láser embrionario en día 4 para realizar la biopsia en estadio de blastocisto. Es ne cesario efectuar estudios prospectivos para confirmar nuestros resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. Bielanska M, Tan SL, Ao A. Chromosomal mosaicism throughout human preimplantation development in vitro: incidence, type, and relevance to embryo outcome. Hum Reprod. 2002;17:413-19. [ Links ]
2. Magli MC, Gianaroli L, Ferraretti AP, Lappi M, Ruberti A, Farfalli V. Embryo morphology and development are dependent on the chromosomal complement. Fertil Steril. 2007;87:534-41. [ Links ]
3. Munné S, Chen S, Colls P, Garrisi J, Zheng X, Cekleniak N. Maternal age, morphology, development and chromosome abnormalities in over 6000 cleavage-stage embryos. Reprod Biomed Online. 2007;14:628-34. [ Links ]
4. Munné S, Alikani M, Tomkin G, Grifo J, Cohen J. Embryo morphology, developmental rates, and maternal age are correlated with chromosome abnormalities. Fertil Steril. 1995;64:382-91. [ Links ]
5. . Gutiérrez-Mateo C, Colls P, Sánchez-García J, Escudero T, Prates R, Ketterson K, Wells D, Munné S. Validation of microarray comparative genomic hybridization for comprehensive chromosome analysis of embryos. Fertil Steril. 2011;95(3):953-8. [ Links ]
6. Treff NR, Ferry KM, Zhao T, Su S, Forman EJ, Scott RT. Cleavage stage embryo biopsy significantly impairs embryonic reproductive potential while blastocyst biopsy does not: a novel paired analysis of cotransferred biopsied and nonbiopsied sibling embryos. Fertil Steril. 2011;96:S2. [ Links ]
7. Scott KL, Hong KH, Scott Jr RT. Selecting the optimal time to perform biopsy for preimplantation genetic testing. Fertil Steril. 2013;100(3):608-14. DOI: http://dx.doi.org/10.1016/j.fertnstert.2013.07.004. [ Links ]
8. Sepúlveda S, Garcia J, Arriaga E, Diaz J, NoriegaPortella L, Noriega-Hoces L. In vitro development and pregnancy outcomes for human embryos cultured in either a single medium or in a sequential media system. Fertil Steril. 2009;91:1765-70. [ Links ]
9. Portella J, Bendezú P, Noriega-Hoces L, Noriega Portella L, Sepúlveda S. Descarga de la maduración final ovocitaria con gonadotropina coriónica humana o un agonista de la GnRH en donantes de ovocitos: análisis retrospectivo de cohortes. Rev Peru Ginecol Obstet. 2014;60(1):29-38. [ Links ]
10. Racowsky C, Vernon M, Mayer J, Ball GD, Behr B, Pomeroy KO, et al. Standardization of grading embryo morphology. Fertil Steril. 2010;94(3):11523. doi: 10.1016/j.fertnstert.2010.05.042. [ Links ]
11. López P, López R, Noriega L, Sepúlveda S. Diagnóstico genético preimplantacional: análisis de aneuploidías únicas. An Fac med. 2013;74(1):11-4. http://dx.doi.org/10.15381/anales.v74i1.2015. [ Links ]
12. Franasiak JM, Forman EJ, Hong KH, et al. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening. Fertil Steril. 2014;101(3):656-63 e1. doi: 10.1016/j.fertnstert.2013.11.004. [ Links ]
13. Lu L, Lv B, Huang K, Xue Z, Fan G, Zhu X. Recent advances in preimplantation genetic diagnosis and screening. J Assist Reprod Genet. 2016;33:1129. doi:10.1007/s10815-016-0750-0. [ Links ]
14. Hassold T, Hall H, Hunt P. The origin of human aneuploidy: where we have been, where we are going. Hum Mol Genet. 2007;16 (R2):R203-R208. [ Links ]
15. Stevens J, Wale P, Fernandez A, Munne S, Gardner DK, Schoolcraft WB. Laser biopsy of day 3 embryos yields higher implantation rate than biopsy with acidic tyrodes. Fertil Steril. 2005;84:S378. [ Links ]
16. Dahdouh EM, Balayla J, Garcia-Velasco JA. Impact of blastocyst biopsy and comprehensive chromosome screening technology on preimplantation genetic screening: A systematic review of randomized controlled trials. Reprod BioMed Online. 2015;30(3):281-9. [ Links ]
17. Scott Jr RT, Upham KM, Forman EJ, Zhao T, Treff NR. Cleavage stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial. Fertil Steril. 2013;100(3):624-30. doi: 10.1016/j.fertnstert.2013.04.039. [ Links ]
18. Carter J. Richter KS. Kearns WG. Comparison of embryo development between non-biopsy cycles and laser assisted biopsy cycles for preimplantation genetic diagnosis (PGD) within the same patient population. Fertil Steril. 2004; 82:S242. [ Links ]
19. Herrero L, Basile N, Garcia Velasco J, Costa Borges N, Calderon G. A systematic study using a laser reveals differences in the blastocyst hatching rate and clinical outcomes between two different methods: classic assisted hatching (AH) and zona thinning (ZT). Fertil Steril. 2016;106:e309. [ Links ]
El material contenido en este manuscrito no ha sido publicado previamente, ni enviado a otra revista, con excepción del resumen, el cual ha sido publicado como póster en la Reunión Bienal de la Asociación Latinoamericana de investigadores en Reproducción Humana, ALIRH 2015.
Conflictos de interés: Ninguno.
Fuente de financiamiento: Propio.
Correspondencia:
Pamela Villanueva-Zúñiga
Clínica de Fertilidad Asistida Concebir: Calle Los Olivos 364 San Isidro, Lima.
Teléfono: 989227171-997952496.
Recibido: 6 febrero 2017
Aceptado: 11 junio 2017