Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.78 no.4 Lima Oct./Dic. 2017
http://dx.doi.org/10.15381/anales.v78i4.14257
ARTÍCULO ORIGINAL
Factores clinicopatológicos asociados a la amplificación del genHER2/neu en pacientes con cáncer de mama HER2 2+
Clinicopathological factors associated with the amplification of the HER2 /neu genein patients with breast cancer HER2 2+
Rosa América Meléndez Guevara1, Angélica Yeyli Asencio Aguedo2
1 Médico especialista en Anatomía Patológica. Jefa del Servicio de Patología Quirúrgica y Necropsias del Hospital Nacional Guillermo Almenara.
2 Médico especialista en Anatomía Patológica, Médico Asistente del Servicio de Patología Quirúrgica y Necropsias del Hospital Nacional Guillermo Almenara.
Resumen
Introducción. Un subgrupo de los carcinomas de mama sobreexpresa el receptor 2 del factor de crecimiento epidérmico (HER2). La determinación de esta sobreexpresión se realiza por inmunohistoquímica. La dificultad de diagnóstico surge cuando el resultado es ambiguo (2+), haciendo necesario realizar hibridación in situ (ISH) para determinar la amplificación del gen HER2/neu. Objetivo. Determinar si la amplificación del gen HER2/neu en los casos HER2 2+, se encuentra asociado a factores clinicopatologicos pronósticos. Diseño. Estudio descriptivo de corte transversal. Institución. Servicio de patología quirúrgica, Hospital Guillermo Almenara Irigoyen. Lima, Perú. Participantes. Casos de cáncer de mama HER2 2+. Metodología. Se estudiaron 117 casos de cáncer de mama HER2 2+ diagnosticados entre los años 2010 2015, a los que posteriormente se les realizó ISH. Todos los datos fueron analizados con el programa estadístico SPSS 22. Se utilizó el test de Chi cuadrado para analizar la asociación entre las variables. Principales medidas de resultados. Factores asociados a la amplificación del gen HER2/neu. Resultados. La amplificación del gen HER2/neu se observó en 41% del total de casos. En estos, se observó con mayor frecuencia un grado histológico III (66%), compromiso ganglionar presente (61%), tamaño tumoral ≥ 2 cm (86%) y Ki 67 ≥ 20% (83%). Se encontró una asociación estadísticamente significativa con una edad ≥ 50 años (X2 test, P=0,004) y el grado histológico III (X2 test, P=0.017). Conclusión. La amplificación del gen HER2/neu en casos ambiguos está asociado a una edad ≥ 50 años y grado histológico III.
Palabras clave. Factor de crecimiento epidérmico; Hibridación in situ; Cáncer de mama.
Abstract
Introduction: A subgroup of breast carcinomas overexpress epidermal growth factor-2 (HER2). The determination of this overexpression is carried out by immunohistochemistry. The difficulty of diagnosis by this method arises when the result is ambiguous (2+), thus it is necessary to perform in situ hybridization (ISH) to determine the amplification of the HER2/neu gene. Objective: To determine if, in HER2 2+ cases, the amplification of the HER 2 / neu gene is associated with prognostic clinicopathological factors. Design: Observational, cross-sectional, descriptive study. Institution: Surgical pathology service, Guillermo Almenara Irigoyen Hospital. Lima, Peru. Participants: Cases of breast cancer HER2 2+. Methodology: We studied 117 cases of Her2 2+ breast cancer diagnosed between the years 2010 2015, to which ISH was subsequently performed. All the data were analyzed with the statistical program SPSS 22. The Chi-square test was used to analyze the association between the variables. Main results measures: Factors associated with the amplification of the HER2 / neu gene. Results: Amplification of the HER2 / neu gene was observed in 41% of the total cases. In these, a histological grade III (66%), lymph node involvement (61%), tumor size ≥ 2 cm (86%) and Ki 67 ≥ 20% (83%) were observed more frequently. A statistically significant association was found with an age ≥ 50 years (X2 test, P = 0,004) and histological grade III (X2 test, P = 0.017). Conclusion: Amplification of the HER2/ neu gene in ambiguous cases is associated with an age ≥50 years and histological grade III
Keywords: HER2; in situ hybridization (ISH); Breast cancer.
INTRODUCCIÓN
El cáncer de mama es la neoplasia maligna más frecuente en la población femenina, en la cual, constituye aproximadamente el 25% (1). En el Perú, ocupa el segundo lugar después del cáncer de cuello uterino (2).
Un 25 a 30 % de los carcinomas de mama, sobreexpresan el receptor 2 del factor de crecimiento epidérmico humano (HER2) (3), estos son denominados cáncer de mama HER2 positivo, los cuales se caracterizan por ser altamente agresivos, tener alta tasa de recidiva, metástasis tempranas y un tiempo menor de sobrevida (4).
El HER2, es una proteína miembro de la familia de receptores para factores de crecimiento. Está presente normalmente en la membrana celular cumpliendo funciones en el crecimiento, supervivencia y proliferación celular (5). El incremento de su presencia se define como una sobreexpresión, que generalmente se da como producto de un incremento del número de copias (amplificación) del gen que la codifica, el gen HER2/neu, ubicado en el brazo largo del cromosoma 17 (6).
Un avance importante en el tratamiento del cáncer de mama HER2 positivo lo constituyen los anticuerpos monoclonales, de ellos el más estudiado y aceptado es el trastuzumab (7); cuya principal función radica en bloquear la acción de esta proteína. La terapia con trastuzumab produce una mejora de la supervivencia libre de enfermedad en aproximadamente el 50% de las pacientes y en 33%, mejora la supervivencia global (8-9). Sin embargo, el costo elevado de este fármaco y sus potenciales efectos adversos entre los que figuran fiebre, vómitos, dolor de cabeza, fatiga, y algunos más serios a considerar, como las cardiomiopatías y la toxicidad pulmonar (10-11), hacen necesario determinar la expresión del HER2 para decidir el uso de esta terapia con un balance costo beneficio adecuado para las pacientes.
Es así, que la Sociedad Americana de Oncología Clínica y el Colegio Americano de Patólogos (ASCO/CAP) recomiendan la determinación del gen o de la proteína HER-2/neu en todos los casos de cáncer de mama invasivo (12).
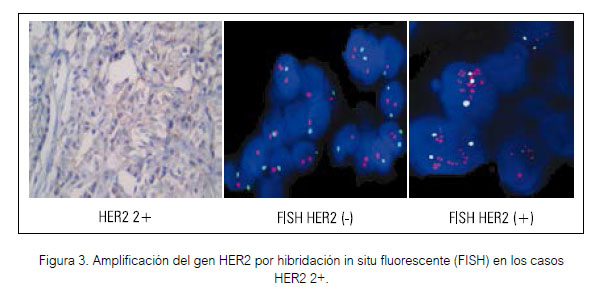
Para detectar la sobreexpresión de esta proteína se utiliza primariamente la inmunohistoquímica (IHC), por ser este el método más económico y fácil de realizar en la mayoría de laboratorios. La IHC permite clasificar los casos como positivos (3+), ambiguos (2+) y negativos (0 o 1+). Se recomienda que los casos ambiguos, conocidos también como HER2 2+, deben ser estudiados por métodos dirigidos a detectar la amplificación del gen HER2/ neu.
Actualmente la hibridación in situ (ISH) es la técnica recomendada para determinar estos casos (5,13). Esta puede ser realizada por diferentes métodos tales como la fluorescencia, PCR, cromógenos, genómica o multicolor. La hibridación in situ por fluorescencia (FISH) es el método más usado porque posee una sensibilidad y especificidad del 98% y 100%, respectivamente (14). A pesar de ello, no constituye el método primario de diagnóstico por su alto costo y necesidad de un laboratorio bien equipado y personal capacitado. Su uso por tanto está reservado para definir los casos con resultado HER2 2+ por IHC; Se ha reportado que un 24% a 33% de ellos llegan a amplificar el gen HER2/neu (15,16,17).
El objetivo del presente estudio fue conocer qué proporción de casos diagnosticados por IHC como HER2 2+ llegan a amplificar el gen por FISH y analizar si existe alguna asociación entre esta amplificación y factores clinicopatologicos considerados pronósticos en el cáncer de mama.
MÉTODOS
Se realizó una revisión retrospectiva de todos los casos de pacientes con cáncer de mama entre los años 2010 y 2015 del Hospital Guillermo Almenara Irigoyen con resultado HER2 2+ por inmunohistoquímica a quienes se realizó FISH en la misma muestra. Los casos fueron seleccionados de la base de datos del Servicio de Patología Quirúrgica y Necropsias.
Se consignaron datos tales como la edad, subtipo histológico, grado histológico, tamaño tumoral, invasión vascular, compromiso ganglionar y estadio clínico.
Así como la determinación inmunohistoquímica de la expresión de HER2, receptor de estrógeno, progesterona, p53, y factor de proliferación Ki 67. No se pudo obtener los datos completos en todos los casos; la cantidad para cada uno de ellos esta especificada en la sección de resultados.
La inmunohistoquímica fue determinada en tejido parafinado por el método de EnVISION flex, her2, receptores de estrógenos (clona 1D5), receptores de progesterona (clona PGR636), proteína p53 y Ki67; la evaluación de los receptores hormonales y el factor de proliferación se realizaron en porcentajes. La positividad de los receptores hormonales, estrógeno y progesterona fue definida con una expresión nuclear ≥ 10%. El índice del Ki 67 fue dividido en < 20% y ≥ 20%, mientras que la de p53 fue semicuantitativo (consignado como +/-, 1+,2+,3+) siendo (+/-) núcleos ocasionales, (1+) células aisladas o pequeños grupos en menos del 50% del corte, (2+) pequeños o grandes grupos en más del 50% del corte, pero menos del 50% del campo y (3+) en más del 50% del corte y del campo.
El FISH se realizó utilizando el kit Pharm DXTM, siguiendo la metodología determinada por el fabricante y los resultados fueron evaluados según los rangos establecidos para la proporción de sondas HER2 sobre sondas del cromosoma 17 tomando como negativos (menos de 1.8), positivos (mayores de 2.2) o ambiguos (de 1.8 a 2.2), en cuyo caso se contaron 20 núcleos adicionales y se catalogaron como positivos si la proporción era mayor o igual a 2.
Se utilizó el test de Chi cuadrado para analizar la asociación entre la amplificación del gen HER2/neu y las otras variables de estudio; el valor p<0,05 fue considerado significativo. Se utilizó el programa estadístico SPSS 22 para Windows .
RESULTADOS
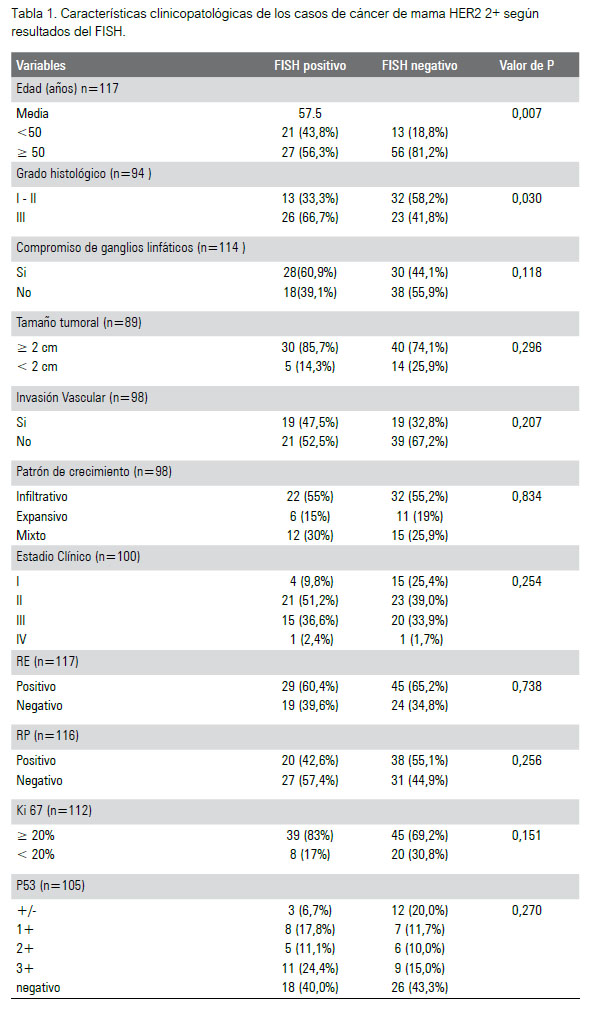
Un total de 117 casos con resultado HER2 2+ por inmunohistoquímica fueron incluidos en este estudio. El promedio de edad de las pacientes estudiadas fue de 57 años y el rango de edad hallado fue de 33 a 88 años. El carcinoma ductal invasivo fue el tipo histológico más frecuente, se observó en 95% de los casos (111), mientras que los subtipos lobulillar y mucinoso constituyeron un 2,6% y 1% de los casos respectivamente. El grado histológico solo fue evaluable en 94 de los 117 casos, de los cuales el 3 % de los casos fue grado I, 45% grado II y 52% grado III. En 114 casos se evaluó el compromiso de ganglios linfáticos, en los cuales se observó una proporción similar de casos comprometidos y no comprometidos, 51% y 49% respectivamente. El tamaño tumoral se clasifico como < de 2 cm y ≥ de 2 cm, de los 98 casos observados para esta variable, el 79% (70) de ellos tuvo una medida ≥ de 2 cm y el 21% restante midió < de 2 cm. La invasión vascular fue analizada en 98 casos, el 39% presento invasión vascular y el 61% no lo presento. En cuanto al patrón de crecimiento, 98 casos fueron evaluados, donde el 55 %(54) de los cuales tuvieron un patrón de crecimiento infiltrativo, un 17%(17) expansivo y un 27 % (27) mixto. El estadio clínico (EC) según el TNM fue valorable en 100 casos, cuyas frecuencias se distribuían de la siguiente manera; 19% EC I, 44% EC II, 35% EC III y 2% EC IV. Con respecto al inmunofenotipo se observó que un 63% de todos los casos (117) expresaron RE, 58% expreso RP. El índice de expresión del Ki 67 fue clasificado como < 20% y ≥ 20%, del total de casos valorables para este marcador (112 casos) el 75% tuvo un índice de Ki 67 ≥ 20% y un 25% tuvo un índice de < 20%. El p53 se evaluó en 105 casos de los cuales un 44% fue negativo, el 20% califico como 3+, 11% 2+ y 15% 1+ o +/(ocasionales).
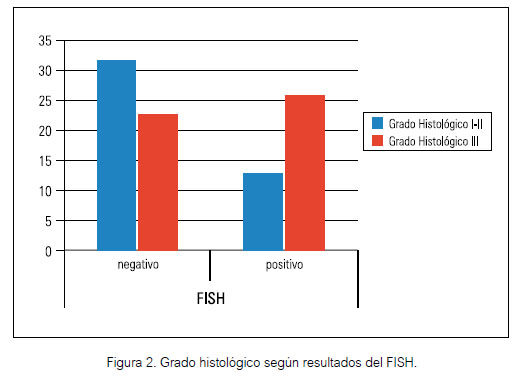
La amplificación del gen HER2 por el método FISH en nuestro estudio se dio en 41% de todos los casos, 59% no amplifico dicho gen. De los casos FISH positivos se observó una mayor frecuencia de los siguientes parámetros con respecto al grupo FISH negativo; el 67% correspondió al grado histológico III vs un 41%, el 61% tuvo compromiso ganglionar vs el 44%, el 86% midió ≥ de 2 cm vs el 74%, el 47% presento invasión vascular vs el 33%, el estadio clínico prevalente fue el EC II (51%), seguido del EC III (36%) vs el 39% y 34% respectivamente para el grupo FISH negativo. El RE se expresó en el 60% de los casos vs 65% y el RP en 43% vs 55%, el 83% tuvo un índice de Ki 67 ≥ 20% vs 69% .El p53 3+ fue en 24% vs 15% (tabla 1).
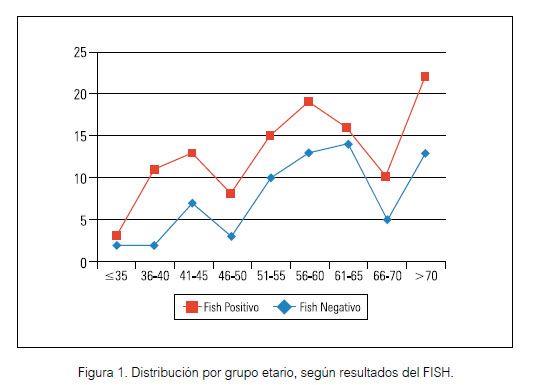
Sin embargo, a pesar de las frecuencias observadas, cuando se aplicó el método estadístico del Chi cuadrado (X2 test) para determinar la asociación entre las variables, solo se halló una asociación estadísticamente significativa entre la edad ≥ 50 años (X2 test, P=0,004), el grado histológico tumoral (X2 test, P=0,017) y la amplificación del HER2 por FISH. Las demás variables no tuvieron un valor estadístico significativo con respecto al resultado del FISH (figuras 1, 2 y 3).
DISCUSIÓN
El uso del anticuerpo monoclonal trastuzumab como tratamiento adyuvante o neoadyuvante de la quimioterapia convencional proporciona una mejora en la supervivencia de las pacientes con cáncer de mama HER2 positivo (7). Sin embargo, el uso de este anticuerpo no está exento de riesgos, estando reportada la cardiotoxicidad como su mayor riesgo adverso, por otro lado, también se debe considerar el factor económico, el cual es elevado. Por lo tanto, la determinación precisa de HER 2 en pacientes con cáncer de mama es una parte importante de los informes de anatomía patológica. Los casos con expresión ambigua (2+) de HER 2 por inmunohistoquímica representan un subgrupo de pacientes que requieren una evaluación adicional necesaria por ISH para determinar la amplificación del gen HER2.
La proporción de casos catalogados como HER2 2+ por inmunohistoquimica que llegaron a amplificar el gen HER2 por el método FISH en nuestro estudio fue de 41%, superior al 24% reportado por Dybdal et al (15) y al 23.4% reportado por Muhammad et al (16). Sin embargo, existen otros estudios como el de Chibon et al (17) que reporta una proporción mayor, 33%. Estas diferentes proporciones podrían explicarse por factores preanalíticos como la fijación, recuperación antigénica, tipo de anticuerpo, variabilidad de interpretación entre observadores, los cuales pueden disminuir la sensibilidad y especificidad de la inmunohistoquimica (18). Para determinar dichos factores se hace necesaria una estandarización de procesos en los laboratorios de anatomía patológica.
Numerosos estudios anteriores han informado que la sobreexpresión de HER2 o la amplificación del gen HER2 está asociado con; un grado histológico alto, ausencia de expresión de receptores hormonales (RE y RP), y un alto índice de Ki67, sin embargo, no existe suficiente evidencia publicada sobre la asociación entre estos y la amplificación del gen HER 2 en casos ambiguos (19,20,21). Nuestro estudio muestra una mayor frecuencia de alto grado histológico, compromiso ganglionar, tamaño tumoral mayor o igual de 2 cm, el estadio clínico II-III, índice Ki 67 ≥ 20% en los casos que llegaron a amplificar el gen HER 2 por FISH; sin embargo, no se encontró una asociación estadísticamente significativa con estas variables, a excepción de la edad ≥ 50 años y un mayor grado histológico. En cuanto a la expresión de los receptores hormonales se observó una mayor proporción de casos con ausencia de expresión de dichos receptores en el grupo que amplifico el gen. El resultado p53 negativo fue prevalente en ambos grupos. No se halló ninguna asociación estadística entre estos parámetros inmufenotipicos y el resultado del FISH.
Nuestros hallazgos permiten concluir que la amplificación del gen HER2/ neu por FISH en los casos determinados como HER2 2+ por IHC se encuentran asociados a una edad ≥ de 50 años y a un mayor grado histológico tumoral. En el presente estudio el 41% de los casos HER2 2+ fueron determinadas como HER2 positivos mediante la técnica del ISH, dándoles la oportunidad de recibir el tratamiento específico. Por lo tanto, se considera que realizar FISH en estos casos es mandatorio. Las limitaciones del presente estudio se dieron por la carencia de datos para algunas variables, sobre las cuales la asociación podría plantearse contando con un mayor número de casos. Asimismo, se requeriría contrastar estos hallazgos con otros centros hospitalarios que realizan FISH para una mejor extrapolación de los resultados a nuestra población en general.
Conflictos de interés: Las autoras del presente artículo declaran no tener conflicto de intereses.
Financiamiento: autofinanciado.
REFERENCIAS BIBLIOGRÁFICAS
1. International Agency for Research on Cancer. Globocan 2012. Estimated Cancer Incidence, Mortality and Prevalence Whorldwide in 2012. http:// globocan.iarc.fr/Default.aspx [ Links ]
2. Registro de Hechos Vitales, Base de Datos de Defunciones OGEI-MINSA; 2007-2011. http://www. minsa.gob.pe/portalweb/02estadistica/estadistica_3.asp?sub5=3 [ Links ]
3. Bilous M, Ades C, Armes J, Bishop J, Brown R, Cooke B, et al. Predicting the HER2 status of breast cancer from basic histopathology fata: an analysis of 1500 breast cancers as part of the HER2000 International Study. Breast. 2003; 12(2):92-98. DOI: https://doi.org/10.1016/S0960-9776(02)00273-4. [ Links ]
4. Menard S, Fortis S, Castiglioni F, Agresti R, Balsari HER2 as a prognostic factor in breast cancer. Oncology. 2001; 61 Suppl 2: 67-72. DOI: https:// doi.org/10.1159/000055404. [ Links ]
5. Popescu NC, King CR, Kraus MH. Localization of the human erB-2 gene on normal and rearranged chromosomes 17 to bands q12-21.32. Genomics. 1989;4(3):362-366. DOI: https://doi. org/10.1016/0888-7543(89)90343-1. [ Links ]
6. Kallioniemi OP, Kallioniemi A, Kurisu W, Thor A, Chen LC, Smith HS, et al. ERBB2 amplification in breast cancer analyzed by fluorescence in situ hybridization. Proc Natl Acad Sci U S A.1992;89(12): 5321-5325, 1992.7. [ Links ]
7. Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2overexpressing metastatic breast cancer. J Clin Oncol. 2002; 20(3):719-26. DOI: 10.1200/ JCO.2002.20.3.719. [ Links ]
8. Romond EH, Perez EA, Bryant J, Suman V, Geyer Ch, Davidson N, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med. 2005;353(16):1673-1684. DOI: 10.1056/NEJMoa052122. [ Links ]
9. Joensuu H, Kellokumpu-Lehtinen PL, Bono P, Alanko T, Kataja V, Asola R, et al. Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N Engl J Med. 2006;354(8):809-820, 2006. DOI: 10.1056/NEJMoa053028. [ Links ]
10. Criscitiello C, Curigliano G. HER2 signaling pathway and trastuzumab cardiotoxicity. Future Oncol. 2013;9(2):179-781. https://doi.org/10.2217/ fon.12.193. [ Links ]
11. Keyhani E, Muhammadnejad A, Karimlou M. Prevalence of HER-2-positive invasive breast cancer: a systematic review from Iran. Asian Pac J Cancer Prev. 2012;13(11): 5477-5482. [ Links ]
12. Wolff AC, Hammond ME, Hicks DG, Dowsett M, McShane LM, Allison KH, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/ College of American Pathologists clinical practice guideline update. J Clin Oncol. 2013;31(31):3997-4013. DOI:10.1200/JCO.2013.50.9984.Epub 2013 Oct 7. [ Links ]
13. Bahreini F, Soltanian AR, Mehdipour P. A metaanalysis on concordance between immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) to detect HER2 gene overexpression in breast cancer. Breast Cancer. 2015;22(6):615-625. DOI: https://doi.org/10.1007/s12282-014-0528-0. [ Links ]
14. Press MF, Bernstein L, Thomas PA, Meisner LF, Zou J, Ma Y, et al.. Her-2/neu gene amplification characterized by fluorescence in situ hybridization: poor prognosis in node-negative breast carcinomas. J Clin Oncol.1997;15(8):2894-904. DOI: 10.1200/ JCO.1997.15.8.2894. [ Links ]
15. Dybdal N, Leiberman G, Anderson S, McCune B, Bajamonde A, Cohen RL, et al. Determination of HER2 gene amplification by fluorescence in situ hybridization and concordance with the clinical trials inmunohistochemical assay in women with metastatic breast cancer evaluated for treatment with trastuzumab. Breast Cancer Res Treat. 2005; 93(1): 3-11. DOI: 10.1007/s10549-004-6275-8. [ Links ]
16. Muhammad A, Mohammed A, Muhammad JH, Muhammad SH, Muhammad NA, Sheeba M, et al. Clinical role of HER2 gene amplification and chromosome 17: a study on 154 IHC-equivocal cases of invasive breast carcinoma patients Tumour Biol. 2016;37(7): 8665-8672. DOI: 10.1007/s13277-015-4657-7. [ Links ]
17. Chibon F, de Mascarel I, Sierankowski G, Brouste V, Bonnefoi H, Debled M, et al. Prediction of HER2 gene status in Her2 2+ invasive breast cancer: a study of 108 cases comparing ASCO/CAP and FDA recommendations. Mod Pathol. 2009; 22(3):403-9. DOI: 10.1038/modpathol.2008.195. [ Links ]
18. Yeh IT. Measuring HER-2 in breast cancer: IHC, FISH, or ELISA? Am J Clin Pathol. 2002; 117 Suppl 1:S26-S35. [ Links ]
19. Hussein MR, Abd-Elwahed SR, Abdulwahed AR. Alterations of estrogen receptors, progesterone receptors and c-erbB2 oncogene protein expression in ductal carcinomas of the breast. Cell Biol Int. 2008;32: 698-707. DOI: 10.1016/j.cellbi.2008.01.007. [ Links ]
20. Lal P, Tan LK, Chen B. Correlation of HER-2 status with estrogen and progesterone receptors and histologic features in 3,655 invasive breast carcinomas. Am J Clin Pathol. 2005; 123:541546. DOI: 10.1309/ YMJ3-A83T-B39M-RUT9. [ Links ]
21. Liu C, Zhang H, Shuang C, Lu Y, Jin F, Xu H, et al. Alterations of ER, PR, HER-2/neu, and P53 protein expression in ductal breast carcinomas and clinical implications. Med Oncol. 2010; 27(3):747-52. DOI: 10.1007/s12032-009-9279-8. [ Links ]
Correspondencia:
Angélica Yeyli Asencio Aguedo
Teléf. 965008273
Direcc. Mz H 15 Brisas de Villa Santiago de Surco.
Citar como: Meléndez Guevara RA, Asencio Aguedo AY. Factores clinicopatológicos asociados a la amplificación del gen HER2/ neu en pacientes con cáncer de mama HER2 2+. An Fac med. 2017;78(4):381-5 DOI: http://dx.doi.org/10.15381/anales.v78i4.14257
Recibido: 18 de mayo 2017.
Aceptado: 15 de julio 2017.