Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.79 no.2 Lima Apr./Jun. 2018
http://dx.doi.org/10.15381/anales.v79i2.14937
ARTÍCULO ORIGINAL
Vitamina D y su relación con factores de riesgo metabólicos para enfermedad cardiovascular en mujeres adultas
Vitamin D and relationship with metabolic risk factors for cardiovascular disease in adult women
Jaime Pajuelo Ramírez1,a, Ivonne Bernui Leo2,b, Hugo Arbañil Huamán3,a, Dante Gamarra González3,a, Marianella Miranda Cuadros4,c, Rafael Chucos Ortiz3,d
1 Miembro Permanente del Instituto de Investigaciones Clínicas. Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Centro de Investigación de Bioquímica y Nutrición. Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Servicio de Endocrinología, Hospital Nacional Dos de Mayo. Lima, Perú.
4 Centro Nacional de Alimentación y Nutrición, Instituto Nacional de Salud. Lima, Perú.
a Médico
b Biólogo
c Nutricionista
d Enfermero
RESUMEN
Introducción. La deficiencia de vitamina D es considerada como un problema de salud pública en otros países. Se ha reportado que esta deficiencia se relaciona con el riesgo a desarrollar enfermedades metabólicas Métodos. Estudio descriptivo, transversal, en 110 mujeres adultas de Lima Metropolitana. Se calculó el índice de masa corporal (IMC) para definir el estado nutricional. Se determinó niveles de insulina, glucosa, perfil lipídico y 25(OH)-D (vitamina D). Se calculó el Homeostatic Model of Assesment Index (HOMA-I). Para definir resistencia a la insulina (RI) se consideró un HOMA-I ≥ 2,7. Para la deficiencia de la 25 (OH)-D el punto de corte fue 30 ng/ mL. Para la ingesta de vitamina D se usó la frecuencia de consumo. La identificación de dislipidemias se hizo con lo recomendado por el Third Report of the National Cholesterol Education Program. Resultados. En las pacientes con déficit de vitamina D, los promedios de edad, IMC, insulina, glucosa, HOMA-I, colesterol total, colesterol HDL, colesterol LDL, y trigliceridos fueron superiores respecto a las pacientes con dosaje de vitamina D normal, encontrándose diferencia estadísticamente significativa para el IMC (p<0,03), niveles de insulina (p<0,01), HOMA-I (p<0,01), y trigliceridos (p<0,01). Además, se determinó déficit de vitamina D en pacientes con resistencia a la insulina con la presencia de obesidad y sobrepeso así como en las pacientes con hipertrigliceridemia (p<0,05); el riesgo de tener déficit de esta vitamina estuvo asociado a resistencia a la insulina (OR:3,28; IC:1,3-8,3) y con hipertrigliceridemia (OR:4,07; IC:1,8-9,3). Conclusiones. La deficiencia de vitamina D mostró asociación con dos variables que identifican el riesgo metabólico: la resistencia a la insulina y la hipertrigliceridemia, en la población estudiada, lo que podría explicar la posible relación de esta vitamina con enfermedades cardiovasculares.
Palabras clave: Vitamina D; Obesidad; Resistencia a la insulina; Dislipidemia; Diabetes mellitus.
ABSTRACT
Introduction. Vitamin D deficiency is considered a public health problem in other countries. Has been reported that this deficiency is related to the risk of developing metabolic diseases. Methods. Study descriptive, cross-sectional design in 110 adult women of Lima Metropolitana. The Body Mass Index (MBI) was calculated to define the nutritional status. Blood levels of insulin, glucose, lipid profile and 25 (OH) D (vitamin D) were determined. It was calculated Homeostatic Model of Assessment Index (HOMA-I). Was calculated and to define insulin resistance (IR) a HOMA-I ≥ 2,7. For the deficiency of 25 (OH)-D, the cut-off point was 30 ng/mL for the intake of vitamin D a frequency of consumption was used. The identification of dyslipidemias was made as recommended by the Third Report of the National Cholesterol Education Program Results. In patients with vitamin D deficiency, the average age, BMI, insulin, glucose, HOMA-I, total cholesterol, HDL cholesterol, LDL cholesterol, and triglycerides were higher compared to patients with normal vitamin D dosage, finding difference statistically significant for BMI (p<0,03), insulin levels (p<0,01), HOMA-I (p<0,01), and triglycerides (p<0,01). In addition, vitamin D deficiency was determined in patients with insulin resistance with the presence of obesity and overweight as well as in patients with hypertriglyceridemia (p<0,05); the risk of having vitamin D deficiency was associated with insulin resistance (OR: 3,28, CI:1,3-8,3) and with hypertriglyceridemia (OR: 4,07, CI:1,8-9,3). Conclusions. The deficiency of vitamin D showed association with two variables that identify metabolic risk: insulin resistance and hypertriglyceridemia, in the study population, which could explain the possible relationship of this vitamin with cardiovascular diseases.
Keywords: Vitamin D; Obesity; Insulin resistance; Dyslipidemia; Diabetes mellitus.
INTRODUCCIÓN
La vitamina D es ampliamente conocida por sus funciones relacionadas a la nutrición, específicamente al rol que desempeña respecto al calcio. El descubrimiento de receptores en algunos órganos, ha permitido descubrir múltiples funciones relacionadas con esta vitamina. Estos nuevos roles se encuentran principalmente en el campo de la inmunología y la inflamación1. Así, en la actualidad se encuentran asociadas a enfermedades crónicas no transmisibles2, siendo el déficit de esta vitamina relacionada con la obesidad3, con la diabetes mellitus (DM)4 y dislipidemias5. Estas enfermedades están presentes en nuestra población, constituyen factores de riesgo para enfermedad cardiovascular, y se caracterizan por su tendencia al incremento en el tiempo6,7,8.
En relación a la DM, se reconoce que la vitamina D 25(OH)-D favorece la sensibilidad a la insulina estimulando la expresión de los receptores de insulina por activación de los receptores activadores de la proliferación de peroxisomas. Estos peroxisomas están implicados en la regulación del metabolismo de los ácidos grasos en el músculo esquelético y en el tejido adiposo. Por otro lado, también favorece la supervivencia de las células beta por inactivación del factor nuclear (NF- kb) y los efectos de las citoquinas9. La 25(OH)-D promueve la secreción de insulina por una acción a través del receptor de las células β del páncreas, ya que esta secreción es dependiente del calcio por su acción en la membrana celular regulado por la calbindina, una proteína que se encuentra en las células beta y que actúa como un modulador de la regulación del calcio intracelular. Por tanto, la vitamina D estimula de manera indirecta la secreción de insulina por regulación de la calbindina9.
Además, estudios previos han proporcionado evidencia de que la deficiencia de vitamina D se encuentra asociada con la función de las células β del páncreas y la resistencia a la insulina que podría afectar el metabolismo de las lipoproteínas y conducir a un aumento en los trigliceridos así como una disminución en el nivel de HDL-C10. Por otro lado, algunos estudios han demostrado una asociación positiva entre los niveles de 25 (OH)-D con el C-HDL y una asociación negativa con los triglicéridos11,12. En cuanto a la obesidad, existen reportes que señalan una disminución de la 25 (OH)-D en personas obesas tanto adultas como en niños; ello probablemente debido a la captación de vitamina D por el tejido adiposo13,14.
En el Perú, los estudios sobre esta vitamina son muy escasos. En un estudio realizado en mujeres postmenopáusicas, con un promedio de edad de 65 años, y que ya presentaban un diagnóstico de osteoporosis primaria, reportaron un 87,5% de deficiencia y un 7,5% de insuficiencia15. Además, en adolescentes se reportó que el 11,3% de adolescentes no obesas y 10,3% de adolescentes obesas presentaron deficiencia de esta vitamina16.
Debido al incremento de enfermedades cardiovasculares en nuestro país por la transición epidemiólogica, el objetivo del presente estudio fue determinar la relación que existe entre la 25 (OH)D con factores de riesgo metabólico para enfermedades cardiovasculares en mujeres adultas.
MÉTODOS
Se realizó un estudio observacional, descriptivo y transversal. Se estudiaron 110 mujeres mayores de 20 años, seleccionadas mediante muestreo por conveniencia. De ellas, 40 con diagnóstico de DM2 que acuden al Servicio de Endocrinología del Hospital Nacional Dos de Mayo en Lima, y el resto correspondió a personal que labora en la mencionada institución. Los criterios de inclusión fueron: edad mayor a 20 años y no consumir vitamina D en la semana previa al estudio. Se excluyeron del presente estudio a personas con patologías que alteren el peso y talla, con la finalidad de evitar un mal diagnóstico nutricional (v.g. personas con edema, escoliosis), y a pacientes con tratamiento anticonvulsivante y con glucocorticoides.
A las participantes del estudio se les pesó y talló, siguiendo la metodología internacionalmente aceptada17; se calculó el índice de masa corporal (IMC) (kg/m2) y se definió el estado nutricional utilizando la referencia de la Organización Mundial de la Salud (OMS)18 la cual considera como puntos de corte para normopeso entre 18,5 a 24,9 kg/m2, sobrepeso de 25 a 29,9 kg/m2 y obesidad a partir de 30 kg/m2.
Para las variables bioquímicas, el método utilizado para determinar la 25 (OH)-D fue la electroquimioluminiscencia automatizada y se utilizó como punto de corte el menor o igual de 30 ng/ mL para definir deficiencia19. Asimismo, se determinó niveles séricos de glucosa, insulina y perfil lipídico: colesterol total (CT), colesterol HDL (C-HDL), colesterol LDL (C-LDL) y triglicéridos (Tg). Se calculó el Homeostatic Model of Assesment Index (HOMA-I) mediante la ecuación de Mathews (insulina basal µUI/mL x glicemia basal mmol/L / 22,5) y se identificó a la resistencia a la insulina (RI) por un valor igual o mayor a 2,7 del HOMA-I20. En cuanto a las dislipidemias, se utilizaron los criterios recomendados por el Third Report of the National Cholesterol Education Program (NCEP)21.
Se cuantificó la ingesta de vitamina D por medio de una encuesta de consumo de los alimentos naturales y enriquecidos aplicada a las participantes del estudio. Con este fin, se elaboró una encuesta de frecuencia de consumo de alimentos que incluía pescados enlatados, huevo, mayonesa y alimentos enriquecidos como: leches, margarina y mantequilla. Para conocer la cantidad de vitamina D de los alimentos naturales se utilizó la tabla de composición de alimentos de los Estados Unidos22, y para los enriquecidos se consideró la información de las etiquetas de dichos productos. Cabe indicar que debido a que algunas etiquetas informaron el contenido de vitamina D en unidades internacionales, estas fueron convertidas a µg (40 UI = 1 µg). La encuesta fue validada por juicio de expertos, nutricionistas con experiencia en evaluación del consumo de alimentos.
Las participantes del estudio firmaron el correspondiente consentimiento informado donde se informó los objetivos del estudio, los riesgos y beneficios, la confidencialidad de los datos y la voluntad de participación. Los datos fueron analizados en el soware estadístico SPSS 18.0 y presentados como promedios, desviación estándar e intervalos de confianza al 95%. Se utilizaron las pruebas t-student y ANOVA para hallar la diferencia de las variables cuantitativas. Asimismo, se utilizó el coeficiente de correlación de Pearson para variables cuantitativas. Para medir la fuerza de la asociación de las variables cuanitativas se calcularon el odds ratio y su intervalo de confianza. En todas las pruebas el nivel de significación fue el p < 0,05.
RESULTADOS
Del total de 110 mujeres adultas estudiadas, el 51,8% tuvieron deficiencia de vitamina D. En las pacientes con déficit de vitamina D, los promedios de edad, IMC, insulina, glucosa, HOMA-I, CT, CHDL, C-LDL, Tg fueron superiores respecto a las pacientes con dosaje de vitamina D normal, encontrándose diferencia estadísticamente significativa para el IMC (p<0,03), niveles de insulina (p<0,01), HOMA-I (p<0,01), y Tg (p<0,01), según se puede observar en la tabla 1.
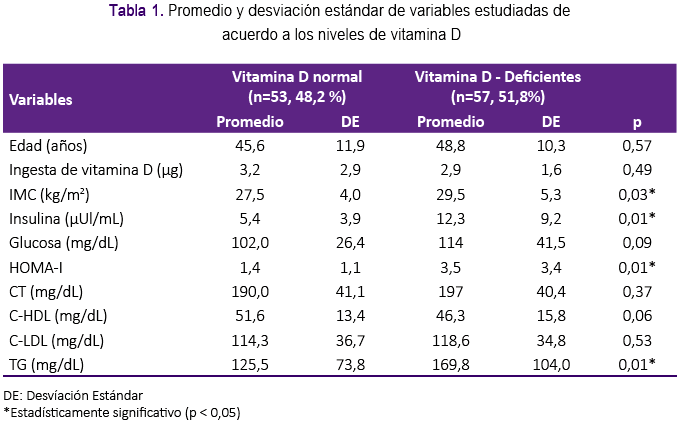
En la tabla 2 se aprecia los niveles promedio de vitamina D, observándose que existe déficit (menos de 30 ng/mL) en pacientes con resistencia a la insulina y con la presencia de obesidad y sobrepeso; esta diferencia respecto a los demás grupos fue significativa (p<0,05). De igual manera, en la tabla 3 se aprecia que de las pacientes que tuvieron déficit de vitamina D, fueron significativamente de mayor prevalencia quienes tuvieron resistencia a la insulina (p<0,01) e hipertrigliceridemia (p<0,02). Respecto a la ingesta de vitamina D según la encuesta aplicada, esta fue de 3 µg/día.

El coeficiente de correlación de Pear-son mostró asociación significativa débil de la deficiencia de vitamina D con el CHDL (r=0,2) y de los Tg (r= -0,3). En el cálculo del OR, se encontró que las únicas asociaciones con el déficit de vitamina D que tuvieron significación estadística fueron con la resistencia a la insulina (OR:3,28; IC:1,3-8,3) y con la hipertrigliceridemia (OR:4,07; IC:1,8-9,3).
DISCUSIÓN
La deficiencia de vitamina D es considerada como un problema de salud pública según un reciente reporte sobre la magnitud de la misma23. Las fuentes que proporcionan esta vitamina son las radiaciones ultravioleta (UVB), los alimentos, los suplementos vitamínicos y los alimentos que son enriquecidos. Dentro de todas estas fuentes, las radiaciones ultravioleta son las que aportan alrededor del 90%, siendo lo restante aportado por los alimentos24. En la presente investigación no se cuantificó el aporte de las radiaciones ultravioleta, aunque asumimos la homogeneidad por cuanto las personas que participaron fueron de raza mestiza y el estudio fue realizado en invierno. En cuanto a la ingesta de vitamina D, el promedio fue de 3 µg/día. Esta cantidad no guardó relación con la cantidad de 25 (OH)-D encontrada en la sangre de la población estudiada. Sin embargo, es necesario considerar el error sistemático o por azar que se da en toda encuesta de consumo de alimentos25. El consumo encontrado en nuestro estudio se encuentra por debajo del requerimiento (10 ug/ día). Similares resultados reportaron los estudios de Rodriguez et. al. con 3 µg/ día26, Lamberg-Allardt et. al. con 4,7 µg/ día27 y Hill et. al. con 4 µg/día28. Valores más bajos fueron reportados en una muestra de adolescentes no obesas con 1,8 µg/día y obesas con 1,7 µg/día16.
En cuanto al dosaje de la 25(OH)-D, se identificó un 51,8% como deficientes, prácticamente una de cada dos personas tuvo esta deficiencia en nuestra población estudiada. Sin embargo, es necesario mencionar que para algunos autores el término deficiencia se considera para aquellas personas que tienen un nivel de 25 (OH)-D por debajo de 20 ng/mL. El punto de corte utilizado en nuestro estudio (30 ng/mL) engloba lo que algunos autores consideran como deficientes (20 ng/mL) e insuficientes (21 a 29,9 ng/ mL)19. La decisión de elegir ese punto de corte fue que solamente el 2,7%, de nuestra población estudiada tenían valores por debajo de 20 ng/mL. Si bien existe un consenso en los puntos de corte a utilizar, la literatura muestra estudios que usan otros puntos de corte29. En ese sentido consideramos como deficiente 25 (OH)-D menor de 30 ng/mL en relación a los normales 25 (OH)-D ≥ de 30 ng/mL, sobre dichos rangos es que se determinó diferencias estadísticamente significativas con aquellas variables relacionadas con eventos cardiovasculares como el IMC, la insulina, el HOMA I y los Tg.
La correlación de la 25 (OH)-D con el IMC mostró una relación negativa aunque débil y no significativa (r= -0,2); es decir, a mayor IMC menor cantidad de 25 (OH)-D, evidenciado cuando observamos que los menores promedios (31 ng/mL) y las mayores prevalencias (62,2%) las tuvieron las pacientes obesas. Situaciones similares se han reportado como los resultados de Ford et. al. en población americana adulta correspondiente al NHANES III (Third National Health and Nutritional Examination Survey)30 y Pereira-Santos et. al. en un metaanálisis referente a 22 estudios31. Sin embargo, la asociación que se encontró con la obesidad, no fue significativa (p<0,06). Existen explicaciones a la menor presencia de 25 (OH)-D en los obesos; una de ellas señala que podría existir una alteración en su producción cutánea o en la absorción intestinal, sin embargo, esto fue desvirtuado por Wortsman pues ambos procesos fueron similares en obesos y en no obesos. Otra explicación podría encontrarse en el aumento del secuestro de la vitamina por el tejido adiposo, así como que el colecalciferol producido a través de la piel o el adquirido por medio de los alimentos sean parcialmente secuestrados antes de pasar por el hígado para su primera hidroxilación3. Otras causas posibles que se señalan son una baja exposición a las radiaciones debido a las limitaciones en el movimiento especialmente en algunas áreas del cuerpo32. También se menciona que el tejido adiposo tiene una menor expresión de una de las enzimas responsables de la 25-hidroxilación de la vitamina D (CYP2J2), así como una tendencia hacia una expresión disminuida de la 1-α hidroxilasa33.
Asimismo, una de las grandes complicaciones de la obesidad es la resistencia a la insulina, usualmente definida como una respuesta biológica subnormal a los efectos fisiológicos de la insulina, reflejada con una disminución de la absorción de la glucosa al interior del músculo esquelético; así como una falta de inhibición de la producción de la glucosa hepática y una reducida capacidad para inhibir la lipólisis en el tejido adiposo. Esta RI se encuentra íntimamente relacionada a la aparición de la DM2 y a las dislipidemias, entre otros34. En ese sentido, la disminución de la 25 (OH)-D en los obesos, puede interactuar sinérgicamente con el tejido adiposo influenciando el riesgo de RI y por ende de DM230. En nuestro encontramos significación estadística con las diferencias de promedio y prevalencia entre los grupos que presentan o no RI y también en el grupo que adicionamos su estado nutricional a la presencia o no de RI. Por otro lado, en el análisis de asociación con la RI (p< 0,01) se determinó un OR de 3,28 (IC 1,30-8,27) que indica que las personas con bajos niveles de 25(OH)-D presentan 3 veces más riesgo de presentar RI. Si bien en la mayoría de estudios muestran una relación inversa, no en todos existe asociación y esto podría deberse a las diferencias en el diseño, a la población estudiada y a la edad de los participantes35. Por ejemplo, Kabadi et. al. estimaron, en su estudio con los datos del NHANES 2000-2006, que el 47% de casos de RI puede ser explicado por la interacción que existe entre la obesidad y los bajos niveles de 25 (OH)-D. Ellos encontraron que los obesos con niveles bajos de 25(OH)-D tienen 33 veces más riesgo de RI que los obesos con cantidades suficientes de 25(OH)-D36. Existen investigaciones que indican que la relación de la 25 (OH)-D con la RI no es concluyente. Song Mi et. al. refiere que los niveles de 25 (OH)-D fueron inversamente asociados con el HOMA-I en un análisis univariado, pero esta asociación no fue significativamente estadística cuando se la ajustó por sexo y edad37. En la misma dirección apunta deViera quien en un estudio de un grupo de pre diabéticos y un grupo control, los valores de HOMA-I y de 25 (OH)-D no fueron significativos38. Por otro lado, Dua encontró que a menores valores de 25(OH)-D los valores de HOMA-I se incrementaban39, hecho similar encontrado en nuestro estudio.
Cuando relacionamos la 25 (OH)-D con la DM2, se observó que las pacientes diabéticas tuvieron un promedio menor (30,9 ng/mL) y una prevalencia mayor de déficit (52,5%) que las no diabéticas; sin embargo, estas diferencias no fueron significativas. Estudios en otros países reportaron valores más bajos que los nuestros; en España, encontraron un promedio de 20,7 ng/mL en aquellos que desarrollaron DM240. Lo mismo se reportó en la India donde las diferencias con los no diabéticos tampoco fueron significativas39. Taheri et. al. reportó en diabéticos un promedio menor que en los no diabéticos41. En el Reino Unido la situación fue semejante42. Clemente-Postigo et. al. reportó niveles bajos de 25(OH)-D en pacientes diabéticos comparados a normoglicémicos; esta relación fue independiente de los valores de IMC, esto se explicaría por las evidencias mostradas que la 25(OH)-D influye directamente sobre las células beta del páncreas mediante los receptores o indirectamente por el rol en regular los niveles de calcio extra-celular y el flujo del mismo a través de las células beta43. Estudios epidemiológicos han mostrado que bajas concentraciones de 25 (OH)-D se encuentran asociadas con un incremento del riesgo de desarrollar DM tipo 2, pero esta asociación no significa causalidad, por cuanto estudios con genes relacionados a la 25 (OH)-D así lo han demostrado44.
En el presente estudio no se encontró asociación con la DM. Los reportes existentes sobre esta asociación de la deficiencia de vitamina D con la DM son inconsistentes; mientras unos han reportado asociación45, otros no lo han hecho46. En base a algunos de estos estudios es que se ha propuesto la suplementación de vitamina D en pacientes diabéticos; sin embargo, revisiones sistemáticas y metaanálisis han llegado a la conclusión que esta suplementación no presentó un efecto en la mejora del control metabólico47.
Los bajos niveles séricos de 25 (OH)D también se han asociado con un perfil lipídico desfavorable, lo que podría explicar la posible relación con la enfermedad cardiovascular y la mortalidad. Jorde identificó 22 estudios transversales de los niveles séricos de 25 (OH)-D y los lípidos, encontrando una asociación positiva de la 25 (OH)-D con el C-HDL y una negativa con los Tg11, similar a lo hallado en el presente estudio.
En este estudio se ha observado asociación negativa con los Tg (r= -0,3) y positiva con el C-HDL (r=0,2) y ambas presentaron significación estadística (p< 0,05). También se halló que, en nuestros pacientes de estudio, las pacientes con déficit de 25 (OH)-D tienen 4 veces más riesgo de presentar hipertrigliceridemia. Guasch et. al. demostró una asociación de la 25 (OH)-D con la hipertrigliceridemia, y esta asociación persistió después de ajustarlo con varias variables confuso-ras, por lo que sugiere que la 25 (OH)-D puede tener un rol en el perfil lipídico y que esto a su vez es mediado por la inflamación48.
Las limitantes a destacar en el presente estudio fueron el número reducido de participantes así como el tipo de muestreo utilizado, por cuanto nuestros resultados se circunscriben a las pacientes estudiadas. Asimismo, no se consideró si las participantes del estudio fueron pre o postmenopáusicas ya que esta condición predispone al déficit de esta vitamina.
En conclusión, en las participantes de nuestro estudio, la deficiencia de vitamina D se asoció con dos variables identificadas como factores de riesgo cardiometabólico como la resistencia a la insulina y la hipertrigliceridemia; sin embargo, son necesarios estudios posteriores y en mayor población para fortalecer esta relación en nuestra realidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Gil A, Plaza-Diaz J, Mesa MD. Vitamin D: classic and novel actions. Ann Nutr Metab. 2018,72:87-95.DOI: 10.1159/000486536. [ Links ]
2. Machin J. Beyond deficiency: new views on the function and health effects of vitamin. Annal of the Academy of Sciencies. 1992;669:1-39. DOI: 10.1111/j.1749-6632.1992.tb17084.x. [ Links ]
3. Worstman J, Matsuoka L, Chen T, Lu Z, Holick M. Decreased bioavailability of vitamin D in obesity. Am J Clin Nut. 2000;72:690-693. [ Links ]
4. Berridge M. Viyamin D deficiency and diabetes. Biochem J. 2017;474:1321-1332. DOI: 10.1042/BCJ20170042. [ Links ]
5. Ge H, Sun H, Wang T, Liu X,Li X, Yu F et al. The association between serum 25 hidroxyvitamin D3 concentrations and serum lipid in rural population of China. Lipid Health Dis. 2017;16(1):215. DOI: 10.1186/S12944-017-0603-6. [ Links ]
6. Villena J. Diabetes Mellitus in Peru. Annals of Global Health. 2015;81(6): 765-775. DOI: org.10/1016/j.aogh.2015.12.018. [ Links ]
7. Pajuelo J. El sobrepeso y la obesidad en el Perú. Facultad de Medicina UNMSNM. Unidad Wellnes Nestlé S.A. Lima 2012. [ Links ]
8. Pajuelo J, Sánchez-Abanto J. Estado nutricional del adulto en relación al riesgo cardiovascular. Rev Soc Peru Med Interna. 2010; 23(3):85-91. [ Links ]
9. Harinayan Venkata Ch. Vitamin D and diabetes mellitus. Hormones. 2014;13(2):163-181. [ Links ]
10. Karnchanasorn R, Ou HY, Chiu KC. Plasma 25-hydroxyvitamin D levels are favorably associated with beta-cell function. Pancreas. 2012;41(6):863-868. DOI: 10.1097/MPA.0B013E31823C947C. [ Links ]
11. Jorde R, Figenschau Y, Hutchinson M, Emaus N, Grimnes G. High serum 25-hydroxivitamin D concentrations are associates with a favorable serum lipids profile. Eur J Clin Nutr. 2010;64:1457-1464. [ Links ]
12. Jorde R, Grimnes G. Vitamin D and metabolic health with special reference to the effect of vitamin D on serum lipids. Prog Lipid Res. 2011;50:303-312. [ Links ]
13. Holichk M. Vitamin D deficiency in obesity and health consequences. Curr Opin Endocrinol & Diabetes. 2006;13:412-418. [ Links ]
14. Luong K, Nguyen LTH. Vitamin D and obesity. Med Chem. 2012;2:11-19. DOI: 10.4172/21610444.1000107. [ Links ]
15. Sotelo W, Calvo A. Niveles de vitamina D en mujeres postmenopáusica con osteoporosis primaria. Rev Med Hered. 2011;22(1):10-14. [ Links ]
16. Pajuelo J, Bernui I, Sánchez-González J, Agüero R, Miranda M, Estrada B, Et. al. Deficiencia de la vitamina D en adolescentes con obesidad. An Fac Med. 2016;77(1):15-19. DOI: doi.org/10.15381/anales.v77i1.11547. [ Links ]
17. Lohman T, Roche A, Martorell R. Anthropo metric standardization reference manual. Champaign IL Human Kinetics Book, 1988. [ Links ]
18. World Health Organization (WHO). Obesity. Preventing and managing. The global epidemic. Geneva 3-5 June 1997. [ Links ]
19. Holichk M, Binkley N, Bischoff-Ferrari H, Gordon C, Hanley D, Heaney R et al. Evaluation, treatment, and prevention of vitamin D deficiency: An Endocrine Society clinical practice guidelines. J Clin Endocrinol Metab. 2011;96:1911-30. [ Links ]
20. Matthews D, Hosker J, Rudenski A, Naylor B, Teacher D, Turner R. Homeostasis model assessment insulin resistance and cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-419. [ Links ]
21. Expert panel on detection, evaluation and treatment of high blood cholesterol in adults: executive summary of the Third Report of the National Cholesterol Education Program (NCEP). JAMA. 2001;285:2486-2497. [ Links ]
22. United States Department of Agriculture, National Nutrient Database for Standard Reference (Release27, released agosto 2014). Disponible en: https://www.ars.usda.gov/northeast-area/beltsville-md/beltsville-human-nutrition-research-center/nutrientdata-laboratory/docs/sr27-home-page/. [ Links ]
23. Holick M. The vitamin deficiency pandemic: Approaches for diagnosis, treatment and prevention. Rev Endocr Metab Disord. 2017;18(2):153-165. DOI: 10.1007/s11154-017-9424-1. [ Links ]
24. Prentice A. Vitamin D deficiency: a global perspective. Nutrition Review. 2008;66(Suppl. 2):S153S164. DOI: 10.1111/j.1753-4887.2008.00100.x. [ Links ]
25. Beaton G. Approaches to analyses of dietary: relationship between planned analysis and choice methodology. Am J Clin Nutr. 1994;59:253S-261S. [ Links ]
26. Rodriguez-Rodriguez E, Navia B, López-Sobaler A, Ortega R. Vitamin D in overweight/obese women and its relationships with dietetic and anthropometric variables. Obesity. 2009;17:778-782. DOI: 10.1038/oby.2008.649. [ Links ]
27. Lamberg-Allardt C, Outila T, Karkkainen M, Rita H, Valsta L. Vitamin D deficiency and bone health in healthy adults in Finland: could this be a concern in other parts of Europa?. J Bone Miner Res. 2001;16:2066-2073. [ Links ]
28. Hill T, Obrien M, Cushman K, Flynn A, Kiely M. Vitamin D intakes in 18-64-y-old Irish adults. Eu J Clin Nutr. 2004;59:404-410. [ Links ]
29. Grubler M, Marz W, Pilz S, Grammer T, Trummer Ch, Mullner Ch et. al. Vitamin D concentrations, cardiovascular risk and events-a review of epidemiological evidence. Rev Endocr Metab Disord .2017;18:259-272. DOI: 10.1007/s1154-017-9417-0. [ Links ]
30. Ford E, Ajani U, McGuire L, Liu S. Concentrations of serum vitamin D and the metabolic syndrome among U.S. adults. Diabetes Care. 2005;28(5):1228-1230. [ Links ]
31. Pereira-Santos M, Costa P, Assis M, Santos C, Dantos D. Obesity and vitamin D deficiency: a systemic review and meta analysis. Obesity reviews. 2015:16:341-349. DOI: 10.1111/obr.12239. [ Links ]
32. Savastano S, Barrea L, Savanelli MC, Nappi F, DiSomma C, Orio F et al. Low vitamin D status and obesity: role of nutritionist. Rev Endocr Metab Disord. 2017;18:215-225. DOI: 10.1007/s1154017-9410-7. [ Links ]
33. Vanlint S. Vitamin D and obesity. Nutrients. 2013;5:949-956. DOI: 10.3390/nu5030949. [ Links ]
34. Schenk S, Saberi M, Olefsky M. Insulin sensivity: modulation by nutrients and inflammations. The Journal of Clinical Investigation. 2008;118(9);2992-3002. [ Links ]
35. Kayaniyil S, Vieth R, Retnakaran R, Knight JA, Qi Y, Gerstein HC, et. al. Association of vitamin D with insulin resistance and β-cell dysfunction in subjects at risk for type 2 diabetes. Diabetes Care.2010; 33:1379–1381. DOI: 10.2337/dc09-2321. [ Links ]
36. Kabadi S, Lee B, Liu L. Joint effects of obesity and vitamin D insufficiency on insulin resistance and type 2 diabetes. Results from the NHANES 2001-2006. Diabetes Care. 2012;35:2048-2054. DOI: 10.2337/dc12-0235. [ Links ]
37. Mi Song B, Chang Kim H, Phil-Choi D, Min Oh S, Suh I. Association between serum 25-hydroxyvitamin D level and Insulin Resistance in a rural population. Yonsei Med J. 2014;55(4):1036-1041. DOI: doi:org/10.3349/ymj.2014.55.4.1036. [ Links ]
38. deViera G, Nascimento L, Saado A, Soibelman V, Bitencourt C. No association between 25-hydroxyvitamin D levels and prediabetes in Brazilian patients. A cross-sectional study. Sao Paulo Med J. 2015;133(2):73-7. DOI: 10.1590/15163180.2013.7180005. [ Links ]
39. Dutta D, Maisnam I, Shrivastava A, Sinha A, Ghos S, Mukhopadyay P. Serum vitamin-D predicts insulin resistance in individuals with pre-diabetes. Indian J Med Res. 2013;138:853-860. [ Links ]
40. González-Molero I, Rojo-Martínez G, Morcillo S, Gutiérrez-Repiso C, Rubio-Martín ED, Almaraz M. Vitamin D and incidence of diabetes: a prospective cohort study. Clinical Nutrition. 2012;31:571-573. DOI: 10.1016/j.clnu.2011.12.001. [ Links ]
41. Taheri E, Sadesimeolia A, Djalali M, Qorbani M, Madani M. The relationship between serum 25-hydroxy vitamin D concentrations and obesity in type2 diabetic patients and healthy subjects. Journal of Diabetes & Metabolic Disorders. 2012;11:16. DOI: doi:org.10.1186/2251-6581/-11-16. [ Links ]
42. Alam U, Najam O, Al-Himdani S, Benoliel S, Jinadev P, Berry J. Marked vitamin D deficiency in patients with diabetes in the UK: ethnic and seasonal differences and an association with dyslipidaemia. Diabet Med. 2012;29:1343-45. DOI: 10.1111/j.14645491.2012.03692.x. [ Links ]
43. Clemente-Postigo M, Muñoz-Garach A, Serrano M, et al. Serum 25-hydroxivitamin D and adipose tissue vitamin D receptor gene expression; relationship with obesity and type 2 diabetes. J Clin Endocrinol Metab. 2015;100(4):E591-E595. DOI: 10.1210/jc.201-3016. [ Links ]
44. Ye Z, Sharp S, Burgess S, Scott R. Association between circulating 25-hydroxivitamin D and incident type 2 diabetes: a mendelian randomization study. Lancet Diabetes Endocrinol. 2015;3:35-42. DOI: org/10.1016/52213-8587(14)70184-6. [ Links ]
45. Pittas A, Sun Q, Manson J, Dawson-Hughes B, Hu F. Plasma 25 hidroxyvitamin D concentration and risk of incident type 2 diabetes in women. Diabetes Care. 2010;33(9):2021-2023. DOI: org10.2337/dc10-0790. [ Links ]
46. Fondjo L, Owiredu W, Sakyi S, Lain E, Adotey-Kwofie A, Anton E, et al. Vitamin D status and its association with insulin resistance among type 2diabetics: a case control study in Ghana. PLoS ONE. 2017;12(4):e0175388. DOI: org/10.1371/journal.pone.0175388. [ Links ]
47. Krul-Poel Y, ter Wee M, Lips P, Simsek S. The effect of Vitamin D supplementation on glycaemic control in patients with type 2 diabetes mellitus: a sistematic review and meta-analysis. European Journal of Endocrinology. 2017;176:R1-R14. DOI: 10.1530/EJE-16-0391. [ Links ]
48. Guasch A, Bullo M, Rebassa A, Bonada A Plasma vitamin D and parathormone are associated with obesity and atherogenic dyslipidemia: a cross sectional study. Cardiovascular Diabetology. 2012;11:149. DOI: 10.1186/1475-2840-11-149. [ Links ]
Conflictos de interés: Los autores declaran no tener conflictos de interés.
Fuentes de financiamiento: Vicerectorado de Investigación de la Universidad Nacional Mayor de San Marcos.
Correspondencia:
Jaime Pajuelo Ramírez
Japara18@yahoo.com
Recibido: 2 de abril 2018
Aprobado: 6 de junio 2018















