Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.79 no.4 Lima oct./dic 2018
http://dx.doi.org/10.15381/anales.v79i4.15640
ARTÍCULO DE REVISIÓN
Restricción alimentaria intermitente: repercusiones en la regulación de la homeostasis energética hipotalámica y tejido adiposo
Intermittent food restriction: repercussions in the regulation of hypothalamic energy homeostasis and adipose tissue
Mariana Rosas Fernández1,3,a, Carlos Concha Vilca2,3,b, Leandro Oliveira Batista3,c,Kelse Tibau de Albuquerque1,2,3,d
1 Programa de Pós-Graduação em Nutrição, Universidade Federal do Rio de Janeiro. Rio de Janeiro, Brasil.
2 Programa de Pós-Graduação em Ciências Fisiológicas, Universidade Federal do Rio de Janeiro, Brasil. Rio de Janeiro, Brasil.
3 Laboratório de Nutrição Experimental, Universidade Federal do Rio de Janeiro – Macaé. Rio de Janeiro, Brasil.
a ORCID: https://orcid.org/0000-0002-8104-4544
b ORCID: https://orcid.org/0000-0002-0431-3587
c ORCID: https://orcid.org/0000-0002-0632-0502
d ORCID: https://orcid.org/0000-0002-6086-472X
RESUMEN
La práctica de restricción alimentaria intermitente (RAI) bien como sus variaciones, es utilizada por individuos con intensión de pérdida de masa corporal. Existen evidencias científicas favorables a esta práctica; no obstante, son insuficientes los estudios que muestren las consecuencias a largo plazo y sus repercusiones en el control de la homeostasis energética en el sistema nervioso central (SNC). Considerando su creciente utilización, tanto como su recomendación y además de la controversia existente en la bibliografía, la presente revisión tiene como objetivo mostrar los efectos de la RAI sobre la regulación central de la homeostasis energética registrados en la literatura.
Palabras clave: Restricción Calórica; Dieta Reductora; Tejido Adiposo; Homeostasis; Sistema Nervioso Central.
ABSTRACT
The practice of intermittent food restriction (IFR) along its variations, is used by individuals with an intentional loss of body mass. There is scientific evidence favorable to this practice; however, studies showing the long term consequences and their impact on the control of energy homeostasis at the level of the central nervous system (CNS) are insufficient. Considering the increase in its use, as well as in its recommendation and the great controversy existing in the bibliography, the present review aims to show the effects of RAI on the central regulation of energy homeostasis reported in the literature.
Keywords: Caloric Restriction; Diet Reducing; Adipose Tissue; Homeostasis; Central Nervous System.
INTRODUCCIÓN
La restricción alimentaria intermitente (RAI) es una estrategia de pérdida rápida de peso, recomendada tanto por profesionales del área de salud, como personal no calificado1. Los últimos años su práctica se popularizó y viene siendo cada vez más utilizada por la población2. Basados en los beneficios de la restricción alimentaria continua (RAC) sobre la salud en general3; pero concomitante en la dificultad para su realización a largo plazo, surge la RAI como alternativa a la RAC, ofreciendo mantener los mismos beneficios para la salud4–7.
Las variaciones de la RAI la tornaron flexible, permitiendo opciones que se ajusten con las preferencias y necesidades de los usuarios. Los estudios realizados tanto en humanos como en animales concuerdan en afirmar reducción de la masa corporal, principal objetivo de la práctica de RAI5,8,9,10. Sin embargo, exceptuando ese resultado, sus efectos periféricos sobre la masa adiposa corporal, la masa libre de grasa, concentraciones séricas de glucosa, triglicéridos y marcadores cardiovasculares son aún discrepantes11,12, siendo que, estudios realizados en animales muestran resultados desfavorables13–16. Asimismo, son escasas las investigaciones que demuestren el efecto de la RAI en el SNC y en el tejido adiposo. Debido a la heterogeneidad en los resultados y la falta de evidencia científica conclusiva, es objetivo de esta revisión, exponer los efectos de la RAI sobre el SNC y tejido adiposo, así como su repercusión sobre la homeostasis energética.
METODOLOGÍA DE BÚSQUEDA Y SELECCIÓN DE RESULTADOS
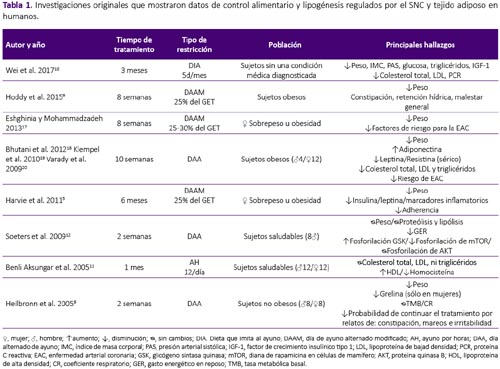
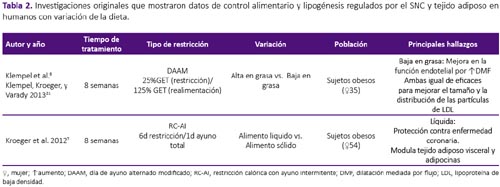
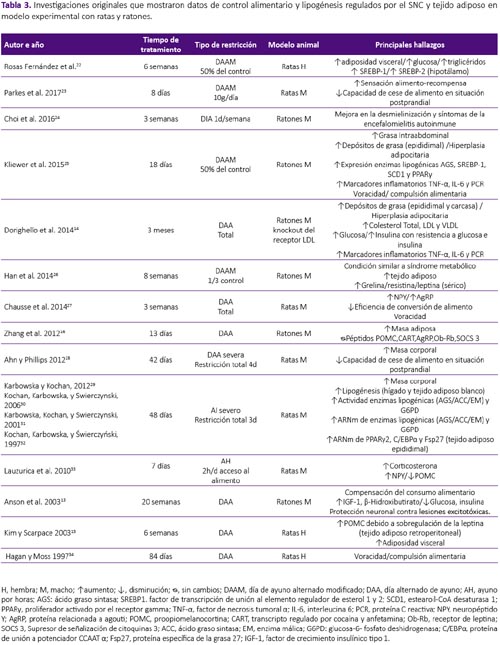
La revisión se realizó a partir de una búsqueda en la base de datos Scopus, sin restricción temporal e incluyendo artículos publicados hasta enero del 2018. Se utilizaron las palabras clave: intermittent fasting, intermittent feeding, food restriction and fasting/refeeding. Fueron seleccionados los estudios originales que mostraron datos de control alimentario y lipogénesis regulados por el SNC y tejido adiposo tanto en humanos como en modelo experimental con ratas y ratones. Fueron excluidas las revisiones, estudios con atletas, actividad física, estudios in vitro, en modelo animal diferente al establecido y estudios que objetivasen observar el efecto de drogas y alcohol en este modelo, por no formar parte del objetivo de la presente revisión. De los 441 artículos encontrados por términos de búsqueda, fueron seleccionados 30 siguiendo los criterios de inclusión y exclusión establecidos, tal como se aprecian en la tabla 1, 2 y 3.
DESARROLLO DEL TEMA
Caracterización de la RAI
Existen diversas variaciones de la RAI, entre las principales y más utilizadas están: el ayuno intermitente (AI), que demanda la realización de restricción de uno o dos días por semana, continuos o alternados, y puede ser total o restringido al 25-30% del gasto energético total (GET). El ayuno durante horas (AH) varía ampliamente, entre 8 y 22 horas, siendo práctica común omitir el desayuno o la cena. El día de ayuno alternado (DAA) exige la realización de restricción total, seguido de realimentación a voluntad al día siguiente, por periodos que van desde una a diez semanas. La dificultad de completar un día total de ayuno, exigió su adaptación, surgiendo así, el día alternado de ayuno modificado (DAAM), el cual consiente en el consumo de 25-50% del GET en los días de ayuno, seguido de libre acceso a alimento durante los días de realimentación35,36. Por último, la dieta que imita al ayuno (DIA), la más recientemente denominación, demanda restricción entre 2550% del GET durante cinco días consecutivos al mes10,24. Además, existen alternativas entre las dietas mencionadas anteriormente, con variaciones donde el usuario puede consumir dietas sólidas, liquidas, bajas o altas en grasas o carbohidratos e hiperproteicas, durante los periodos de restricción alimentaria. La duración de su práctica es muy diversa, pudiendo prolongarse de dos semanas a seis meses.
Regulación en la homeostasis energética
La homeostasis energética es rigurosamente controlada por el SNC, siendo el hipotálamo centro integrador de señales periféricas y centrales37. En el periodo postprandial, son producidas desde la periferia señales hormonales como insulina, leptina y colecistocinina, que informan sobre la disponibilidad de nutrientes, todas ellas alcanzan al hipotálamo vía circulación sanguínea38,39, a esto se suma la liberación de serotonina central desde los núcleos del rafe40. De esta forma, estas señales permiten la activación de neuronas anorexígenas proopiomelanocortina (POMC) y transcripto regulado por cocaína y anfetamina (CART), que finalizan en la sensación de saciedad. En el periodo de ayuno, la grelina y el glucagón son secretadas por el estómago y el páncreas respectivamente. Ambas hormonas informan al hipotálamo del descenso de nutrientes, con lo cual son activadas neuronas orexígenas neuropéptido Y (NPY) y proteína relacionada a agouti (AgRP) que incrementan el apetito y disminuyen el gasto energético39. De este modo, la RAI somete al organismo a periodos prolongados de ayuno, pudiendo promover modificaciones en el control de la homeostasis energética.
Efecto de la RAI sobre las hormonas orexígenas y anorexígenas
La RAI ejerce efecto sobre la modulación de señales periféricas sobre estados de hambre y saciedad. El AI realizado por sujetos saludables durante dos semanas, promovió concentraciones menores de grelina en mujeres, situación que no fue observada en los hombres, mostrando las diferencias de género en la respuesta de esta estrategia de pérdida de peso8. En sujetos obesos, la RAI condujo al aumento de adiponectina, pero disminución de leptina y resistina séricas18. Los resultados observados fueron independientes de la distribución de macronutrientes al final de 8 semanas de tratamiento6. Mujeres con sobrepeso u obesidad realizando restricción al 25% del GET 2 días consecutivos por semana, también mostraron reducción de leptina sérica sin cambios en los cuerpos cetónicos circulantes ni en la concentración de grelina al final de 6 meses de tratamiento5. En modelo animal se observó aumento en la concentración de corticosterona durante el periodo de ayuno, indicando la activación del eje hipotálamo-hipófisis-adrenal33. En ratones macho, hubo incremento en la concentración sérica de grelina, resistina y leptina, independiente de la edad26.
Efecto de la RAI sobre las respuestas orexígenas y anorexígenas hipotalámicas
Por su evidente intervención invasiva, los efectos de RAI sobre el SNC son limitados a estudios en modelo animal. Kim y Scarpace15, observaron aumento en la expresión de POMC en el hipotálamo de ratas macho Sprague Dawley luego de 6 semanas de AI; sin embargo, este fue relacionado a sobre expresión de leptina en el tejido adiposo. Contrario a estos resultados y utilizando el mismo modelo, Chausse et al.27 observaron incremento en la expresión de los neurotransmisores orexígenos NPY y AgRP, acontecimiento que se mantuvo, inclusive cuando los animales fueron realimentados. Trece días de tratamiento con ayuno intermitente total o parcial, aumentaron la expresión de NPY, niveles que regresaron a la normalidad cuando el tratamiento fue prolongado hasta los 42 días en ratones hembra C57BL/6, no fueron observados cambios en la expresión de los neuropéptidos POMC, CART, AgRP y en el receptor de leptina ObRb16. La restricción alimentaria por 22h seguida de realimentación por 2h, durante 7 días, aumentó la expresión del ARNm de NPY y redujo la expresión de POMC, sin cambios en la expresión del transportador de serotonina en ratas hembra Sprague Dawley33. También, se observó incremento en la expresión de SREBP1 y 2 en el hipotálamo de ratas hembra Wistar luego de 6 semanas de RAI, afectando así la disminución de la saciedad presentada en estos animales22.
La RAI causa perjuicios en la regulación de la homeostasis energética, aumentando la expresión de las hormonas orexígenas concomitante a la disminución de las hormonas anorexígenas, que resultó en la compensación del consumo alimentario en animales. Este factor podría estar implicado en el desencadenamiento de la hiperfagia con disminución del gasto energético en reposo, responsable por la recuperación de peso, que resulta en la deserción de las dietas restringidas en calorías12,41. En estudios en modelo animal con programación metabólica, donde las ratas gestantes fueron sometidas a restricción alimentaria por periodos prolongados, se observaron alteraciones en los efectos anorexígenos hipotalámicos de la insulina, leptina y serotonina de la prole. Por consiguiente, los autores concluyeron que periodos de restricción de nutrientes continuos o intermitentes, causan resistencia a la acción de estos anorexígenos, comprometiendo así la señalización de estas vías en esa generación42,43,44.
Pese a la pérdida de masa corporal, la literatura muestra resultados negativos en las señales que regulan la ingestión de alimentos en los centros hipotalámicos. Por lo cual, esta estrategia de pérdida de peso conlleva a perjuicios para la salud debido a la sobreexpresión de neuropéptidos orexígenos acompañados de mayor ingestión alimentaria en respuesta a los prolongados periodos de ayuno27,33.
Efecto de la RAI en el tejido adiposo
Estudios en humanos muestran únicamente como efecto de la RAI sobre el tejido adiposo, reducción de la masa grasa y circunferencia de cintura tras la intervención17,18,20. Sin embargo, a pesar de que algunos estudios coinciden con esos hallazgos, cuando el tejido adiposo es analizado a nivel celular y molecular, las consecuencias del tratamiento no parecen favorables. Así, para observar los efectos de la restricción alimentaria intermitente severa, Kochan et al.30 sometieron a ratas macho Wistar a privación de alimento y realimentación a cada 3 días, observando que, tras 8 ciclos de RAI la actividad de la enzima lipogénica ácido graso sintasa (AGS) aumentó en 47% en el tejido adiposo blanco epididimal, 9 veces más que el grupo control, manteniéndose 3 veces más elevado, hasta el 12° día de realimentación. La lipogénesis y la actividad de las enzimas acetil Co-A carboxilasa (ACC), AGS y enzima málica (EM), aumentaron substancialmente tras cada ciclo de restricción-realimentación y se mantuvieron elevadas tras 6 días de realimentación. Para mostrar la consecuencia de este tratamiento los autores compararon animales tratados contra un grupo sin tratamiento y sometieron ambos grupos a 72h de ayuno, evidenciando el aumento exacerbado de la actividad de la enzimas AGS y EM en el grupo sometido a restricción intermitente severa31,32. Karbowska y Kochan29, utilizando el mismo modelo de RAI severa, observaron cambios en la expresión de enzimas relacionadas a la deposición de triglicéridos e incremento en la expresión del ARNm de los genes peroxisoma proliferador activado por el receptor gamma 2 (PPARγ2), proteína de unión a potenciador CCAAT α (C /EBPα) y la proteína específica de la grasa 27 (Fsp27) en el tejido adiposo epididimal de ratas macho Wistar. Ratones machos sometidos a ayuno intermitente al 50% del consumo del control en el día de restricción, mostraron aumento en la expresión de enzimas y factores de transcripción que promueven de novo lipogénesis y adipogénesis, tales como: ácido graso sintasa (AGS), proteína de unión a los elementos regulatorios de esteroles 1 (SREBP-1), estearoil-CoA desaturasa 1 (SCD1) y PPARγ; así como de la lipoproteinlipasa (LPL), involucrada en la lipólisis. A p esar de no haber cambios en la masa adiposa, se observó diferencia significativas en los niveles séricos de leptina y en las adipocinas inflamatorias, interleucina 6 (IL-6) y factor de necrosis tumoral α (TNF-α)14,25.
Los estudios son discrepantes en relación a la masa grasa en humanos; sin embargo, en modelo animal, los datos muestran aumento en los depósitos de grasa retroperitoneal, epididimal, de carcasa y en la expresión de genes relacionados con la deposición de triglicéridos en tejido adiposo. La actividad enzimática en el tejido adiposo también se vio afectada después de repetidos ciclos de restricción, encontrando sobre actividad de hasta 1000 veces, en las enzimas lipogénicas. Es usual que después de periodos de ayuno, las personas prefieran el consumo de alimentos apetecibles, además de presentar alteración en los patrones de alimentación45. Teniendo en cuenta que los principales adeptos a esta práctica son la población con sobrepeso y obesidad, es probable que la deserción a la RAI y consecutivo consumo de dietas apetecibles, acaben ocasionando perjuicios aún mayores para la salud. En modelo animal inducido a obesidad, la RAI, seguida de realimentación con dieta alta en grasa, incrementó considerablemente el consumo alimentario, así como el riesgo de desarrollar obesidad visceral, dislipidemias y esteatosis hepática no alcohólica46 . En cuanto a dieta alta en carbohidratos, condujo sobre expresión de enzimas relacionadas con la adipogénesis, AGS y acetil-CoA carboxilasa (ACC), tanto en el hígado como en el tejido adiposo blanco47.
Adhesión, hambre y saciedad
La adhesión a intervenciones dietéticas orientadas a la reducción de masa corporal es indispensable para alcanzar el objetivo de pérdida de peso. Como se explicó anteriormente, el hambre y la saciedad son regulados por el SNC, y dietas restrictivas afectan el control de la homeostasis energética, dificultando el cumplimiento de la dieta debido a los prolongados periodos de restricción alimentaria. Se observó que el ayuno intermitente causó aumento en la sensación de hambre en sujetos saludables, con disminución en la satisfacción después de 14 días de práctica, indicando dificultad para continuar la dieta por períodos prolongados de tiempo8. La adhesión a la RAI, con dos días consecutivos de restricción por semana, fue de 63% en el primer mes y disminuyó a 44% al final de los seis meses de tratamiento5. En cuanto protocolos modificados de restricción, regímenes altos en grasa durante el periodo de restricción, parecen tener mejor adherencia comparados a los bajos en grasa6. En el estudio realizado por Hoddy et al.9, se identificaron síntomas adversos al ayuno intermitente, entre ellos, constipación, retención hídrica, mareos y malestar general al final de ocho semanas de tratamiento. Estudios realizados en animales, revelan que ratas macho sometidas a ayuno intermitente, lograron compensar el consumo alimentario en el día de realimentación. Además, se observó comportamiento de voracidad en ratones macho sometidos a ayuno intermitente total o parcial, los cuales consumieron en 2h, el 53% de la ración presentada, pasando el resto del tiempo por un ayuno prolongado25,27.
Se evindenció ausencia en la respuesta a la saciedad en humanos48 y en animales49,50, luego del consumo de dietas densamente energéticas o con alto contenido de azúcares refinados, considerados alimentos altamente apetitosos que alteran la respuesta anorexígena. Cabe destacar que, Hagan y Moss34 observaron compulsión alimentaria en animales sometidos a ciclos repetidos de restricción y realimentación, inclusive cuando retornaron a libre acceso al alimento. Además, la RAI disminuyó la respuesta sensorial de saciedad, visto que los animales continuaron alimentándose sin cesar, aun cuando fueron alimentados previamente23,28. De esta forma, las consecuencias de la RAI son comparables con el consumo de alimentos considerados altamente apetecibles y podría causar prejuicios en la activación de las señales de saciedad, promoviendo así, perfil obesogénico.
Algunos estudios que utilizaron el modelo de RAI para inducir estrés en animales, mostraron alteraciones en la liberación de dopamina51,52,53, concluyendo los autores que este neurotransmisor constituye un mecanismo de recompensa y podría aumentar la motivación para consumir alimento en los periodos de libre acceso al alimento. A su vez, el estrés puede inducir resistencia a la insulina y leptina, llevando a la recuperación de masa y grasa corporal54,55, lo que podría colaborar al desarrollo de obesidad.
CONCLUSIONES
La evidencia científica en cuanto a RAI es controversial. Las variaciones entre regímenes alimentarios, duración del periodo de restricción, momento de toma de muestra y sobre todo, en estudios en humanos la muestra reducida y la falta de un grupo control, son algunos factores que podrían contribuir a la heterogeneidad de los resultados.
La RAI independiente de sus variaciones, conduce a la pérdida de peso en humanos y en animales; sin embargo, el ajuste calórico y educación nutricional, muestran tener similares resultados en cuanto a reducción de la masa corporal, siendo la forma más eficaz y recomendada de pérdida de peso a largo plazo. Si bien la RAI surge como una alternativa a las dificultades presentadas para mantener la dieta hipocalórica, los estudios en humanos no indicaron adhesión al régimen, concluyendo en dificultad para realizar esta dieta por períodos prolongados.
El prejuicio causado en el hipotálamo y en el tejido adiposo evidenciados en el modelo animal, así como su relación con la compulsión alimentaria, compensación del consumo calórico en los días de alimentación ad libitum, la consecuente recuperación de masa corporal y aumento del estrés, fragilizan la indicación de esta estrategia para humanos con el fin de pérdida de peso, especialmente por la escasa investigación en sus efectos a largo plazo sobre el SNC.
REFERENCIAS BIBLIOGRÁFICAS
1. Vergés M. Paleo Dieta Para Deportistas: Guía Para Una Alimentación Evolutiva. 1st Ed. Barcelona: AMAT. 2016.
2. Jáuregui-Lobera I. Fad diets, miracle diets, diet cult… but no results. JONNPR. 2017;2(3):90-93. DOI: 10.19230/jonnpr.1301.
3. Jiménez R. Caloric restriction, a way for prevention and treatment of type 2 diabetes? Rev Chil Nutr. 2012;39(3):88–93. DOI: http://dx.doi.org/10.4067/S0717-75182012000300013. [ Links ]
4. Halberg N. Effect of intermittent fasting andrefeeding on insulin action in healthy men. J Appl Physiol. 2005;99(6):2128-2136. DOI: 10.1152/japplphysiol.00683.2005. [ Links ]
5. Harvie MN, Pegington M, Mattson MP, Frystyk J, Dillon B, Evans G, et. al. The effects of intermittent or continuous energy restriction on weight lossand metabolic disease risk markers: a randomized trial in young overweight women. Int J Obes. 2011;35(5):714-727. DOI: 10.1038/ijo.2010.171. [ Links ]
6. Klempel MC, Kroeger CM, Norkeviciute E, Goslawski M, Phillips SA, Varady KA. Benefit of a low-fat over high-fat diet on vascular health during alternate day fasting. Nutr Diabetes. 2013;3(5):e71. DOI: 10.1038/nutd.2013.14. [ Links ]
7. Kroeger CM, Klempel MC, Bhutani S, Trepanowski JF, Tangney CC, Varady KA. Improvement in coronary heart disease risk factors during an intermittent fasting/calorie restriction regimen: Relationship toadipokine modulations. Nutr Metab. 2012;9(98):1. DOI: https://doi.org/10.1186/1743-7075-9-98. [ Links ]
8. Heilbronn LK, Smith SR, Martin CK, Anton SD, Ravussin E. Alternate-day fasting in nonobesesubjects: effects on body weight, body composition, and energy metabolism. Am J Clin Nutr. 2005;81(1):69–73. DOI: 10.1093/ajcn/81.1.69. [ Links ]
9. Hoddy KK, Kroeger CM, Trepanowski JF, Barnosky AR, Bhutani S, Varady KA. Safety of alternate day fasting and effect on disordered eating behaviors. Nutr J. 2015;14(44):1-3. DOI: 10.1186/s12937015-0029-9. [ Links ]
10. Wei M, Brandhorst S, Shelehchi M, Mirzaei H,Cheng CW, Budniak J, et al. Fasting-mimicking diet and markers/risk factors for aging, diabetes, cancer, and cardiovascular disease. Send to Sci Transl Med. 2017;9(377):eaai8700. DOI: 10.1126/scitranslmed.aai8700. [ Links ]
11. Benli Aksungar F, Eren A, Ure S, Teskin O, Ates G. Effects of Intermittent Fasting on Serum Lipid Levels, Coagulation Status and Plasma Homocysteine Levels. Ann Nutr Metab. 2005;49(2):77-82. DOI: 10.1159/000084739. [ Links ]
12. Soeters MR, Lammers NM, Dubbelhuis PF, et al. Intermittent fasting does not affect wholebody glucose, lipid, or protein metabolism. Am J Clin Nutr. 2009;90(5):1244-1251. DOI: 10.3945/ajcn.2008.27327. [ Links ]
13. Anson RM, Guo Z, de Cabo R, Iyun T, Rios M, Hagepanos, et al. Intermittent fasting dissociates beneficial effects of dietary restriction onglucose metabolism and neuronal resistanceto injury from calorie intake. Proc Natl Acad Sci. 2003;100(10):6216–6220. DOI: 10.1073/pnas.1035720100. [ Links ]
14. Dorighello GG, Rovani JC, Luhman CJF, Paim BA, Raposo HF, Vercesi AR, et al. Food restriction by intermittent fasting induces diabetes and obesity and aggravates spontaneous atherosclerosis development in hypercholesterolaemic mice. Br J Nutr. 2014;111(06):979-986. DOI: 10.1017/S0007114513003383. [ Links ]
15. Kim YW, Scarpace PJ. Repeated fasting/refeeding elevates plasma leptin without increasing fat mass in rats. Physiol Behav. 2003;78(3):459-464. DOI: 10.1016/S0031-9384(03)00016-7. [ Links ]
16. Zhang L-N, Mitchell SE, Hambly C, Morgan DG, Clapham JC, Speakman JR. Physiological and behavioral responses to intermittent starvation in C57BL/6J mice. Physiol Behav. 2012;105(2):376-387. DOI: 10.1016/j.physbeh.2011.08.035. [ Links ]
17. Eshghinia S, Mohammadzadeh F. The effects of modified alternate-day fasting diet on weight loss and CAD risk factors in overweight and obese women. J Diabetes Metab Disord. 2013;12(1):1-4. DOI: 10.1186/2251-6581-12-4. [ Links ]
18. Bhutani S, Klempel MC, Berger RA, Varady KA. Improvements in Coronary Heart Disease Risk Indicators by Alternate-Day Fasting Involve Adipose Tissue Modulations. Obesity. 2012;18(11):21522159. DOI: 10.1038/oby.2010.54. [ Links ]
19. Klempel MC, Bhutani S, Fitzgibbon M, Freels S, Varady KA. Dietary and physical activity adaptations to alternate day modified fasting: implications for optimal weight loss. Nutr J. 2010;9(35):10-1186. DOI: 10.1186/1475-2891-9-35. [ Links ]
20. Varady KA, Bhutani S, Church EC, Klempel MC. Short-term modified alternate-day fasting: a novel dietary strategy for weight loss and cardioprotection in obese adults. Am J Clin Nutr. 2009;90(5):11381143. DOI: 10.3945/ajcn.2009.28380. [ Links ]
21. Klempel MC, Kroeger CM, Varady KA. Alternate day fasting increases LDL particle size independently of dietary fat content in obesehumans. European journal of clinical nutrition. 2013;67(7):783–785. [ Links ]
22. Rosas Fernández MA, Concha Vilca CM, Batista LO, Ramos VW, Cinelli LP, Tibau de Albuquerque K. Intermittent food restriction in female rats induces SREBP high expression in hypothalamus and immediately postfasting hyperphagia. Nutrition.2018;48:122-126. DOI: 10.1016/j.nut.2017.11.026. [ Links ]
23. Parkes SL, Furlong TM, Black AD, Balleine BW. Intermittent feeding alters sensitivity to changes in reward value. Appetite. 2017;113:1-6. DOI: 10.1016/j.appet.2017.02.009. [ Links ]
24. Choi IY, Piccio L, Childress P, Bollman B, Ghosh A, Brandhorst, et al. A Diet Mimicking FastingPromotes Regeneration and Reduces Autoimmunity and Multiple Sclerosis Symptoms. Cell Rep. 2016;15(10):2136-2146. DOI: 10.1016/j.celrep.2016.05.009. [ Links ]
25. Kliewer KL, Ke JY, Lee HY, Stout MB, Cole RM, Samuel VT, et al. Short-term food restriction followed by controlled refeeding promotes gorging behavior, enhances fat deposition, and diminishes insulin sensitivity in mice. J Nutr Biochem. 2015;26(7):721-728. DOI: 10.1016/j.jnutbio.2015.01.010. [ Links ]
26. Han JM, Kim HG, Lee JS, Choi MK, Kim YA, Son CG. Repeated Sense of Hunger Leads to the Development of Visceral Obesity and Metabolic Syndrome in a Mouse Model. Chowen JA, ed. PLoS ONE. 2014;9(5):e98276. DOI: 10.1371/journal.pone.0098276. [ Links ]
27. Chausse B, Solon C, Caldeira da Silva CC, Masselli Dos Reis IG, Manchado-Gobatto FB, Gobatto CA, et al. Intermittent Fasting Induces Hypothalamic Modifications Resulting in Low Feeding Efficiency, Low Body Mass and Overeating. Endocrinology. 2014;155(7):2456-2466. DOI: 10.1210/en.20132057. [ Links ]
28. Ahn S, Phillips AG. Repeated cycles of restricted food intake and binge feeding disrupt sensory-specific satiety in the rat. Behav Brain Res. 2012;231(2):279-285. DOI: 10.1016/j.bbr.2012.02.017. [ Links ]
29. Karbowska J, Kochan Z. Intermittent fasting upregulates Fsp27/Cidec gene expression in white adipose tissue. Nutrition. 2012;28(3):294-299. DOI: 10.1016/j.nut.2011.06.009. [ Links ]
30. Kochan Z, Karbowska J, Swierczynski J. The effects of weight cycling on serum leptin levels and lipogenic enzyme activities in adipose tissue. J Physiol Pharmacol. 2006;57(Suppl 6):115-27. [ Links ]
31. Karbowska J, Kochan Z, Swierczynski J. Increaseof lipogenic enzyme mRNA levels in rat white adipose tissue after multiple cycles of starvation-refeeding. Metabolism. 2001;50(6):734-738. DOI: 10.1053/meta.2001.23309. [ Links ]
32. Kochan Z, Karbowska J, Swierczynski J. Unusual increase of lipogenesis in rat white adipose tissue after multiple cycles of starvation-refeeding. Metabolism. 1997;46(1):10-17. DOI: 10.1016/S0026-0495(97)90160-8. [ Links ]
33. Lauzurica N, García-García L, Pinto S, Fuentes JA,Delgado M. Changes in NPY and POMC, but not serotonin transporter, following a restricted feeding/repletion protocol in rats. Brain Res. 2010;1313:103-112. DOI: 10.1016/j.brainres.2009.11.075. [ Links ]
34. Hagan MM, Moss DE. Persistence of binge-eating patterns after a history of restriction with intermittent bouts of refeeding on palatable food in rats: implications for bulimia nervosa. Int J Eat Disord. 1997;22(4):411–420. [ Links ]
35. Harvie M, Howell A. Potential Benefits and Harms of Intermittent Energy Restriction and Intermittent Fasting Amongst Obese, Overweight and Normal Weight Subjects-A Narrative Review of Humanand Animal Evidence. Behav Sci. 2017;7(1):1-22. DOI: 10.3390/bs7010004. [ Links ]
36. Tinsley GM, La Bounty PM. Effects of intermittent fasting on body composition and clinical healthmarkers in humans. Nutr Rev. 2015;73(10):661-674. DOI: 10.1093/nutrit/nuv041. [ Links ]
37. Cintra D, Ropelle E, Pauli J. Obesidade e Diabetes: Fisiopatología e Sinalizacao Celular. 1st ed. Sao Paulo: Sarvier. 2011.
38. Flak JN, Myers MG. Minireview: CNS Mechanisms of Leptin Action. Mol Endocrinol. 2016;30(1):3-12. DOI: 10.1210/me.2015-1232. [ Links ]
39. Maior AS. Hormonal regulation of food intake: A brief review. Medicina. 2012;45(3):303–309. [ Links ]
40. Hensler JG. Serotonin. In: Basic Neurochemistry: Principles of Molecular, Cellular, and Medical Neurobiology. 8th ed. Amsterdam, Boston: Elsevier/Academic Press. 2012.
41. Coutinho SR, Halset EH, Gåsbakk S, Rehfeld JF, Kulseng B, Truby H, et al. Compensatory mechanisms activated with intermittent energy restriction: A randomized control trial. Clin Nutr. 2018;37(3):815-823. DOI: 10.1016/j.clnu.2017.04.002. [ Links ]
42. Pôrto LCJ, Sardinha FLC, Telles MM, Guimarães RB, Albuquerque KT, Andrade IS, et al. Impairment of the serotonergic control of feeding in adult female rats exposed to intra-uterine malnutrition. Br J Nutr. 2009;101(8):1255–1261. DOI: 10.1017/S0007114508061503. [ Links ]
43. Sardinha FLC, Telles MM, Albuquerque KT, Oyama LM, Guimarães PA, Santos OF, et al. Gender difference in the effect of intrauterine malnutrition on the central anorexigenic action of insulin in adult rats. Nutrition. 2006;22(11-12):1152-1161. DOI: 10.1016/j.nut.2006.07.002. [ Links ]
44. Telles MM, da Silva TG, Watanabe RLH, de Andrade IS, Estadella D, Nascimento CM, et al. Lateral hypothalamic serotonin is not stimulated during central leptin hypophagia. Regul Pept. 2013;184:75-80. DOI: 10.1016/j.regpep.2013.03.027. [ Links ]
45. Schaumberg K, Anderson DA, Reilly EE, Anderson LM. Does short-term fasting promote pathological eating patterns? Eat Behav. 2015;19:168-172. DOI: 10.1016/j.eatbeh.2015.09.005. [ Links ]
46. Duarte FO, Sene-Fiorese M, Cheik NC, Maria AS, de Aquino AE Jr, Oishi JC, et al. Food restriction and refeeding induces changes in lipid pathways and fat deposition in the adipose and hepatictissues in rats with diet-induced obesity: Food restriction with diet-induced obesity changes in lipid pathways. Exp Physiol. 2012;97(7):882-894. DOI: 10.1113/expphysiol.2011.064121. [ Links ]
47. Kim TS, Freake HC. High carbohydrate diet and starvation regulate lipogenic mRNA in rats in atissue-specific manner. J Nutr. 1996;126(3):611. [ Links ]
48. Tey SL, Brown RC, Gray AR, Chisholm AW, Delahunty CM. Long-term consumption of high energydense snack foods on sensory-specific satietyand intake. Am J Clin Nutr. 2012;95(5):1038-1047. DOI: 10.3945/ajcn.111.030882. [ Links ]
49. Attuquayefio T, Stevenson RJ, Boakes RA, etal. A high-fat high-sugar diet predicts poorer hippocampal-related memory and a reduced ability to suppress wanting under satiety. J ExpPsychol Anim Learn Cogn. 2016;42(4):415-428. DOI: 10.1037/xan0000118. [ Links ]
50. Reichelt AC, Morris MJ, Westbrook RF. Cafeteriadiet impairs expression of sensory-specific satiety and stimulus-outcome learning. Front Psychol. 2014;5(852):1-11. DOI: 10.3389/fpsyg.2014.00852. [ Links ]
51. Carr KD. Chronic food restriction: Enhancing effects on drug reward and striatal cell signaling.Physiol Behav. 2007;91(5):459-472. DOI: 10.1016/j.physbeh.2006.09.021. [ Links ]
52. Pothos EN, Creese I, Hoebel BG. Restricted eatingwith weight loss selectively decreases extracellular dopamine in the nucleus accumbens and alters dopamine response to amphetamine, morphine, and food intake. J Neurosci. 1995;15(10):6640–6650. [ Links ]
53. Pothos EN, Hernandez L, Hoebel BG. Chronic food deprivation decreases extracellular dopamine in the nucleus accumbens: implications for a possible neurochemical link between weight loss and drug abuse. Obes Res. 1995;3(4):525S-529S. [ Links ]
54. Park S, Hong SM, Sung SR, Jung HK. Long-Term Effects of Central Leptin and Resistin on Body Weight, Insulin Resistance, and β-Cell Function and Mass by the Modulation of Hypothalamic Leptin and Insulin Signaling. Endocrinology.2008;149(2):445-454. DOI: 10.1210/en.2007-0754. [ Links ]
55. Park S, Ahn IS, Kim DS. Central infusion of leptin improves insulin resistance and suppresses β-cell function, but not β-cell mass, primarily through thesympathetic nervous system in a type 2 diabeticrat model. Life Sciences. 2010;86(23-24):854-862. DOI: 10.1016/j.lfs.2010.03.021. [ Links ]
Conflictos de interés: Los autores declaran no tener conflictos de interés
Fuente de financiamiento: Autofinanciado
Correspondencia:
Universidade Federal do Rio de Janeiro. Campus UFRJ Macaé.
Av. Aloísio da SilvaGomes,50 – CEP: 27930-560, Macaé , Rio deJaneiro, Brasil.
+55 (22) 21414019
alerosas06@gmail.com
Recibido: 21 de septiembre 2018
Aprobado: 26 de noviembre 2018