Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.80 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/anales.802.16415
REPORTE DE CASOS
Adolescente con esclerosis múltiple de alta actividad
Adolescent with highly active multiple sclerosis
Charles Huamaní1,2,a, Edgard Rojas3,a
1 Universidad Nacional San Antonio Abad del Cusco. Cusco, Perú.
2 Universidad Andina del Cusco. Cusco, Perú.
3 Servicio de Neurología, Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
a Médico neurólogo
RESUMEN
La esclerosis múltiple (EM) es una enfermedad autoinmune del sistema nervioso central (SNC) que se puede presentar de formas muy variadas y progresa generando discapacidad. Menos del 5% de los casos son pediátricos, y aún menos frecuentes son los casos de EM de formas agresivas o de alta actividad. Presentamos el caso de un adolescente de 13 años que en seis meses tuvo tres brotes, cada vez más agresivos, con una alta carga de lesión evidenciada en la resonancia magnética y rápida progresión de su discapacidad. Discutimos la aproximación diagnóstica de la EM en la edad pediátrica, su forma de presentación y la valoración de formas de EM con alta actividad.
Palabras clave: Esclerosis Múltiple; Enfermedad Autoinmune; Sistema Nervioso Central; Adolescente (fuente: DeCS BIREME).
ABSTRACT
Multiple sclerosis (MS) is an autoimmune disease of the central nervous system (CNS) that can occur in many different ways and progresses generating disability. Less than 5% of cases are pediatric, and even less frequent are the cases of MS in aggressive or highly-active forms. We present the case of a 13-year old boy who in six months had three attacks, each time more aggressive, with a severe disease burden evidenced by MRI and a rapid progression of his disability. We discuss the diagnostic approach of the MS in the pediatric age, its form of presentation and the evaluation of highly active MS forms.
Keywords. Multiple Sclerosis; Autoimmune Diseases; Central Nervous System; Adolescent (source: MeSH NLM).
INTRODUCCIÓN
La esclerosis múltiple (EM) es una enfermedad autoinmune crónica con compromiso clínico variable pues daña cualquier área del sistema nervioso central (SNC). Afecta principalmente a la población joven (20-40 años), y menos del 5% son menores de 18 años1,2. La presencia de brotes de exacerbación clínica con periodos de remisión, o forma remitente-recurrente (EM-RR) es la más común1. Sin embargo, esta puede presentarse de forma agresiva, debido a un rápido incremento de la discapacidad, de lesiones nuevas en resonancia magnética (RM), o brotes frecuentes3. Presentamos el caso de un adolescente con EM-RR que presentó en seis meses, tres brotes con clínica muy variada y cada vez más agresiva.
REPORTE DE CASO
Varón de 13 años, obeso (IMC 32Kg/ m2), mestizo, procedente de Chiclayo (costa norte del Perú), sin antecedentes recientes de vacunación u otra comorbilidad. Inicia su enfermedad con inestabilidad para la marcha, vértigo, cefalea holocránea con náuseas y vómitos no explosivos, y disminución de agudeza visual de ojo derecho que fue lo único que persistió luego de dos semanas de remisión espontánea.
A los dos meses, presentó inestabilidad para la marcha, alteración amnésica y cefalea con vómitos no explosivos de 6 a 7 veces al día. Durante dos semanas el paciente mejoró progresivamente, se le realizó una RM cerebral donde se observó múltiples lesiones desmielinizantes ovoideas, principalmente periventriculares, también yuxtacorticales y en tallo encefálico, algunas de estas captadoras de contraste en anillo completo (figura 1). Recibió como tratamiento dexametasona 4mg endovenoso cada 8 horas por 3 días y luego fue referido a nuestro hospital (Lima). En nuestra evaluación, el paciente se encontraba despierto, con discalculia, alteración de la memoria a corto plazo, nistagmo horizontal, hemiparesia derecha con grado de fuerza 4/5, dismetría derecha e hiperreflexia generalizada. Se calculó su EDSS (Expanded Disability Status Scale) en 4,5 puntos en el acmé de la enfermedad, y en 3,5 puntos al momento de llegar a nuestro hospital. En el estudio de líquido cefalorraquídeo (LCR) se encontró glucosa en 88mg/dL, proteínas en 36 mg/dL, 2 células/mL y más de 5 bandas oligoclonales restringidas al LCR. En la RM cerebral (figuras 1 y 2) y medular (figura 3), realizada como control luego de un mes, se identificó múltiples lesiones desmielinizantes a nivel yuxtacortical, periventricular, infratentorial, medular, algunas aún con realce al contraste y otras como agujeros negros, además de atrofia cerebral significativa cualitativamente para la edad. Los potenciales evocados visuales indicaron compromiso desmielinizante prequiasmático. Los anticuerpos IgG para virus Epstein Barr fueron positivos, los estudios de ANA, ANCA, ELISA-VIH fueron negativos. Se hizo el diagnóstico de EM-RR y se iniciaron los trámites para el uso de interferón beta-1b. Regresando a Chiclayo, en el control mensual siguiente, su EDSS fue de 2,5 puntos.
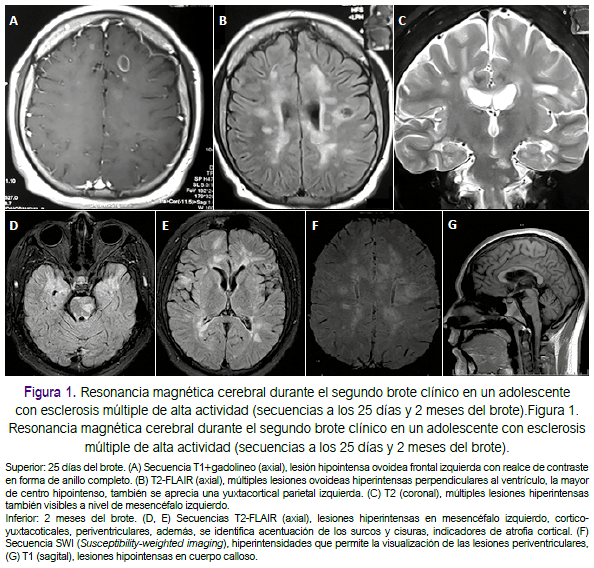
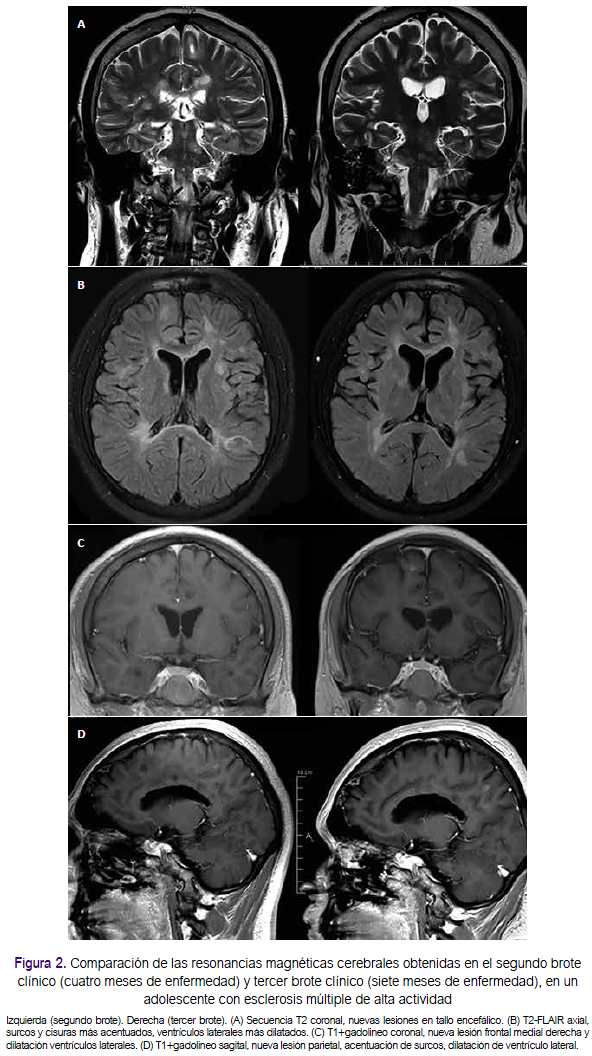
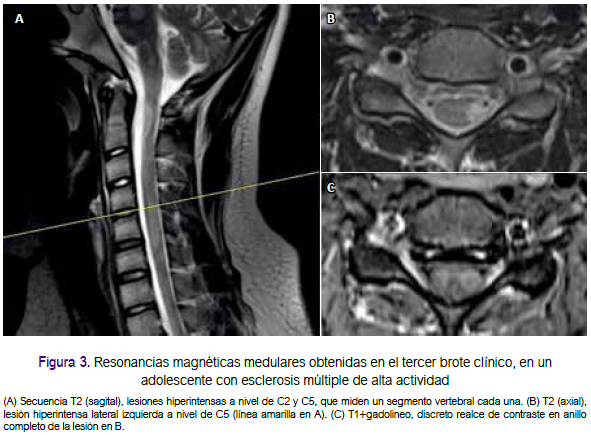
A los cinco meses del inicio de su enfermedad comenzó a usar interferón β-1b. Durante la primera semana de uso, presentó disminución de fuerza de miembro inferior izquierdo que progresó a hemiparesia izquierda y luego cuadriparesia. En tres semanas, se agregó disartria escándina, incontinencia urinaria y fecal (EDSS: 7 puntos). Recibió pulsos de metilprednisolona por 5 días con mejoría parcial; sin embargo, al finalizar se agregó temblor de reposo, inicialmente cefálico que en cuatro días se generalizó, con alteración de la memoria semántica y episódica. El paciente fue trasladado nuevamente a Lima; al examen se encontraba despierto, orientado, con acalculia, alteración de la memoria a corto y largo plazo, disartria escándina, paraparesia con grado de fuerza 4/5, hiperreflexia generalizada, sensibilidad conservada, temblor de reposo y acción axial, marcha atáxica, pulsión a la derecha, dismetría y adiadococinecia (EDSS: 5 puntos), por lo recibió un segundo curso de pulsos de metilprednisolona por 7 días, logrando mejoría (EDSS: 3 puntos). En el nuevo estudio de RM cerebral y medular se identificaron nuevas lesiones captadoras de contraste a nivel yuxtacortical y medular, nuevas lesiones en la secuencia T2, y acentuación de la atrofia cerebral (figuras 2 y 3). En nuestro hospital, el único tratamiento autorizado para pacientes con EM son los interferones; sin embargo, debido a la severidad del cuadro, se planteó el inicio de uso de terapias de segunda línea.
DISCUSIÓN
En la población pediátrica la EM no es frecuente, por ello se recomienda realizar el diferencial con la encefalomielitis diseminada aguda (ADEM). La ADEM suele ser precedida de una infección viral o vacunación, es una afección multifocal del SNC que cursa con encefalopatía (alteración de la conciencia no causada por fiebre o enfermedad sistémica), y en la RM se evidencian lesiones difusas, mal demarcadas, de 1-2cm, comúnmente en tálamo o ganglios basales4,5. Para el diagnóstico de EM se requiere, en cambio, cumplir en RM los criterios de diseminación en espacio (lesiones en dos de las siguientes áreas: yuxtacortical, infratentorial, médula o periventricular) y de diseminación en tiempo (lesiones que realzan con el contraste junto a otras que no lo hacen, o nuevas lesiones en la RM de control)6 , con el reparo que en la población pediátrica se agrega que al menos uno de los dos brotes no tenga encefalopatía4.
Otro hallazgo importante para esta diferenciación es la presencia de bandas oligoclonales en el LCR, presente en el 77% de los casos de EM2,4,7, y raramente encontrado en la ADEM5. Otras diferencias en la RM son, por ejemplo, la ausencia de agujeros negros (lesiones hipointensas en T1) en la ADEM en el debut clínico, dado que estos indican severa lesión desmielinizante previa, lo cual sí nos sugiere EM5, las lesiones ovoideas y perpendiculares a los ventriculares (dedos de Dawson) también son muy sugerentes de EM así como la ausencia de lesiones bilaterales difusas7. Además en nuestro paciente observamos cualitativamente signos de atrofia cortical (surcos y cisuras pronunciados) y múltiples lesiones en cuerpo calloso, que sugieren la cronicidad de la enfermedad y se correlacionan fuertemente con un mal pronóstico en relación a discapacidad y afectación cognitiva8. Por último, en la EM es mucho más probable que las lesiones en la RM sean visibles en la secuencia SWI (Susceptibility-weighted imaging) (figura 2) en comparación con el ADEM, donde casi no son visibles9 .
Son pocos los estudios sobre EM en población pediátrica. Se sabe que se presenta como EM-RR en el 97% de los casos, siendo muy raras las formas primarias progresivas4. Inicia con compromiso monofocal (55%), con síntomas sensitivos (54%), motores (45%) o visuales (39%)2. El periodo entre brotes es de 15 a 24 meses1,10. La progresión del EDSS es variable según la población estudiada, en 5 años incrementa en promedio de 1,1 puntos10, aunque a menor edad la severidad clínica es mayor. Nuestro paciente presentó en 6 meses un incremento de 3 puntos en su EDSS, múltiples lesiones nuevas y 3 eventos clínicos cada vez más severos, con compromiso clínico multifocal, amplio compromiso infratentorial y mayor acentuación de la atrofia cortical, por lo que se trata de una EM atípica por su agresividad.
No existe un consenso para definir EM de alta actividad, severa o agresiva11, pero según el Rio Score los pacientes que en un año presenten al menos un nuevo brote, evidencia de dos nuevas lesiones en RM, o un incremento en 1 punto en la EDSS tendrán una mala respuesta terapéutica si sólo se usan interferones, inclusive aquellos que reúnan estas tres características tienen 8,6 veces la probabilidad de nuevos brotes e incremento de su discapacidad a los 3 años de seguimiento, por lo que se debe considerar la probabilidad del cambio de medicación12. Otros factores de riesgo de alta actividad presentes en nuestro paciente fueron el sexo masculino, la severidad de los brotes, el que desarrolle brotes multifocales, con compromiso motor, cerebeloso y esfinteriano, el rápido progreso de la enfermedad evaluado a través del EDSS, el elevado número de lesiones visibles en RM, la presencia de agujeros negros y lesiones infratentoriales11.
Nuestro paciente presentó una forma de EM muy agresiva que requirió el cambio precoz a terapias de segunda línea con el fin de disminuir la progresión de la enfermedad. En la población pediátrica los únicos fármacos aprobados son los de primera línea (interferón y acetato de glatiramer)13, aunque el 30% de los pacientes requerirá un cambio en la medicación, sea por intolerancia o por inefectividad14. Son pocos los fármacos de segunda línea que cuentan con un ensayo clínico aleatorizado concluido en población pediátrica; por ejemplo, el fingolimod (fase 3) ha mostrado disminuir el número de brotes anuales aunque con más efectos adversos que el interferon β-1a15.
En conclusión, la EM es una enfermedad que también se puede presentar con alta agresividad en la población pediátrica, son varias las consideraciones para diferenciarla al inicio de otras enfermedades como la ADEM, valiéndose de una adecuada evaluación clínica, RM y estudio de bandas oligoclonales. Realizado el diagnóstico se deben identificar los factores de riesgo para la progresión de la enfermedad y establecer la severidad del cuadro. El pronóstico depende del inicio precoz de la terapia modificadora de la enfermedad, lamentablemente en la población pediátrica no existen muchas opciones terapéuticas para formas agresivas o de alta actividad.
REFERENCIAS BIBLIOGRÁFICAS
1. Renoux C, Vukusic S, Mikaeloff Y, Edan G, Clanet M, Dubois B, et al. Natural history of multiple sclerosis with childhood onset. N Engl J Med. 2007;356(25):2603-13. DOI: 10.1056/NEJMoa067597. [ Links ]
2. Belman AL, Krupp LB, Olsen CS, Rose JW, Aaen G, Benson L, et al. Characteristics of Children and Adolescents With Multiple Sclerosis. Pediatrics. 2016;138(1): e20160120. DOI: 10.1542/peds.2016-0120. [ Links ]
3. Rush CA, MacLean HJ, Freedman MS. Aggressive multiple sclerosis: proposed definition and treatment algorithm. Nat Rev Neurol. 2015;11(7):379-89. DOI: 10.1038/nrneurol.2015.85. [ Links ]
4. Waldman A, Ghezzi A, Bar-Or A, Mikaeloff Y, Tardieu M, Banwell B. Multiple sclerosis in children: an update on clinical diagnosis, therapeutic strategies, and research. Lancet Neurol. 2014;13(9):936-48. DOI: 10.1016/S1474-4422(14)70093-6. [ Links ]
5. Krupp LB, Tardieu M, Amato MP, Banwell B, Chitnis T, Dale RC, et al. International Pediatric Multiple Sclerosis Study Group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders: revisions to the 2007 definitions. Mult Scler. 2013;19(10):1261-7. DOI: 10.1177/1352458513484547. [ Links ]
6. Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol. 2018;17(2):162-73. DOI: 10.1016/S1474-4422(17)30470-2. [ Links ]
7. Hintzen RQ, Dale RC, Neuteboom RF, Mar S, Banwell B. Pediatric acquired CNS demyelinating syndromes: Features associated with multiple sclerosis. Neurology. 2016;87(9 Suppl 2):S67-73. DOI: 10.1212/WNL.0000000000002881. [ Links ]
8. Popescu V, Agosta F, Hulst HE, Sluimer IC, Knol DL, Sormani MP, et al. Brain atrophy and lesion load predict long term disability in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2013;84(10):1082-91. DOI: 10.1136/jnnp-2012-304094. [ Links ]
9. Kelly JE, Mar S, D’Angelo G, Zhou G, Rajderkar D, Benzinger TL. Susceptibility-weighted imaging helps to discriminate pediatric multiple sclerosis from acute disseminated encephalomyelitis. Pediatr Neurol. 2015;52(1):36-41. DOI: 10.1016/j.pediatrneurol.2014.10.014.
10. Huppke B, Ellenberger D, Rosewich H, Friede T, Gartner J, Huppke P. Clinical presentation of pediatric multiple sclerosis before puberty. Eur J Neurol. 2014;21(3):441- 6. DOI: 10.1111/ene.12327. [ Links ]
11. Freedman MS, Rush CA. Severe, Highly Active, or Aggressive Multiple Sclerosis. Continuum. 2016;22(3):761- 84. DOI: 10.1212/CON.0000000000000331. [ Links ]
12. Río J, Rovira A, Blanco Y, Sainz A, Perkal H, Robles R, et al. Respuesta al tratamiento con interferón beta en pacientes con esclerosis múltiple. Validación del Rio Score. Rev Neurol. 2016; 63(4):145-150. DOI: https://doi.org/10.33588/rn.6304.2016127. [ Links ]
13. Ghezzi A, Amato MP, Makhani N, Shreiner T, Gartner J, Tenembaum S. Pediatric multiple sclerosis: Conventional first-line treatment and general management. Neurology. 2016;87(9 Suppl 2):S97-S102. DOI: 10.1212/WNL.0000000000002823. [ Links ]
14. Chitnis T, Ghezzi A, Bajer-Kornek B, Boyko A, Giovannoni G, Pohl D. Pediatric multiple sclerosis: Escalation and emerging treatments. Neurology. 2016;87(9 Suppl 2):S103-9. DOI: 10.1212/WNL.0000000000002884. [ Links ]
15. Chitnis T, Arnold DL, Banwell B, Bruck W, Ghezzi A, Giovannoni G, et al. Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis. N Engl J Med. 2018;379(11):1017-27. DOI: 10.1056/NEJMoa1800149. [ Links ]
Conflictos de interés: CH no tiene conflictos de interés. ER ha recibido honorarios como conferencista por BAYER S. A., como Clinical Advisor por GENZYME del Perú S. A., y apoyo para asistencia a congresos porBAYER S. A., STHENDAL S. A., TEVA S. A. y TECNOFARMA S. A.
Fuentes de financiamiento: Autofinanciado.
Contribuciones de autoría: Los autores participamos en la concepción del artículo, participamos en su redacción y aceptamos la versión final para su publicación.
Confidencialidad de los datos: Se guardó la confidencialidad del caso clínico sin presentar mayores datos del paciente.
Derecho a la privacidad y consentimiento informado: Se guardó la confidencialidad del caso clínico sin presentar mayores datos del paciente. Se le solicitó la autorización del paciente para su publicación, siempre que información personal no sea divulgada.
Correspondencia:
Charles Augusto Huamaní Saldaña
Av. Arriba Perú 1154, Lima 42, Perú
huamani_ca@hotmail.com
Recibido: 12 de marzo 2019
Aprobado: 20 de abril 2019
Publicación en línea: 28 de junio 2019














