Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.80 no.2 Lima Apr./Jun. 2019
http://dx.doi.org/10.15381/anales.802.16424
GUÍAS DE PRÁCTICA CLÍNICA
Guía de práctica clínica para el manejo de pacientes con fibrilación auricular en el Seguro Social del Perú (EsSalud)
Clinical practice guideline for the management of atrial fibrillation for the Peruvian Social Security (EsSalud)
Richard Soto-Becerra1, Jessica Hanae Zafra-Tanaka2, Sergio Goicochea-Lugo2, Christoper A. Alarcon-Ruiz3, Kevin Pacheco-Barrios2, Alvaro Taype-Rondan2, Carolina Guevara-Caicedo1, Gladys Espinoza-Rivas1, Mario Cabrera-Saldaña1, Pío Zelaya-Castro1, Ricardo Zegarra-Carhuaz1, Diana Urday-Ipanaqué2, Raúl Timaná-Ruiz2
1 Instituto Nacional Cardiovascular INCOR, EsSalud. Lima, Perú.
2 Instituto de Evaluación de Tecnologías en Salud e Investigación, EsSalud. Lima, Perú.
3 Unidad de Investigación para la Generación y Síntesis de Evidencias en Salud, Universidad San Ignacio de Loyola. Lima, Perú.
RESUMEN
Introducción. El presente artículo resume la guía de práctica clínica (GPC) para el manejo de pacientes con fibrilación auricular (FA) en el Seguro Social del Perú (EsSalud). Objetivo. Proveer recomendaciones clínicas basadas en evidencia para el manejo de pacientes con FA en EsSalud. Métodos. Se conformó un grupo elaborador (GEG) que incluyó médicos especialistas y metodólogos. El GEG formuló 9 preguntas clínicas a ser respondidas por la presente GPC. Se realizó búsquedas sistemáticas de revisiones sistemáticas y, cuando fue considerado pertinente, estudios primarios en Medline durante el 2017. Se seleccionó la evidencia para responder cada una de las preguntas clínicas planteadas. La certeza de la evidencia fue evaluada usando la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE). En reuniones de trabajo periódicas, el GEG usó la metodología GRADE para revisar la evidencia y formular las recomendaciones, los puntos de buenas prácticas clínicas y los flujogramas de la GPC. Finalmente, la GPC fue aprobada con Resolución N° 91 – IETSI – ESSALUD – 2018. Resultados. La presente GPC abordó 9 preguntas clínicas, divididas en tres temas: prevención de eventos tromboembólicos, estrategias de control y manejo de FA en emergencias. En base a dichas preguntas se formularon 12 recomendaciones (6 recomendaciones fuertes y 6 recomendaciones condicionales), 29 puntos de buena práctica clínica, y 2 algoritmos. Conclusión. El presente artículo resume la metodología y las conclusiones basadas en evidencias de la GPC para manejo de pacientes con FA en EsSalud.
Palabras clave: Fibrilación Auricular; Guía de Práctica Clínica; Enfoque GRADE; Medicina Basada en Evidencias (fuente: DeCS BIREME).
ABSTRACT
Abstract. This article summarizes the clinical practice guide (CPG) for the management of patients with atrial fibrillation (AF) in the Social Security of Peru (EsSalud). Objective. To provide clinical recommendations based on evidence for the management of patients with AF in EsSalud. Methods. A CPG for the management of patients with AF in EsSalud was developed. To this end, a guideline development group (GDG) was established, including medical specialists and methodologists. The GDG formulated 9 clinical questions to be answered by this CPG. Systematic searches of systematic reviews and, when it was considered pertinent, primary studies were conducted in Medline during 2017. The evidence to answer each of the posed clinical questions was selected. The quality of the evidence was evaluated using the Grading of Recommendations Assessment, Development, and Evaluation (GRADE) methodology. In periodic work meetings, the GDG used the GRADE methodology to review the evidence and formulate the recommendations, points of good clinical practice, and the flowchart of the CPG. Finally, the CPG was approved with Resolution No. 91 – IETSI – ESSALUD – 2018. Results. This CPG addressed 9 clinical questions, divided into three topics: prevention of thromboembolic events, maintenance therapy and management of AF. Based on these questions, 12 recommendations (6 strong recommendations and 6 weak recommendations), 29 points of good clinical practice, and 2 algorithms were formulated. Conclusion. This article summarizes the methodology and evidence-based conclusions from the CPG for the management of AF in EsSalud.
Keywords: Atrial Fibrillation; Clinical Practice Guideline; GRADE Approach; Evidence-Based Medicine (source: MeSH NLM).
INTRODUCCIÓN
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente en la práctica clínica1. Se caracteriza por presentar una frecuencia auricular desorganizada, asociada a una respuesta ventricular variable. De acuerdo a su presentación, la FA se puede clasificar en tres tipos: FA paroxística (se presenta como episodios súbitos autolimitados con una duración máxima de una semana), FA persistente (cuando la alteración del ritmo persiste por más de una semana, luego de lo cual se puede autolimitar o responder a tratamiento) y FA permanente (aquella que por consenso médico - paciente se decide solamente controlar la frecuencia ventricular para el manejo de síntomas, no siendo de interés restaurar el ritmo sinusal debido a las características clínicas del paciente y la propia arritmia). Además, la FA valvular se presenta en portadores de prótesis valvular mecánica o en presencia de estenosis mitral moderada o severa, en quienes hay mayor riesgo de eventos tromboembólicos2.
La mortalidad por eventos cardiovasculares aumenta en pacientes con FA3. Además, dentro de las principales complicaciones de la FA se encuentran el accidente cerebrovascular isquémico por émbolos4, falla cardiaca5, infarto de miocardio6 y demencia7. El tratamiento de la FA consiste en tomar dos grandes decisiones: controlar el ritmo o la frecuencia cardiaca, e iniciar antitrombóticos o no. Entonces, es importante que la toma de estas decisiones se base en evidencia científica.
Debido a la alta prevalencia de la FA y el impacto en la morbimortalidad en los pacientes, la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) elaboró la guía de práctica clínica (GPC) basada en evidencias sobre el manejo de FA, cuyas recomendaciones serán aplicadas por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC se encuentra detallado en su versión completa, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html). En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG): Se conformó un GEG, que incluyó metodólogos y médicos especialistas en cardiología.
Formulación de preguntas: En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 9 preguntas clínicas que se muestran en la tabla 1, cada una de las cuales pudo tener una o más preguntas PICO (Población, Intervención, Comparador, Desenlaces), teniendo en cuenta que cada pregunta PICO pudo tener uno o más desenlaces de interés.
Búsqueda y selección de la evidencia: Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante el 2017 se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en Medline) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC sobre el tema) (Material suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia: La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja8 según se muestra en la tabla 2. Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) y se usaron tablas de perfiles de evidencias de GRADE (Material suplementario 2). Finalmente, se le asignó a la pregunta PICO el nivel de certeza más bajo alcanzado por alguno de los desenlaces considerados como críticos.

Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales, detalladas en la tabla 2, usando la metodología GRADE9. Para ello, se tuvo en consideración: 1) beneficios y daños de las opciones, 2) valores y preferencias de los pacientes, 3) aceptabilidad por parte de los profesionales de salud, 4) factibilidad de las opciones en los establecimientos de salud de EsSalud, y 5) uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Asimismo, el GEG formuló puntos de buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica.
Revisión por experto externo: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Además, la versión completa fue enviada por vía electrónica a un experto externo para su revisión (mencionado en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC: La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 91 – IETSI – ESSALUD – 2018.
Actualización de la GPC: La presente GPC tiene una validez de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
RECOMENDACIONES
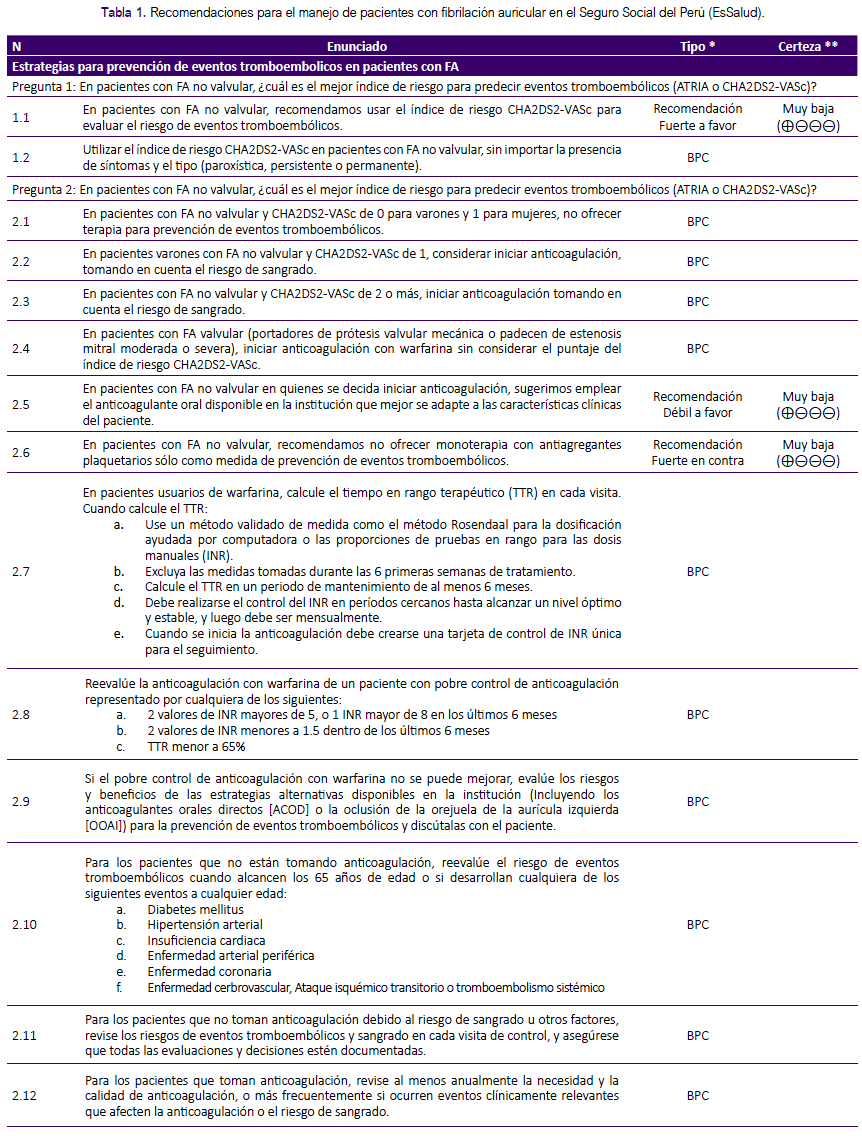
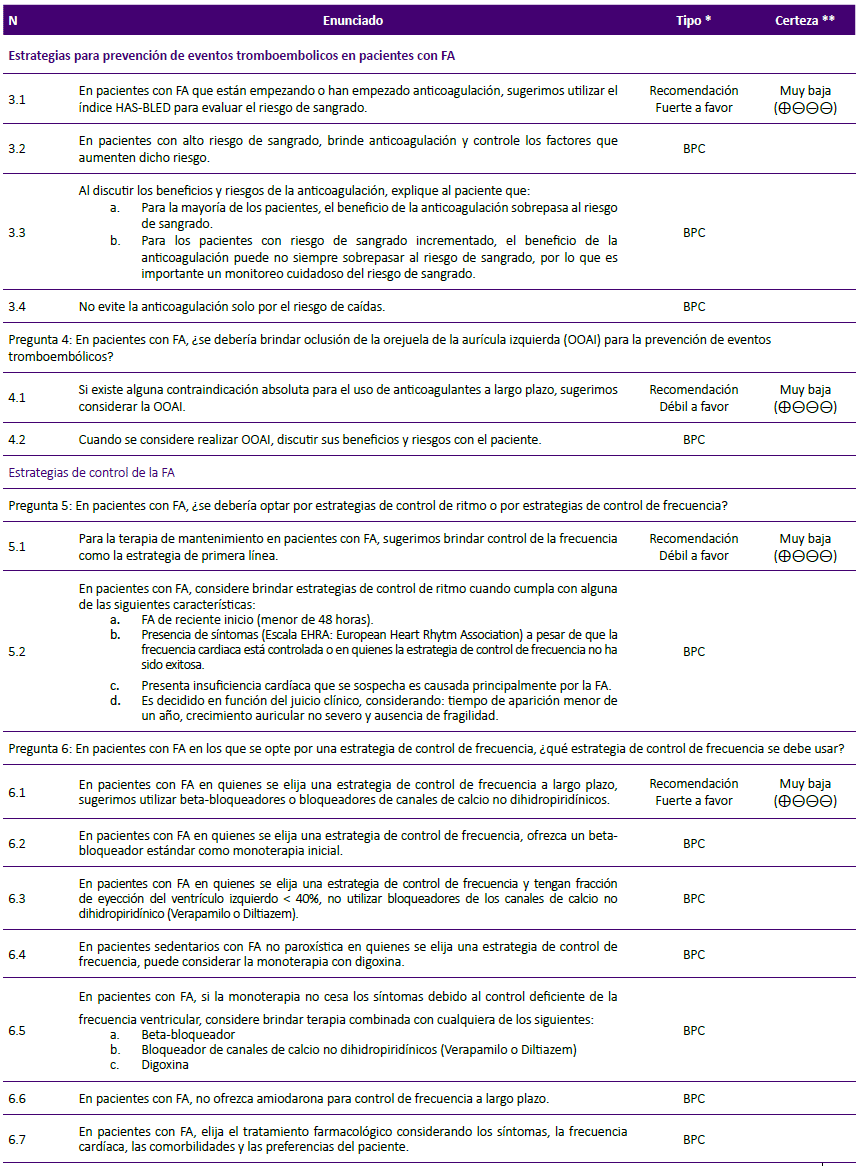
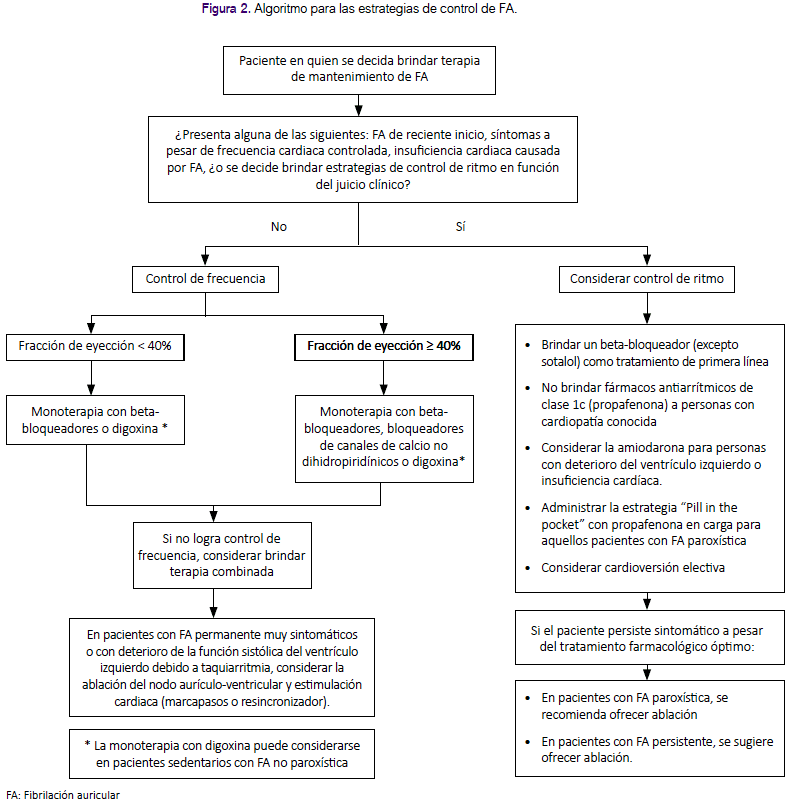
La presente GPC abordó nueve preguntas clínicas, divididas en tres temas: prevención de eventos tromboembólicos, terapia de mantenimiento y manejo de FA en emergencias. En base a dichas preguntas se formularon 12 recomendaciones (6 recomendaciones fuertes y 6 recomendaciones condicionales), 29 puntos de buena práctica clínica y 2 algoritmos, mostrados en la tabla 1 y figuras 1 y 2.
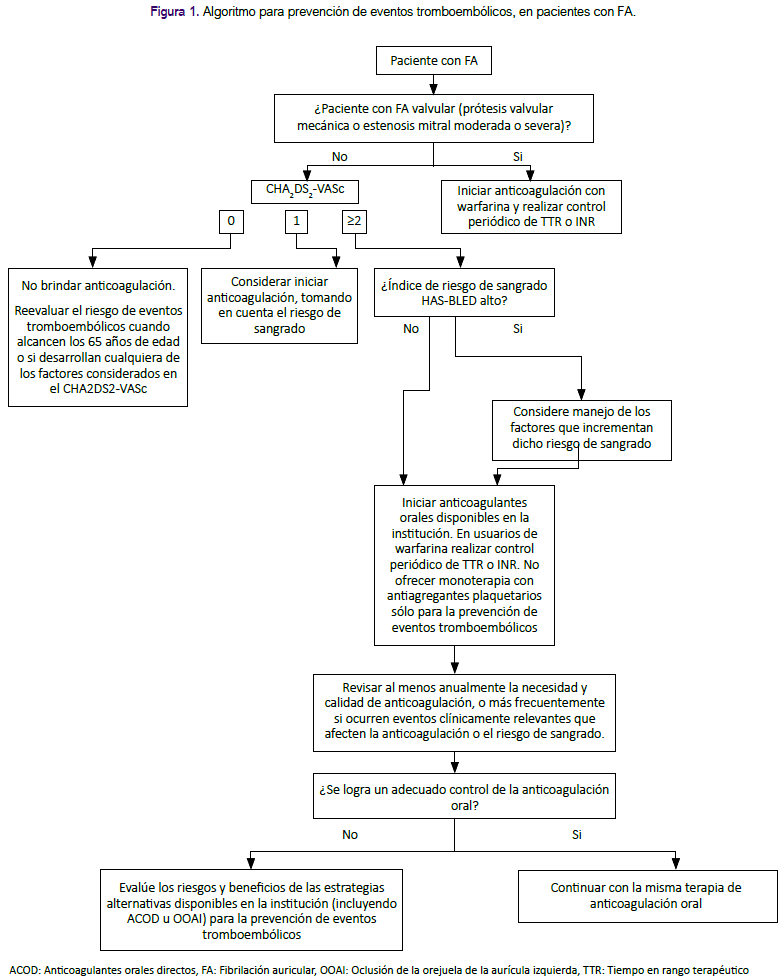
Esta GPC se enfoca en pacientes adultos con FA. Para el manejo de esta patología, el médico tratante debe evaluar el riesgo de eventos tromboembólicos (pregunta 1), elegir la terapia antitrombótica para prevenir eventos tromboembólicos según el índice de riesgo en pacientes valvulares y no valvulares (pregunta 2), determinar el índice de riesgo para predecir sangrado en pacientes con terapia de anticoagulación (pregunta 3), evaluar la posibilidad de realización de la oclusión de la orejuela auricular izquierda (OOAI) (pregunta 4), elegir la estrategia de control de la FA según el tipo de paciente (pregunta 5, 6, 7 y 8), y finalmente determinar el manejo en emergencia de pacientes con FA de presentación aguda (pregunta 9).
A continuación, se expondrán las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación.
ESTRATEGIAS PARA PREVENCIÓN DE EVENTOS TROMBOEMBÓLICOS EN PACIENTES CON FIBRILACIÓN AURICULAR.
Pregunta 1: En pacientes con FA no valvular, ¿cuál es el mejor índice de riesgo para predecir eventos tromboembólicos (ATRIA o CHA2DS2-VASc)?
De la evidencia a la decisión:
Durante el manejo de la FA el uso de anticoagulantes tiene por objetivo reducir el riesgo de eventos tromboembólicos. Sin embargo, en pacientes con FA no valvular, debido a que este riesgo puede ser bajo y que el uso de anticoagulantes puede causar sangrado, éstos se suelen brindar sólo en pacientes con alto riesgo de eventos tromboembólicos, siempre valorando el riesgo/beneficio de esta terapia10. Para evaluar el riesgo de eventos tromboembólicos en pacientes con FA no valvular se usan distintos índices de riesgo, como el Congestive heart failure, Hypertension, Age, Diabetes mellitus, Stroke score (CHA2DS2), su versión actualizada agregando Vascular disease, Age and Sex (CHA2DS2-VASc)11,12,13 mostrada en la tabla 3, y el índice Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA)14,15.

La RS de Chen16, 2013, encontró que los índices CHA2DS2 y CHA2DS2-VASc tenían similar capacidad para predecir riesgo de accidente cerebrovascular (ACV) y tromboembolismo, pero CHA2DS2-VASc tenía mejor capacidad para detectar personas con riesgo bajo. La RS de Zhu17, 2016, incluyó cohortes con seguimiento entre 0,92 y 3,4 años, encontrando una capacidad predictiva para eventos tromboembólicos (c-statistic) similar entre el índice ATRIA y el CHA2DS2-VASc.
Se consideró que el índice CHA2DS2- VASc y el índice ATRIA tienen similar capacidad predictiva para eventos tromboembólicos. Sin embargo, el uso del índice CHA2DS2-VASc es menos costoso, más factible (no requiere pruebas de laboratorio) y aceptado (se tiene mayor experiencia clínica en su aplicación) que el índice ATRIA en nuestro contexto. Es por ello que se decidió formular una recomendación a favor del uso del índice CHA2DS2-VASc.
A pesar que la certeza de la evidencia fue muy baja, se consideró que optar por un índice diferente al CHA2DS2-VASc (como ATRIA) incurriría en más demoras, por la necesidad de pruebas de laboratorio sin obtener un beneficio evidente; por lo que se decidió emitir una fuerza de recomendación fuerte.
Puntos de BPC:
Se consideró que, en pacientes con FA no valvular, se debe utilizar el índice de riesgo CHA2DS2-VASc sin importar la presencia de síntomas y el tipo de FA (paroxística, persistente o permanente).
Pregunta 2: En pacientes con FA, ¿qué terapia antitrombótica se debería brindar para la prevención de eventos tromboembólicos?
De la evidencia a la decisión:
En pacientes con alto riesgo de eventos tromboembòlicos (evaluado con CHA2DS2-VASc), se requiere definir qué terapia antitrombótica brindar: ya sea anticoagulantes (inhibidores de vitamina K, como la warfarina; y anticoagulantes orales directos [ACOD]) o antiagregantes plaquetarios (como la aspirina)18.
La RS de Tereshchenko19, 2016, encontró que aquellos que los paciente con FA que recibieron antiagregantes plaquetarios tenían mayor riesgo de desarrollar un evento tromboembólico en comparación a los que recibieron anticoagulantes (inhibidores de vitamina K o ACOD); sin embargo no se hallaron diferencias para el riesgo de hemorragia ni mortalidad por todas las causas al comparar ambas terapias. Tampoco se encontraron diferencias al comparar los inhibidores de vitamina K con los ACOD para los desenlaces antes mencionados. Por ello se decidió formular una recomendación a favor del uso de anticoagulantes orales disponibles en la institución. Debido a que la certeza de la evidencia fue muy baja, se decidió asignarle una fuerza de recomendación débil.
Asimismo, teniendo en cuenta los resultados de Tereshchenko 2016, se decidió formular una recomendación en contra del uso de antiagregantes plaquetarios como monoterapia para prevenir eventos tromboembólicos, por el mayor riesgo de estos eventos frente al uso de anticoagulantes. A pesar que la certeza de la evidencia fue muy baja, debido a la menor eficacia de los antiagregantes plaquetarios y que el uso de inhibidores de vitamina K es factible y aceptado por los especialistas, se consideró que la mono-terapia con antiagregantes plaquetarios no está justificada, por lo que se asignó una fuerza de recomendación fuerte.
Puntos de BPC:
A continuación, se justificarán los puntos de BPC más relevantes:
-
Para decidir el inicio de anticoagulación se creyó conveniente definir los puntos de corte de CHA2DS2-VASc. La RS de Van Doorn20, 2017, encontró que el riesgo de ACV por 100 personas-año en pacientes con FA reclutados de la población general fue: IRR: 0,21 (IC 95%: 0,07 a 0,45) para un puntaje de 0, IRR: 0,67 (IC 95%: 0,41 a 0,98) para un puntaje de 1, IRR: 1,50 (IC 95%: 0,93 a 2,21) para un puntaje de 2 y IRR: 2,37 (IC 95%: 1,75 a 3,08) para un puntaje de 3; mientras que en aquellos reclutados de establecimientos de salud el riesgo encontrado fue: IRR: 0,59 (IC 95%: 0,17 a 1,25) para un puntaje de 0, IRR: 1,37 (IC 95%: 0,52 a 2,61) para un puntaje de 1, IRR: 2,63 (IC 95%: 1,27 a 4,48) para un puntaje de 2 y IRR: 3,73 (IC 95%: 2,02 a 5,96) para un puntaje de 3.
-
Según estos resultados, se consideró que los pacientes con índice CHA2DS2VASc ≥ 2 tienen un riesgo mayor de presentar ACV y aquellos con puntaje de 0 no presentan un riesgo significativo. Sin embargo, aunque los estudios incluidos en la RS de Van Doorn20 no realizaron un análisis según sexo, los autores consideraron que las mujeres con una puntuación de 1 (puntaje dado por el sexo) tienen un riesgo menor que los hombres con una puntuación de 1 (puntaje dado por la presencia de un factor de riesgo). Esto se corrobora con lo encontrado en el estudio de Nielsen21, 2018, en donde las mujeres con puntaje CHA2DS2-VASc de 1 tuvieron similar riesgo de ACV en comparación a los varones con puntaje CHA2DS2-VASc de 0. Por lo mencionado, se consideró iniciar terapia con anticoagulantes orales disponible en EsSalud para la prevención de eventos tromboembólicos en pacientes con CHA2DS2-VASc de ≥ 1 para varones y ≥ 2 para mujeres.
-
Para el manejo de FA valvular (portadores de prótesis valvular mecánica o presencia de estenosis mitral moderada o severa) se consideró incluir la anticoagulación con warfarina sin tener en cuenta el puntaje del índice CHA2DS2-VASc debido al gran riesgo de eventos tromboembólicos.
-
Para control y seguimiento de pacientes en tratamiento con inhibidores de vitamina K (warfarina), se decidió sugerir el uso del tiempo en rango terapéutico (TTR) calculado mediante el método Rosendaal22 o mediante el porcentaje de mediciones de INR dentro del rango terapéutico, teniendo en cuenta que el primero de ellos es más complejo23 y su implementación en la consulta podría ser difícil.
-
Se decidió reevaluar la anticoagulación con warfarina en los pacientes con pobre control de anticoagulación, como lo sugiere la GPC de NICE24 , 2014.
-
Si el pobre control de anticoagulación con warfarina no puede ser mejorado, se consideró evaluar los riesgos y beneficios de estrategias alternativas para prevenir eventos tromboembólicos (ACOD u oclusión de la orejuela de la aurícula izquierda [OOAI]) y discutirlas con el paciente. Dabigratrán 110mg es un ACOD disponible en EsSalud que puede utilizarse en este escenario25.
Pregunta 3: En pacientes con FA, ¿qué índice de riesgo se debería usar para predecir sangrado?
De la evidencia a la decisión:
En pacientes con FA que reciben terapia de anticoagulación es importante evaluar el riesgo de sangrado para la toma de decisiones respecto al tratamiento26. Existen diversos índices de riesgo de sangrado para estos pacientes: Hypertension, Abnormal renal or liver function, Stroke, Bleeding, Labile INRs, Elderly, Drugs/alcohol score (HASBLED)26,27, detallado en la tabla 4; ATRIA15; Hepatic or Renal Disease, Ethanol Abuse, Malignancy, Older Age, Reduced Platelet Count or Function, Re-Bleeding, Hypertension, Anemia, Genetic Factors, Excessive Fall Risk and Stroke score (HEMORR2HAGES)28; y CHADS229 .

La guía NICE 2014 realiza una RS y concluye que el índice HAS-BLED posee mejor capacidad de discriminación para sangrado en comparación a otras herramientas24. Sin embargo, recientemente se ha desarrollado un nuevo índice de riesgo: ATRIA; siendo necesario comparar la capacidad predictiva de ambos índices para sangrado mayor, en pacientes que reciben terapia de anticoagulación. Al respecto, la RS de Zhu30, 2015, encontró similar capacidad predictiva para sangrado mayor entre el índice ATRIA y el HAS-BLED, teniendo este último una reclasificación (Net Reclassification Improvement, NRI) del 20% sobre el índice ATRIA.
Si bien, los índice HAS-BLED y ATRIA tienen capacidad predictiva similar para sangrado mayor, HAS-BLED ofrece un mayor NRI, siendo además ampliamente utilizado y aceptado en nuestro contexto. Por ello se decidió formular una recomendación a favor del uso del índice HAS-BLED.
A pesar que la certeza de la evidencia fue muy baja, se consideró que el uso del índice ATRIA incurriría en mayores demoras y gastos por requerir depuración de creatinina, sin mostrar un beneficio evidente; por lo cual no se podría justificar su uso. Debido a ello, se decidió asignarle una fuerza de recomendación fuerte.
Puntos de BPC:
-
Se decidió emitir puntos de BPC sobre qué hacer cuando el paciente tenga alto riesgo de sangrado, la necesidad de discutir el tratamiento con el paciente, y la advertencia de no dejar de indicar la anticoagulación solo por el riesgo de caídas.
Pregunta 4: En pacientes con FA, ¿se debería brindar oclusión de la orejuela de la aurícula izquierda (OOAI) para la prevención de eventos tromboembólicos?
De la evidencia a la decisión:
Debido a que la orejuela de la aurícula izquierda es donde se forma el 90% de los trombos en pacientes con FA no valvular31, se han desarrollado diversas técnicas para aislarla de la circulación quirúrgicamente u ocluirla mediante la colocación percutánea de dispositivos intra-auriculares.
A pesar que la OOAI sería una alternativa terapéutica lógica en pacientes con FA, su eficacia y riesgos deben ser evaluados comparándola con la terapia habitual (anticoagulación oral). La RS de Tereshchenko19, 2016, comparó la eficacia y seguridad de los anticoagulantes (inhibidores de vitamina K) frente a dispositivos intra-auriculares en pacientes con FA no valvular, no encontrando diferencias entre ambas terapias para el riesgo de eventos tromboembólicos, sangrado y mortalidad por todas las causas. Además, se consideró que la OOAI puede presentar eventos adversos importantes como taponamiento cardiaco y embolización o trombosis asociada al dispositivo32.
Considerando que OOAI y anticoagulantes tuvieron similar eficacia, pero que OOAI podría tener eventos adversos importantes, se estableció que OOAI no podría ser una terapia de primera línea. Sin embargo, se consideró que podría ser una alternativa en pacientes en quienes la terapia con anticoagulantes sea contraindicada o no sea tolerada, por lo cual se decidió formular una recomendación a favor del uso de OOAI en este grupo de pacientes.
Debido a la certeza de evidencia baja, y que la OOAI requiere de equipamiento especial (sala de operaciones, equipos de cateterismo y personal capacitado), se decidió asignarle una fuerza de recomendación débil.
ESTRATEGIAS DE CONTROL DE LA FIBRILACIÓN AURICULAR
Pregunta 5: En pacientes con FA, ¿se debería optar por estrategias de control de ritmo o por estrategias de control de frecuencia?
De la evidencia a la decisión:
Para el manejo de FA se pueden realizar estrategias de control de ritmo que tienen por objetivo recuperar el ritmo sinusal (como son: antiarrítmicos, beta-bloqueadores), o las estrategias de control de frecuencia que buscan reducir la frecuencia ventricular (como son: beta-bloqueadores, bloqueadores de canales de calcio, digoxina o también amiodarona)33. Ambas estrategias han demostrado mejorar los síntomas y la calidad de vida de los pacientes con FA33; sin embargo, es importante esclarecer si existe superioridad de una sobre la otra en términos de desenlaces a largo plazo.
En la RS de Sethi34, 2017, no se encontraron diferencias para el riesgo de mortalidad por todas las causas, ACV, ni calidad de vida entre ambas estrategias; sin embargo, se encontró que los pacientes con terapia de control de ritmo presentaron mayor riesgo de efectos adversos severos (muerte, discapacidad u hospitalización prolongada) durante un seguimiento de 24 meses.
Considerando que las estrategias de control de frecuencia tienen similar eficacia, pero menor riesgo de efectos adversos severos en comparación con las estrategias de control de ritmo, se decidió formular una recomendación a favor del uso de estrategias de control de frecuencia.
Debido a que la certeza de la evidencia fue muy baja, se decidió asignarle una fuerza de recomendación débil.
Puntos de BPC:
-
El GEG en consenso decidió emitir un punto de BPC especificando en qué escenarios se podría optar por una estrategia de control de ritmo.
Pregunta 6: En pacientes con FA en los que se opte por una estrategia de control de frecuencia, ¿qué estrategia de control de frecuencia se debe usar?
De la evidencia a la decisión:
Las estrategias de control de frecuencia incluyen a fármacos con efecto cronotrópico negativo e inhibición de la conducción por el nodo AV como los beta-bloqueadores35, los bloqueadores de canales de calcio no-dihidropiridínicos (verapamilo y diltiazem)36,37 y la digoxina que es un fármaco inotrópico positivo38. Debido a posibles diferencias en el balance de riesgo/beneficios, se evaluó cuáles de estos fármacos deberían usarse de primera línea.
La RS de Sethi39, 2018, encontró superioridad de los beta-bloqueadores frente a digoxina en reducción de frecuencia cardiaca en las primeras 6 horas; sin hallar diferencias entre las 6 y 24 horas. Sin embargo, al comparar digoxina frente a los bloqueadores de canales de calcio no hubo diferencias para ambos periodos de tiempo.
Respecto a los eventos adversos, las RS incluidas encontraron que la digoxina en comparación con otras alternativas tuvo similar mortalidad a corto plazo (seguimiento de 2 horas hasta 4 semanas), mayor mortalidad a largo plazo (seguimiento de 1 a 4,7 años) similar calidad de vida y similar riesgo de eventos adversos severos24,40.
Considerando que el uso de betabloqueadores fue superior a digoxina y similar a los bloqueadores de canales de calcio para el control de la frecuencia cardiaca, teniendo además un menor riesgo de mortalidad a largo plazo en comparación con digoxina, se formuló una recomendación a favor del uso de beta-bloqueadores o bloqueadores de canales de calcio en pacientes con FA que requieran una estrategia de control de frecuencia.
A pesar que la certeza de la evidencia fue muy baja, se consideró a los betabloqueadores y bloqueadores de canales de calcio como terapia de primera elección antes que digoxina, por lo cual se decidió asignarle una fuerza de recomendación fuerte.
Puntos de BPC:
A continuación, se justificarán los puntos de BPC más relevantes:
-
Debido que los beta-bloqueadores pueden ser usados en personas con o sin insuficiencia cardiaca, se decidió establecer su uso como primera opción en pacientes con FA que requieran una estrategia de control de frecuencia.
-
Debido a su efecto inotrópico negativo36,37, el uso de bloqueadores de canales de calcio no dihidropiridínicos (verapamilo o diltiazem) debería ser utilizados en FA con fracción de eyección del ventrículo izquierdo ≥ 40%.
-
Se consideró importante restringir el uso de digoxina en pacientes sedentarios con FA no paroxística por ser un grupo específico que podría beneficiarse con dicha terapia24.
-
Debido a los eventos adversos por amiodarona, no debería ser indicada para control de frecuencia a largo plazo24 y su uso debería reservarse solo cuando la monoterapia y terapia combinada con beta-bloqueadores, bloqueadores de canales de calcio o digoxina no fuese exitosa13.
-
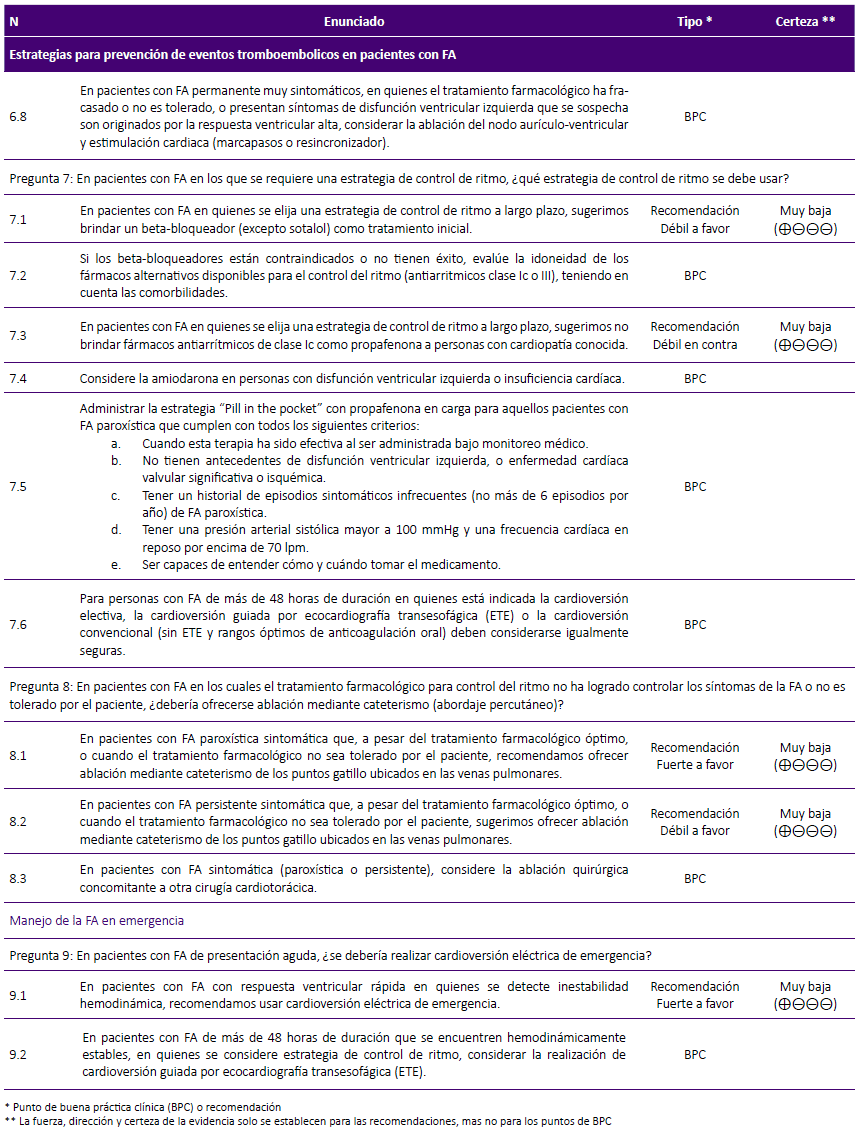
Teniendo en cuenta a la RS de la guía NICE24, 2014, que encontró que los pacientes sometidos a ablación del nodo AV e implante de marcapaso presentaron mejor calidad de vida y menor persistencia de palpitaciones en comparación a los sometidos a tratamiento farmacológico, se decidió considerar que, en pacientes con FA permanente muy sintomáticos, en quienes el tratamiento farmacológico ha fracasado, no es tolerado, o presentan síntomas de disfunción ventricular izquierda que se sospecha son originados por la respuesta ventricular alta, se considere la ablación del nodo aurículo-ventricular y estimulación cardiaca (marcapasos o resincronizador).
Pregunta 7: En pacientes con FA en los que se requiere una estrategia de control de ritmo, ¿qué estrategia de control de ritmo se debe usar?
De la evidencia a la decisión:
Si se elige una estrategia de control de ritmo, el objetivo de esta terapia es recuperar el ritmo sinusal y mantenerlo. Esta pregunta buscó comprar las distintas estrategias de control de ritmo (antiarrítmicos y beta-bloqueadores).
La RS de Lafuente-Lafuente41, 2015, encontró que en comparación con el control, el sotalol presentó mayor mortalidad por todas las causas, retiro por efectos adversos y efectos pro-arrítmicos; pero menor recurrencia de FA. Los antiarrítmicos Ia presentaron mayor mortalidad, similar retiro por efectos adversos y efectos pro-arrítmicos; pero menor recurrencia de FA. Tanto los antiarrítmicos 1C como los beta-bloqueadores presentaron similar mortalidad, mayor retiro por efectos adversos y efecto pro-arritmico; pero menor recurrencia de FA.
Considerando que, a diferencia del sotalol y los antiarrítimicos 1A, los betabloqueadores no se asociaron a mayor mortalidad, y que presentan menores contraindicaciones en la mayoría de pacientes con comorbilidades a comparación de los antiarrítmicos 1C, se decidió emitir una recomendación a favor del uso de beta-bloqueadores (excepto sotalol) como la terapia inicial de manejo. Debido a que la certeza de la evidencia fue muy baja, se decidió asignarle una fuerza de recomendación débil.
Además, como lo menciona la guía NICE24, 2014, el GEG consideró que en pacientes con cardiopatía estructural o isquémica conocida, el riesgo de brindar fármacos antiarrítmicos clase 1C como propafenona sería mayor al beneficio, por lo cual se decidió emitir una recomendación en contra a su indicación. Considerando que la certeza de la evidencia fue muy baja, se decidió asignarle una fuerza de recomendación débil.
Puntos de BPC:
-
Se emitieron puntos de BPC sobre qué hacer cuando los beta-bloqueadores están contraindicados o su uso no tenga éxito, y sobre cuándo considerar la indicación de amiodarona.
-
Se consideró el uso de "pill in the pocket" en un grupo de pacientes con FA paroxística, debido a su eficacia para revertir los episodios de FA paroxística, y que a pesar de su eficacia inferior a la terapia antiarrítmica continua o al manejo intrahospitalario, proporciona un ahorro importante de recursos y brinda la oportunidad de obtener un manejo más rápido42.
-
Considerando que no hay diferencia en la tasa de recuperación del ritmo, riesgo de eventos tromboembólicos y mortalidad por todas las causas en pacientes sometidos a cardioversión eléctrica guiada por ETE frente a la no guiada43, se decidió sugerir que, si se opta por una cardioversión electiva, se podría utilizar la cardioversión guiada o no por ETE, siempre que haya personal capacitado e infraestructura adecuada.
Pregunta 8: En pacientes con FA en los cuales el tratamiento farmacológico para control del ritmo no ha logrado controlar los síntomas de la FA o no es tolerado por el paciente, ¿debería ofrecerse ablación mediante cateterismo?
De la evidencia a la decisión:
La terapia de ablación se basa en el aislamiento eléctrico de los puntos gatillo de la FA ubicados generalmente en las venas pulmonares, y se realiza aplicando alguna forma de energía (usualmente radiofrecuencia), para producir una lesión controlada que evite la despolarización arrítmica de este conjunto de células, aislando eléctricamente las venas pulmonares de la aurícula izquierda. Puede realizarse por cateterismo (percutáneamente) o quirúrgicamente44.
Esta pregunta busca evaluar, en pacientes con FA, el posible uso de ablación o continuar brindando tratamiento farmacológico para control del ritmo, cuando con el tratamiento de primera línea no se consiguió el control de síntomas o la medicación no se tolera. Esto se evaluó para FA paroxística y no paroxística.
Con respecto a FA paroxística, la RS de Hakalahti45, 2014, encontró que los pacientes que recibieron ablación tuvieron menor riesgo de presentar recurrencia de FA. Con respecto a FA no paroxística, la RS de Nyong46, 2016, encontró que los pacientes que recibieron ablación mediante cateterismo (abordaje percutáneo) tuvieron menor riesgo de arritmia auricular o recurrencia de FA, menor riesgo de necesitar cardioversión, menor hospitalizaciones de causa cardiaca, menor bradicardia significativa (o necesidad de marcapasos) y similar riesgo de complicaciones en comparación con aquellos que recibieron tratamiento farmacológico para control del ritmo.
FA paroxística: Considerando que la ablación mediante cateterismo tiene mayor eficacia en el manejo de FA paroxística frente al tratamiento farmacológico, pero es menos factible y requiere mayor uso de recursos, se formuló una recomendación a favor de la ablación mediante cateterismo solo cuando el tratamiento farmacológico no se tolere o no sea exitoso. A pesar que la certeza de la evidencia fue muy baja, debido a la experiencia existente en el manejo de FA paroxística con ablación en nuestro contexto y a la falta de alternativas factibles en pacientes con tratamiento farmacológico no exitoso, se decidió emitir una fuerza de recomendación fuerte.
FA persistente: Dado que la ablación mediante cateterismo tiene mayor eficacia en el manejo de FA persistente frente al tratamiento farmacológico, con similares complicaciones para ambas terapias, pero al ser menos factible y requerir un mayor uso de recursos, se formuló una recomendación a favor del uso de la ablación mediante cateterismo, solo cuando el tratamiento farmacológico no se tolere o no sea exitoso. Considerando que la certeza de la evidencia fue muy baja, se decidió emitir una fuerza de recomendación débil.
Puntos de BPC:
-
La RS de Wang47, 2018, comparó la realización concomitante de cirugía cardiaca y ablación de la aurícula izquierda versus la realización exclusiva de cirugía cardiaca, concluyendo que la ablación quirúrgica concomitante es una estrategia segura y eficaz; por lo cual se decidió considerar realizar la ablación quirúrgica concomitante en pacientes con FA sintomática que serán sometidos a cirugía cardiotorácica.
MANEJO DE LA FA EN EMERGENCIA
Pregunta 9: En pacientes con FA de presentación aguda, ¿se debería realizar cardioversión eléctrica de emergencia?
De la evidencia a la decisión:
La FA de presentación aguda es aquella con duración menor a 48 horas y presencia de síntomas como palpitaciones, hipotensión, entre otros24. Esta puede presentarse en dos escenarios posibles: 1) cuando la FA es de nueva aparición (paciente con FA cuyos síntomas son nuevos y se sospecha que la FA comenzó en < 48 h); y 2) cuando falla el control de la frecuencia ventricular en pacientes con FA preexistente persistente o permanente48.
En estos casos, las estrategias de manejo variarán según las circunstancias clínicas, y se deberá considerar: 1) el estado hemodinámico del paciente, 2) si es probable que la FA sea un evento primario, 3) la duración de la FA y el consiguiente riesgo tromboembólico si el ritmo sinusal se restablece de forma aguda, 4) las comorbilidades asociadas y si el tratamiento de éstas mejorará el control de la frecuencia o la probabilidad de restablecer y mantener el ritmo sinusal48.
En el manejo de un paciente con presentación aguda de FA las estrategias principales son el control de la frecuencia cardiaca y la restauración del ritmo. Para el control del ritmo, se plantea la posibilidad de realizar cardioversión eléctrica de emergencia.
La RS de Cohn49, 2013, encontró una incidencia de control de ritmo cardíaco de 85,5% a 97% y una incidencia de eventos adversos de 0,06% (1 evento de accidente cerebrovascular) al realizar cardioversión eléctrica de emergencia en pacientes con FA hemodinámicamente inestables. Considerando esto, se decidió formular una recomendación a favor del uso de cardioversión eléctrica de emergencia. A pesar que la certeza de la evidencia fue muy baja, se consideró que la cardioversión eléctrica de emergencia es una intervención factible, que puede significar un ahorro de recursos a largo plazo y es la única intervención disponible para este grupo de pacientes en riesgo de muerte, por lo cual se decidió emitir una fuerza de recomendación fuerte.
Puntos de BPC:
-
Se consideró importante evaluar la cardioversión guiada por ETE en emergencias, cuando la FA tenga una duración mayor de 48 horas y el paciente se encuentre hemodinámicamente estable. Como se mencionó en la pregunta 7, se sabe que no hay diferencia en la tasa de recuperación de ritmo, riesgo de eventos tromboembólicos y mortalidad por todas las causas en pacientes sometidos a cardioversión eléctrica guiada frente a la no guiada por ETE43. Por ello, se decidió considerar el uso de ETE para estos casos siempre que haya personal capacitado e infraestructura adecuada.
AGRADECIMIENTOS
Agradecemos al Dr. Felix Alonso Re-villa Manchego, médico especialista en cardiología del Hospital Nacional Dos de Mayo, por realizar la revisión externa de la presente guía.
REFERENCIAS BIBLIOGRÁFICAS
1. Rahman F, Kwan GF, Benjamin EJ. Global epidemiology of atrial fibrillation. Nat Rev Cardiol. 2014;11(11):639-54. DOI: 10.1038/nrcar-dio.2014.118. [ Links ]
2. Camm AJ, Lip GY, De Caterina R, Savelieva I, Atar D, Hohnloser SH, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 2012;33(21):2719- 47. DOI: 10.1093/eurheartj/ehs253. [ Links ]
3. Ruff CT, Bhatt DL, Steg PG, Gersh BJ, Alberts MJ, Hoffman EB, et al. Long-term cardiovascular outcomes in patients with atrial fibrillation and atherothrombosis in the REACH Registry. Int J Cardiol. 2014;170(3):413-8. DOI: 10.1016/j.ijcard.2013.11.030. [ Links ]
4. Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA. 2001;285(22):2864-70. DOI: 10.1001/jama.285.22.2864. [ Links ]
5. Schnabel RB, Rienstra M, Sullivan LM, Sun JX, Moser CB, Levy D, et al. Risk assessment for incident heart failure in individuals with atrial fibrillation. Eur. J. Heart Fail. 2013;15(8):843-9. DOI: 10.1093/eurjhf/hft041. [ Links ]
6. Soliman EZ, Safford MM, Muntner P, Khodneva Y, Dawood FZ, Zakai NA, et al. Atrial fibrillation and the risk of myocardial infarction. JAMA Intern Med. 2014;174(1):107-14. DOI: 10.1001/jamainternmed.2013.11912. [ Links ]
7. Udompanich S, Lip GY, Apostolakis S, Lane DA. Atrial fibrillation as a risk factor for cognitive impairment: a semi-systematic review. QJM. 2013;106(9):795-802. DOI: 10.1093/qjmed/hct129. [ Links ]
8. Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011;64(4):401-6. DOI: 10.1016/j.jclinepi.2010.07.015. [ Links ]
9. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013;66(7):719-25. DOI: 10.1016/j.jclinepi.2012.03.013. [ Links ]
10. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest. 2010;137(2):263-72. DOI: 10.1378/chest.09-1584. [ Links ]
11. MDCalc, CHA2 DS2 -VASc Score for Atrial Fibrillation Stroke Risk [Internet]. United States: MDCalc. 2005 [actualizado 17 oct 2018; citado 4 abr 2018]. Disponible en: https://www.mdcalc.com/cha2ds2-vasc-score-atrial-fibrillation-stroke-risk. [ Links ]
12. Lip GY. The CHA2DS2-VASc score for stroke risk stratification in patients with atrial fibrillation: a brief history. Eur Heart J. 2015;36:2880 - 2885. DOI: 10.1093/eurheartj/ehv431. [ Links ]
13. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37(38):2893- 2962. DOI: 10.1093/eurheartj/ehw210. [ Links ]
14. MDCalc, ATRIA Stroke Risk Score [Internet]. United States: MDCalc. 2005 [actualizado 25 may 2018; citado 4 abr 2018]. Disponible en: https://www.mdcalc.com/atria-stroke-risk-score. [ Links ]
15. MDCalc, ATRIA Bleeding Risk Score [Internet]. United States: MDCalc. 2005 [actualizado 25 May 2018; citado 4 abr 2018]. Disponible en: https://www.mdcalc.com/atria-bleeding-risk-score. [ Links ]
16. Chen JY, Zhang AD, Lu HY, Guo J, Wang FF, Li ZC. CHADS2 versus CHA2DS2-VASc score in assessing the stroke and thromboembolism risk stratification in patients with atrial fibrillation: a systematic review and meta-analysis. J Geriatr Cardiol. 2013;10(3):258-66. DOI: 10.3969/j.issn.1671-5411.2013.03.004. [ Links ]
17. Zhu W, Fu L, Ding Y, Huang L, Xu Z, Hu J, et al. Meta-analysis of ATRIA versus CHA2DS2-VASc for predicting stroke and thromboembolism in patients with atrial fibrillation. Int J Cardiol. 2017;227:436-42. DOI: 10.1016/j.ijcard.2016.11.015. [ Links ]
18. Steinberg BA, Piccini JP. Anticoagulation in atrial fibrillation. BMJ. 2014;348:g2116. DOI: https://doi.org/10.1136/bmj.g2116. [ Links ]
19. Tereshchenko LG, Henrikson CA, Cigarroa J, Steinberg JS. Comparative Effectiveness of Interventions for Stroke Prevention in Atrial Fibrillation: A Network Meta-Analysis. J Am Heart Assoc. 2016;5(5):e003206. DOI: 10.1161/JAHA.116.003206. [ Links ]
20. Van Doorn S, Debray TPA, Kaasenbrood F, Hoes AW, Rutten FH, Moons KGM, et al. Predictive performance of the CHA2DS2-VASc rule in atrial fibrillation: a systematic review and meta-analysis. J Thromb Haemost. 2017;15(6):1065-77. DOI: 10.1111/jth.13690. [ Links ]
21. Nielsen PB, Skjoth F, Overvad TF, Larsen TB, Lip GYH. Female Sex Is a Risk Modifier Rather Than a Risk Factor for Stroke in Atrial Fibrillation: Should We Use a CHA2DS2-VA Score Rather Than CHA2DS2- VASc?. Circulation. 2018;137(8):832-40. DOI: 10.1161/CIRCULATIONAHA.117.029081. [ Links ]
22. Rosendaal FR, Cannegieter SC, Van der Meer FJ, Briet E. A method to determine the optimal intensity of oral anticoagulant therapy. Thromb Haemost. 1993;69(3):236-9. [ Links ]
23. Caldeira D, Cruz I, Morgado G, Stuart B, Gomes AC, Martins C, et al. Is the time in therapeutic range using the ratio of tests equivalent to the Rosendaal method? Blood Coagul Fibrinolysis. 2015;26(8):972- 6. DOI: 10.1097/MBC.0000000000000312. [ Links ]
24. National Clinical Guideline Centre (NICE). Atrial fibrillation: the management of atrial fibrillation. London: National Institute for Health and Care Excellence (UK); 2014. (NICE Clinical Guidelines, No. 180.) Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK248059/. [ Links ]
25. IETSI-EsSalud. Eficacia y seguridad de Dabigatran 110mg en pacientes adultos con fibrilación auricular no valvular de alto riesgo tromboembólico y respuesta inadecuada a warfarina. Dictamen preliminar de evaluación de Tecnología Sanitaria n° 043-SDEPFYOTS-DETS IETSI-2016. Lima, Perú. 2016. [ Links ]
26. Lip GY, Banerjee A, Lagrenade I, Lane DA, Taillandier S, Fauchier L. Assessing the risk of bleeding in patients with atrial fibrillation: the Loire Valley Atrial Fibrillation project. Circ Arrhythm Electrophysiol. 2012;5(5):941-8. DOI: 10.1161/CIRCEP.112.972869 [ Links ]
27. MDCalc, HAS-BLED Score for Major Bleeding Risk [Internet]. United States: MDCalc. 2005 [actualizado 25 May 2018; citado 10 abr 2018]. Disponible en: https://www.mdcalc.com/has-bled-score-majorbleeding-risk#next-steps. [ Links ]
28. MDCalc, HEMORR2 HAGES Score for Major Bleeding Risk [Internet]. United States: MDCalc. 2005 [actualizado 25 May 2018; citado 14 abr 2018]. Disponible en: https://www.mdcalc.com/hemorr2hages-scoremajor-bleeding-risk. [ Links ]
29. MDCalc, CHADS2 Score for Atrial Fibrillation Stroke Risk [Internet]. United States: MDCalc. 2005 [actualizado 25 may 2018; citado 14 abr 2018]. Disponible en: https://www.mdcalc.com/chads2-score-atrialfibrillation-stroke-risk. [ Links ]
30. Zhu W, He W, Guo L, Wang X, Hong K. The HASBLED score for predicting major bleeding risk in anticoagulated patients with atrial fibrillation: a systematic review and meta-analysis. Clin Cardiol. 2015;38(9):555-61. DOI: 10.1002/clc.22435. [ Links ]
31. Alli OO, Holmes DR. Left atrial appendage occlusion for stroke prevention. Curr Probl Cardiol. 2015;40(10):429-76. DOI: 10.1016/j.cpcardiol.2015.06.005. [ Links ]
32. Lempereur M, Aminian A, Freixa X, Gafoor S, Kefer J, Tzikas A, et al. Device-associated thrombus formation after left atrial appendage occlusion: A systematic review of events reported with the Watchman, the Amplatzer Cardiac Plug and the Amulet. Catheter Cardiovasc Interv. 2017;90(5):e111-e121. DOI: 10.1002/ccd.26903. [ Links ]
33. Halsey C, Chugh A. Rate Versus Rhythm Control for Atrial Fibrillation. Heart Failure Clinics. 2016;12(2):193-203. DOI: https://doi.org/10.1016/j.hfc.2015.08.016. [ Links ]
34. Sethi NJ, Feinberg J, Nielsen EE, Safi S, Gluud C, Jakobsen JC. The effects of rhythm control strategies versus rate control strategies for atrial fibrillation and atrial flutter: A systematic review with meta-analysis and Trial Sequential Analysis. PloS One. 2017;12(10):e0186856. DOI: 10.1371/journal.pone.0186856. [ Links ]
35. Dorian P, Angaran P. beta-Blockers and atrial fibrillation: hypertension and other medical conditions influencing their use. Can J Cardiol. 2014;30(5):S38- 41. DOI: https://doi.org/10.1016/j.cjca.2013.09.029. [ Links ]
36. National Center for Biotechnology Information. Pub- Chem Database. Verapamil, CID=2520 [Internet]. United States: National Institutes of Health (NIH). 2004 [citado 14 abr 2018]. Disponible en: https://pubchem.ncbi.nlm.nih.gov/compound/2520. [ Links ]
37. National Center for Biotechnology Information. PubChem Database. Diltiazem hydrochloride, CID=62920 [Internet]. United States: National Institutes of Health (NIH). 2004 [citado 14 abr 2018]. Disponible en: https://pubchem.ncbi.nlm.nih.gov/compound/62920. [ Links ]
38. National Center for Biotechnology Information. Pub- Chem Database. Digoxin, CID=2724385 [Internet]. United States: National Institutes of Health (NIH). 2004 [citado 14 abr 2018]. Disponible en: https://pubchem.ncbi.nlm.nih.gov/compound/2724385. [ Links ]
39. Sethi NJ, Nielsen EE, Safi S, Feinberg J, Gluud C, Jakobsen JC. Digoxin for atrial fibrillation and atrial flutter: A systematic review with meta-analysis and trial sequential analysis of randomised clinical trials. PloS One. 2018;13(3):e0193924. DOI: 10.1371/journal.pone.0193924. [ Links ]
40. Qureshi W, O’Neal WT, Soliman EZ, Al-Mallah MH. Systematic review and meta-analysis of mortality and digoxin use in atrial fibrillation. Cardiol J. 2016;23(3):333-43. DOI: 10.5603/CJ.a2016.0016.
41. Lafuente-Lafuente C, Valembois L, Bergmann JF, Belmin J. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev. 2015(3):Cd005049. DOI: 10.1002/14651858.CD005049.pub4. [ Links ]
42. Saborido CM, Hockenhull J, Bagust A, Boland A, Dickson R, Todd D. Systematic review and costeffectiveness evaluation of ‘pill-in-the- pocket’ strategy for paroxysmal atrial fibrillation compared to episodic in-hospital treatment or continuous antiarrhythmic drug therapy. Health Technol Assess. 2010;14(31):iii-iv, 1-75. DOI: 10.3310/hta14310.
43. Klein AL, Grimm RA, Murray RD, AppersonHansen C, Asinger RW, Black IW, et al. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med. 2001;344(19):1411-20. DOI: 10.1056/NEJM200105103441901. [ Links ]
44. Santangeli P, Marchlinski FE. Techniques for the provocation, localization, and ablation of nonpulmonary vein triggers for atrial fibrillation. Heart Rhythm. 2017;14(7):1087-96. DOI: 10.1016/j.hrthm.2017.02.030. [ Links ]
45. Hakalahti A, Biancari F, Nielsen JC, Raatikainen MJ. Radiofrequency ablation vs. antiarrhythmic drug therapy as first line treatment of symptomatic atrial fibrillation: systematic review and meta- analysis. Europace. 2015;17(3):370-8. DOI: 10.1093/europace/euu376. [ Links ]
46. Nyong J, Amit G, Adler AJ, Owolabi OO, Perel P, Prieto-Merino D, et al. Efficacy and safety of ablation for people with non-paroxysmal atrial fibrillation. Cochrane Database Syst Rev. 2016;11:Cd012088. DOI: 10.1002/14651858.CD012088.pub2. [ Links ]
47. Wang X, Wang C, Ye M, Lin J, Jin J, Hu Q, et al. Left atrial concomitant surgical ablation for treatment of atrial fibrillation in cardiac surgery: A meta-analysis of randomized controlled trials. PloS One. 2018;13(1):e0191354. DOI: 10.1371/journal.pone.0191354. [ Links ]
48. Long B, Robertson J, Koyfman A, Maliel K, Warix JR. Emergency medicine considerations in atrial fibrillation. Am J Emerg Med. 2018;36(6):1070-8. DOI: 10.1016/j.ajem.2018.01.066. [ Links ]
49. Cohn BG, Keim SM, Yealy DM. Is emergency department cardioversion of recent-onset atrial fibrillation safe and effective?. J Emerg Med. 2013;45(1):117-27. DOI: 10.1016/j.jemermed.2013.01.027. [ Links ]
Conflictos de interés: Richard Soto Becerra y Mario Raúl Cabrera Saldaña declaran haber recibido financiamiento de la compañía farmacéutica Boehringer Ingelheim por concepto de charlas o presentaciones de capacitación del anticoagulante dabigatrán en pacientes con fibrilación auricular. Carolina Guevara Caicedo declara haber recibido financiamiento de la compañía farmacéutica Boehringer Ingelheim, por participar en un proyecto de investigación en el cual recolectó información de pacientes con fibrilación auricular. Los demás autores declaran no tener conflicto de interés financiero y no financiero, con relación a los temas descritos en el presente documento.
Fuente de financiamiento: Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), EsSalud, Perú.
Contribuciones de autoría: Todos los autores participaron en la realización de la guía. JHZT, SGL, CAAR y KPB se encargaron de las búsquedas sistemáticas, la evaluación de calidad de los estudios y la evaluación de la certeza de la evidencia para cada pregunta. DUI redactó la primera versión del artículo. Todos los autores revisaron y aprobaron la versión final del artículo.
Correspondencia:
Raúl Timaná-Ruiz
raul.timana@essalud.gob.pe
Recibido: 13 de junio 2019
Aceptado: 24 de junio 2019
Publicación en línea: 28 de junio 2019














