Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Medicina
Print version ISSN 1025-5583
An. Fac. med. vol.80 no.3 Lima July/Sep. 2019
http://dx.doi.org/10.15381/anales.803.16860
REPORTE DE CASOS
Miasis oral nosocomial en una unidad de cuidados intensivos
Nosocomial oral myiasis in an intensive care unit
Alejandro Gutierrez1,2,a
1 Hospital Nacional Edgardo Rebagliati Martins, EsSalud. Lima, Perú.
2 Facultad de Odontología, Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Cirujano dentista, especialista en cirugía oral y maxilofacial, magister en gerencia de servicios de salud. ORCID: https://orcid.org/0000-0002-0705-7144.
RESUMEN
Presentamos un caso de miasis nosocomial ocurrido en un hospital peruano, cuyo agente etiológico identificado fue Cochliomyia hominivorax, en un paciente de 82 años que estuvo internado en una unidad de cuidados intensivos por insuficiencia respiratoria aguda tipo I, y sepsis por absceso hepático, el cual fue sometido a intubación para brindarle respiración mecánica asistida. Al tercer día de ingreso a UCI se observó presencia de múltiples larvas maduras de tercer estadio en cavidad oral. El tratamiento consistió en la extracción manual de las larvas y terapia de ivermectina a razón de 0,2 miligramos por kilogramo de peso con respuesta favorable. Al mes de ser diagnosticado de miasis el paciente fallece por complicaciones de sepsis hepática y neumonía.
Palabras Clave: Miasis; Infección Hospitalaria; Infección por Gusano Barrenador (fuente: DeCS BIREME).
ABSTRACT
We present the case of nosocomial myiasis, which occurred in a Peruvian hospital, whose etiological agent was identified as Cochliomyia hominivorax, associated with an 82-year-old patient who was admitted to an intensive care unit, due to acute respiratory failure type I, and sepsis due to abscess hepatic, which underwent intubation to provide assisted mechanical ventilation. On the third day of admission to the ICU, multiple mature larvae were observed in the oral cavity. The treatment consisted of the manual extraction of the larvae, and ivermectin therapy at a rate of 0,2 milligrams per kilogram of weight with favorable response. One month after being diagnosed with myiasis. The patient died of complications of hepatic sepsis and pneumonia.
Keywords: Myiasis; Cross Infection; Screw Worm infection (source: MeSH NLM).
INTRODUCCIÓN
La miasis, derivado del griego (mya, o mosca), fue propuesta por primera vez por Hope (1) para definir las parasitosis de los humanos causadas por larvas de dípteros; y la ocurrencia en la cavidad oral fue descrita por primera vez por Laurence en 1909 (2). Las miasis nosocomiales u hospitalarias son infestaciones que se adquieren durante la hospitalización; por lo tanto, no estaban presentes ni estaban en proceso de desarrollo en el momento de la admisión en el hospital (3). Según Hira, se consideran miasis nosocomiales aquellas que se manifiestan luego de tres días de la fecha de internamiento de un paciente (4).
Existen al menos veinte especies de moscas responsables de causar miasis, cuyas larvas se alimentan de los tejidos vivos o necróticos de su hospedero a fin de completar su ciclo de vida, siendo las larvas de Cochliomyia hominivorax (Coquerel, 1858) y Dermatobia hominis (Wiedemann, 1819) los agentes causales más comunes de miasis humanas en America (5).
En la literatura médica nacional se han reportado casos de miasis asociados a Cochliomyia hominivorax (6,7,8), Dermatotobia hominis (9), y Oestrus Ovis (10); sin embargo, solo se encontró un caso sobre miasis nosocomial (11). En general, la literatura coincide en que existe un subregistro de casos de miasis nosocomiales (3). Para analizar la situación sobre casos publicados de miasis oral en una unidad de cuidados intensivos en el Perú, se realizó una búsqueda en las siguientes bases de datos: Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS: http://lilacs.bvsalud.org), Scientific Electronic Library Online (SciELO: http://www.scielo.org), y PubMed (http://www.ncbi.nlm.nih.gov/pubmed), esta búsqueda se realizó tanto en idioma inglés como en español, al finalizar la pesquisa no se obtuvo ningún resultado. Así, presentamos el caso de un paciente de 82 años con miasis oral, la cual se manifestó mientras estuvo hospitalizado en una unidad de cuidados intensivos.
REPORTE DE CASO
Paciente varon de 82 años, con antecedentes de hipertensión arterial (HTA), enfermedad de Alzheimer, demencia senil, dependiente total, fue admitido en sala de emergencia de un hospital de Lima por presentar deposiciones abundantes, alza térmica y vómitos explosivos. Fue evaluado como síndrome neuroléptico maligno y síndrome febril de etiología desconocida. Al noveno día fue hospitalizado por persistencia y agravamiento de síntomas, donde realizaron la analítica correspondiente y evaluación para descarte de neoplasia vesicular con compromiso hepatico o absceso hepático,
Al décimo día de su hospitalización fue transferido a unidad de cuidados intensivos (UCI) por presentar insuficiencia respiratoria aguda tipo 1, sepsis por absceso hepático, HTA no controlada, y sometido a intubación para brindarle respiración mecánica asistida. Al tercer día de ingreso a UCI se observó presencia de múltiples larvas en cavidad oral (Figura 1A), las cuales fueron retiradas manualmente y enviadas al servicio de microbiología. Al día siguiente fue evaluado por el servicio de odontoestomatologia; al examen no se evidenciaron larvas en cavidad oral, se encuentró enfermedad periodontal, sialorrea, bolsas periodontales, halitosis e higiene oral deficiente. Se solicitó tomografía computarizada para descarte de extensión de miasis a fosas nasales o senos maxilares, y se sugirió iniciar tratamiento sistémico con ivermectina a razón de 0,2 miligramos por kilo de peso y lavados con clorhexidina al 0,12%.
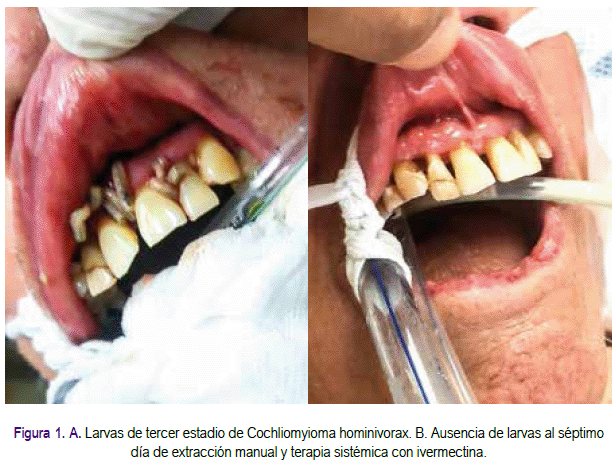
Al realizar controles periódicos, no se reportó presencia de larvas durante la siguiente semana (Figura 1B). El resultado del examen directo parasitológico concluyó la presencia de larvas de tercer estadio de Cochliomyia hominivorax. El resultado de la tomografía salió negativo con respecto a la presencia de larvas en fosas nasales o senos maxilares.
Después de 27 días de haber ingresado a UCI fue enviado a unidad de cuidados intermedios, y posteriormente a piso de hospitalización, donde fallece a causa de sepsis por absceso hepático y neumonía.
DISCUSIÓN
El primer caso de gusano barrenador del ganado o Cochliomyioma hominivorax en humanos, registrado en los Estados Unidos, data de 1833 cuando un hombre escalpado por indígenas murió a causa de la infestación del parásito. En 1858 el entomólogo francés Charles Coquerel publicó el primer artículo científico describiendo un caso colectado de un humano en la prisión de la Isla del Diablo, en la Guyana Francesa, de donde proviene el nombre de hominivorax, o "devorador de hombres".
Este gusano es oriundo del continente americano en donde se le encuentra en forma endémica en 30 millones de kilómetros cuadrados, superficie que contiene a todos los países y territorios de la América del Sur, con la excepción de Chile. En tanto en el Caribe afecta a Cuba, Haití, Jamaica, República Dominicana y Trinidad y Tobago. Mediante la técnica de los insectos estériles con rayos gama de cobalto 60, se ha logrado erradicar la plaga en los Estados Unidos, México, Centroamérica y el norte de África (12). Las moscas responsables prefieren un ambiente caliente y húmedo, de modo que la miasis está restringida a los meses de verano en zonas de clima templado, pero puede ocurrir en todos los meses del año en países tropicales y subtropicales (13).
Por ser un organismo holometábolo, el ciclo biológico de la mosca Cochliomyia Hominivorax atraviesa por cuatro etapas: mosca o adulto, huevecillo, larva y pupa o crisálida. El ciclo se inicia con el apareo de dos moscas, adultas y fértiles (macho y hembra), después de un corto periodo la mosca hembra comienza a buscar una herida fresca en cualquier tipo de animal de sangre caliente (incluyendo humanos), para depositar sus huevos. Cuando encuentra la herida apropiada, la hembra puede depositar hasta 1600 huevos a los bordes de las heridas. Se incuban entre 12 y 24 horas, y el primer grupo de larvas sale de los huevos y penetra la herida. Las larvas se alimentan únicamente de tejidos vivos; estas permanecen en la herida aproximadamente 7 días. Las larvas o gusanos se dirigen a la entrada de la herida y penetran dejando los espiráculos posteriores en la superficie para respirar; durante este período de 5 a 7 días se realiza el desarrollo larvario del primer al tercer estadío. La larva de tercer estadio sale y cae al suelo, donde se entierra (pupa), y dependiendo de la temperatura y humedad del suelo se convierte en adulta en un período de 5 a 7 días, para iniciar nuevamente el ciclo de vida.
En relación a la distribución entre los sexos, la miasis oral es más común en el sexo masculino. Pese a que abarca todos los grupos etáreos, su ocurrencia en niños puede ocasionar daños más severos o llevar a la muerte (13). La miasis oral es muy rara en personas sanas; sin embargo, existen reportes de infestación de tejido sano, sugiriendo que la hipersalivación es un factor predisponente (14). En pacientes sistémicamente comprometidos, la higiene personal inadecuada, el alcoholismo, la senilidad, el retraso mental, la hemiplejia y la respiración bucal durante el sueño pueden facilitar el desarrollo de esta (15), también la diabetes y la existencia de enfermedades vasculares periféricas son factores predisponentes (13); además del antecedente de traumas maxilofaciales (16). Otro factor relacionado a esta patología es la halitosis severa, pues atrae a las moscas para depositar sus larvas (17), así como ciertas afecciones patológicas locales como el cancrum oris y tumores malignos orales (18). También la diabetes y la existencia de enfermedades vasculares periféricas son factores predisponentes (13).
Cuando se presenta puede manifestarse en bolsas periodontales, que es la ubicación más común, heridas post exodoncias (19,20), y en diversas localizaciones dentro de la cavidad bucal (21,22). Las moscas depositan sus huevos directamente sobre el tejido lesionado, después que estas eclosionan las larvas obtienen su nutrición de los tejidos circundantes, y se introducen más profundamente en los tejidos blandos, pudiendo hasta producir "túneles", separando la encía y el mucoperiostio del hueso.
Dentro de los signos y síntomas más comúnmente descritos están la presencia de mialgia, fiebre, halitosis acentuada, malestar, además de inflamación de los tejidos circundantes, ulceraciones, necrosis tisular. Los exámenes de laboratorio incluyen eosinofilia y elevada tasa de sedimentación de eritrocitos. El movimiento de las larvas facilita el diagnostico; sin embargo, en ausencia de ese movimiento, a veces, además del examen visual clínico, la exploración quirúrgica y el examen histopatológico llevan al diagnóstico definitivo (13).
Según Dutto y colaboradores, los factores contribuyentes más importantes para la miasis nosocomial son: niveles de conciencia deprimidos o movilidad disminuida, presencia de heridas expuestas o tejido necrótico, malos estándares de higiene, falta de ventanas apantalladas y clima cálido (23). Además, mantener las puertas abiertas o en mal estado, así como una mala disposición de los desechos, debido a que facilitan el acceso de moscas al entorno intrahospitalario (3). Este caso presenta características similares a los reportados en la literatura; así, se trata de un paciente varon de 82 años, con antecedentes de enfermedad de Alzheimer, demencia senil, dependiente total, con insuficiencia respiratoria tipo 1, sepsis por absceso hepático, HTA no controlada e intubado, atado al ventilador mecánico (falta de sellado labial), con una higiene bucal deficiente, sialorrea, halitosis y presencia de bolsas periodontales. Estas condiciones contribuyeron a la aparición de la miasis oral. Además, según la historia clínica fue infestado el mes de marzo (verano); considerando el ciclo biológico de la mosca Cochliomyia hominivorax, probablemente la infestación se produjo durante la hospitalización, antes de ingresar a UCI, por falta de mallas en las ventanas.
Se han publicado casos de miasis en unidad de cuidados intensivos en Canadá (24), Costa Rica (25), Estados Unidos (26), Irán (27,28,29), Francia (30), Kuwait (4), Malasia (31), Corea (32), y Turquía (33). Sin embargo, solo se encontró tres reportes de miasis oral en unidad de cuidados intensivos (29,32,33). Según Lima, la prevalencia de la miasis oral en la población se subestima y los casos no se informan en la literatura (34).
El tratamiento tradicional consiste en la extirpación manual de las larvas; en algunos casos, cuando existen múltiples larvas y avanzada destrucción tisular, la aplicación de sustancias tópicas asfixiantes ha sido recomendada a fin de asegurar la completa remoción de todas las larvas. Entre las sustancias reportadas en la literatura se encuentra el uso de gel de digluconato de clorhexinida al 0,2%, solución de éter, aceite de trementina, vaselina sólida, yodoformo, aceite de creosota (13,18), cloroformo, empastes de albahaca (11), etc. Sin embargo, hay una tendencia creciente de autores que defienden modalidades de tratamiento consideradas menos invasivas y muy prometedoras, como el uso de ivermectina o ungüento de nitrofurazona; estos tratamientos alternativos, sin la eliminación mecánica controlada de las larvas, son controvertidos y pueden ser peligrosos, con el potencial de ser ineficaces o causar que la infección se propague a otras regiones del cuerpo.
En este caso se administró el tratamiento sistémico con ivermectina, además de irrigación con clorhexidina al 0,12% como complemento de la extracción manual de las larvas. La ivermectina es un agente antiparasitario de la familia de los macrolidos, que bloquea los impulsos de las terminaciones nerviosas de los endoparásitos, produciendo la parálisis y muerte de la larva (35). Goyal reportó el tratamiento exitoso con ivermectina en serie de casos de miasis en cavidad oral, a razón de 6 mg por vía oral, y otra dosis igual a las 24 h (36). En este paciente fue suficiente una dosis única de Ivermectina a 0,2 miligramos por kilo de peso, como lo sugieren algunos autores (37,38).
REFERENCIAS BIBLIOGRÁFICAS
1. Hope F. On insects and their larvae occasionally found in the human body. 1840; 2:256-271.
2. Laurence S. Dipterous larvae infection. Br. Med. J. 1909; 9:88. [ Links ]
3. Sánchez-Sánchez R, Calderón-Arguedas O, Mora-Brenes N, Troyo A. Miasis nosocomiales en América Latina y el Caribe: ¿una realidad ignorada?. Rev Panam Salud Publica. 2014; 36(3):201–5. [ Links ]
4. Hira PR, Assad RM, Okasha G, Al-Ali FM, Iqbal J, Mutawali KE, et al. Myasis in Kuwait: nosocomial infections caused by Lucilia Sericata and Megaselia Scalaris. Am. J. Trop. Med. Hyg. 2004; 70(4):386–89. DOI: 10.4269/ajtmh.2004.70.386. [ Links ]
5. Ferreira E, Bianque de Olivera J, Paes M, Lobo A, Andrade A, Rosas dos Santos E. Miíases humanas por Cochliomyia hominivorax (Coquerel, 1858) (Diptera, Calliphoridae) em hospitais públicos na cidade do Recife, Pernambuco, Brasil. Entomol. Vect. 2005; 12 (1): 37-51. DOI: 10.1590/S0328-03812005000100003. [ Links ]
6. Calderón-Castrat X, Idrogo-Bustamante JL, Peceros-Escalante J, Ballona R. Wound myiasis caused by Cochliomyia hominivorax: the role of entodermoscopy. International Journal of Dermatology. 2017;56(3): 330-332. DOI: 10.1111/ijd.13432. [ Links ]
7. Espinoza A, Quiñones J, Garay O. Miasis en cavidad oral por Cochliomyia hominivorax: Reporte de un caso. Rev Peru Med Exp Salud Publica. 2009; 26(4): 573-76. DOI: 10.17843/rpmesp.2009.264.1421. [ Links ]
8. Failoc V, Silva H. Review of Cases and a Patient Report of Myiasis with Tracheostomy, Peru. Emerging Infectious Diseases. 2016; 22(3):563-5. DOI: 10.3201/eid2203.151631. [ Links ]
9. Bongiorno M, Pistone G, Arico M. Myiasis with Dermatobia hominis in a Sicilian traveller returning from Perú. Travel medicine and infectious disease. 2007; 5: 196-8. DOI: 10.1016/j.tmaid.2006.09.007. [ Links ]
10. Hoyer P, Williams R, Lopez M, Cabada M. Human Nasal Myiasis Caused by Oestrus ovis in the Highlands of Cusco, Peru: Report of a Case and Review of the Literature. Case Reports in Infectious Diseases. 2016; 2016:1-4. DOI: 10.1155/2016/2456735. [ Links ]
11. Piedra I, Lipa C. Miasis Oral. Rev Soc Peru Med Interna. 2015; 28(3): 136-8. [ Links ]
12. Vargas-Terán M. Hoja de Ruta para la Supresión y Erradicación Progresiva del Gusano Barrenador del Ganado (GBG) Cochliomyia hominivorax del Continente Americano. Organismo Internacional de Energía Atómica, ONU, Viena, Austria. 2018. Disponible en: https://www.iaea.org/sites/default/files/hoja-de-ruta-gbg-rla5075.pdf. [ Links ]
13. Cavalcanti A. Miíase Oral: etiologia, diagnóstico e tratamento. Rev. Fac. Odontol. Porto Alegre, Porto Alegre. 2008;49:32-35. [ Links ]
14. Yazar S, Dik B, Yalcin S, Demirtas F, Yaman O, Ozturk M, et al. Nosocomial Oral Myiasis by Sarcophaga sp, in Turkey. Yonsei Medical Journal. 2005; 46(3): 431-34. DOI: 10.3349/ymj.2005.46.3.431. [ Links ]
15. Gursel M, Aldemir OS, Ozgur Z, Ataoglu T. A rare case of gingival myiasis caused by Diptera (Calliphoridae). J Clin Periodontol. 2002; 29(8): 777–780. DOI: 10.1034/j.1600-051X.2002.290816.x. [ Links ]
16. Gomes Pereira J, Machado M, Patelli M. Miíase de língua: relato de um caso de infestação hospitalar. Rev. Cir. Traumatol. Buco-Maxilo-fac. 2008; 8(4): 47-50. [ Links ]
17. de Freitas M, Sanglard-Oliveira C, Drummond M, Ferreira E, Duarte A, Nogueira M. Miíase bucal e doença de Alzheimer: relato de caso clínico. Rev. Bras. Geriatr. Gerontol. 2012; 15(4):805-11. DOI: 10.1590/S1809-98232012000400019. [ Links ]
18. Bhola N, Jadhav A, Borle R, Adwani N, Khemka G, Jadhav P. Primary Oral Myiasis: A Case Report. Case Reports in Dentistry. 2012;2012:734234. DOI: 10.1155/2012/734234. [ Links ]
19. Athari A, Fallah T. Dental cavity myiasis due to Wohlfahrtia Magnifica. Medical Journal of the Islamic Republic of Iran. 1993; 7(3):209-10. [ Links ]
20. Bozzo L, Athie I, Paes O, Scully C. Oral myiasis caused by sarcophagidae in an extraction wound. Oral Surg Oral Med Oral Pathol, 1992; 74(6):733-5. DOI: DOI: 10.1016/0030-4220(92)90399-B.
21. Silveira M, Pinheiro S, da Silva V, de Azevedo M, Correia R. Cavitary myiasis mimicking peritonsilar abscess. Braz J Otorhinolaryngol. 2015; 81:336-8. DOI: 10.1016/j.bjorl.2015.01.005. [ Links ]
22. Mederos A, Prevot D, Samón R, Fitó Y. Miasis en Estomatología. Presentación de caso. Rev Inf Cient. 2015; 92(1):987-94. [ Links ]
23. Dutto M, Pellegrino M, Vanin S. Nosocomial myiasis in a patient with diabetes. Journal of hospital infection. 2013; 83(1):74-6. DOI: 10.1016/j.jhin.2012.08.019. [ Links ]
24. Szakacs T, MacPherson P. Nosocomial myiasis in a Canadian intensive care unit. CMAJ. 2007; 177(7):719-20. DOI: 10.1503/cmaj.061598. [ Links ]
25. Calderon Ólger, Luna S, Miranda G, Troyo A. Blaesoxipha plinthopyga (Diptera: Sarcophagidae) como responsable de miasis nosocomiales en Costa Rica. Acta méd costarric. 2014; 56 (1):31-4. [ Links ]
26. Miller A, George-Dalmida S, Miller C. Myiasis in an intensive care unit in the United States: A case report. Open J Clin Med Case Rep. 2018; 4:1379. [ Links ]
27. Hazratian T, Tagizadeh A, Chaichi M, Abbasi M. Pharyngeal Myiasis Caused by Sheep Botfly, Oestrus ovis (Diptera: Oestridae) Larva, Tabriz, East Azarbaijan Province, Iran: a Case Report. J Arthropod-Borne Dis. 2017; 11(1): 166–170. [ Links ]
28. Mircheragui S, Mircheragui S, Ramezani H, Riabi A, Parsapour A. Nasal Nosocomial Myiasis Infection Caused by Chrysomya bezziana (Diptera: Calliphoridae) Following the Septicemia: A Case Report. Iran J Parasitol. 2016; 11 (2): 284-289. [ Links ]
29. Leylabadlo H, Kafil H, Aghazadeh M, Hazratian T. Nosocomial oral myiasis in ICU patients: occurrence of three sequential cases. GMS Hygiene and Infection Control. 2015; 10:1-3. DOI: 10.3205/dgkh000259. [ Links ]
30. Ramiara P, Puidupin A, Morillon M, Carpentier J. Myiasis in intensive care: interest of entomological survey. Annales Françaises d’Anesthésie et de Réanimation. 2006; 25:1165–72. DOI: 10.1016/j.annfar.2006.08.003.
31. Nazni WA, Jeffery J, Lee HL, Lailatul AM, Chew WK, Heo CC. Nosocomial nasal myiasis in an intensive care unit. Malaysian. J Pathol. 2011; 33(1): 53-6. [ Links ]
32. Jang M, et. al. A Case of Oral Myiasis Caused by Lucilia sericata (Diptera: Calliphoridae) in Korea. Korean J Parasitol. 2013; 51(1): 119-123. DOI: 10.3347/kjp.2013.51.1.119. [ Links ]
33. Çiftçio¢glu N, Altintaș K, Haberal M. A case of human orotracheal myiasis caused by Wohlfahrtia magnifica. Parasitol Res. 1997; 83(1):34-6. DOI: 10.1007/s004360050203.
34. Lima S, Asprino L, Prado A, Fernandes R, de Moraes M. Oral myiasis caused by Cochliomyia hominivorax treated nonsurgically with nitrofurazone: report of 2 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;109(3):e70-3. DOI: 10.1016/j.tripleo.2009.11.014. [ Links ]
35. Ribeiro A, Almeida T, Lopes J, Araujo J, Viana J. Oral myiasis: does an indication for surgical treatment still exist? Two case reports. Oral Surg Ora Med Oral Pathol Oral Radiol. 2012; 114(3): 10-14. DOI: 10.1016/j.oooo.2011.09.003. [ Links ]
36. Goyal S, Karjodkar F, Sansare K, Salve P, Virani R , Motghare D. Oral Myiasis treated with Ivermectin: A Case Series. Int J Oral Health Med Res. 2017;3(5):76-78. [ Links ]
37. de Hollanda A, Silva A, Zaracho G. Ivermectina en el tratamiento de la Miasis Humana. An. Fac. Cienc. Méd. 2005;38(3):1-4. [ Links ]
38. Singh S, Athar M, Chaudhary A, Vyas A, Tiwari S. Effect of Ivermectin on Wound Myiasis- A Hospital Based Study. Ann Clin Lab Res. 2017;5(4): 200. [ Links ]
Conflictos de interés: El autor declara no tener conflictos de interés.
Fuente de financiamiento: Autofinanciado
Correspondencia:
Alejandro Gutierrez Patiño-Paul
agutierrezpp3@hotmail.com
Recibido: 18 de abril 2019
Aceptado: 3 setiembre 2019
Publicación en línea: 30 de setiembre 2019














