INTRODUCCIÓN
La retinopatía diabética (RD) es una complicación neurovascular de la diabetes mellitus (DM) tipo I y II, que produce ceguera y afecta principalmente a la población laboralmente activa y adulta mayor 1,2,3. Existen dos tipos de RD, la proliferativa (RDP) y no proliferativa (RDNP). Esta última tiende a progresar a la RDP, y se caracteriza por un crecimiento anormal de nuevos vasos sanguíneos en la retina 4. Se estima que más de un tercio de los pacientes con DM tiene algún grado de RD 5.
Por el daño vascular y consecuente alteración de las barreras hematorretinianas, durante la RD puede existir extravasación de fluido en las capas retinales, y si esto ocurre en el área macular o perimacular, puede producir visión borrosa. A esta condición se le denomina edema macular diabético (EMD), la cual es definida como el engrosamiento de la retina que involucra o está cerca del centro de la mácula (500 micras o menos del centro de la fóvea), y representa la causa más común de pérdida visual en los pacientes con DM 6. El EMD afecta al 3% de los ojos con RDNP leve, el 38% de los ojos con RDNP moderado a severo y el 71% de los ojos con RDP 6, 7.
El diagnóstico y tratamiento oportuno de la RD y EMD pueden reducir las complicaciones y discapacidades generadas por estas condiciones. Por este motivo, la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social de Salud del Perú (EsSalud) priorizó la realización de la presente guía de práctica clínica (GPC) con la finalidad de establecer lineamientos basados en evidencias para el diagnóstico y tratamiento de la RD y EMD, cuyos enunciados serán aplicados por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión extensa, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
Conformación del grupo elaborador de la guía (GEG)
Se conformó un GEG, que incluyó metodólogos y médicos oftalmólogos subespecialistas en retina y vítreo.
Formulación de preguntas
En concordancia con los objetivos y alcances de esta GPC, el GEG formuló cuatro preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (outcomes) de interés.
Búsqueda y selección de la evidencia
Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante el 2018 se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y Cochrane Controlled Register of Trials) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC sobre el tema). Cuando se encontró RS de calidad aceptable, se seleccionó una RS para la toma de decisiones, y se actualizó cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios (Material Suplementario 1).
Evaluación de la certeza de la evidencia
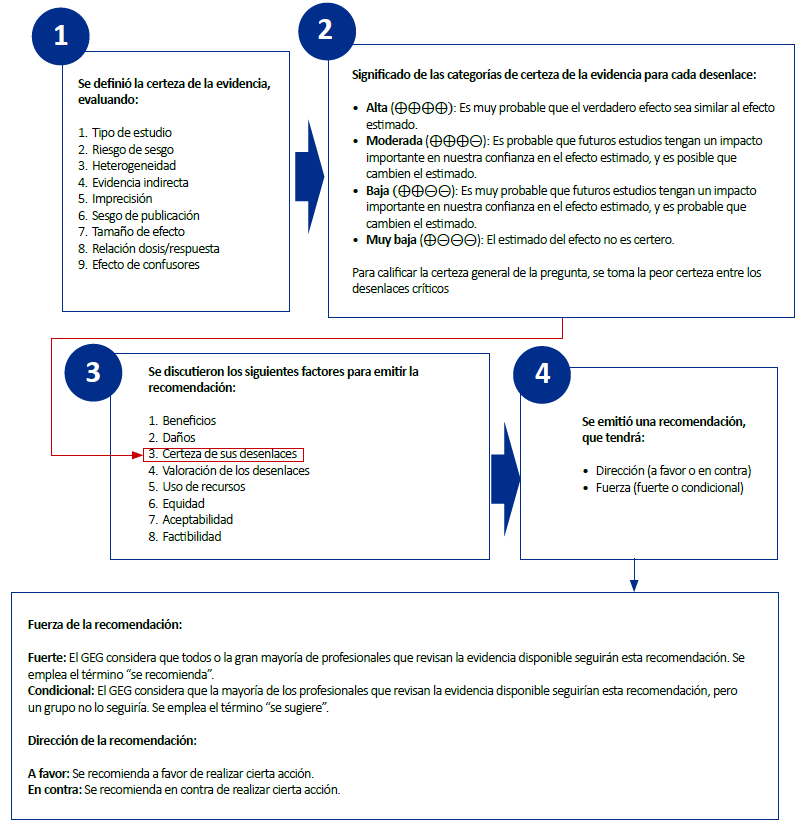
La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja o muy baja (Figura 1). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 8) y se elaboró las tablas de perfiles de evidencias de GRADE (Material Suplementario 2). Finalmente, se le asignó a la pregunta PICO el nivel de certeza más bajo alcanzado por alguno de los desenlaces considerados como críticos.
Formulación de las recomendaciones
El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Figura 1) por consenso o por mayoría simple, usando la metodología GRADE 9. Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones; 2) Valores y preferencias de los pacientes; 3) Aceptabilidad por parte de los profesionales de salud; 4) Factibilidad de las opciones en los establecimientos de salud en EsSalud; y 5) Uso de recursos. Asimismo, el GEG formuló puntos de buenas prácticas clínicas (BPC) en consenso, para los cuales no se realizaron una búsqueda sistemática de la evidencia o no se encontró evidencia suficiente para basar una recomendación; así como enunciados basados en dictámenes de evaluación de tecnología sanitaria.
Revisión por expertos externos
La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión extensa fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
RECOMENDACIONES
La presente GPC abordó cuatro preguntas clínicas con relación a tres temas: diagnóstico, tratamiento de elección y tratamiento adyuvante. En base a dichas preguntas se formularon seis recomendaciones (cuatro fuertes y dos condicionales), 19 puntos de BPC y un flujograma (Tabla 1 y Figura 2).
Tabla 1. Recomendaciones en base a preguntas clínicas con relación al diagnóstico, tratamiento de elección y tratamiento adyuvante de la retinopatía diabética y edema macular diabético
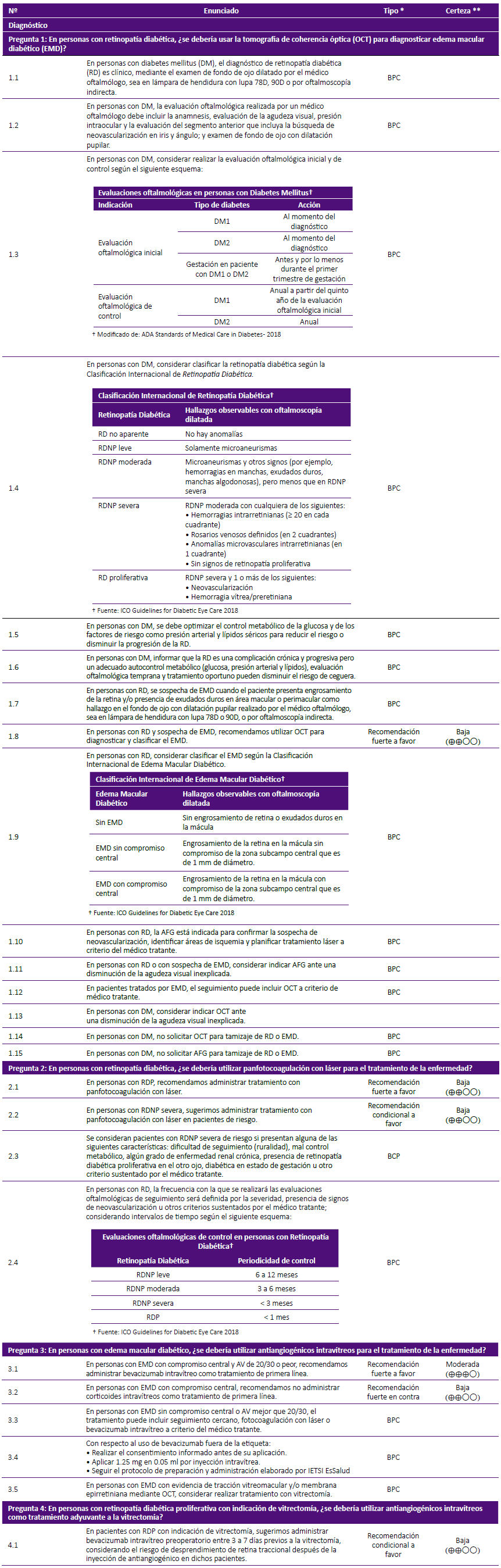
* Recomendación (R) o punto de buena práctica clínica (BPC)
** La fuerza, dirección y calidad de la evidencia sólo se establecen para las recomendaciones, más no para los puntos de BPC
DM: Diabetes mellitus; RD: Retinopatía diabética; RDNP: Retinopatía diabética no proliferativa; RDP: Retinopatía diabética proliferativa; EMD: Edema macular diabético; OCT: Tomografía de coherencia óptica; AFG: Angiofluoresceinografía retinal; ADA: American Association Ophthalmology; ICO: International Council of Ophthalmology
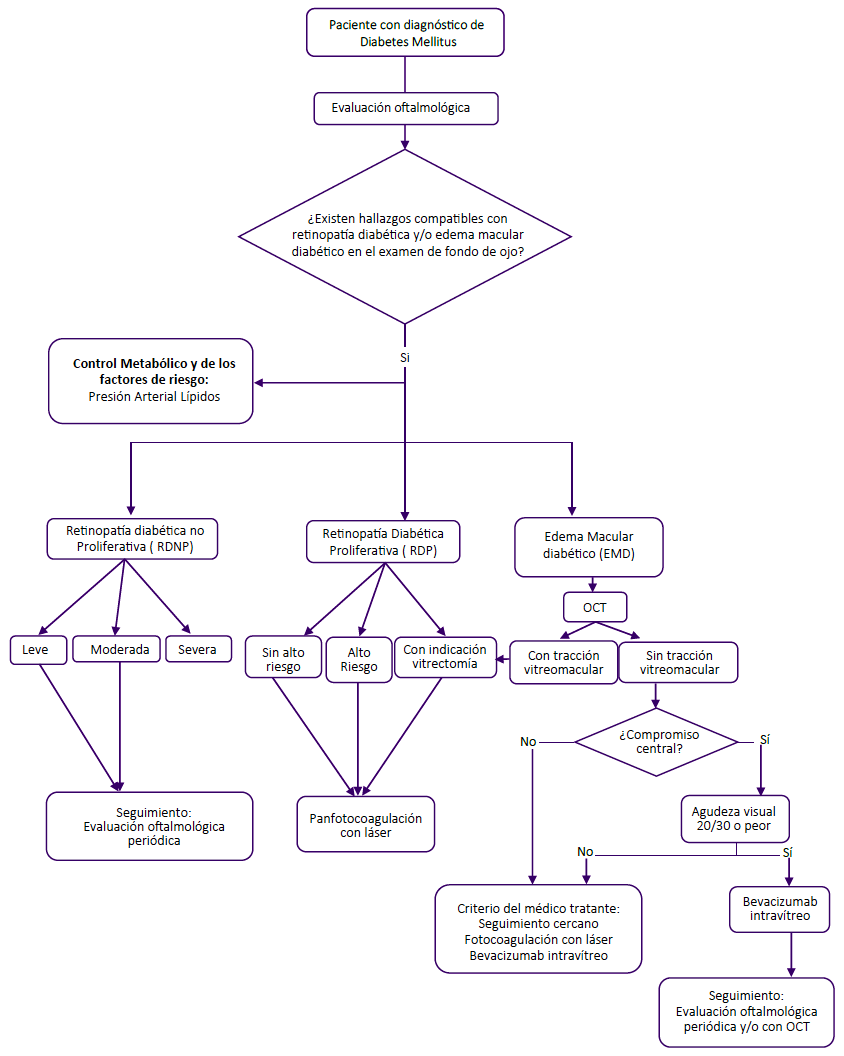
Nota: No se emitieron recomendaciones para pacientes con edema macular persistente o refrectario a tratamiento con antiangiogénicos intravítreos.
OTC: Tomografía por coherencia óptica
Figura 2. Flujograma del manejo de la retinopatía diabética y edema macular diabético
La presente GPC se enfoca en pacientes mayores de 18 años con diabetes mellitus tipo I o II. En estas personas se abordó la realización de la evaluación oftalmológica para el diagnóstico de RD y el uso del OCT para el diagnóstico de EMD, el uso de panfotocoagulación con láser para pacientes con RD, el uso de antiangiogénicos intravítreos en personas con EMD y en personas con RDP que tengan indicación de vitrectomía.
A continuación, se expondrá un resumen del razonamiento seguido para llegar a las recomendaciones y puntos de BPC de cada pregunta clínica.
Pregunta 1: En personas con retinopatía diabética, ¿se debería usar la tomografía de coherencia óptica (OCT) para diagnosticar edema macular diabético (EMD)?
El diagnóstico del EMD es clínico y tradicionalmente la prueba de referencia era la fotografía estereoscópica de fondo de ojo; sin embargo, se considera subjetiva al solo permitir identificar hallazgos sugestivos de edema macular o microaneurismas 10. La OCT podría proporcionar una evaluación objetiva y cuantitativa del edema macular, por lo que cada vez más es reconocida como el método de diagnóstico de referencia para EMD 11.
Para esta pregunta se encontró una sola RS: Virgili 2015 11, que presentó una adecuada calidad metodológica (AMSTAR-2: 14/16). Esta RS realizó un meta-análisis (MA) de 9 estudios observacionales (1303 ojos, 759 personas) que tuvo como objetivo determinar la precisión diagnóstica de la OCT para detectar el EMD en personas con RD, considerando como prueba de referencia la evaluación de fondo de ojo (en tres estudios se empleó biomicroscopia, en cuatro estudios se empleó fotografía estereoscópica y en dos estudios se empleó ambas técnicas). Esta RS encontró que la OCT tuvo una sensibilidad de 81% (IC 95%: 74% a 86%) y una especificidad de 85% (IC 95%: 75% a 91%). Sin embargo, no se puede determinar con certeza la precisión diagnóstica de la OCT al no existir una prueba de referencia (gold standard) con el cual comparar.
En base a lo evidenciado, el GEG consideró que en la actualidad la OCT es la prueba de referencia para diagnosticar EMD, que además permite realizar el seguimiento en los pacientes con tratamiento. Por este motivo, se decidió emitir una recomendación a favor del uso de la OCT para diagnosticar y clasificar EMD en personas con RD. A pesar de que la certeza de la evidencia fue baja, se consideró que no usar OCT conllevaría dificultades en el diagnóstico y seguimiento de EMD, por lo cual se decidió emitir una recomendación fuerte.
Puntos de BPC: Se estableció 14 puntos de BPC sobre: el diagnóstico y la evaluación oftalmológica de pacientes con RD según lo recomendado por la American Academy of Ophthalmology (AAO) 12; la evaluación oftalmológica inicial en pacientes con diabetes según lo recomendado por la ADA 1; el uso de la clasificación internacional de RD según la International Council of Ophthalmology (ICO) 4; el control de los factores de riesgo asociados a la RD y el autocontrol metabólico según lo recomendado de la ADA 1; el empleo de la clasificación internacional de EMD según la ICO; el uso de angiofluorescencia retinal; el seguimiento de los pacientes con EMD; y el adecuado uso de la OCT en pacientes con RD según las recomendaciones de la AAO 12.
Pregunta 2: En personas con retinopatía diabética, ¿se debería utilizar panfotocoagulación con láser para el tratamiento de la enfermedad?
La panfotocoagulación con láser es una técnica que destruye selectivamente la retina hipóxica, lo cual disminuye la demanda de oxígeno, citoquinas y factores de crecimiento (como el factor de crecimiento endotelial vascular), disminuyendo así la neovascularización en personas con RD 13, 14.
Para responder esta pregunta se encontró una sola RS: Evans 2014 15, que presentó una adecuada calidad metodológica (AMSTAR-2: 14/16). Esta RS incluyó ensayos clínicos aleatorizados (ECA) realizados en pacientes con retinopatía diabética proliferativa (RDP) y con retinopatía diabética no proliferativa (RDNP).
Esta RS encontró que al año de seguimiento, el grupo que recibió panfotocoagulación con láser tuvo similar agudeza visual (definida como la pérdida de 15 letras o más en la mejor agudeza visual corregida [MAVC] (11,5% versus 11,6%, RR: 0,99; IC 95%: 0,89 - 1,11), menor riesgo de desarrollar pérdida severa de la visión (MAVC < 6/60) (2,5% versus 4,4%, RR: 0,46; IC 95%: 0,24 - 0,86) y menor progresión de la retinopatía diabética (23,1% versus 41,0%, RR: 0,49; IC 95%: 0,37 - 0,64); en comparación con el grupo control. No se mostró datos sobre pérdida de visión periférica, un efecto adverso posible de la panfotocoagulación.
Se observa que la panfotocoagulación con láser presenta beneficios significativos, por lo cual se decidió emitir recomendaciones a favor de su uso en pacientes con RDP y RDNP. Respecto a la fuerza, se decidió emitir una recomendación fuerte para pacientes con RDP (quienes, al presentar mayor riesgo de progresión de la enfermedad, se verían más beneficiados por la intervención). En tanto que se decidió emitir una recomendación condicional en pacientes con RDNP (quienes, al presentar menor riesgo de progresión de la enfermedad, se verían menos beneficiados por la intervención).
Puntos de BPC: Se estableció dos puntos de BPC sobre: quienes son los pacientes con RDNP en riesgo para nuestro contexto en opinión del GEG; y la frecuencia de las evaluaciones oftalmológicas en pacientes con RD según lo recomendado por la AAO 12.
Pregunta 3: En personas con edema macular diabético, ¿se debería utilizar antiangiogénicos intravítreos para el tratamiento de la enfermedad?
El EMD se caracteriza por el incremento de la permeabilidad vascular y la consecuente acumulación de líquido exudativo en la mácula, lo que produce edema macular 16. Esto tiene como mediador clave al factor de crecimiento endotelial vascular (VEGF), por lo que se ha sugerido que las inyecciones intravítreas de medicamentos inhibidores del VEGF serían útiles en el tratamiento del EMD17. Para esta pregunta clínica se realizaron tres preguntas PICO:
La primera pregunta PICO comparó los anti-VEGF intravítreos vs fotocoagulación con láser. Para responder esta pregunta PICO se encontró solo una RS: Virgili 2018 17, que presentó una adecuada calidad metodológica (AMSTAR-2: 15/16). Esta RS realizó un meta-análisis en red (MAR) y en la comparación mixta encontró que el grupo que recibió anti-VEGF (bevacizumab intravítreo) presentó mayor probabilidad de "ganancia igual o mayor a tres líneas de agudeza visual" al año (RR: 2,47; IC 95%: 1,81 - 3,37), mayor agudeza visual al año (diferencia de medias [DM]: -0,12; IC 95%: -0.15 a -0.09), menor volumen macular al año (DM: -46 µm; IC 95%: -78 a -14), y similar incidencia de efectos adversos a los dos años (RR: 0,93; IC 95%: 0,73 - 1,19) en comparación con el grupo que recibió fotocoagulación con láser.
La segunda pregunta PICO comparó los anti-VEGF intravítreos entre sí: Para esta pregunta PICO se encontró una sola RS: Virgili 2018 17, que presentó una adecuada calidad metodológica (AMSTAR-2: 15/16). Esta RS en la comparación mixta encontró que, a un año de seguimiento, el grupo que recibió bevacizumab intravítreo tuvo similar "ganancia mayor o igual a tres líneas de agudeza visual" (RR: 1,11; IC 95%: 0,87 - 1,43), similar agudeza visual (DM: 0,00; IC 95%: -0,02 a 0,03), mayor volumen macular (DM: -29 µm; IC 95%: -58 a -1), y similar incidencia de efectos adversos (mortalidad por todas las causas, eventos aterotrombóticos) (RR: 1,04; IC 95%: 0,84 - 1,28) en comparación al grupo que recibió ranibizumab intravítreo.
Se observa que el empleo de anti-VEGF intravítreo presenta mayores beneficios y menores daños en comparación con fotocoagulación con láser. Además, entre los anti-VEGF, el bevacizumab intravítreo presenta similares beneficios y efectos adversos que el ranibizumab intravítreo a un menor costo. Por ello, se decidió emitir una recomendación a favor del uso de bevacizumab como tratamiento de primera línea. La certeza de la evidencia fue moderada, por lo cual se decidió emitir una recomendación fuerte.
La tercera pregunta PICO comparó la combinación de anti-VEGF con corticoide intravítreo vs anti-VEGF. Para esta pregunta PICO se encontró una sola RS: Mehta 2018 16, que presentó una adecuada calidad metodológica (AMSTAR-2: 14/16). Esta RS incluyó en la mayoría de ECA al bevacizumab 1,25 mg/0,05 ml (7/8) como anti- VEGF y como inyección de corticoide intravítreo a la triamcinolona 2 mg/0,05 ml (6/8). Esta RS encontró que a un año de seguimiento, el grupo tratado con anti-VEGF y corticoide intravítreos presentó similar agudeza visual (DM: -2,29; IC 95%: -6,03 a 1,45), similar volumen macular (DM: -0,20 μm; IC 95%: -37,14 - 37,53), y mayor incidencia de eventos adversos (29,3% versus 7,7%; OR: 5,66; IC 95%: 3,62 - 8,84) en comparación al grupo al que solo se le administró anti-VEGF.
Considerando que la combinación de bevacizumab con corticoide intravítreos no presentó más beneficios, pero sí más efectos adversos respecto al uso de solo bevacizumab, se decidió emitir una recomendación en contra del empleo de esta combinación. A pesar de que la certeza de la evidencia fue baja, se consideró que su indicación generaría un mayor uso de recursos, por lo cual se decidió emitir una recomendación fuerte.
Puntos de BPC: Se establecieron tres puntos de BPC sobre: el tratamiento en pacientes con EMD sin compromiso central o agudeza visual mejor que 20/30 según lo recomendado por la ICO 4; el uso del bevacizumab fuera de la etiqueta según las "Recomendaciones para la preparación de bevacizumab inyección intravítrea, IETSI-EsSalud, 2018"; y la indicación de vitrectomía en pacientes con EMD con evidencia de tracción vitreomacular y/o membrana epirretiniana mediante OCT según la ICO.
Pregunta 4: En personas con retinopatía diabética proliferativa con indicación de vitrectomía, ¿se debería utilizar antiangiogénicos intravítreos como tratamiento adyuvante a la vitrectomía?
De la evidencia a la decisión:
La vitrectomía pars plana es un procedimiento quirúrgico usado para el tratamiento de complicaciones graves de la RDP, como el desprendimiento de retina traccional y la hemorragia vítrea 18. La complicación más importante posterior a una vitrectomía es la hemorragia de la cavidad vítrea posterior (POVCH), que ocurre en un 30% de los casos.
La POVCH se puede presentar en un periodo temprano (primeros días del postoperatorio) o tardío (meses después de la cirugía), retrasa la recuperación visual y conduce a una elevada presión intraocular, esto dificulta aún más el tratamiento de la RD. El 10% de los pacientes requieren cirugía de revisión, lo que tiene implicancias significativas para los recursos como el tiempo y el costo 22.
El VEGF aumenta la permeabilidad vascular y produce neovascularización en la cavidad vítrea posterior 19, por lo cual se ha propuesto que el uso de anti-VEGF (preoperatorio a la vitrectomía) puede reducir la incidencia de POVCH 20.
Para responder esta pregunta se encontró dos RS: Zhao 2018 21) y Smith 2015 22, que presentaron una adecuada calidad metodológica (AMSTAR-2: 9/16 y 14/16; respectivamente). En estas RS la mayoría de estudios incluidos usó bevacizumab, y el tiempo transcurrido entre la administración de anti-VEGF intravítreo y la vitrectomía varió de 1 a 21 días, la mayoría reportó que la administración de anti-VEGF fue de 7 días antes de la vitrectomía (9/15).
La RS de Smith22) evaluó la mayoría de los desenlaces relevantes, excepto agudeza visual, la cual fue evaluada por la RS de Zhao 21. La RS de Smith 22 realizó MA de 10 ECAs y encontró que el grupo tratado preoperatoriamente con anti-VEGF intravítreo presentó menor incidencia de POVCH temprano (cuatro semanas) (9,05% versus 31,1%, RR: 0,35; IC 95%: 0,23 - 0,53), similar incidencia de POVCH tardío (seis meses) (13,04% versus 19,75%, RR: 0,72; IC 95%: 0,30- 1,72), menor incidencia de lavado de la cavidad vítrea (6 meses) (1,91% versus 10,44%, RR: 0,19; IC 95%: 0,06 a 0,67), y similar incidencia de eventos adversos (desprendimiento de retina) (3,36% versus 9,14%, RR: 0,46; IC 95%: 0,19 a 1,08) en comparación con el grupo control.
La RS de Zhao 2018 21) realizó un MA de siete ECAs y encontró que el grupo tratado preoperatoriamente con anti-VEGF intravítreo presentó mayor agudeza visual en comparación con el grupo control (DM: -0,30; IC 95%: -0,44 a -0,16).
En general se observa que el grupo que usa inyección intravítrea preoperatoria de anti-VEGF (bevacizumab) presentó menor riesgo de POVH y mejor agudeza visual, por lo que se decidió emitir una recomendación a favor de su uso. Además, considerando que la certeza de la evidencia fue baja, por lo que se decidió emitir una recomendación condicional.