INTRODUCCIÓN
La obtención, aislamiento y purificación de compuestos con actividad antimicrobiana a partir de la fermentación de hongos filamentosos es una metodología ampliamente utilizada bajo diversas condiciones y objetivos. Los hongos producen determinados metabolitos durante su interacción y desarrollo en distintas circunstancias ambientales como temperatura, disponibilidad de nutrientes, pH o tiempo de fermentación en medio líquido 1. Es así como elaboran diversos compuestos de variada naturaleza química como alcaloides, sesquiterpenlactonas, esteroles insaturados y politerpenos 2,3,4. En el género Aspergillus se han reconocido alrededor de 226 metabolitos secundarios, los cuales poseen diversa actividad biológica: antimicrobiana, citotóxica, antioxidante, antinflamatoria y antitumoral 5,6.
Para la extracción de los metabolitos secundarios de Aspergillus fumigatus se ha obtenido el hongo de diversas fuentes: marinas, endofíticos, de suelos, entre otros; y se ha evaluado su actividad antimicrobiana sobre bacterias Gram negativas, Gram positivas y hongos patógenos 7,8,9. La cinética del metabolismo de Aspergillus spp. se puede dividir en dos fases: trofofase e idiofase. La primera es fundamental para el desarrollo de moléculas precursoras y cofactores para la síntesis de metabolitos secundarios en la siguiente fase. Y la idiofase, o fase estacionaria, donde la depleción de la concentración de carbohidratos y conidias conduce a una mayor producción de metabolitos secundarios los cuales no son indispensables para el correcto funcionamiento de las vías metabólicas esenciales del crecimiento, contrario a los metabolitos primarios, sino surgen como respuesta de adaptación, depredación y competencia 10-13.
A nivel regional de América Latina ocupamos el cuarto lugar en frecuencia (54%, 84/154) de Staphylococcus aureus meticilino resistente (MRSA) aislado de hemocultivos 14. Respecto a infecciones invasivas por neumococo, el aislamiento de cepas resistentes a penicilina ha disminuido ante la introducción de la vacuna conjugada heptavalente; sin embargo, las cepas resistentes que ocasionan meningitis o infecciones no meníngeas aún sobrepasan el 50% (49/56) 15.
El objetivo del presente estudio fue demostrar la capacidad antimicrobiana del extracto crudo de Aspergillus fumigatus sensu stricto, aislado de una muestra clínica correspondiente a un aspergiloma pulmonar, sobre cocos Gram positivos causantes de infecciones de alto impacto epidemiológico. Ello como una alternativa para descubrir y producir mejores y más accesibles compuestos antibióticos que sean eficientes ante la resistencia de estas bacterias.
MÉTODOS
Diseño del estudio
Se realizó un estudio observacional utilizando un aislamiento clínico de A. fumigatus sensu stricto (AF303), obtenido a partir de un paciente con aspergiloma, cuya caracterización genotípica la incluye dentro de la sección Fumigati 16.
Muestra
Se emplearon 30 cepas clínicas de Staphylococcus aureus (S.au), 15 sensibles y 15 resistentes a meticilina; y 27 cepas de Streptococcus pneumoniae (S.pn), 15 sensibles y 12 no sensibles a penicilina. Se contó igualmente con cepas de Staphylococcus aureus ATCC 25923 y Streptococcus pneumoniae ATCC 49619. Las cepas bacterianas fueron identificadas, determinando sus perfiles de susceptibilidad antimicrobianos y se encuentraban conservadas en la Sección de Bacteriología del Instituto de Medicina Tropical ''Daniel Alcides Carrión'' de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos.
Obtención de un cultivo monospórico
Se realizó una primera resiembra en agar papa dextrosa (APD) y se incubó por 7 días a 35° C para el estudio de las características macroscópicas y microscópicas. La concentración de las conidias estuvieron en un rango de 1x106 - 4x106 conidias/mL; por ello se realizó un subcultivo en agar sulfato, papa, dextrosa (SPG) el cual fue incubado a 37°C por 7 días. Se preparó una solución Tween 80 al 1% y 10 mL fueron vertidos al subcultivo, se agitó la mezcla con ayuda de un vórtex y dejándose en reposo para un correcto desprendimiento de conidias de la superficie. En una batería de tubos con 4,5 mL de caldo peptonado se realizaron diluciones al medio con 0,5 mL de la resuspensión de conidias hasta alcanzar la concentración indicada previamente 7.
Fermentación líquida
Para la pre-fermentación, en un matraz Erlenmeyer se añadió 45 mL de caldo SPG más los 5 mL del cultivo monospórico y fue incubado a temperatura ambiente por 5 días en agitación constante de 120 rpm. Luego, el volumen fue trasferido a un caldo SPG fresco de 250 mL llevándose a un tiempo de incubación de 7 días en las mismas condiciones de rotación y temperatura. En ambos casos se mantuvo una relación proporcional de 1/5 entre el volumen del caldo de cultivo y el volumen del matraz de Erlenmyer.
Culminado el tiempo de fermentación, se filtró el caldo de cultivo usando una bomba al vacío acoplado a un sistema estéril con filtro de poro de 0,22 µm.
Extracción de metabolitos secundarios
En una pera de decantación se mezcló un volumen del caldo de cultivo mas un volumen de acetato de etilo, en proporción al tercio realizando 3 lavados consecutivos. Se obtuvieron dos fases tras la extracción: una fase orgánica y una fase acuosa. Ambas fases se utilizaron para la evaluación antimicrobiana por difusión en agar. La fase orgánica se evaporó al aire circulante a 40°C y se obtuvo una masa cruda de producción de metabolitos secundarios.
Caracterización química cualitativa del extracto crudo
El extracto crudo obtenido fue disuelto en etanol (v/v) para evaluar semicuantitativamente las reacciones de identificación de alcaloides (reacción de Mayer), terpenos y esteroles (reacción de Liebermann-Burchard) y lactonas (reacción de Legal).
Evaluación antimicrobiana
Siguiendo las especificaciones del manual M100-A2 del Clinical & Laboratory Standards Institute (CLSI) se prepararon los medios estandarizados Agar Müller-Hinton (MH) y MH con 5% de sangre de carnero para S.au y S.pn respectivamente. Se prepararon discos estériles en blanco (Whatman N° 42) de 6 mm de diámetro los cuales fueron impregnados con 25 uL del extracto crudo de AF303 por triplicado, concentrado en unidades de 100 mg/mL, utilizando DMSO 5% (Figura 1). Se dejaron secar por 15 minutos y se conservaron en congelación a -20° C. Igualmente, se impregnaron discos control con 25 uL de la fase acuosa de la extracción orgánica, y discos control negativo con DMSO 5%.
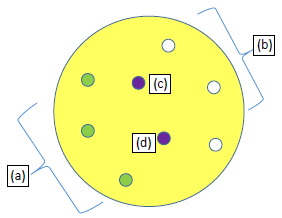
Figura 1 Plantilla para la disposición de discos de 6 mm, en una placa de Petri de 90 mm con agar Mueller-Hinton, cargados con 25 uL de extracto crudo de la fermentación líquida de Aspergillus fumigatus. (a) Disco con 25 uL del extracto crudo de AF, (b) Disco con 25 uL de la fase acuosa de AF, (c) Cepa referencial AF, (d) Control negativo - DMSO 5%.
Se evaluó la actividad del extracto crudo sobre cepas referenciales (ATCC) de ambos géneros de bacterias Gram positivas, además de la muestra de cepas clínicas. Se consideró la presencia de actividad antimicrobiana por la observación de un halo de inhibición mayor a 6 mm 7,8,9.
Análisis estadístico
Se utilizó el software estadístico R Core Team (2013) para el análisis de proporción de varianzas y diferencia de promedios de dos grupos mediante la prueba de hipótesis con una significancia de 5%. Para el análisis exploratorio de datos se utilizó la prueba de Shapiro-Wilk, constatando la distribución normal. Finalmente se aplicó la prueba paramétrica de Tukey para el análisis múltiple de medias de los halos de inhibición.
RESULTADOS
Del aislamiento clínico de A. fumigatus sensu stricto, se obtuvo una masa de 182 mg en 600 mL de caldo de cultivo. Se evidenciaron alcaloides, y esteroles y triterpenos, mas no se detectó la presencia de sesquiterpenlactonas. La valoración de las reacciones en escala semi-cuantitativa se detalla en la tabla 1.
Tabla 1 Resultados de la caracterización química del extracto crudo de AF 303 procedente del aislamiento clínico de A. fumigatus sensu stricto.
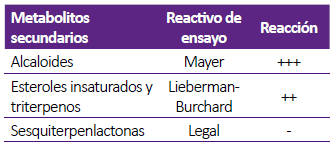
(-) Negativo,
(+) Baja evidencia
(++) Evidencia
(+++) Alta evidencia
Los metabolitos secundarios presentes en el extracto crudo de A. fumigatus sensu stricto, presentaron actividad antimicrobiana sobre la totalidad de cepas clínicas de Staphylococcus aureus y Streptococcus pneumoniae.
La presencia de actividad antimicrobiana del extracto se evidenció por un halo de inhibición mayor de 6 mm, así como de las cepas referenciales ATCC 7,8,9. Realizando el ensayo por triplicado se obtuvo un promedio 20 mm sobre S.au ATCC 25923, y de 22 mm sobre S.pn ATCC 49619.
Para el ensayo por disco difusión sobre cepas clínica de S. au sensibles a la meticilina (15/39) se obtuvo un promedio, de los halos de inhibición, de 24,02 +/- 0,57 mm; para S. aureus resistentes a meticilina (15/30) se obtuvo un promedio de 23,62 +/- 4,68 mm (Tabla 2). Al evaluar el extracto orgánico sobre cepas de neumococo sensibles a penicilina (15/27), se obtuvo un promedio de 25,82 +/- 4,05 mm; sobre las cepas no sensibles (12/27) se obtuvo un promedio de 26,5 +/- 5,39 mm (Tabla 3, Figura 2).
Tabla 2 Promedio de los diámetros de inhibición por triplicado producidos por el extracto crudo de AF303 (procedente del aislamiento clínico de A. fumigatus sensu stricto.), sobre cepas clínicas de Staphylococcus aureus.
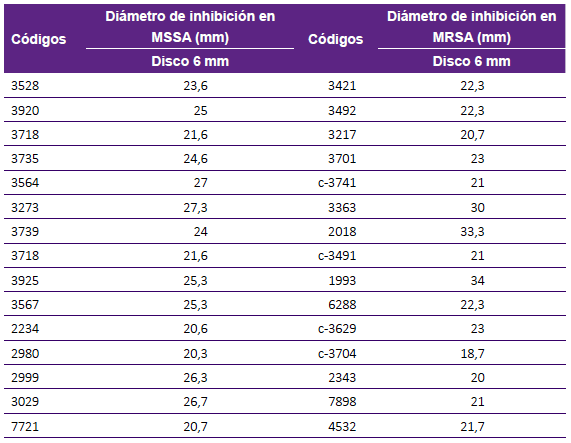
MSSA: Staphylococcus aureus meticilino sensible
MRSA: Staphylococcus aureus meticilino resistente
AF303: extracto crudo de cepa clínica de Aspergillus fumigatus sensu stricto
Tabla 3 Promedio de los diámetros de inhibición por triplicado producidos por el extracto crudo de AF303 (procedente del aislamiento clínico de A. fumigatus sensu stricto.), sobre cepas clínicas de Streptococcus pneumoniae.
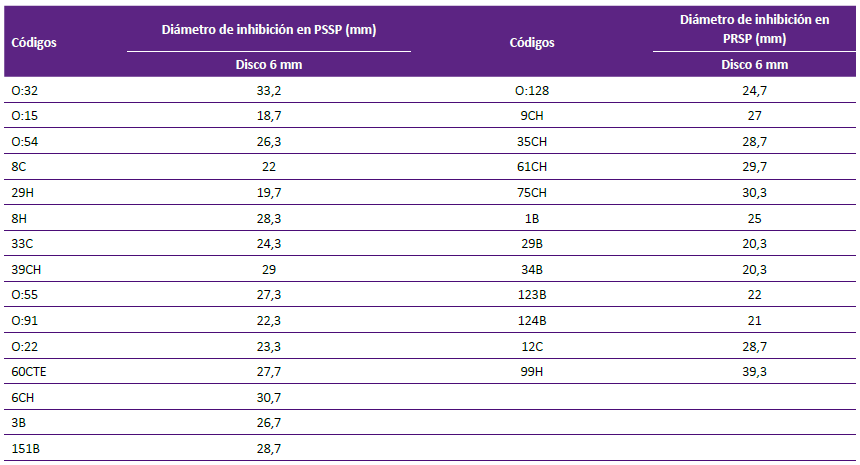
PSSP: Streptococcus pneumoniae penicilino sensible
PRSP: Streptococcus pneumoniae penicilino no sensible
AF303: extracto crudo de cepa clínica de Aspergillus fumigatus sensu stricto
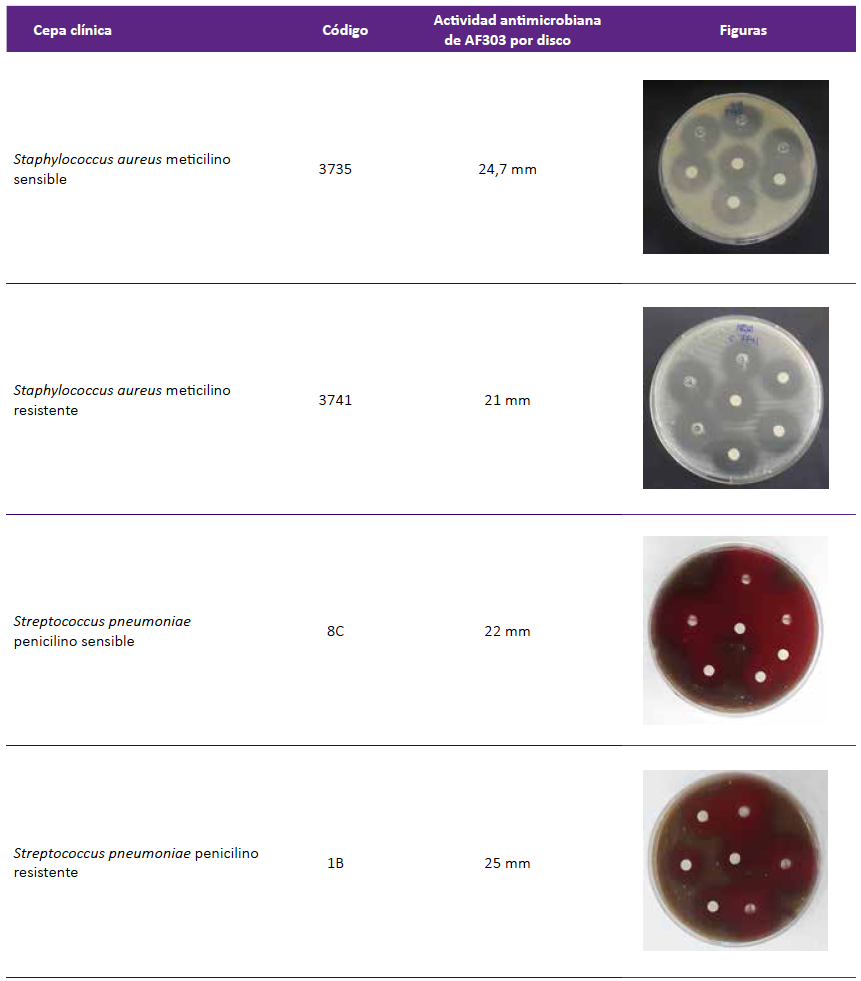
Figura 2 Actividad antimicrobiana producida por el extracto crudo de AF303 (procedente del aislamiento clínico de A. fumigatus sensu stricto.), sobre cepas clínicas de Staphylococcus aureus y Streptococcus pneumoniae.
Al comparar la diferencia de promedios entre las cepas sensibles y resistentes de S.au y S.pn, se determinó estadísticamente (p<0,05) que el promedio obtenido sobre las cepas sensibles no es mayor al promedio sobre las cepas resistentes. Mediante la comparación múltiple de medias por la prueba de Tukey se observó que no existe diferencia significativa entre ambos grupos (Figura 3).
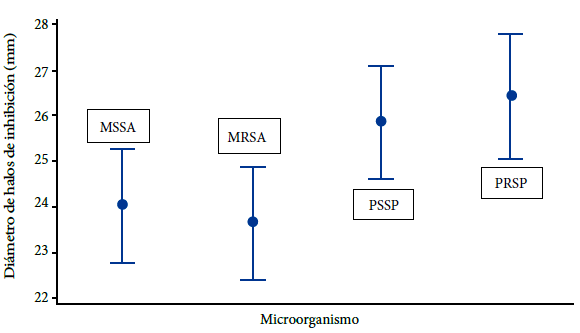
MSSA: Staphylococcus aureus meticilino sensible
MRSA: Staphylococcus aureus meticilino resistente
PSSP: Streptococcus pneumoniae penicilino sensible
PRSP: Streptococcus pneumoniae penicilino resistente.
Figura 3 Intervalos de los diámetros de inhibición antimicrobiana por difusión en disco, producidos por el extracto crudo de AF303 procedente del aislamiento clínico de A. fumigatus sensu stricto, sobre cepas clínicas de Staphylococcus aureus y Streptococcus pneumoniae.
DISCUSIÓN
Los metabolitos secundarios presentes en el extracto crudo, de la cepa proveniente de micosis invasiva (AF 303), presentaron actividad antimicrobiana sobre la totalidad de cepas clínicas de Staphylococcus aureus y Streptococcus pneumoniae. Este es el primer reporte en la región el cual evalúa la extracción de principios activos provenientes de una cepa clínica de AF, ya que estudios previos han tomado como muestra hongos ambientales provenientes de suelos y plantas (endofíticos) 1,7,8,9. Las distintas formas de interacción desde el desarrollo infeccioso del hongo, con las características del medio (ambiental o interno humano), además de factores genéticos intrínsecos de cada especie, determinan la importancia de evaluar cepas de aislamientos clínicos por la particularidad en la generación de metabolitos secundarios 4.
Una cepa ambiental de AF se encuentra influenciada por factores abióticos (temperatura, pH, nutrientes) y factores bióticos (depredadores y competidores). Si bien es cierto, un AF causante de infección está igualmente influenciada los mismos factores en el medio interno, estos cambian drásticamente según las condiciones en homeostasis (37°C, pH 7,35 - 7,45, bioelementos), además de enfrentarse a las moléculas y células del sistema inmunológico. En el presente estudio se muestra una media estadística superior a la mayoría de estudios donde evalúan cepas ambientales. Esto difiere de la hipótesis que señalaba que un hongo pierde la propiedad de generar metabolitos secundarios con actividad antimicrobiana al encontrarse fuera de su planta hospedera 18.
Una explicación tentativa para estos resultados es que los metabolitos secundarios de AF, al ser una plétora de principios activos, no poseen los mismos sitios diana de los antibióticos betalactámicos evaluados en este estudio. Se podría decir que existe una sinergia entre las moléculas presentes en el extracto que ejercerían acción sobre más de un blanco en la estructura bacteriana 7.
La principal limitación de este tipo de estudios es la falta de estandarización, la cual es transversal en el procesamiento desde la extracción de metabolitos secundarios hasta la evaluación antimicrobiana. Existe un amplio rango de condiciones y técnicas que varían de autor en autor, como son: solvente de extracción, volumen del inóculo del extracto crudo, medio de cultivo de fermentación, condiciones de incubación, puntos de corte, entre otros 19, 20. El sesgo por la inexistencia de normalización del protocolo impedirá que estos resultados sean extrapolados para otras cepas clínicas, siempre y cuando no se reproduzcan las mismas condiciones experimentales del presente estudio.
La fortaleza del estudio fue obtener un óptimo rendimiento en la obtención de la masa cruda en comparación a otras metodologías de fermentación. En comparación con otros estudios donde obtuvieron 600 mg en 2 L y 8,3 g en 30 L 6,7,8, el rendimiento de este estudio es más eficiente según la cepa, condiciones de fermentación y concentración del extracto.
El rango de halos de inhibición según los antecedentes varían desde 12 mm a 30,3 mm (2 ,6), siendo también ausente la actividad antimicrobiana. Los hallazgos de este estudio son consistentes con Valgas y Kalyani y col. quienes utilizando una concentración de 100 mg/mL obtuvieron una media del halo de inhibición sobre Sau ATCC 25923 de 20 y 18 mm 17,18. Otros estudios han tomado como punto de corte un diámetro mayor a 9 mm 6,8, 10 mm 2 y 12 mm 1 respectivamente, lo cual se relaciona con el tamaño del disco que los autores utilizaron en sus ensayos.
Un objetivo ulterior en este tipo de estudio de naturaleza preliminar será caracterizar la fracción de acetato de etilo donde por estudios de cromatografía líquida de alto desempeño (HPLC) y espectrometría de masas acoplada a cromatografía de gases (MS-GC), con los cuales se pueda eventualmente aislar novedosos compuestos antimicrobianos. Esto podría conllevar al estudio de nuevos principios activos sobre bacterias resistentes. Diversos autores señalan que la metodología de este tipo de estudios abre nuevas perspectivas en investigación biomédica, siendo la fuente de información para líneas secundarias sobre resistencia antimicrobiana en la era pos-antibiótica 8. Asimismo, es necesario que estudios posteriores puedan reproducir la metodología sobre bacterias Gram negativas de importancia clínica en infecciones asociadas a la atención en salud o adquiridas en la comunidad.















