INTRODUCCIÓN
Los triatominos son insectos hematófagos pertenecientes a la familia Reduvidae y de la subfamilia Triatominae. Tienen importancia epidemiológica porque un grupo de ellos transmiten el protozoario Trypanosoma cruzi, el agente etiológico de tripanosomiasis americana, conocida como la enfermedad de Chagas. En el norte del Perú existe una gran diversidad de triatominos que cumplen el rol de vector para la transmisión de parásito Tripanosoma cruzi 1,2,3,4 y uno de ellos, el más importante, es el triatomino Panstrongylus herreri, por encontrarse en mayor porcentaje (más del 90%) en los estudios de campo realizados en la zona norte o nororiente del país, encontrando la mayoría de sus estadios en áreas intradomiciliarias (5; así por ejemplo, se ha reportado la presencia de este triatomino en los departamentos de Piura, Cajamarca y Amazonas (10.
Para la clasificación de los vectores de los distintos parásitos, la taxonomía es una herramienta base 6; sin embargo, en los últimos años se ha complementado con herramientas moleculares para realizar un análisis más exacto y rápido. Marcilla en el 2001 utilizó la región del segundo separador transcrito interno de ADN ribosomal (ITS-2) como marcador molecular para poder resolver relaciones existentes entre distintas poblaciones de triatominos. Esto permitió diferenciar a los triatominos por el tamaño (número de pares de bases) de amplificación de dicha región (7. Luego, en 2002 Marcilla realizó un estudio con los distintos géneros de Panstrongylus indicando que Panstrongylus herreri y Panstrongylus lignarus son la misma especie. Estos estudios apoyan que dichas regiones de ADNr son muy importantes para estudios filogenéticos y a varios niveles taxonómicos (8.
En el Perú, los estudios moleculares por PCR en triatominos, sobre todo en la región norte del país, son escasos. El único realizado fue en el año 2008 por Ancca, quien realizó un estudio en los departamentos de Cajamarca y Amazonas, reportando la presencia de Panstrongylus herreri infectados por Trypanosoma cruzi, y encontrando una amplificación de la región ITS-2 de 960 pares de bases (pb) (9.
Si bien se ha reportado la presencia de este vector en zonas donde antes no se había reportado 5,10, es aún desconocida su presencia en otras áreas geográficas de nuestro país. Así, el objetivo de la presente investigación fue determinar las características biológicas y moleculares de las cepas de Panstrongylus sp. nativas del Perú, reportadas en distintas regiones del Perú. Además de caracterizarlas y agruparlas genéticamente para su mejor estudio y control, utilizando el marcador molecular ITS-2 del ADN ribosomal, mediante la técnica del PCR (11,12,).
MÉTODOS
Se realizó un estudio observacional descriptivo, en los departamentos de Trujillo (Trujillo), Amazonas (Bagua), Cajamarca (Cajabamba, Chota), y Ucayali (Pucallpa- Campo verde). La recolección de vectores se realizó desde setiembre 2014 a abril de 2015; y la identificación molecular entre agosto 2016 a diciembre 2019.
Recolección de triatominos
Se realizó la colección de muestras de vectores según el protocolo realizado por Solís et al. (4 donde la colecta de especímenes se realiza principalmente en la mañana en zonas intradomiciliarias, recolectando manualmente en bolsas de plástico para luego ser trasladados a frascos de boca ancha cubiertos con un tul para mantenerlos vivos, rotulados según fecha de captura, procedencia y en qué ambiente se encontraron. Las muestras obtenidas fueron remitidas al Laboratorio de Serología y Bioquímica Parasitaria del Instituto de Medicina Tropical Daniel A. Carrión de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos. Todos los especímenes de triatominos (ninfas y/o adultos hembras y machos) fueron identificados según la clave dicotómica de Lent & Wygodzinsky 13. Los triatominos colectados se mantuvieron en frascos de vidrio cubiertos con tul para una adecuada oxigenación y facilitar su supervivencia; asimismo, fueron alimentados con sangre de aves (pollos) hasta el momento de la extracción de ADN.
Población y muestra
La población la conformó el material biológico recolectado, que consistió en especímenes de Panstrongylus sp. procedentes de las regiones donde se hizo la recolección. Por medio de muestreo intencional, se seleccionó una muestra de 50 especímenes: 10 especímenes de cada región.
Identificación biológica y molecular
Se utilizó como técnica la observación, y como instrumento la lista de verificación. La observación se hizo mediante la caracterización de los especímenes de Panstrongylus sp. Para su agrupación taxonómica. Para la identificación molecular se utilizó el marcador molecular ITS-2 del ADN ribosomal para su amplificación mediante la técnica de PCR 8,9,11,12.
El procedimiento de extracción de ADN se realizó entre los meses de diciembre 2015 y agosto del 2016. El ADN genómico del vector se obtuvo a partir de las patas de cada insecto, utilizando protocolos realizados por Ancca 9 y Fraga 14. La extracción del ADN genómico se realizó utilizando el kit DNeasy tissue handbook de QUIAGEN(r) con una ajuste final de volumen de resuspensión de 200 μL.
Luego de la extracción de ADN se realizó la amplificación de la región ITS-2 del ADNr con los primers específicos 8.
Síntesis de primers
Se sintetizaron los primers (cebadores/ iniciadores) para la amplificación de la región ITS-2 del ADNr. Los primers que se utilizaron fueron los siguientes: 5.8T (5'CATAGC GGT GGA TCA CTC GG) y 28T (5'GCACTAT CAA GC A ACA CGA CTC) (8,9.
Estandarización del PCR
Para realizar el PCR se consideró la concentración final de la reacción de PCR fue de 1X para el buffer de reacción de Taq polimerasa, 4mM de ClMg2 (Invitrogen (r)), 2 mM para los dNTPs, 1 μM para cada uno de los primers y 1 U (r)Taq DNA Polymerase (Invitrogen (r)).
Las condiciones para el termociclador fueron: inicio 92°C x 2 minutos; denaturación 92°C por 30 segundos; alineamiento 55°C por 30 segundos; extensión 72°C por 40 segundos. Este proceso se llevó haciendo uso de 33 ciclos, luego se finalizó a 72°C por 2 minutos. Los productos fueron visualizados mediante un gel de agarosa al 1% y teñidos con SYBR green utilizándose el marcador de peso molecular 100 pb.
RESULTADOS
Se observaron especímenes de Panstrongylus sp. ninfas, adultos hembras o machos. Todos fueron identificados según la clave dicotómica de Lent (13 y Wygodzinsky 15, y comparados con la clave de Elliot 6. El 100% de especímenes evaluados correspondieron morfométricamente a la especie Panstrongylus herreri.
Respecto a la caracterización molecular se observó la amplificación de una banda de interés: ITS-2. Las muestras se corrieron por duplicado, además de colocar dos controles negativos a fin de verificar que no había contaminación al momento de realizar las soluciones para el PCR. En las 5 zonas de recolección de muestras, se observaron 3 patrones diferentes de ITS-2 en las muestras de Panstrongylus herreri. Las muestras de la zona de Trujillo y Ucayali presentaron una banda de ITS-2 de 960pb, las muestras de las zonas de Cajamarca y Cajabamba presentaron una banda ITS-2 de 800pb, y las muestras de la región de Bagua presentaron una banda de 750pb (Figura 1).
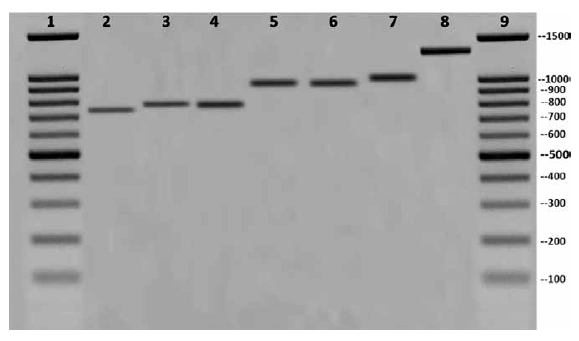
Figura 1 Amplificación del ITS-2: línea 1 y 9, marcador de peso molecular de 100pb; línea 2: Panstrongylus herreri (Bagua) 750pb; línea 3: Panstrongylus herreri (Cajabamba) 800pb; línea 4: Panstrongylus herreri (Cajamarca) 800pb; línea 5: Panstrongylus herreri (Ucayali) 960pb; línea 6: Panstrongylus herreri (Trujillo) 960pb; línea 7: Triatoma infestans -1000pb; línea 8: Rodnius sp. - 1300pb.
DISCUSIÓN
El género Panstrongylus ha sido localizado con denominaciones sinónimas en diversas partes del Perú. Previamente se estableció la presencia del vector en el norte del Perú, predominantemente en los departamentos de Cajamarca y Amazonas, pero con estos resultados se puede afirmar la presencia de Panstrongylus herreri en los departamentos de Trujillo y Ucayali.
Mediante la caracterización molecular se pudo comprobar que la banda de ITS-2 de Panstrongylus herreri en Perú presentó tres patrones: 960pb (Trujillo, Ucayali); 800pb (Cajamarca, Cajabamba) y 750pb (Bagua). Ancca y colaboradores encontraron en el 2008 muestras de Panstrongylus herreri que presentaron una banda ITS-2 de un tamaño 960pb en los departamentos de Cajamarca y Amazonas, dicho tamaño de banda también fue encontrado en las muestras obtenidas en nuestro estudio, en los departamentos de Trujillo y Ucayali respectivamente.
El año 2017 se estableció, por primera vez, la presencia de Panstrongylus lignarius, también conocido como Panstrongylus herreri, en el estado de Rondonia, Brasil, cuya aparición era preocupante, porque se encontró que esta especie estaba infectada naturalmente con Trypanosoma cruzi y había evidencia de sus capacidades de encontrarse localizada en otros países de América del Sur 16. Por su parte, Ribero (17 y colaboradores reportaron la presencia de P. lignarius (P. herreri) en el estado de Acre, zona limítrofe con el departamento de Madre de Dios.
Se ha reportado que Panstrongylus herreri es un vector principal de la enfermedad de Chagas, y su éxito como vector se debía a su capacidad para establecer colonias domiciliadas, concluyéndose que, a pesar de haberse detectado una disminución en las tasas de oviposición, el potencial de P. herreri como vector de la enfermedad de Chagas en ambientes distintos del Amazonas debe ser considerado 18.
Por su parte, Nevoa, Mendes, da Silva, Soares, Oliveira, Ribeiro 19 en su artículo científico establecieron que los triatominos eran artrópodos hematófagos vectores de Trypanosoma cruzi, el agente causante de la enfermedad de Chagas.
Además, se ha establecido que Panstrongylus lignarius, considerado uno de los triatominos más versátiles porque podía parasitar a diferentes hospederos, se encontraba en diferentes hábitats y países, tenía un comportamiento selvático, peri doméstico y doméstico, y era un vector muy importante de la transmisión de enfermedad de Chagas, especialmente en el Perú 19.
El género Panstrongylus se ha localizado con denominaciones sinónimas en diversas partes del Perú; y mediante los resultados de esta investigación, se ha establecido al 100% que las muestras obtenidas fueron Panstrongylus herreri. Debido a su gran capacidad de adaptación, es posible ver su movimiento en la zona norte del Perú, Trujillo y Ucayali, y en otras zonas de Sudamérica, Brasil principalmente.
Mediante la caracterización molecular, se demostró que mediante el marcador molecular ITS-2 del ADN ribosomal, se pudo observar 3 patrones diferentes: 960pb; 800pb; 750pb. De los cuales solo el patrón 960pb era el primero en ser reportado en los departamentos de Cajamarca y Amazonas, y en este estudio dicho patrón se encontró en los departamentos de Trujillo y Ucayali.















