INTRODUCCIÓN
Esta es la tercera neumonía por coronavirus en los últimos 20 años en el mundo: en el 2002 el coronavirus del síndrome respiratorio agudo severo (SARS-CoV), en 2012 el coronavirus del síndrome respiratorio del Medio Oriente (MERS-CoV), y el 31 de diciembre de 2019 se reportó el SARS-CoV-2 que la Organización Mundial de la Salud (OMS) denominó la enfermedad por coronavirus 2019 (COVID-19) 1. Actualmente representa un problema global de salud pública. Los murciélagos son los anfitriones de más de 30 coronavirus, siendo el reservorio natural de SARS-CoV, MERS-CoV y SARS-CoV-2; se presume que el pangolín sería el mamífero intermediario para la afección en humanos 2.
El genoma de los coronavirus codifica cuatro proteínas estructurales principales [espiga (S), envoltura (E), membrana (M) y nucleocápside (N)]. La proteína S juega un papel esencial en la unión a las células diana. El SARS-CoV-2 y el SARS-CoV se unen a la enzima convertidora de angiotensina 2 (ACE2, Angiotensin-converting enzyme 2) 3.
En el presente artículo resume la evidencia actual respecto a la clínica ocular, fisiopatología, inmunología ocular y respuesta inmunitaria ocular frente al COVID 19.
DESARROLLO DEL TEMA
Clínica ocular por COVID 19
Dentro de las manifestaciones clínicas más comunes se encuentran: fiebre 77,4 - 98,6%, tos 59,4 - 81,8%, fatiga 38,1 - 69,6%, disnea 3,2 - 55%, mialgia 11,1 - 34,8%, producción de esputo 28,2 - 56,5% 1. Las manifestaciones oftalmológicas son como otras conjuntivitis virales: dolor, sensación de cuerpo extraño, hiperemia conjuntival, secreciones 4; aunque de manera aislada se reportó un paciente con tarsadenitis y hemorragia subconjuntival 5.
Desde los inicios de la enfermedad se empezaron a reportar casos concomitantes de pacientes con neumonía por COVID-19 y conjuntivitis: Chen y col. reportaron un caso 6, Ye y col. reportaron 3 casos 7. Por otro lado, Li y col. reportaron dos casos de conjuntivitis como primer síntoma 8. En un estudio observacional, en pacientes hospitalizados con neumonía por COVID-19, de 92 pacientes diagnosticados, un paciente tenía conjuntivitis como el primer síntoma, cuatro pacientes presentaron conjuntamente neumonía y conjuntivitis 9. Guan y col. reportaron conjuntivitis en 9 de 1099 pacientes con COVID-19 10.
Existen reportes sobre el aislamiento de ARN viral en conjuntiva de pacientes con conjuntivitis. Shen y col. encontraron de 30 pacientes, uno con prueba positiva 11; Sun y col. de 72 pacientes, un paciente 12; Duan y col. del total de 38, encontraron de 12 pacientes con sintomatología ocular, de ellos dos presentaron resultado positivo 4. Sin embargo, Chen y col. demostraron que de 67 pacientes, tres pacientes dieron positivos, pero no presentaron clínica ocular 13.
Llama la atención un reporte de caso en Italia, en paciente con COVID-19 y clínica ocular, se realizó seguimiento contínuo con hisopado conjuntival, encontrándose positivo aún días después que la clínica ocular desapareciera 14.
Fisiopatología por COVID 19
El ciclo de vida del virus en el huésped consta de 5 pasos: unión, penetración, biosíntesis, maduración y liberación. La proteína S es una glicoproteína, que puede ser escindida por la furina proteasa del huésped en dos polipéptidos, S1 y S2, el polipéptido S1 se une al receptor del huésped y el polipéptido S2 media la fusión de la envoltura viral y la membrana celular 15.
ACE2 pertenece a la familia de proteasas unidas a membrana, es una glicoproteína carboxipeptidasa que contiene iones de zinc y participa en la actividad fisiológica del sistema renina-angiotensina (RAS) 16. En el ser humano, ACE2 se expresa en células epiteliales de la cavidad oral, vía respiratoria, entre otras 17. También se expresa en células epiteliales corneales y conjuntivales, células endoteliales corneales e incluso en fibroblastos corneales 18.
La proteína S de SARS-CoV puede regular negativamente e inducir la eliminación del ectodominio catalíticamente activo de ACE2. La reducción de la función en ACE2 puede generar una disfunción local del RAS, aumentando la respuesta inflamatoria y la permeabilidad vascular 19.
La respuesta del sistema inmunitario a COVID 19 aún no está bien entendida. Extrapolando lo conocido sobre la inmunidad a SARS-CoV y otros coronavirus, podemos sugerir que la respuesta inmune inicia con la activación de ciertos receptores de reconocimiento de patrones (PRRs, pattern recognition receptors) expresados en las células huésped; estos receptores distinguen el material viral mediante la detección de moléculas en lugares biológicos inapropiados. Los principales PRRs son 20:
TLR7 (toll-like receptor 7), que se activa por la presencia de ARN en los endosomas.
RIG-I (retinoic acid-inducible gene I) y MDA-5 (melanoma differentiation-associated protein 5), que reconocen el ARN viral bicatenario citosólico.
STING (stimulator of interferon genes), esta vía no reconoce directamente el ARN viral, pero podría ser activado por el ADN mitocondrial liberado luego del daño celular. La activación de los PRRs inicia una compleja cascada de señalización intracelular que conduce a la síntesis de interferones (IFN) alfa, beta, gama y otras citocinas inflamatorias (20) .
Se ha descrito que el SARS-Cov puede evadir la detección inmune durante la respuesta innata inicial como evitar la detección de ARN, alterar la producción de IFN tipo I o bloquear la acción del IFN sobre STAT 1/2 (signal transducer and activator of transcription) (21. Esta propiedad de evasión inmune podría explicar lo períodos de incubación largos de hasta 24 días 1.
Las células presentadoras de antígeno (APC, antigen presenting cells), presentan antígenos virales a las células T CD8 y CD4. Después del análisis de MHC-I, se observó que la secuencia de COVID-19 es introducida por alelos de HLA C (human leukocyte antigen C) 21.
Una vez que las células del linaje mieloide se activan a través de PRRs, pueden presentar eficientemente péptidos virales en MHC I y comenzar a expresar moléculas coestimuladoras que ayudan a las células T del sistema inmunitario adaptativo 20. En la activación de la inmunidad celular, las células T CD8 + se vuelven competentes para matar células infectadas por virus; mientras que las células CD4 + ayudan a la inmunidad humoral, haciendo que las células B se diferencien en células plasmáticas, produciendo anticuerpos específicos para un antígeno viral. Se ha observado que la seroconversión de inmunoglobulinas (Igs) M y G, es mediada por las células T auxiliares. En SARS-CoV se informó que las células T de memoria CD4 + (TNFα, IL-2, IFN) y CD8 + (TNFα, IFNγ) podrían persistir en pacientes recuperados durante 4 años 22.
La infección por COVID-19 mostró una "tormenta de citocinas", con niveles aumentados de IL1-β, IL1RA, IL6, IL7, IL8, IL9, IL10, FGF2 básico, GCSF, GMCSF, IFNγ, IP10, MCP1, MIP1α, MIP1β, PDGFB, TNFα, y VEGFA. Pacientes de UCI con COVID-19 producían más IL-6 y GM-CSF que las que no requerían UCI 20.
En pacientes con SARS-Cov, el desarrollo de enfermedad respiratoria aguda coincide con la seroconversión de IgG en el 80% de los pacientes. Además, los pacientes que desarrollaron el anticuerpo anti-S neutralizante más rápido, tenían una mayor probabilidad de morir: a los pacientes fallecidos les tomó un promedio de solo 14,7 días alcanzar sus niveles máximos, en comparación con 20 días para los pacientes recuperados 23. En pacientes con COVID-19, la detección de anticuerpos totales séricos es el marcador más temprano y sensible, este aumento se produce a partir de la segunda semana del inicio sintomatológico. La seroconversión de IgM e IgG se produjo entre la tercera y cuarta semana de los primeros síntomas, la IgM presentó el nivel más bajo en la semana 5 y casi nula en la semana 7, mientras que la IgG persiste pasado las 7 semanas 24.
Sistema inmunológico ocular
El enfoque de privilegio inmune proporciona protección contra la inflamación intraocular minimizando el riesgo de daño en la visión. El desarrollo y mantenimiento del microambiente intraocular inmunosupresor a través de la generación de linfocitos T reguladoras (LTregs) se produce por 25:
En la desviación inmune asociada a la cámara anterior (ACAID, anterior chamber associated immune deviation), se retienen precursores de células T citotóxicas y expanden clonalmente células B que secretan IgG 1 los cuales no fijan complemento; además, inhibe células CD4 + y células B que secretan Ig fijadores de complemento. Dichas funciones son mediadas por células T CD4 + reguladores aferentes, células T CD8 + reguladores eferentes y células T CD8 + que inhiben células B que sintetizan IgG fijadoras de complemento. Los Tregs CD8 + eferentes actúan en el ojo y la periferia, mientras que los Tregs CD4 + aferentes actúan en los órganos linfoides secundarios.
Las células del endotelio corneal pueden generar LTregs (CD25+ y Foxp3+) a partir de células T CD8 +, a través de la activación del TGF β (Transforming growth factor beta) unido a la membrana.
El humor acuoso contiene factores inmunosupresores como la α MSH (melanocyte-stimulating hormone alfa), VIP (vasoactive intestinal peptide) y TGF- β2, los cuales promueven la conversión de células T vírgenes en LTregs Foxp3 +.
Las células del epitelio pigmentario generan LTregs (CD25 +, Foxp3 +), que suprimen a las células T activadas por distintos mecanismos como el aumento de TGF- β, contacto célula-célula y/o interacciones de muerte celular proramada (PD-1, cell death programmed protein 1)/ (PD-L1, programmed ligand 1), todo ello medidado por mecanismo complejos donde interactúan moléculas de TGF- β (soluble y unido a membrana), la trombospondina 1 (TSP 1), interacciones de la proteína B7-2 / CTLA-4 (Cytotoxic T-lymphocyte-associated protein 4) y CTLA-2 α.
En la superficie ocular existen mecanismos para inhibir el inicio de enfermedades relacionadas con la inflamación, mediada por LTreg CD4 + CD25 + Foxp3 + 26, que brindan privilegio inmune en la superficie ocular 27:
Ignorancia inmunitaria, dada por ausencia de vasos linfáticos corneales, ausencia de linfocitos corneales, pocos MHCII en el epitelio corneal, así como IgA secretora el cual es antiinflamatoria ya que no activa el complemento, además se deposita en la superficie ocular evitando la entrada de patógenos.
Tolerancia inmune: las células dendríticas corneales son inmaduras, hay una falta de respuesta del potencial innato corneal, existe un subconjunto DC CD103+ en donde se ha demostrado que la expresión de CD103+ en células no T es esencial para la función de los LTeg in vivo 28.
Entorno inmunosupresor: linfocitos intraepiteliales CD8+ en modo supresor, presencia de ligandos de la muerte en la glándula lagrimal y conjuntiva, como TRAIL (TNF-Related Apoptosis- InducingLigand), ligando CD95 (CD95L o FasL), TGF- β2.
El tejido linfoide asociado a la mucosa (MALT, mucosa-associated lymphoid tissue), a nivel ocular tiene el nombre tejido linfoide asociado a los ojos (EALT, Eye-associated lymphoid tissue), dentro del cual encontramos al tejido linfoide asociado a glándula lagrimal (LGALT, lacrimal glandassociated lymphoid tissue), tejido linfoide asociado a Conjuntiva (CALT, conjunctiva-associated lymphoid tissue), tejido linfoide asociado a drenaje (LDALT, lacrimal drainage-associated lymphoid tissue) 27.
Por lo tanto, la superficie ocular es un compartimento inmune único, en el que las características anatómicas, fisiológicas e inmunológicas actúan de manera sincronizada para fomentar un microambiente tolerante, existiendo un adecuado balance entre las diferentes moléculas como son 29: citoquinas inflamatorias (IL-1, IL-6, TNF-α, IL-17A, IFN-γ); citoquinas reguladoras como el TGF-β que induce Treg Foxp3 +; factores inhibitorios como PD-L1, CD95L y TRAIL; neuropéptidos pleiotrópicos como neuropeptido P (NP); neuropéptidos antinflamatorios como α-MSH, CGRP (calcitonin gene-related peptide) y VIP; quimiocinas.
La producción de la respuesta inmune ocular mediado por Igs se produce luego de una exposición a antígenos que pueden ser a nivel ocular o extraocular 30. Para que el LGALT logre tener una respuesta inmune mediante IgA se sabe que esta no puede ser generada por un flujo a contracorriente de antígenos desde la conjuntiva, sino que el estímulo para la migración de linfoblastos puede venir desde el NALT o MALT gastrointestinal, usando la vía linfática del conductor torácico desde los ganglios mesentéricos/cervicales 30. El CALT es capaz de captar y procesar antígenos para una adecuada respuesta inmune adaptativa 27.
Conclusión de respuesta inmunitaria ocular y COVID 19
Al no existir por el momento un mecanismo exacto que explique la inmunidad ocular y el COVID-19, nos basamos de la bibliografía revisada. El COVID-19 puede ingresar mediante inoculación directa de gotas de saliva, por continuidad nasofaríngea, o autoinoculación por manos contaminadas (Figura 1). El momento de contagio se puede evidenciar con los diferentes tiempos de manifestaciones oculares en el contexto de los pacientes con COVID-19, ya sea la afección ocular como primer síntoma o síntoma concomitante (6-10.
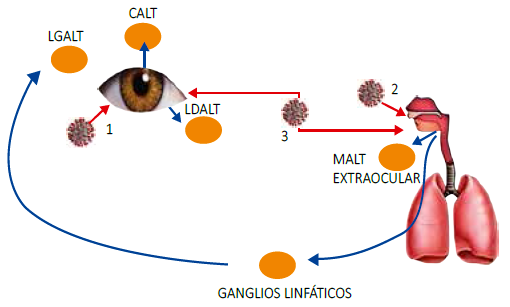
Tejido linfoide asociado a la mucosa (MALT, mucosa-associated lymphoid tissue)
Tejido linfoide asociado a glándula lagrimal (LGALT, lacrimal glandassociated lymphoid tissue)
Tejido linfoide asociado a conjuntiva (CALT, conjunctiva-associated lymphoid tissue)
Tejido linfoide asociado a drenaje (LDALT, lacrimal drainage-associated lymphoid tissue).
Figura 1 Ingreso del virus y activación del sistema linfoide. Las Flechas rojas indican el ingreso del COVID-19: 1. Ingreso a través de la superficie ocular, 2. Ingreso por el sistema respiratorio, 3. Ingreso del COVID-19 compartiendo la vía lacrimonasal. Las flechas azules indican la activación del sistema inmune luego del ingreso del COVID-19, el ingreso del virus por vía ocular ocasiona una respuesta inmune por CALT y LDALT, mientras que por vía extraocular genera una respuesta por MALT extraocular y LGALT.
El virus luego de unirse a los receptores ACE-2 de las células oculares, se produce el reconocimiento de la infección mediante los PRRs 20, dando inicio a una respuesta local, mediado por inmunidad innata y luego inmunidad adaptativa (Figura 2), llevando a la formación de IgA, IgM y IgG, así como la activación de células T efectoras. La síntesis lagrimal de IgA se pueden dar luego de una exposición primaria del virus en la conjuntiva o como respuesta a una infección extraocular, además IgA evita la infección de las células de superficie ocular mediante un mecanismo antiinflamatorio 21-24.
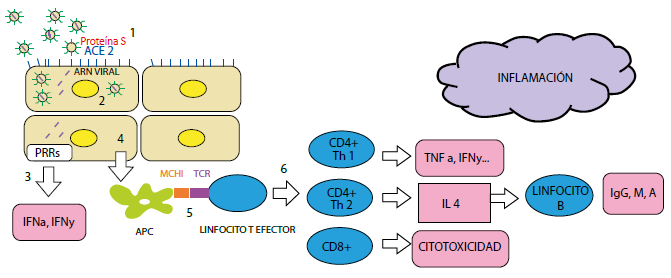
Enzima convertidora de angiotensina 2 (ACE2, angiotensin-converting enzyme 2)
Receptores de reconocimiento de patrones (PRRs, pattern recognition receptors)
TLR7 (toll-like receptor 7)
RIG-I (retinoic acid-inducible gene I)
MDA-5 (melanoma differentiation-associated protein 5)
TNF-α (tumor necrosis factor α)
IFN (interferon)
Células presentadoras de antígeno (APC, antigen presenting cells)
MHC clase I (major histocompatibility complex I)
Receptor de linfocitos T (TCR, T cell receptor)
Figura 2 Proceso inflamatorio en la superficie ocular. Se describe el proceso inflamatorio a nivel de la superficie ocular: 1.- Unión del COVID 19 a través de la Proteína S (Rojo) al Receptor ACE 2 (Azul) de la Célula del Epitelio conjuntival. 2.- Replicación intracelular del COVID 19. 3.- Reconocimiento del ARN viral (morado) mediado por PRRs (TLR 7, RIG 1, MDAS), produciendo aumento de citocinas entre ellas IFN alfa, IFN gama. 4.- Se produce activación de las APCs. 5.- APC mediante el MCH I interactúa con TCR del Linfocito, produciendo Linfocitos T efectores. 6.- Aumento de Linfocitos CD4 + , CD 8+, que van a llevar al aumento de interleucinas inflamatorias, síntesis de anticuerpos y citotoxicidad.
Los síntomas clínicos se podrían desarrollar de manera secundaria a una disminución ACE-2 local o por activación inicial de citosinas 16,18. A diferencia de la clínica sistémica de algunos pacientes por la tormenta de citocinas, en el sistema ocular encontramos una serie de procesos que van a regular una actividad inflamatoria autolimitada, la cual estaría brindada por el privilegio inmune, mediado por un aumento de los LTreg así como la secreción de IgA 25,27,29,30. Figura 3.
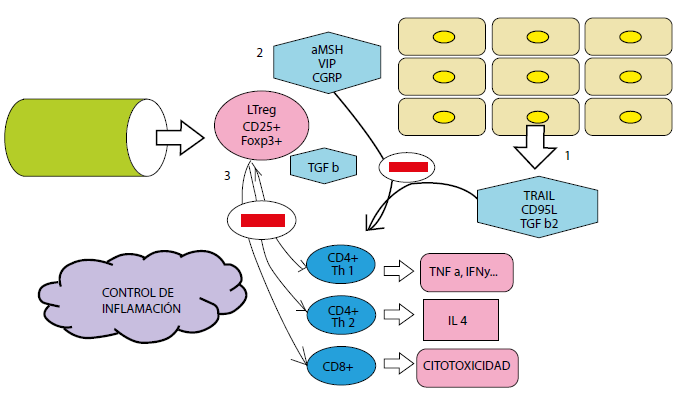
TRAIL (TNF-Related Apoptosis- InducingLigand)
TGF- β2 (Transforming growth factor beta)
CGRP (Calcitonin gene-related peptide)
α MSH (Melanocyte-stimulating hormone alfa)
VIP (vasoactive intestinal peptide)
LTreg (Linfocitos T reguladores CD25+Foxp3+)
Figura 3 Regulación de inflamación por el privilegio inmune ocular. Control del proceso inflamatorio por diversos factores: 1. Expresión en la conjuntiva de ligandos de muerte: TRAIL, CD95L, TGF β2. 2. Secreción de neuropéptidos inibitorios: α- MSH, VIP, CGRP. 3. Producción en los órganos linfoides de LTreg: CD25+Foxp3+, quienes además aumentan TGF β.
Interesante lo encontrado por Duan y col 4, quienes reportaron que pacientes con clínica ocular v.s. los que no hicieron clínica ocular, presentaron mayor conteo de leucocitos (10 900 v.s 5730, p=0,009). La linfocitopenia constituye un marcador de peor pronóstico y reflejo de una desregulación del sistema inmune; por lo tanto, planteamos que por medio del privilegio inmune ocular, luego de la afección ocular, se podría liberar LTreg al sistema linfático evitando dicha desregulación.
Es desconocida la vía de contagio a través de las secreciones oculares; sin embargo, consideramos que podría darse a inicios de la colonización conjuntival. Los reportes indican presencia de ARN viral en la conjuntiva en el contexto de pacientes con y sin clínica ocular 4,11-14. Por lo tanto, la positividad del hisopado conjuntival no necesariamente llevaría a manifestación clínica, dándose una falta de capacidad viral para infectar la superficie ocular, sea por una neutralización de Ig A o porque el ARN encontrado sea parte de fragmentos de virus desintegrados. Asimismo, los resultados negativos en la superficie ocular pueden verse influenciados por la concentración del virus o el proceso de los métodos diagnósticos.















