INTRODUCCIÓN
La bartonelosis es una infección causada por bacterias del género Bartonella, responsable de múltiples manifestaciones clínicas, dependiendo de la especie y del estado inmunológico del paciente, ocasionando infecciones tanto en humanos como en animales domésticos y silvestres 1, 2.
Hasta inicios del año 1990, el género Bartonella tuvo una sola especie, B. bacilliformis. La posterior identificación de otras especies de Bartonella como agentes causantes de enfermedades como el arañazo de gato, angiomatosis bacilar y fiebre de las trincheras, ha dejado en evidencia su importancia como patógenos humanos 1.
B. bacilliformis es el agente causal de la enfermedad de Carrión, la cual es endémica y reemergente en el Perú, limitada a ciertas regiones del ande peruano y algunos focos en Ecuador y Colombia (3, 4. Se transmite por la picadura del mosquito Lutzomyia verrucarum, cuya distribución altitudinal va de los 900 a los 3000 msnm 5.
En el Perú, la enfermedad de Carrión es endémica en los departamentos de Lima, Ancash, La Libertad, Piura, Caja-marca, Amazonas, Huancavelica, Ayacucho y Cusco, siendo el humano el único reservorio de B. bacilliformis 6. Se han documentado brotes de la enfermedad de Carrión en zonas no endémicas, evidenciando ser una enfermedad reemergente con potencial de expansión geográfica 7.
Los métodos de diagnósticos actuales de la enfermedad de Carrión en nuestro medio se basan en los antecedentes epidemiológicos, las manifestaciones clínicas, el frotis sanguíneo coloreado con Giemsa o Wright y el aislamiento del agente patógeno mediante hemocultivo. En zonas endémicas, el método de elección en la fase aguda de la enfermedad es la observación al microscopio de frotis sanguíneos coloreados en busca de eritrocitos con bacilos intracelulares. El método es poco sensible (24%-36%), aunque revela una alta especificidad (96%) 4, 8. En la etapa crónica de la enfermedad, la detección bacteriana en las verrugas tiene una menor sensibilidad (10% o menos) 8. Por otro lado, el cultivo de B. bacilliformis requiere de un tiempo prolongado de incubación, es laborioso, tiene escasa sensibilidad, y requiere de cierta experticia en su preparación y en la conservación de la esterilidad del medio de cultivo 9.
Una alternativa al frotis sanguíneo y hemocultivo es el uso de métodos moleculares, entre los que destaca la técnica de reacción en cadena de polimerasa (PCR), que mostró ser más sensible que los frotises sanguíneos 10, 11) y el cultivo 11. Sin embargo, debido a los altos costos de los equipos y la necesidad de contar con un entrenamiento especializado para su ejecución, es difícil su implementación en las zonas endémicas alejadas de los centros urbanos. Recientemente, la amplificación isotérmica mediada por bucle parece ser una técnica promisoria para el diagnóstico de la enfermedad de Carrión, no solo por su sensibilidad, sino por su rapidez y requerir un menor equipamiento que las pruebas de PCR convencionales 12.
El diagnóstico de la enfermedad de Carrión más utilizado en nuestro medio es el serológico, predominando las pruebas de inmunofluorescencia indirecta (IFI) 13, 14, prueba de ELISA 13, 15, 16 y Western blot 17. A pesar de sus innegables ventajas, las pruebas primarias son costosas, requieren un largo tiempo para obtener un resultado, necesitan equipo especializado y personal entrenado para su ejecución e interpretación. Además, una de las limitaciones de estas pruebas serológicas primarias es que no cuentan con un buen antígeno definido. Los distintos antígenos evaluados como el BB65 (GroEL), 75kDa (FtsZ), 43 kDa, fla o Pap31 (HbpA), principalmente en las pruebas de ELISA, han revelado resultados poco satisfactorios 8.
La prueba de contrainmunoelectroforesis (CIEF) es una técnica de inmunoprecipitación que utiliza antígenos puros o totales, y permite la rápida detección de anticuerpos o antígenos microbianos solubles en una variedad de fluidos corporales y tejidos. Otras ventajas de la CIEF son: la obtención de resultados en corto tiempo, el uso de un pequeño volumen, la simplicidad del procedimiento y el requerir un mínimo equipamiento 18. El objetivo del presente estudio fue determinar la sensibilidad y especificidad de la CIEF utilizando un antígeno sonicado obtenido de una cepa de Bartonella sp., para detectar anticuerpos contra la bacteria comparado con el cultivo como estándar de referencia.
MÉTODOS
Diseño del estudio
Se realizó un estudio de evaluación de pruebas diagnósticas. El diseño muestral fue por conveniencia, se seleccionaron sueros de pacientes con diagnóstico clínico y bacteriológico de enfermedad de Carrión del repositorio de sueros del Laboratorio de la Enfermedad de Carrión del Instituto de Medicina Tropical "Daniel A. Carrión" (IMT/DAC), de la Universidad Nacional Mayor de San Marcos (UNMSM).
Muestra
Para el estudio se seleccionaron 60 sueros de pacientes con diagnóstico clínico y bacteriológico (examen de frotis y cultivo) de bartonelosis del repositorio de sueros del Laboratorio de la Enfermedad de Carrión del IMT/DAC. Cada suero estaba en un criovial y fue guardado a -20 °C.
Para evaluar la reacción cruzada potencial, se consideraron 54 muestras de sueros de personas con otras infecciones, de las cuales 21 fueron de pacientes con fiebre tifoidea, 14 con brucelosis, 6 con enfermedad de Chagas, 3 con sífilis, 3 con toxoplasmosis, 2 con fasciolosis, 1 con hidatidosis, 1 con paragonimiasis, 1 con cisticercosis, 1 con himenolepiasis nana y 1 con aspergilosis.
Nueve sueros de personas sanas fueron obtenidos del repositorio de sueros del Laboratorio del Programa Especial de Bartonelosis Humana del IMT/DAC - UNMSM, sin antecedentes de viaje a zona endémica, o de haber padecido de bartonelosis.
Se incluyó en el estudio a aquellas personas que dieron su consentimiento informado escrito para uso futuro de muestras.
Cepas bacterianas y condiciones del cultivo
Se realizaron subcultivos de un aislado de Bartonella sp. proveniente de un cultivo positivo de un paciente con diagnóstico clínico de enfermedad de Carrión (IMT/ DAC 162-13/oct-2015). Estos subcultivos se realizaron en medio bifásico 19 con y sin componentes sanguíneos de carnero (glóbulos rojos y plasma), y sin antibióticos. La prueba de pureza de la cepa bacteriana se determinó mediante la observación al microscopio del frotis coloreado con Leishman. El cultivo puro fue cosechado, lavado y almacenado a -20 °C hasta ser sonicado.
Obtención del antígeno bacteriano
Las colonias de Bartonella resuspendidas en el tampón salino fosfato (PBS) pH 7,2 fueron lavadas por 2-3 veces mediante centrifugación a 3000 rpm a 4°C. La separación final del sedimento bacteriano se realizó mediante filtración, con ayuda de filtros Millipore de 0,45 µm. Previo a la sonicación, a la masa bacteriana se le adicionó azida de sodio a la concentración final de 1/5000, y se ajustó su concentración al patrón de turbidez de 0,5 de la escala de Mc Farland.
La sonicación de la masa bacteriana se realizó de tres formas diferentes: 3 ciclos de un pulso de 1 minuto de sonicación en periodos de 2 minutos de descanso 17, 5 ciclos de un pulso de 1 minuto de sonicación en periodos de 1 minuto de descanso 16, y 20 ciclos de un pulso de 20 segundos de sonicación en periodos de 10 segundos de descanso. Todas las sonicaciones se realizaron a 22,5 KHz de frecuencia, con intensidad de onda de 6,5, y los descansos de los sonicados fueron en baño de hielo. La masa bacteriana sonicada fue centrifugada a 14000 rpm por 15 minutos a 4°C, eliminándose el sedimento y obteniéndose el sobrenadante, el cual fue almacenado en pequeños volúmenes a -20 °C hasta su uso. Al sobrenadante del sonicado se les realizó el dosaje de proteínas por el método de Löwry 20.
Electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE)
Se realizó la electroforesis de proteínas en gel de poliacrilamida con dodecil sulfato sódico mediante el método de Laemmli, 21) usando un gel de separación de poliacrilamida del 12% y un gel de concentración al 5%. La muestra antigénica fue separada en una cámara electroforética Biometra Standard Power pack P25 (Labgene Scientific SA, Suiza), a 95 V para el gel de concentración y 125 V para el gel de resolución. El peso de las proteínas de la mezcla antigénica fue estimado mediante el uso de un estándar de peso molecular (Perfect protein Markers Novagen(r) Merck Millipore), con pesos moleculares en el rango de 10-225 kDa. Los geles fueron coloreados con Coomassie Blue al 0,05%.
Contrainmunoelectroforesis
La prueba de CIEF se efectuó de acuerdo al procedimiento descrito por Cornejo y col. (1993) 22. Las bandas de precipitación inespecíficas se eliminaron con citrato trisódico al 5% 23. Las láminas fueron después lavadas, secadas y teñidas con Amido Black 10B (Merck) 22.
Titulación del antígeno de Bartonella
La titulación del antígeno sonicado de Bartonella se realizó usando un suero de paciente (IMT/DAC 155-12/oct-2012), conteniendo anticuerpos anti-Bartonella, y proveniente de un paciente diagnosticado con enfermedad de Carrión a nivel clínico, microbiológico y molecular. Para su titulación el antígeno fue empleado sin diluir (1:1) y diluido en forma seriada al doble en solución salina amortiguada, y enfrentado con el suero de paciente sin diluir. El título del antígeno fue la inversa de la máxima dilución que produjo bandas de precipitación nítidas.
Determinación del tamaño y distancia entre los pocillos, y volúmenes de los reactivos
Para la estandarización de la prueba se evaluaron los tamaños de los pocillos de 3, 4 y 5 mm, volúmenes de los reactivos de 12, 21 y 36 μL, y distancia entre los pocillos de 3, 4 y 5 mm.
Evaluación de los sueros
Los sueros humanos fueron evaluados mediante la prueba de CIEF estandarizada, empleando el antígeno titulado.
Análisis de resultados
Para el análisis electroforético se construyó la curva estándar utilizando los valores de Rf y el logaritmo del peso molecular de las proteínas estándar. Para hallar los pesos moleculares de las proteínas en estudio se interpoló los datos de los Rf de dichas proteínas en la curva estándar construida.
La CIEF se consideró positiva cuando se evidenció al menos una banda de precipitación luego de la coloración con el colorante Amido Black.
Análisis estadístico
Los cálculos para la determinación de la sensibilidad, especificidad y valores predictivos de la prueba se realizaron de acuerdo a lo descrito por Fernández y col. (24.
RESULTADOS
Se estudió un total de 60 muestras de suero provenientes de pacientes con diagnóstico clínico y bacteriológico de bartonelosis. Los pacientes tuvieron entre 3 y 76 años de edad, con una edad promedio de 42,4 años y una desviación estándar de ± 16,3. El 70% (42) de los pacientes fueron del sexo masculino y 30% (18) fueron del sexo femenino, según se muestra en la tabla 1.
Tabla 1 Características demográficas de los pacientes con diagnóstico bacteriológico y clínico de bartonelosis. Sueros del Laboratorio de la Enfermedad de Carrión del IMT/DAC UNMSM.

El cultivo bacteriano del aislado de Bartonella (IMT/DAC 162-13/oct-2015) reveló colonias típicas del género. El frotis de estas colonias coloreadas con el colorante Leishman mostró la presencia de bacterias cocoides y cocobacilares. La prueba de pureza de la cepa no mostró contaminación con otros microorganismos bacterianos.
En un inicio, cuando se preparó el medio de cultivo con componentes sanguíneos de carnero (eritrocitos y plasma), la suspensión bacteriana obtenida, lavada y sonicada, utilizada como antígeno en la prueba de CIEF reveló resultados falso positivos con 1/3 de los sueros provenientes de personas sanas. Por esta razón, se eliminaron los componentes sanguíneos de carnero para el cultivo de la cepa bacteriana utilizada como fuente de antígeno para la prueba.
La extracción óptima de proteínas de Bartonella sp. se obtuvo por sonicación de la masa bacteriana con 20 ciclos de un pulso de 22,5 KHz, con intensidad de onda de 6,5, en periodos de 20 segundos de sonicación por 10 segundos de descanso entre cada sonicación, en baño de hielo, lo cual se comprobó cuando se enfrentaron el antígeno obtenido con un suero positivo.
La electroforesis en condiciones reductoras (SDS-PAGE) del aislado de Bartonella sonicado reveló tres bandas de proteínas con pesos moleculares de 66.2 kDa, 74.5 kDa y 97.3 kDa, respectivamente, tal como se muestra en la figura 1.
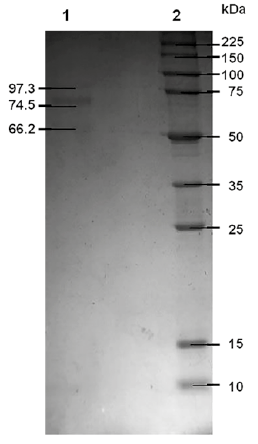
Figura 1 Análisis electroforético, SDS-PAGE al 12%, del sonicado de la cepa de Bartonella (IMT/DAC 162-13/oct-2015), utilizada como antígeno para la prueba de CIEF. Carril 1: las bandas mostradas corresponden a proteínas de 66,2 kDa, 74,5 kDa y 97,3 kDa; carril 2: marcador de peso molecular.
La concentración óptima del antígeno bacteriano en la prueba de CIEF fue 0,64 mg/mL. Figura 2.

Figura 2 Titulación del antígeno bacteriano (IMT/DAC 162-13/oct-2015) utilizando el suero de paciente (IMT/DAC 155-12/ oct-2012), con diagnóstico clínico, microbiológico y molecular de enfermedad de Carrión. Se observa una banda de precipitación nítida solo con el antígeno no diluido (puro). La flecha superior indica la dirección del movimiento del antígeno (cátodo - ánodo)
Al evaluar el tamaño y la distancia óptima entre los pocillos, se encontró que el diámetro y la distancia entre los pocillos que mejor revelaron un resultado positivo fueron de 3 mm, y el volumen utilizado para cada reactante fue de 12 μL.
Los sueros de 60 pacientes con diagnóstico de enfermedad de Carrión fueron evaluados mediante la prueba de CIEF, de los cuales 26 fueron positivos (Figura 3) y 34 fueron negativos (Tabla 2). La prueba fue positiva en el 44% (19/43) y en el 41% (7/17) de los sueros de pacientes en fase aguda y crónica de la enfermedad, respectivamente. La mayoría de los sueros positivos revelaron solo una banda de precipitación. Los sueros de 54 pacientes con otras infecciones fueron evaluados mediante la prueba de CIEF para determinar la especificidad de la prueba, de los cuales solo el suero proveniente de un paciente con hidatidosis fue positivo, siendo el resto de los sueros negativos. Asimismo, los sueros de 9 personas sanas fueron negativos para la misma prueba (Tabla 2).

Figura 3 CIEF del suero (Ac) de pacientes (i, ii, iii) con diagnóstico bacteriológico y clínico de bartonelosis frente al antígeno (Ag) sonicado de Bartonella sp. Se observa una banda de precipitación entre el suero del paciente iii y el Ag, después de que la lámina fue coloreada. Se observan reacciones negativas para los otros dos sueros evaluados, i e ii. La flecha superior indica la dirección del movimiento del antígeno (cátodo - ánodo).
Tabla 2 Resultados de la prueba de CIEF con sueros de pacientes con diagnóstico de bartonelosis, sueros de personas sanas y sueros de pacientes con otras infecciones.

La prueba de CIEF reveló una sensibilidad de 43,3% y una especificidad de 98,4%. El valor predictivo positivo fue de 96,3% y el valor predictivo negativo fue de 64,6%.
DISCUSIÓN
En nuestro país, la búsqueda de nuevos métodos y técnicas de diagnóstico de la enfermedad de Carrión ha sido escasa, a pesar de que B. bacilliformis es una bacteria difícil de cultivar y de identificar 1, y a la baja sensibilidad que revela el frotis sanguíneo coloreado con Giemsa 8, principal método de diagnóstico en las zonas endémicas. Este interés no ha aumentado a pesar de haberse descubierto que en el Perú no solamente circula B. bacilliformis, sino también otras especies de Bartonella causantes de enfermedad en humanos, como B. quintana, B. clarridgeiae, B. rochalimae, B. ancashensis y B. henselae 25, pudiendo originar esta última un cuadro clínico similar al ocasionado por B. bacilliformis 1. Sin embargo, sigue siendo B. bacilliformis el principal agente bacteriano del género Bartonella que causa enfermedad en el Perú 8. Dado el riesgo potencial de pérdida de vidas humanas por la infección por Bartonella, es necesario contar con técnicas serológicas para un pronto diagnóstico de la enfermedad.
La CIEF es una prueba que ha sido usada con éxito para el diagnóstico serológico y constituye una técnica relativamente simple para detectar anticuerpos contra una variedad de agentes patógenos 22,26,27. La prueba es rápida y sencilla de realizar, requiere pequeños volúmenes de los reactivos y el antígeno debe ser soluble. Este estudio demostró que la prueba posee una elevada especificidad para detectar casos de infección por Bartonella, pero es poco sensible incluso en la etapa aguda de la enfermedad. Otras pruebas, como la IFI 14 y el Western blot 17 han revelado ser sensibles para el diagnóstico de la enfermedad de Carrión en esta etapa de la infección.
Las condiciones de cultivo de la bacteria revelaron ser de extrema importancia, debido a que cuando creció en presencia de plasma o sangre de carnero, estos componentes se incorporaron al antígeno y fueron la causa de reacciones falsas positivas con sueros de personas sanas, probablemente debido a la presencia de antígenos heterófilos 28. La obtención del antígeno, libre de componentes hemáticos de carnero, por sonicación, fue sencilla y rápida. Dos estudios previos habían reportado la obtención de antígeno sonicado de B. bacilliformis y su uso con éxito en pruebas serológicas primarias (16, 17, aunque las condiciones de extracción de las proteínas antigénicas fueron diferentes.
El análisis del perfil proteico por SDSPAGE del extracto bacteriano sonicado reveló tres bandas de 66,2, 74,5 y 97,3 kDa. El aparente escaso número de bandas detectadas se puede deber al método de coloración del gel empleado, el Coomassie Blue, que es menos sensible que la coloración de plata 29. Knobloch reportó la obtención de seis proteínas antigénicas específicas para sueros de pacientes con enfermedad de Carrión por inmunoblot, cuyos pesos moleculares fueron de 18, 26, 36, 48, 65 y 75 kDa 30. Aunque son evidentes las diferencias en el perfil proteico de ambas preparaciones, también parecería que hay bandas en común o muy cercanas en peso molecular. Es más, el antígeno de 75 kDa, considerado uno de los dos principales antígenos de B. bacilliformis, debido a que presenta fuerte reactividad en los inmunoensayos, podría ser la banda de 74,5 kDa revelada en la SDS-PAGE. El uso de un estándar de peso molecular de amplio rango (10-225 kDa) pudo afectar la precisión de la determinación del peso molecular. En cambio, Mallqui y col. 17) reportaron siete antígenos inmunoreactivos de bajo peso molecular identificados por Western Blot, entre 13-42 kDa, de los cuales dos fueron específicos para la enfermedad de Carrión en fase crónica, los antígenos de 17 y 18 kDa.
La concentración óptima del antígeno de 0,64 mg/mL utilizada en la CIEF fue menor a la reportada por Díaz y col. 31, quienes usaron 1 mg/mL para detectar anticuerpos anti-Brucella. Esta menor concentración de antígeno requerida para detectar anticuerpos contra Bartonella puede reflejar un contenido enriquecido de proteínas específicas obtenidas por sonicación y reveladas en la SDS-PAGE.
En relación al diámetro de los pocillos, la distancia entre ellos y el volumen del antígeno y de los sueros utilizados, fueron similares a los reportados por Cornejo y col. 22, lo que hace a la CIEF una prueba versátil, dado que se puede adaptar para detectar anticuerpos contra bacterias y parásitos; y económica, porque emplea pequeños volúmenes de los reactantes.
La CIEF reveló 43,3% de sensibilidad para los casos de la infección por Bartonella sp., un valor superior al 27,8% y 33,7% obtenido por HAI e IFI, respectivamente, reportado por Knobloch y col. 13 con sueros de pacientes con enfermedad de Carrión. Solo la prueba de ELISA, el inmunoblot y la IFI aplicados para el diagnóstico serológico de la enfermedad de Carrión, con antígeno de esta especie de Bartonella, han mostrado mayor sensibilidad. Para el ELISA, Knobloch y col. 13, Anaya y col. 16 y Padilla y col. 32 reportaron una sensibilidad de 54,8%, 68,6% y 70,4%-85,2%, respectivamente; mientras que para el inmunoblot la sensibilidad reportada por Mallqui y col. fue de 70% 17, un valor similar alcanzado por la IFI reportada por Chamberlin y col. 14.
La falta de una moderada o elevada sensibilidad de la CIEF podría tentarnos a afirmar que se debe a que los sueros provienen en su mayoría (72%, 43/60) de casos en fase aguda de la enfermedad, porque se ha demostrado que cuando se evalúan sueros en la etapa crónica, la sensibilidad de las pruebas serológicas como la IFI y el inmunoblot superan el 92% de sensibilidad 14,17. Sin embargo, cuando se comparó la positividad de la CIEF considerando la fase de la enfermedad se encontró que fue similar (44% en fase aguda versus 41% en fase crónica), lo cual significa que esta explicación es insatisfactoria. Una mejor explicación de la baja sensibilidad de la CIEF se debe a que necesita un elevado número de complejos antígeno-anticuerpo para tornarse positiva, dado que se trata de una prueba secundaria, en contraste con las pruebas primarias como el ELISA, la IFI y el inmunoblot, que por lo general son más sensibles y requieren menos complejos inmunitarios para ser positivas. Asimismo, se desconoce si todas las proteínas de la suspensión sonicada migran al ánodo, de no ocurrir le restaría sensibilidad a la prueba.
En este estudio, el 98% de los sueros provenientes de personas sanas o que no estaban infectadas por Bartonella fueron seronegativos, indicando que la especificidad de la CIEF es lo suficientemente alta como para ser usada conjuntamente con una prueba serológica sensible para el diagnóstico de bartonelosis. La única muestra de suero que originó un resultado positivo falso provino de un paciente con hidatidosis, y no fue posible establecer la razón de este inesperado resultado. La prueba de ELISA desarrollada por Anaya y col. 16) presentó baja sensibilidad y su especificidad, considerando no solo los sueros de personas sanas sino también los sueros de personas con otras infecciones bacterianas, fue de 69,8%, lo que no permite su empleo como prueba diagnóstica. Asimismo, el inmunoblot para el diagnóstico de la enfermedad de Carrión desarrollado por Malqui y col. (17) fue 100% específico para los sueros control negativos, provenientes de personas sanas, pero fue solo 79% específico para los sueros de pacientes con otras infecciones bacterianas, siendo llamativo un 34% de reacciones cruzadas con los sueros de pacientes con brucelosis, una enfermedad prevalente en nuestro medio 33. Esta baja especificidad tanto del ELISA como del inmunoblot, podría explicarse por la presencia de antígenos no específicos en los extractos totales usados en ambas pruebas, lo cual no ocurriría con el antígeno bacteriano sonicado obtenido usado en la CIEF.
La prueba de CIEF estandarizada para detectar anticuerpos contra Bartonella es específica de género, no reacciona con el suero de pacientes con otras infecciones bacterianas evaluadas, incluyendo brucelosis, pero los casos detectados en este estudio corresponden únicamente a pacientes con sospecha de infección por B. bacilliformis, la principal especie de Bartonella que se reporta en el país 6.
La limitación más importante del estudio fue no haber podido comparar los resultados de la CIEF con una prueba serológica primaria, a fin de determinar que la falta de reactividad de los sueros podría deberse a la falta de sensibilidad propia de la prueba condicionada por la presencia de antígenos que carecen de migración anódica y no a la ausencia de anticuerpos, sea porque el paciente era seronegativo o por su deterioro debido al tiempo de almacenamiento. Otra limitación a resaltar fue el uso de sueros de pacientes con bartonelosis aguda o crónica no confirmada por métodos moleculares, lo que impide afirmar si la CIEF es género o especie específica. Asimismo, no se evaluó la especificidad de la prueba con muestras de suero de pacientes infectados con Coxiella burnetti, Chlamydia trachomatis y Rickettsia rickettsii, reportadas como causas de reacción cruzada con B. henselae y B. quintana 34, 35, debido a que no se contaba con dichos sueros. Además, la relativa baja concentración del antígeno podría haber afectado la sensibilidad del ensayo, porque solo fue capaz de dar resultados positivos cuando no se diluyó.
En conclusión, este estudio ha mostrado una escasa sensibilidad de la CIEF para detectar anticuerpos contra Bartonella en pacientes con sospecha de infección por B. bacilliformis. Sin embargo, es una prueba con elevada especificidad, que podría ayudar en el diagnóstico serológico si se usa conjuntamente con una prueba sensible, como la IFI 14 o el Western blot 17. Se requieren futuras investigaciones para evaluar el antígeno bacteriano sonicado obtenido en este estudio, en otras pruebas serológicas como el ELISA o el inmunoblot, con las cuales se podría lograr la detección de un mayor número de casos, y de esta forma evaluar su valor como antígeno específico.















