INTRODUCCIÓN
La definición de pancreatitis crónica (PC) incluye distintas variedades de patologías relacionadas con cambios fibroinflamatorios progresivos de la glándula pancreática cuya patogénesis es poco clara; sin embargo, se ha reportado factores de riesgo como el alcoholismo, el tabaquismo y la genética. Las distintas formas de PC se clasifican en: pancreatitis crónica calcificante (desarrollo de cálculos intra-ductales en el conducto pancreático principal o sus ramas, generando hipertensión ductal), pancreatitis crónica obstructiva (secundaria a una injuria directa sobre el ducto pancreático o tumores obstructivos) y pancreatitis crónica autoinmune (asociada a depósitos de IgG4 con respuesta rápida a corticoides) 1.
La pancreatitis crónica calcificante (PCC) es la forma más común. Está relacionada a dolor crónico incapacitante e insuficiencia pancreática exocrina y endocrina. El dolor en PCC usualmente es postprandial, epigástrico, irradiado al dorso, asociado a náuseas y vómitos. Se observa en el 85% de los casos 2. La insuficiencia pancreática exocrina se manifiesta cuando la perdida de la función pancreática sobrepasa el 90% y el signo característico es la esteatorrea; asimismo, asociada a la perdida de células beta del páncreas, el paciente desarrollará diabetes mellitus 3. El diagnóstico se confirma si se observan calcificaciones intra-ductales en la tomografía computarizada (TC) o resonancia magnética (RM); sin embargo, ambas tienen baja sensibilidad. La eco-endoscopia combina características tanto del ducto como del parénquima pancreático, clasificando dichos hallazgos en consistentes, sugestivos e intermedios para PCC, alcanzando una sensibilidad y especificidad de 91% y 80% respectivamente 4,5. La medición de la concentración de elastasa fecal 1 mayor a 100 µg/gr de deposición, se usa como marcador de insuficiencia pancreática, pero cuenta con sensibilidad y especificidad baja en estadios tempranos de la enfermedad 6. Los hallazgos sugestivos en estudios de imagen y eco-endoscopia sumados a alteraciones en las pruebas de función pancreática en un paciente con signos y síntomas relacionados, configuran el diagnóstico de PCC.
El tratamiento médico de la PCC se basa en cambios del estilo de vida (abandono del tabaco y alcohol) y modificaciones nutricionales, asociado a terapia de reemplazo enzimático. El manejo del dolor abdominal crónico en PCC representa un reto, siendo habitual el uso de opiáceos que generan tolerancia y dependencia. Por esta razón se propone un tratamiento por etapas, progresando desde tratamiento medico y endoscópico (ERCP mas litotripsia y/o stent) hasta el quirúrgico de manera escalonada con el fin de aliviar el dolor y conservar la función pancreática.
La PC a nivel nacional se halla en el 7º lugar de enfermedades gastrointestinales no tumorales, con una tasa de mortalidad que oscila del 0,01 a 0,003 por 100 000 habitantes, lo que constituye una patología infrecuente en nuestro país 7. No existen estudios que indiquen la variedad de PC más frecuente en nuestro territorio.
La pancreatoyeyunostomia lateral (PYL) o procedimiento de Partington Rochelle, es la técnica quirúrgica de elección más frecuente, cuya indicación es el dolor crónico inmanejable producto de la PCC asociada a la presencia de dilatación del conducto pancreático, litiasis intraductal y ausencia de masa inflamatoria dentro del páncreas o dilatación de la vía biliar 8. Reportamos el caso de un paciente con diagnóstico de PCC sometido a PYL laparoscópica, siendo la primera experiencia en el Perú reportada. Describimos la técnica empleada y la complicación tratada con éxito, así como la revisión de la literatura científica pertinente.
REPORTE DE CASO
Paciente varón de 64 años de edad con antecedente de hipertensión arterial, depresión menor y diabetes mellitus tipo II, tratada con hipoglucemiantes orales, usuario de oxicodona por dolor abdominal crónico. Profesa la religión de Testigos de Jehová (rechaza las transfusiones sanguíneas). Desarrolló dos cuadros de pancreatitis aguda en 2015 y en mayo 2017. En esta última se le diagnosticó PCC, mediante TAC y RMN en donde se observó un conducto de Wirsung dilatado (15 mm) con pancreatolitiasis múltiple (cabeza, cuerpo y cola). Tuvo manejo por gastroenterología mediante la colocación de stent plástico de 7 Fr; sin embargo, persistió el dolor abdominal crónico. Siete meses después ingresó al servicio de cirugía, para tratamiento quirúrgico debido al fracaso de la terapia endoscópica (Figura 1).
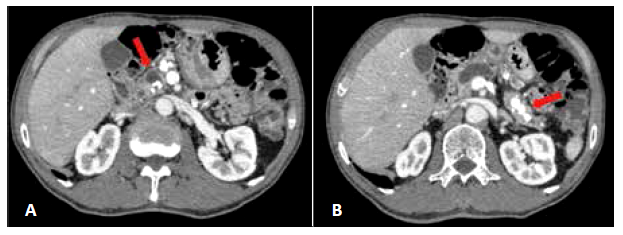
Figura 1 TEM al ingreso al servicio de cirugía: conducto pancreático de 15 mm en región cefálica, alternando con zonas de estrechez. (A) Litiasis de 13 mm en región cefálica y (B) Litiasis de 9 mm en región y caudal. Ausencia de dilatación de la vía biliar y masas en glándula pancreática.
La analítica preoperatoria fue: hemoglobina en 13 g/dL, albumina en 4,6 mg/ dL, INR 0,99. El perfil hepático, renal y marcadores tumorales se encontraban dentro de límites normales.
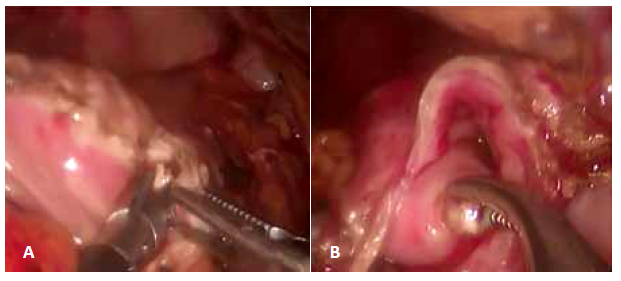
El paciente fue sometido a PYL (Partington-Rochelle) laparoscópica en Julio 2018. Se posicionó al paciente según técnica francesa en anti-trendenlenburg. Se utilizaron 5 trocares, según el esquema de la figura 2. Se aperturó la transcavidad de los epiplones mediante sección del omento gastro-colico usando sellador de vasos. El estómago se suspendió, accediendo a la celda pancreática. Se identificó el conducto pancreático, el cual midió 13 mm de diámetro y se aperturó longitudinalmente en dirección céfalo-caudal (utilizando sellador de vasos), extrayendo múltiples litos de 13 mm y 9 mm en región cefálica y caudal de la glándula pancreática respectivamente (Figura 3).
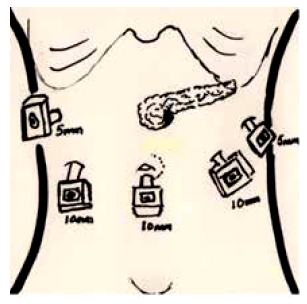
Figura 2 Colocación de trocares en paciente sometido a pancreato-yeyunostomia lateral (Partington-Rochelle) laparoscópica. Posición de paciente según técnica francesa en antitrendenlenburg.
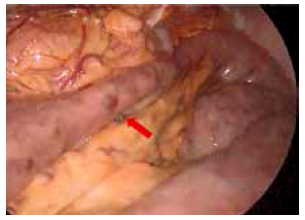
Incidentalmente se observaron lesiones vasculares de aspecto varicoso en la pared del asa yeyunal (Figura 4). Mediante el uso de sutura mecánica se seccionó asa yeyunal a 20 cm del ángulo de Treitz, confeccionando un pie de asa a 60 cm, el cual asciende vía transmesocolica. Se realizó anastomosis pancreato-yeyunal laterolateral en un solo plano, puntos totales, continuos con polidioxanona 3/0. Inicialmente se confeccionó la cara posterior, sin aperturar el intestino, en dirección céfalo-caudal, y luego de la enterotomía, se confeccionó la cara anterior en dirección opuesta. Se colocó un drenaje Jackson Pratt sobre la anastomosis pancreto-yeyunal. Sangrado intra-operatorio mínimo y tiempo operatorio 220 minutos.
El paciente evolucionó con funciones vitales estables, diuresis adecuada y drenaje peritoneal de características sero-hemáticas; sin embargo, cursó con dolor abdominal y se observó moderada distensión abdominal al cuarto día post-operatorio, por lo que se realizó una TAC observándose neumoperitoneo residual, ausencia de colecciones o liquido libre. Al sexto día post-operatorio toleró vía oral, realizó deposiciones, el contenido del drenaje persistió seroso en escaso volúmen. Amilasa en la secreción del dren 10 mg/dL, por lo que se retiró.
Presentó exacerbación del dolor y vómitos biliosos al octavo día post-operatorio, asociado a hematoquezia y descompensación hemodinámica. En la TAC se observó neumoperitoneo, colección con burbuja aérea en celda pancreática, liquido libre alrededor de la anastomosis y en cavidad (Figura 5). Ingresó a sala de operaciones con hemoglobina en 3 mg/ dL, con soporte ventilatorio y vasopresor. No recibió transfusión sanguínea por convicción religiosa. A la apertura de la cavidad se observó hemoperitoneo en un volúmen aproximado de 1 litro, además de abundantes coágulos en la celda pancreática, provenientes de la anastomosis pancreatoyeyunal, dehiscente en cara anterior (Figura 6). Se decidió resecar el asa desfuncionalizada y confeccionar una nueva anastomosis pancreatoyeyunal en Y de Roux; se colocaron dos drenes tubulares, con un tiempo operatorio de 255 minutos.
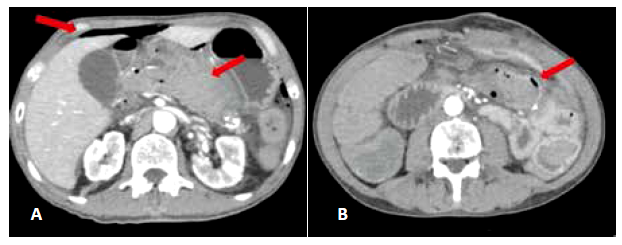
Figura 5 (A) Neumoperitoneo, líquido libre peri-anastomotico y en cavidad. (B) Neumatosis intestinal.
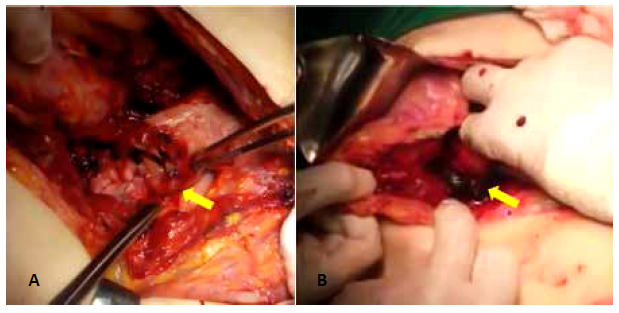
Figura 6 (A) Dehiscencia de anastomosis P-Y en cara anterior. (B) Se observa salida de abundantes coágulos a través de la luz intestinal.
La evolución postoperatoria fue favorable, con funciones vitales dentro de lo normal, diuresis aceptable, drenajes con gasto sero-hematico. El control de hemoglobina en 4 gr/dL. Recibió hierro parenteral, eritropoyetina, ácido fólico y vitamina B12. Fue dado de alta 17 días después, con hemoglobina en 9 gr/dL, tolerando vía oral, realizando deposiciones y deambulando.
En su control a los 6 meses, el paciente refirió alivio del dolor abdominal sin necesidad de narcóticos, manteniéndose en tratamiento con hipoglucemiantes orales para la diabetes mellitus.
DISCUSIÓN
La fisiopatología de la PCC está aún en estudio, sin embargo se sabe que el disbalance entre la hipersecreción proteica y la escasa secreción de bicarbonato a nivel de los ductos interlobulares e intralobulares, genera "tapones" y nidos de calcificación, que a su vez producen hipertensión ductal, hipoperfusión, inflamación y fibrosis de la glándula pancrática 9.
Los objetivos del tratamiento de la PCC son el control del dolor y el retardo en la aparición de la insuficiencia pancreática (endocrina y exocrina). Como recomendación general se debe iniciar con cambios en el estilo de vida (retiro del tabaco y alcohol), suplementación de enzimas pancreáticas y uso racional de analgésicos. Si los síntomas de la PCC no ceden frente al tratamiento médico se optará por el abordaje endoscópico y/o quirúrgico.
El drenaje del conducto Wirsung (endoscópico o quirúrgico) representa una opción terapéutica efectiva en el tratamiento del dolor en pacientes seleccionados. Las indicaciones para tratamiento endoscópico son: PC refractaria al tratamiento médico, cálculos intraductales en la cabeza del páncreas, estenosis del ducto pancreático principal y pseudoquiste sintomático. CPRE más litotripsia extracorpórea por ondas de choque ha mostrado utilidad en cálculos de mayor diámetro, mientras que las estenosis del ducto principal son tratadas con colocación de stent 10.
Diferentes autores identifican que la cirugía es superior al tratamiento endoscópico para el control del dolor en pacientes con PCC y conducto pancreático dilatado. Cahen y col. en un ensayo controlado aleatorio comparó la pancreaticoyeyununostomía con tratamiento endoscópico en 39 pacientes con PCC y una obstrucción distal del conducto pancreático sin masa inflamatoria; el tratamiento endoscópico incluyó drenaje trans-ampular con o sin litotripsia. El alivio total o parcial del dolor se logró en una gran proporción de pacientes que se sometieron a cirugía en comparación con la terapia endoscópica tras 24 meses de seguimiento (75% versus 32%). Las tasas de complicaciones fueron similares. En un estudio de seguimiento de la misma cohorte, los pacientes que se sometieron a cirugía como tratamiento inicial en comparación con la terapia endoscópica requirieron significativamente menos procedimientos adicionales de drenaje (68% versus 5 %) y tuvieron más alivio del dolor (80% versus 38%) durante 79 meses de seguimiento. Además, el 47% de los pacientes que se sometieron a una terapia endoscópica finalmente se sometieron a cirugía 11,12.
Las indicaciones para optar por el tratamiento quirúrgico en PCC son el dolor crónico no controlado con etapas previas del tratamiento médico y/o endoscópico, obstrucción biliar, duodenal o del ducto pancreático, pseudoquiste sintomático y sospecha de neoplasia maligna. El tiempo y la elección del procedimiento son controversiales, dependen de los antecedentes y características morfológicas en cada caso (Tabla 1). Se ha sugerido la cirugía precoz como medida para evitar el uso prolongado de opioides; sin embargo, se ha observado la progresión más rápida a insuficiencia pancreática luego de procedimientos quirúrgicos especialmente en los que se incluye resección del parénquima pancreático 13,14.
Tabla 1 Opciones quirúrgicas para el manejo de pancreatitis crónica (PC) según cambios morfológicos del páncreas.

La pancreato-yeyunostomia lateral (PYL) ofrece una mejoría del dolor en un 80% de los casos, con preservación de la función endocrina y exocrina del páncreas; además de ser un procedimiento seguro con baja mortalidad y morbilidad 15. Por lo cual es el procedimiento descompresivo estándar en pacientes con ducto pancreático dilatado sin masa o pseudoquiste asociado. Partington y Rochelle describieron el procedimiento en 1960 como modificación al procedimiento de Puestow y Gillesby que consistía en la pancreatoyeyunostomia lateral, adicionando la resección de la cola del páncreas y el bazo, con aumento de la morbilidad a corto y largo plazo comparado con la PYL.
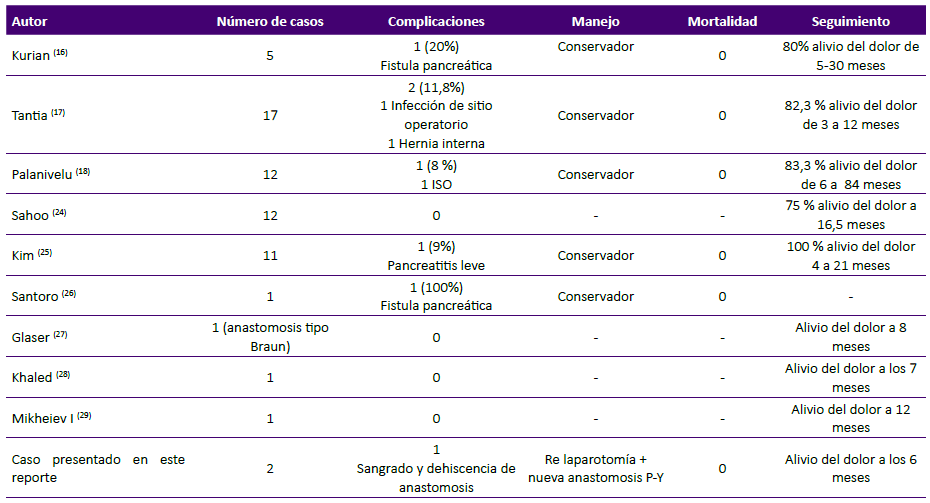
Con el advenimiento de la cirugía mínimamente invasiva, el procedimiento de Partington-Rochelle se ha realizado mediante laparoscopia, confiriéndole los beneficios propios de este abordaje como menos dolor postoperatorio, menor tasa de infección de sitio operatorio y menor estancia hospitalaria. Kurian y Gagner fueron los primeros en reportar la técnica de la PYL laparoscópica en 1999 16 y las series con mayor número de casos son las de Tantia 17 con 17 casos y Palanivelu 18 con 12 casos, reportando morbilidad del 8% - 11%, siendo la principal causa la infección de herida operatoria (Tabla 2). Asimismo, en las series de PYL con cirugía convencional, los autores con mayor casuística son Kalady y col. 19 con 60 casos y Sielezneff y col. 20 con 57 casos, siendo la infección de sitio operatorio, abceso subfrénico y neumonía las principales causas de morbilidad.
Tabla 2 Reportes de pancreato-yeyunostomia lateral (PYL) laparoscópica: complicaciones, mortalidad, manejo y seguimiento.
La hemorragia digestiva posterior a PYL es una complicación infrecuente y de difícil manejo. Prinz y Greenle 21 reportaron 54 PYL, presentando 4 casos de hemorragia digestiva, incluyendo un caso que requirió re-operación producto de hemorragia del lado yeyunal de la anastomosis, sin especificar el manejo quirúrgico en particular. Sudo y col. 22 reportaron 5 casos de hemorragia digestiva, 3 de ellos tratados con manejo conservador y los restantes requirieron embolización arterial; el primero de ellos presentó de manera aguda melena e inestabilidad hemodinámica, el estudio angiográfico revelo el origen del sangrado en la arteria esplénica hacia el asa yeyunal en Y de Roux a través de la pancreático-yeyunostomía, tuvo evolución favorable con embolización de arteria esplénica. El segundo presentó melena y hematemesis, el estudio angiográfico reveló el origen del sangrado en la arteria gastroduodenal hacia el asa yeyunal en Y de Roux a través de la pancreático-yeyunostomia, evolucionando favorablemente con embolización de la arteria gastroduodenal.
En el presente caso, el dolor abdominal crónico y refractario al tratamiento médico con necesidad de uso cotidiano de opiáceos y el fracaso al tratamiento endoscópico fueron las indicaciones del tratamiento quirúrgico. Se observó un conducto pancrático de 15 mm con múltiples litiasis en su interior, en ausencia de masa asociada ni vía biliar dilatada, por lo que se optó por una técnica derivativa pura tipo PYL a lo Partington Rochelle.
Con respecto a la técnica quirúrgica de la PYL, Tantia y col. 17 realizaron la anastomosis PYL en dos planos, con una línea de sutura externa, con puntos separados de seda negra 3/0, puntos sero-musculares en el intestino y una sutura interna continua, puntos totales con poliglactina 3/0. Palanivelu y col. 18 realizaron la anastomosis, previa enterotomía por el borde anti-mesentérico; el plano posterior consistió en una sutura continua con vicryl 3/0 en dirección caudal - cefálico, el plano anterior se confeccionó con puntos separados empezando en los extremos hacia el centro, seguido de puntos de refuerzo entre la capa sero-muscular del intestino y la superficie pancreática.
En el caso reportado, frente a la dehiscencia de la anastomosis P-Y se optó por re-confeccionar en su totalidad dicha anastomosis, a pesar del contexto de inestabilidad hemodinámica del paciente. Roch y col. 23 reportaron 49 casos sometidos al procedimiento de Frey, describiendo 4 (5%) complicaciones hemorrágicas. Describió la re-confección de la anastomosis P-Y en dos casos de hemorragia intra-abdominal; asimismo la ligadura de la arteria gastro-duodenal en el caso de fistula hemorrágica.
El paciente evolucionó favorablemente en su control a los seis meses, con remisión del dolor abdominal crónico y sin empeoramiento de la función endocrina ni exocrina pancreática, compatible con las series de casos reportadas, que indican una tasa de alivio del dolor de 80 % a los 12 meses.
Las series de casos de PYL convencional o laparoscópica muestran baja morbimortalidad post-operatoria. Reportamos la experiencia inicial en PYL laparoscópica en nuestro medio con mínimo sangrado intra-operatorio y tiempo quirúrgico aceptable. Además se presenta la complicación grave en un Testigo de Jehová, siendo de gran importancia el conocer las alternativas de manejo. Se concluye que la descompresión quirúrgica del conducto pancreático en PCC refractaria a manejo médico o endoscópico es un método efectivo para el alivio del dolor y retardar la progresión de la insuficiencia pancreática.