INTRODUCCIÓN
A pesar de los avances económicos y tecnológicos la anemia continúa siendo un problema de salud pública de magnitud en el mundo. Un análisis de los datos reportados entre 1995 - 2011 por 190 países, mostraron una disminución de la prevalencia de anemia de 47 a 43 % en niños, de 43 a 38 % en mujeres embarazadas y de 33 a 29 % en mujeres no embarazadas. Aproximadamente la mitad de las anemias son causadas por deficiencia de hierro. Otras causas frecuentes de anemia son hemoglobinopatías (drepanocitosis, talasemias) y malaria 1.
En el Perú, la anemia es un problema de salud pública considerado grave especialmente en niños. La Encuesta Demográfica y de Salud Familiar, ENDES 2020, encontró una prevalencia de anemia promedio de 40 % en niños de 6 a 35 meses de edad, 20,9 % en mujeres de 15 a 49 años y 25,3 % en mujeres embarazadas 2.
CONSIDERACIONES FISIOLÓGICAS
Un hombre adulto de 70 kg tiene aproximadamente 4 gramos (g) de hierro total en el organismo; 2,5 g circula como hemoglobina en los glóbulos rojos; cerca de 1 g (15 mg/kg) esta almacenado como ferritina y hemosiderina; 0,3 g están contenidos en la mioglobina y enzimas respiratorias, y aproximadamente 120 mg (3 % del total) circula ligado a la transferrina. Esta cantidad de hierro se mantiene constante a lo largo de la vida. El balance del hierro es posible mantener si hay equilibrio entre absorción y perdidas obligatorias (gastrointestinales, piel y menstruaciones). Las pérdidas obligatorias diarias en hombres son de 1 mg y aproximadamente 1,3 - 1,5 mg en mujeres jóvenes. El 90 % de los requerimientos diarios son cubiertos por el Fe reciclado por los macrófagos del RES, 20-25 mg, de eritrocitos senescentes fagocitados (1 % del total) 3.
La absorción del hierro ocurre en el duodeno distal y el yeyuno proximal, requiriendo para ello ser reducido a la forma ferrosa (Fe2+). En figura 1 se muestra la absorción del Fe 4. A través de la ferroportina (Fptn) el Fe gana acceso al liquido extracelular y la circulación donde se liga a la transferrina (Fe-Tfr) para ser transportado a la medula ósea (eritroblastos) y otros tejidos para su utilización, y el Fe excedente es almacenado. La captación celular del Fe es a través de los receptores de la transferrina (TfR).
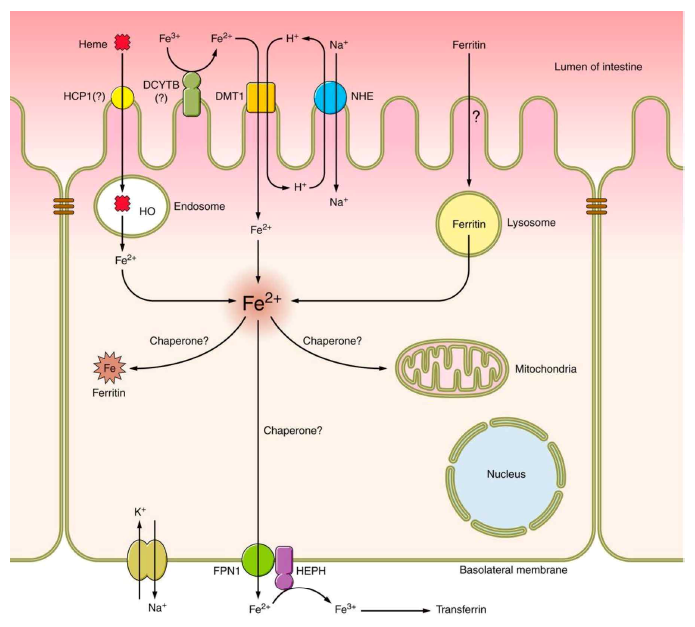
Ingreso del Heme-Fe2+ es por endocitosis; Fe es luego liberado del endosoma por la heme oxigenasa (HO). No Heme-Fe3+ debe ser reducido por el citocromo b duodenal (DCYTB) lo cual es facilitado por vitamina C y su ingreso al interior del citoplasma es facilitado por el transportador de metales divalentes (DMT1). Fe2+ intracellular atraviesa la membrana basolateral del enterocito via ferroportina (FPN1), es oxidada por la hephaestina (HEPH) y ligada a la transferrina extracelular e intravascular para ser transportado a los tejidos para su utilización y almacenamiento.
Fuente: Gulec S. Am J Physiol Gastrointest Liver Physiol. 2014; 307: G397-G409
Figura 1 Mecanismo de absorcion del hierro en el intestino delgado.
Ferroportina y la Hepcidina
Ferroportina (Fptn) es la proteína "exportadora" de hierro y esta presente en las células que absorben (enterocitos) y almacenan hierro (hepatocitos y macrófagos). Su concentración es regulada intracelularmente por la proteína reguladora de hierro-2 (PRI2) y, sistémicamente, por la hormona hepcidina (Hep), de la cual es su receptor. Hepcidina es el regulador "maestro" del metabolismo del hierro, rol que ejerce vía degradación u obliteración de la ferroportina. Niveles elevados de Hep inhiben la absorción y utilización del hierro; y viceversa, niveles bajos o ausentes de Hep facilitan ambos procesos 5.
Hepcidina es principalmente producida en el hígado. Su síntesis es regulada por: a) cambios en niveles de hierro circulante y depósitos de hierro, i.e. en AF su síntesis es inhibida lo que permite mayor absorción y movilización del Fe; b) citoquinas inflamatorias - especialmente IL-6, potencian su síntesis 6. Este es el principal factor patogénico de la anemia de inflamación (AI); y, c) la hormona eritroferrona (ERFE), producida por los eritroblastos en situaciones de "estrés eritropoyetico", i.e. hemorragias, hemolisis, hipoxia. ERFE inhibe la síntesis de hepcidina, lo cual potencia mayor absorción y rápida movilización del Fe necesarios para la síntesis de hemoglobina 7. La figura 2 ilustra los factores involucrados en la síntesis de hepcidina 8.
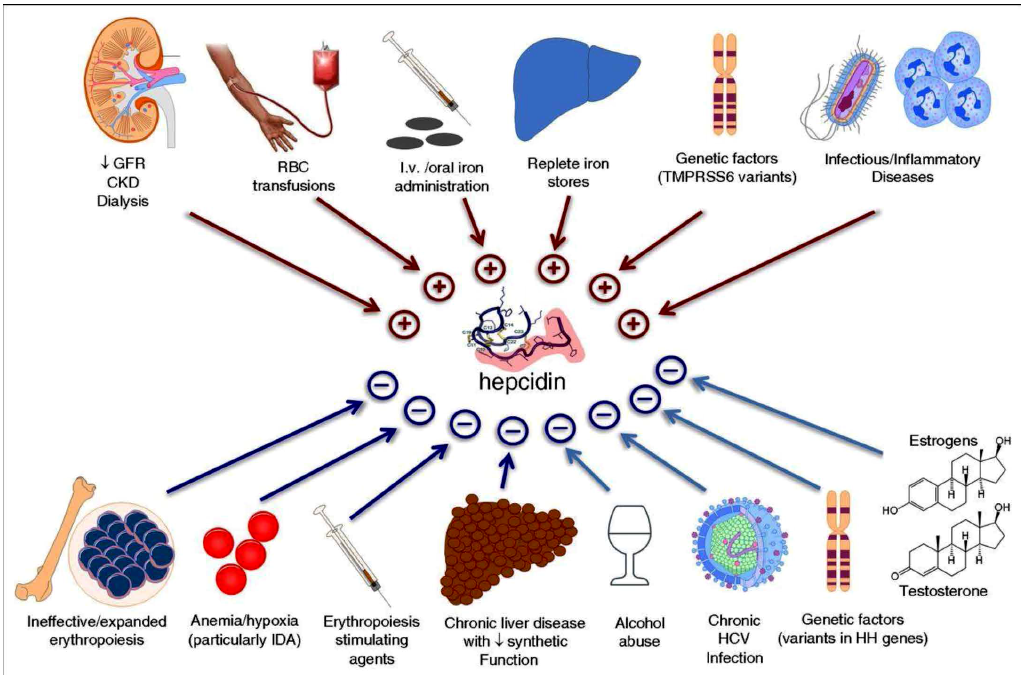
Fuente: Girelli D y col. Blood. 2016;127(23): 2809- 2813.
Figura 2 Condiciones que controlan la síntesis de hepcidina. GFR: Glomerular filtration rate; CKD: Chronic kidney disease; TPMPRSS6 gene (encodes matriptase-3), mutaciones resultan en IRIDA (Iron Refractory Iron Deficiency): anemia ferropénica con niveles normales o elevados de hepcidina; HH: hemocromatosis hereditaria; IDA: Iron deficiency anemia; HCV: Hepatitis C virus; + : ↑ Hepcidina ; - : ↓ Hepcidina
Anemia, deficiencia de hierro (DH) y anemia ferropénica (AF)
La Organización Mundial de la Salud (OMS) define anemia como concentración de hemoglobina (Hb) <13 g/dL en hombres, < 12 g/dL en mujeres no gestantes > 15 años y niños 12- 14 años, < 11,5 g/dL en niños 6-12 años, y < 11 g/dL en mujeres gestantes y niños 6- 59 meses de edad 9.
La fase más temprana de deficiencia de hierro (DH) es la depleción de los depósitos de hierro, que correlaciona con una disminución de la concentración de la ferritina sérica. Ferritina es una proteína almacenadora de hierro hueca: cada molécula puede captar hasta 4,500 moléculas de Fe. Su nivel no es influido por reciente ingesta de hierro. Es un reactante de fase aguda, i.e. su nivel se eleva en procesos inflamatorios de cualquier etiología; daño hepatocelular también causa elevación de ferritina 10.
La OMS considera que ferritina sérica < 15 µg/L en adultos y niños mayores de 5 años y < 12 µg/L en niños menores de 5 años, sin comorbilidades, son diagnósticos de DH 11. En el embarazo, en síndromes asociados con inflamación, el diagnostico de DH requiere una ferritina de < 30 µg/L; en insuficiencia cardiaca y enfermedad renal crónica < 100 µg/L 12. Recientemente, Mei y col. 13, tras analizar datos de laboratorio de estudios nutricionales en 2569 niños y 7498 mujeres jóvenes no grávidas, concluyeron proponiendo diferentes niveles diagnósticos de ferritina sérica: < 20 µg/L en niños y < 25 µg/L en mujeres no gestantes.
Anemia ferropénica (AF) es la fase más avanzada de DH. Las pruebas de laboratorio más utilizadas incluyen el hemograma, reticulocitos, hierro sérico, transferrina (TIBC) y saturación de la transferrina (SatT), receptores de transferrina solubles (sTfR), el índice de sTfR/ log ferritina y la tinción Perl de hierro de la medula ósea. En presencia de niveles normales de ácido fólico y vitamina B12 y función hepática normal, AF es típicamente una anemia microcítica (VCM <80 fl en adultos, <71-78 en niños, de acuerdo con edad). Fe sérico esta disminuido, así como también la saturación de la transferrina (SatT, normal 20- 45 %), i.e. < 15 % en adultos, < 10 % en niños, < 20 % en presencia de inflamación. Notar que el Fe puede estar disminuido secundario a inflamación/infección, o falsamente elevado debido a reciente ingesta de Fe; el nivel de SatT disminuye con inflamación, edad avanzada y desnutrición. La tinción de Fe en medula ósea detecta hemosiderina en eritroblastos y macrófagos; como la ferritina, evalúa los depósitos de Fe, pero es una prueba invasiva y costosa 14. La prueba de sTfR (receptores de transferrina soluble) está elevada en AF, pero su nivel no es afectado por inflamación o enfermedad crónica. Se ha propuesto utilizarla para el diagnóstico diferencial o concurrente de AF y AI. Un metaanálisis de 10 estudios sobre sTfR en pacientes con estas condiciones, encontró una sensibilidad y especificidad de 86% y 75 %, respectivamente 15. El índice de STfR/log ferritina provee un estimado más preciso de la cantidad de hierro en el organismo.
Factores de riesgo y causas de anemia ferropénica
Mujeres en edad reproductiva, lactantes, niños preescolares y adolescentes son propensos a AF debido a requerimientos elevados. Atletas profesionales e individuos con obesidad también son propensos a ferropenia debido a hepcidinemia 16.
Investigación de la etiología de AF es fundamental para orientar el tratamiento. Las causas de AF son básicamente dos: 1) Ingesta insuficiente de Fe, que puede resultar de nutrición deficiente o malabsorción del hierro, secundaria a cirugía bariátrica, enfermedad celiaca, gastritis autoinmune o atrófica debido a Helicobacter pylori (de alta prevalencia en el Perú) y otras causas; 2) Perdidas de sangre anormales, gastrointestinal, uterino y, raramente, urinaria (hemolisis intravascular con hemoglobinuria cronica) son la etiología más común en AF 17,18. En nuestro país, causas adicionales de AF a considerar son parasitosis intestinales especialmente anquilostoma duodenal, malaria, e infecciones gastrointestinales.
Prevención de deficiencia de hierro y anemia ferropénica
Las normas técnicas de Ministerio de Salud del Perú recomiendan el siguiente esquema preventivo: a) En mujeres gestantes, suplementos de hierro 60 mg/día + ácido fólico 400 µg/día, a partir de la 14 semana de gestación hasta 1 mes después del parto; b) En niños, suplementos de hierro (2mg/kg/día) comenzando al mes de edad en lactantes nacidos prematuramente, y a los 4 meses en los nacidos a termino 19.
Tratamiento de anemia ferropénica
Es aconsejable administrar el Fe vía oral temprano en la mañana, cuando el nivel de hepcidina es más bajo, y en ayunas porque el pH acido del jugo gástrico favorece su reducción a Fe 2+. Se recomienda evitar tomar el hierro con té, café, cereales, leche dado que inhiben la absorción del Fe. Algunos investigadores recomiendan tomar Fe con vitamina C 20, pero un estudio prospectivo y aleatorizado (SO4Fe vs. SO4Fe + Vitamina C) en 440 pacientes adultos, no demostró diferencias en los niveles de Hb y ferritina 12 semanas postratamiento entre ambos grupos de pacientes 21.
a. Tratamiento por vía oral
La meta del tratamiento es corregir la anemia y restaurar los depósitos de hierro. El tratamiento estándar consiste en Fe por vía oral (VO) en forma de sales de sulfato, gluconato, ascorbato, o fumarato. El sulfato ferroso (SO4 Fe) tiene mejor absorción, es el más barato y está ampliamente disponible. Un esquema de tratamiento tradicional es 1 tableta de SO4Fe 325 mg (65 mg Fe elemental) 2-3 veces/día por 3-4 meses; y, en niños, 3-6 mg/ kg/día de Fe elemental, dividido en 2-3 dosis. Varios estudios han mostrado una alta incidencia de síntomas gastrointestinales (GI) desagradables secundarios (malestar epigástrico, sabor metálico, náuseas, estreñimiento), que pueden conducir a falta de adherencia al tratamiento.
En casos de intolerancia GI, se ha propuesto el uso de gluconato ferroso que tiene menor toxicidad, o el uso de dosis pequeñas una vez al día. En ancianos y mujeres embarazados el uso de 15 y 50 mg/día demostraron la misma eficacia que la dosificación doble 20. Otras opciones terapéuticas serian el uso de Fe oral en días alternados o el uso de Fe por vía endovenosa.
Respecto a investigaciones sobre esquemas de tratamiento con Fe VO en días alternados, en un estudio en mujeres jóvenes con DH, pero sin anemia, Moretti y col. 22 demostraron que dosis de SO4Fe de 60 mg, o más altas, resultaron en rápido y significativo incremento de la hepcidina por más de 24 hr y menor absorción del hierro administrado 8 horas después o al día siguiente. Un estudio de seguimiento 23 en 19 mujeres con anemia ferropénica tratadas con 100 y 200 mg de SO4Fe en días consecutivos vs. días alternados (interdiarios), encontró que la fracción de absorción del Fe fue 40- 50 % mayor con las dosificaciones alternadas.
Tratamiento con hierro endovenoso (EV)
Actualmente, la aplicación de hierro EV es considerada una adecuada opción terapéutica en las siguientes situaciones clínicas:
Intolerancia GI que conduce a falta de adherencia al tratamiento, y en la cual dosis y esquemas de tratamiento VO alternativos no dieron resultados.
AF refractaria al tratamiento, i.e. malabsorción de Fe, poscirugía bariátrica.
Sangrado GI o uterino que excede la ingesta de Fe VO.
Enfermedad renal crónica requiriendo hemodiálisis y eritropoyetina. Ferropenia en estos pacientes es multifactorial, i.e. pérdida de sangre crónica, absorción deficiente debido a hepcidinemia 24.
Enfermedad inflamatoria del intestino con anemia persistente a pesar de Fe por VO, o durante exacerbaciones de la enfermedad - cuando la absorción de hierro es deficiente 25.
En el 2do. y 3er trimestre del embarazo, en casos de intolerancia gastrointestinal, malabsorción, AF con Hb <10 g/ dL diagnosticada a las 34 semana de gestación 26.
Insuficiencia cardiaca (IC) asociada con DH; esta contribuye a la disfunción miocárdica, calidad de vida pobre y mayor mortalidad. La Sociedad Cardiovascular de Canadá recomienda el uso de hierro EV en pacientes con IC con fracción de eyección disminuida y DH 27.
Las preparaciones de Fe EV que han sido aprobadas por la Federal Drug Administration (FDA) de los Estados Unidos incluyen Fe-gluconato, Fe- sucrosa, Fe- dextrano de bajo peso molecular, Ferumoxytol, Ferric carboximaltosa y Fe Isomaltosado 28. Un metaanálisis de la toxicidad de hierro EV reportados en 103 estudios aleatorizados (Fe EV vs. Fe VO vs. placebo, n= 10 390 pacientes) concluyó que la toxicidad de Fe EV era comparable a la del Fe VO; se observaron reacciones infusionales en 37 pacientes 29.
El tratamiento con Fe endovenoso es factible en hospitales o clínicas de mediana complejidad que cuentan con infraestructura para el monitoreo de la función cardio-respiratoria y personal con experiencia en el manejo de potenciales reacciones adversas 30.
CONCLUSIONES
Los avances en el rol regulador del metabolismo del hierro de la hepcidina y los factores que controlan su síntesis han permitido esclarecer la etiopatogenia de la DH en varias condiciones clínicas y constituyen la base de nuevos esquemas y modalidades de tratamiento. El hierro administrado VO es el tratamiento de primera línea de AF, pero efectos colaterales GI y no adherencia al tratamiento son frecuentes. El Fe VO en días alternados tiene mejor absorción y menor toxicidad GI y, consecuentemente, podría ser una modalidad alternativa al esquema tradicional. Alternativamente, en casos de intolerancia GI y otras situaciones clínicas descritas líneas arriba, el hierro EV puede ofrecerse a los pacientes como tratamiento secundario o de primera línea.















