INTRODUCCIÓN
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune sistémica que se define por la presencia de anticuerpos antifosfolipídicos (AAF) -entre ellos el anticoagulante lúpico, el anticuerpo anticardiolipina, el anti-β2 glicoproteína I, entre otros anticuerpos menos frecuentes-, de trombosis arterial o venosa, y de abortos espontáneos recurrentes 1-3. El SAF es clasificado en primario o secundario, este último cuando está asociado a otros trastornos inmunológicos, principalmente el lupus eritematoso sistémico (LES) 1,3. Puede afectar diversos órganos y sistemas del cuerpo, pero las complicaciones cardiacas conllevan mayor morbimortalidad. Estas últimas se presentan en 1 de 4 pacientes con SAF 4. La notoriedad del presente caso radica en el hallazgo inusual de múltiples masas auriculares en una paciente con SAF, así como los posibles diagnósticos diferencias y tratamiento a partir del caso.
REPORTE DE CASO
Paciente mujer de 31 años, quien un mes antes del ingreso, presentó petequias y equimosis difusas, meno-metrorragia y gingivorragia. Se le halló anemia y plaquetopenia severa, por lo que fue referida a nuestra institución en julio del 2021. No presentó fiebre, ni otros síntomas. La paciente refirió antecedentes de hipertensión arterial desde aproximadamente 1 año, con tratamiento irregular. También refirió tres episodios de infección urinaria en el último año, sin especificación del tipo. Otro antecedente fue el de síndrome convulsivo de causa no especificada con tratamiento eventual con fenitoína oral; y cálculos coraliformes bilaterales e hidronefrosis bilateral moderada a severa.
La paciente presentó un episodio de COVID-19 leve hace aproximadamente 6 meses. No se refirió antecedentes de diabetes, tuberculosis, contacto tuberculoso, enfermedades respiratorias, enfermedad renal crónica, HIV, hepatitis y dengue. Tuvo 3 abortos espontáneos en dos años, no tiene hijos, niega métodos anticonceptivos y no recuerda fecha de última menstruación. Niega uso de alcohol, drogas, tabaco y medicamentos.
Al examen físico, se encontró funciones vitales estables, múltiples equimosis y petequias, ausencia de adenopatías, lesiones orales y edemas. En el examen respiratorio y cardiovascular no hubo alteraciones, tampoco hubo visceromegalias en el abdomen. El examen ginecológico fue normal. El resto del examen físico no evidenció hallazgos contributivos.
En la analítica al ingreso la hemoglobina fue 8,1 g/dL, los leucocitos fueron 17 340 por mm3 sin bastones, las plaquetas estuvieron en 14 000 por mm3. Las constantes corpusculares y lámina periférica fueron no contributivas. El tiempo parcial de tromboplastina activada (TTPA) fue 72 segundos, el INR 1,45 segundos, el Coombs directo tuvo ++/+++, el fibrinógeno fue 305 mg/dL. La serología para VIH, VDRL y pruebas de hepatitis fueron negativas. En el perfil inmune, los anticuerpos antinucleares, anti-DNA, C3, C4, anti-Smith, anti-LA, anti-RO, anti RNP, anti SCL70, AMA-M2, anti-JO-1, anti-centrómero y anti-histonas fueron negativos.
La proteinuria en orina de 24 horas fue 1640 mg. El Bk en orina en 2 muestras fueron negativas. El examen completo de orina presentó: leucocitos de 90-100/campo, hematíes: 50-60/campo, hematíes dismórficos: 35%. No se solicitó urocultivo. La uro-tomografía sin contraste evidenció litiasis coraliforme bilateral e hidronefrosis bilateral severa.
La paciente fue diagnosticada con Síndrome de Evans (Púrpura Trombocitopénica Inmune y Anemia hemolítica) y probable Lupus ANA negativo. Ella recibió tratamiento para infección del tracto urinario (ITU) complicada con piperazilinatazobactam a dosis corregida por 10 días. Además, fue tratada con dexametasona 40 mg endovenoso (EV) cada 24 horas por tres días, luego prednisona 60 mg cada 24 horas, ante la pobre respuesta se le inició inmunoglobulina humana 5%: 24 frascos en 5 días y 500 mg EV de ciclofosfamida, con respuesta parcial. La paciente fue dada de alta asintomática, en buen estado general con los diagnósticos: LES seronegativo en corticoterapia (25 mg cada 12 horas de prednisona), plaquetopenia en 92 000 plaquetas, litiasis coraliforme bilateral con enfermedad renal crónica estadio IV y con urocultivo con crecimiento de Pseudomona aeruginosa sensible a meropenem, sin síntomas urinarios. Para este último diagnóstico se planteó como un germen colonizante. La paciente fue referida a Lima para nefrostomía percutánea, la cual no se realizó por hallársele germen multi resistente, infección urinaria y trombocitopenia severa.
La paciente reingresa a hospital por presentar disnea progresiva, por lo que se le realiza un ecocardiograma transtorácico (ETT) que mostró masas en aurícula derecha (AD). Posteriormente con un ecocardiograma transesofágico (ETE) se caracterizó mejor estas masas intracardiacas como se muestran en la figura 1. Se encontró 4 masas en AD, pediculadas (en diferentes partes de la AD), móviles, 2 heterogéneas (con contenido hiperecogénico en su interior) y 2 homogéneas, bordes irregulares, de múltiples formas (2 cuadrangulares, una ovoide y una alargada), y sin evidencia de alteración estructural asociada.
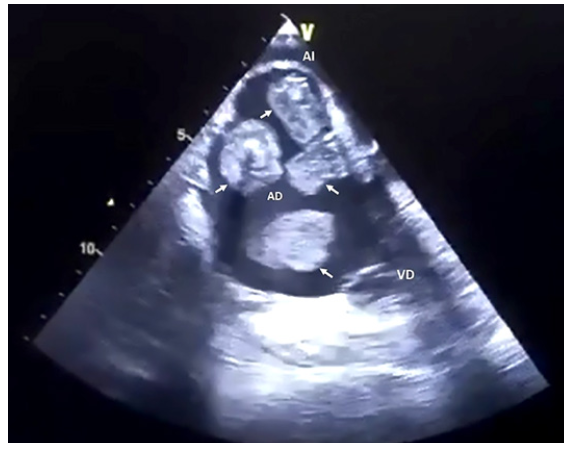
Figura 1 Imagen de los 4 trombos en aurícula derecha por ecocardiograma transesofágico (flechas blancas)
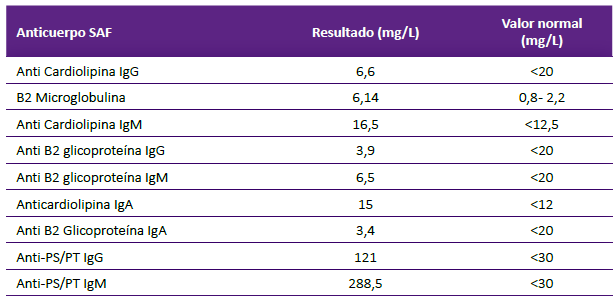
Asimismo, un perfil de laboratorio para SAF se muestra en la tabla 1. Con estos resultados se confirmó el diagnóstico de SAF secundario a LES. Se concluyó en alta probabilidad de trombosis intracardiaca asociado a SAF, por lo que se indicó anticoagulación plena con enoxaparina, y referencia a Hospital de alta complejidad para posibilidad de cirugía cardiaca. La paciente falleció unos días después de manera súbita. No se realizó necropsia.
DISCUSIÓN
La presencia de 3 abortos, convulsiones, síndrome de Evans y la positividad de biomarcadores hicieron posible un sólido diagnóstico de SAF 5. La paciente además tuvo infecciones urinarias a repetición y litiasis coraliforme. El daño renal probablemente se deba a estos dos mecanismos y a la autoinmunidad. Casals et al, describieron una serie de 100 casos de SAF e infecciones, 10% de ellos tenían ITU demostrada 6. En Uruguay, Consani et al, en 339 pacientes con enfermedades autoinmunes (20,4% con SAF) hallaron que 46,9% tenían infecciones; en ellos, 31,7% tuvieron ITU 7.
En la paciente se usó corticoides, ciclofosfamida e inmunoglobulina sin previo urocultivo, pero con cobertura antibiótica de amplio espectro. Si bien esta conducta no es el estándar, debemos comentar la premura de tratamiento y problemas logísticos con los cultivos. Además, la Pseudomona aeruginosa hallada al final, se consideró contaminante y la paciente fue referida con profilaxis antibiótica. Los portadores de cálculos coraliformes están en estado de infección permanente por bacterias que degradan la urea 8.
El 25% de pacientes con SAF tienen complicaciones cardiovasculares 4, las más frecuentes son las valvulopatías (endocarditis no infecciosa, fibrosis e insuficiencia valvular) y ateroesclerosis prematura. Menos frecuentemente: disfunción ventricular (por infartos previos) e hipertensión pulmonar; y muy raramente: trombosis intracardiaca (en cualquier cámara o en varias cámaras cardiacas, con o sin disfunción ventricular) 3, con alta mortalidad sin diagnóstico y tratamiento oportuno.
Al hallar masas intracardiacas en pacientes con SAF, la primera posibilidad son trombos. El diagnóstico diferencial son los mixomas (sin relación directa con SAF), por las similitudes encontradas en reportes anteriores: masas pediculadas, móviles y sin cardiopatía estructural. Sin embargo, su localización más frecuente es la aurícula izquierda, unida casi siempre por un pedículo al septum interauricular adyacente a la fosa oval 9, sus márgenes bien definidos y su contenido heterogéneo por zonas ecolúcidas 10,11. Otras posibilidades son el fibroelastoma (pequeño y válvular) y el rabdomioma (pequeño, ventricular y en niños). El angiosarcoma y el linfoma son principalmente auriculares, pero sin pedículo e infiltración a pared 11.
En 1994 fueron descritos 9 pacientes mujeres con trombosis cardiaca: 3 asociados a LES, 3 por SAF primario y tres por SAF asociados a otros problemas autoinmunes 12. Villani et al, describieron a una mujer de 54 años con episodios de trombosis venosa profunda y tres trombos en aurícula derecha demostrados por biopsia 13.
En la imagen de ETE se pudo observar masas de diferentes características, probablemente debido a su antigüedad, lo que pone de manifiesto diferentes fases en los trombos cardiacos, mucho mejor definidas en la trombosis coronaria 14. Lo clásico en un trombo cardiaco reciente es su forma alargada (serpentiforme), móvil, homogéneo, con mayor densidad del miocardio, sin pedículo 15,16; como la masa ubicada en la parte inferior de la figura. Las 2 masas con formas rectangulares, contenido hiper ecogénico y pediculados corresponderían a trombos antiguos organizados; y la cuarta masa de forma cuadrangular, pero sin contenido hiper ecogénico, probablemente a un trombo organizado menos antiguo 10,17.
Los mecanismos en la formación de trombos intracardiacos en SAF son inciertos. Los complejos antígeno-anticuerpo de las células endoteliales generan disfunción endotelial, hipercoagulabilidad y trombosis, además de inhibición de la fibrinólisis 18. Nosotros presentamos un caso muy raro de múltiples masas en AD con gran definición por ETE, que, por las características morfológicas, concluimos como posibles trombos. Si bien en la actualidad, la ETT es una herramienta adecuada para el diagnóstico, la ETE define mejor las características de las aurículas. Probablemente, es equiparable a una resonancia magnética nuclear (RMN)/tomografía cardiaca, aunque estas pueden aportar otros datos adicionales 3. La ETE se puede realizar al lado de la cama del paciente y tiene menor costo. La RMN no está disponible en muchos hospitales, como el nuestro.
El tratamiento de la trombosis asociada a SAF es la anticoagulación intensa y prolongada, independiente del tratamiento con corticoides e inmunosupresores. El anticoagulante oral indicado es la warfarina (o acenocumarol), proponiendo valores de INR entre 2,0 a 3,0 para trombosis venosa profunda en SAF 1, que puede intensificar-se a valores de 3,0 a 4,0 en recurrencias (a pesar de anticoagulación plena) o trombos intracardiacos 1,3. También puede asociarse ácido acetilsalicílico. Sin embargo, para trombosis intracardiaca (principalmente de cavidades derechas) la evidencia es escasa. Nuestra paciente recibió anticoagulación plena con enoxaparina, en espera de referencia para cirugía cardiaca, pero lamentablemente falleció súbitamente, probablemente por TEP masivo o accidente cerebrovascular. Respecto a los anticoagulantes orales directos no se cuenta con evidencia para su uso en estos pacientes.
Finalmente debemos comentar la muerte súbita de nuestra paciente. Existen varias hipótesis; hay reportes de tromboembolia pulmonar masiva en pacientes con trombos auriculares y SAF, entre otras posibilidades figuran un síndrome coronario agudo relacionado a disfunción endotelial y el proceso inflamatorio presente, la presencia de fibrilación ventricular por una cardiomiopatía asociada y también un accidente cerebrovascular hemorrágico 1. Lamentablemente no se realizó la necropsia.
Nuestro caso se suma a otros reportes de masas en AD en pacientes con SAF, la mayoría de las veces se trata de una trombosis intracardiaca, que es una rara complicación y tiene difícil manejo médico. Según algunos reportes 2, el tratamiento quirúrgico oportuno sería una buena opción para mejorar el pronóstico de estos pacientes.