INTRODUCCIÓN
La Organización Mundial de la Salud ha manifestado que la resistencia antibiótica es una de las mayores amenazas para la salud global, la seguridad alimentaria y el desarrollo 1. La resistencia antibiótica genera un incremento de los costos médicos asociados al cuidado de la salud 2,3, la morbimortalidad 3,4 y las estancias hospitalarias 4.
A nivel mundial, se ha evidenciado el incremento de gérmenes multidrogoresistentes (MDR) en Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae y Staphylococcus aureus, principalmente en las Unidades de Cuidados Intensivos (UCI), todos con potencial de causar brotes hospitalarios e incluso diseminación internacional 2,5,6. En Latinoamérica, se han descrito altas tasas de cepas MDR en las UCI, asociados a gérmenes productores de carbapenemasas que son endémicos en algunos países 7-9 y descritos también en Perú 10.
En el Perú, en Lima, se ha reportado alta prevalencia de bacterias MDR en urocultivos de pacientes pediátricos y adultos (45,9%) 11, en hemocultivos de neonatos (≈87%) 12) y gestantes (70%) 13) con sospecha de sepsis, y en niños con bacteriemia (80,6%) 14. Además, en estudios multicéntricos que incluían ciudades de diferentes regiones del país se ha reportado bacterias MDR en el 50 a 70% de los aislamientos 15,16.
Para el control de la resistencia antibiótica se han planteado diferentes estrategias, entre ellas la vigilancia de la resistencia antimicrobiana, que permite introducir políticas e intervenciones basadas en la evidencia 9,17. En este sentido, es importante conocer los patrones de resistencia en diferentes ciudades y hospitales, y su variación a lo largo de los años.
El presente estudio busca describir la variación de la prevalencia de cepas MDR entre los años 2012 y 2019, de las bacterias más frecuentemente aisladas en muestras clínicas de pacientes atendidos en un Hospital de tercer nivel de atención de una ciudad de altura en el Perú, y determinar los factores asociados al aislamiento de cepas MDR. Además, describir la prevalencia de otros fenotipos de resistencia en el periodo de estudio.
MÉTODOS
Diseño y población de estudio
Se realizó un estudio observacional transversal a partir de una cohorte histórica de aislamientos bacterianos de muestras clínicas de pacientes atendidos entre abril del 2012 y marzo del 2019.
Se consideraron los siguientes criterios de inclusión: aislamientos bacterianos de muestras clínicas de pacientes atendidos durante el periodo de estudio con antibiograma realizado mediante un sistema automatizado; el aislamiento debía corresponder a una de las bacterias identificadas con mayor frecuencia y con relevancia clínica: Enterobacterias (Escherichia coli, K. pneumoniae, Enterobacter cloacae, Proteus mirabilis), bacterias no fermentadoras (BNF) (A. baumannii, P. aeruginosa), S. aureus y Enterococcus spp. (E. faecium y E. faecalis); y debían contar con un antibiograma con al menos la mitad de los grupos de antibióticos considerados por Magiorakos et al.18) para la definición de bacterias MDR, extensamente resistente (XDR) y posible XDR (pXDR). Se incluyó solo el primer aislamiento de una misma bacteria aislada en un paciente en un periodo de siete días, salvo que tuviera un patrón de susceptibilidad diferente. Se excluyeron los aislamientos de pacientes atendidos en forma ambulatoria; y las muestras de heces e hisopados rectales.
Además de las variables microbiológicas y características de la muestra, se incluyeron variables demográficas del paciente y el servicio que solicitó la muestra clínica, pudiendo corresponder a pacientes hospitalizados o atendidos en emergencia. Esta información se encontraba disponible en la base de datos del laboratorio de microbiología del hospital.
Ámbito de estudio
El estudio se realizó en el Hospital Nacional Ramiro Prialé Prialé, de tercer nivel de atención, ubicado en la ciudad de Huancayo a 3250 metros sobre el nivel del mar (m.s.n.m.) en Perú. El hospital contaba con 262 camas en el año 2019, y un promedio de 14 090 egresos hospitalarios por año durante el periodo de estudio.
Procedimientos realizados para identificación y antibiograma de bacterias
Durante el periodo de estudio, las muestras clínicas fueron procesadas en el laboratorio de microbiología del hospital, y sembradas en medios de cultivo Agar Sangre y Agar Mac Conkey a 37°C por 24-48 horas. Las cepas fueron identificadas y se les realizó antibiograma en el sistema automatizado VITEK 2 (bioMérieux. Mercyl'Etoile, Francia) según las instrucciones del fabricante. Se utilizaron los puntos de corte de concentración mínima inhibitoria (CMI) establecidos por CLSI (Clinical & Laboratory Standards Institute), según los puntos de corte recomendados en el año del diagnóstico. Se confirmó la resistencia a carbapenemes con el método fenotípico de discos combinados con inhibidor. Respecto al control de calidad de los procedimientos realizados en el servicio de microbiología, debemos mencionar que si bien son realizados no se rigen a un cronograma anual.
Patrones de resistencia antibiótica
Se consideró los resultados de susceptibilidad intermedia como resistentes. Para la definición de la resistencia bacteriana (MDR, XDR y pXDR) se usaron los criterios descritos por Magiorakos et al. 18 y para el análisis se consideraron las muestras de hemocultivos, urocultivos, líquidos biológicos estériles, secreciones respiratorias y otras secreciones (secreciones no respiratorias no estériles).
En relación con los otros fenotipos de resistencia evaluados, para las Enterobacterias: K. pneumoniae y E. coli se consideró que presentaban betalactamasas de espectro extendido (BLEE) si presentaban resistencia a cefalosporinas de 1° generación, a Cefuroxima y sensibilidad a Cefoxitina; además de cumplir con al menos dos de los siguientes requisitos: resistencia a Aztreonam, resistencia a Ampicilina (solo para E. coli) y sensibilidad a Carbapenémicos 19. Del mismo modo se evaluó la resistencia a Carbapenémicos en P. aeruginosa y A. baumannii; también se evaluó la resistencia a meticilina en S. aureus y la resistencia a vancomicina en Enterococcus spp. Finalmente, se definió como S. aureus resistente a meticilina (SARM) a cualquier cepa resistente a oxacilina.
Análisis estadístico
El análisis se realizó con el programa STATA versión 17.0 y OpenEpi. Se realizó el análisis descriptivo mediante determinación de frecuencias. Se evalúo la asociación entre cada factor estudiado y el desenlace "bacteria MDR" mediante determinación de la razón de prevalencias (RP). Se evaluó significancia mediante la prueba de Chi cuadrado de Pearson. Además, se realizó análisis multivariado mediante regresión de Poisson. Se incluyeron aquellas variables con RP cruda estadísticamente significativa, y que además no estuvieran asociadas entre sí. En todos los análisis, se consideró como categoría de referencia, aquella con menor proporción de cepas MDR. El nivel de significancia fue 0,05.
RESULTADOS
Se identificaron 24 580 antibiogramas, 6 959 cumplieron con los criterios de inclusión (Figura 1), y se observó un menor número de aislamientos en el año 2014 debido a problemas con el sistema informático. La mayoría de las cepas fueron aisladas de pacientes mujeres (61,9%) y de muestras de urocultivo (68,3%). Solo el 7,3% de las muestras correspondieron a hemocultivos.
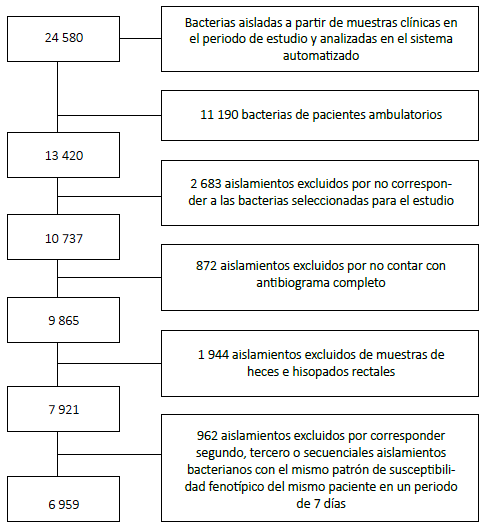
Figura 1 Flujograma para selección de aislamientos incluidos de acuerdo con criterios de elegibilidad.
Las Enterobacterias fueron el grupo aislado con mayor frecuencia en todos los grupos etarios y según tipo de muestra se aisló una mayor prevalencia de BNF en muestras de secreciones respiratorias (Tabla 1).
Tabla 1 Características de los pacientes y muestras clínicas en las que se aislaron los grupos de bacterias evaluadas.
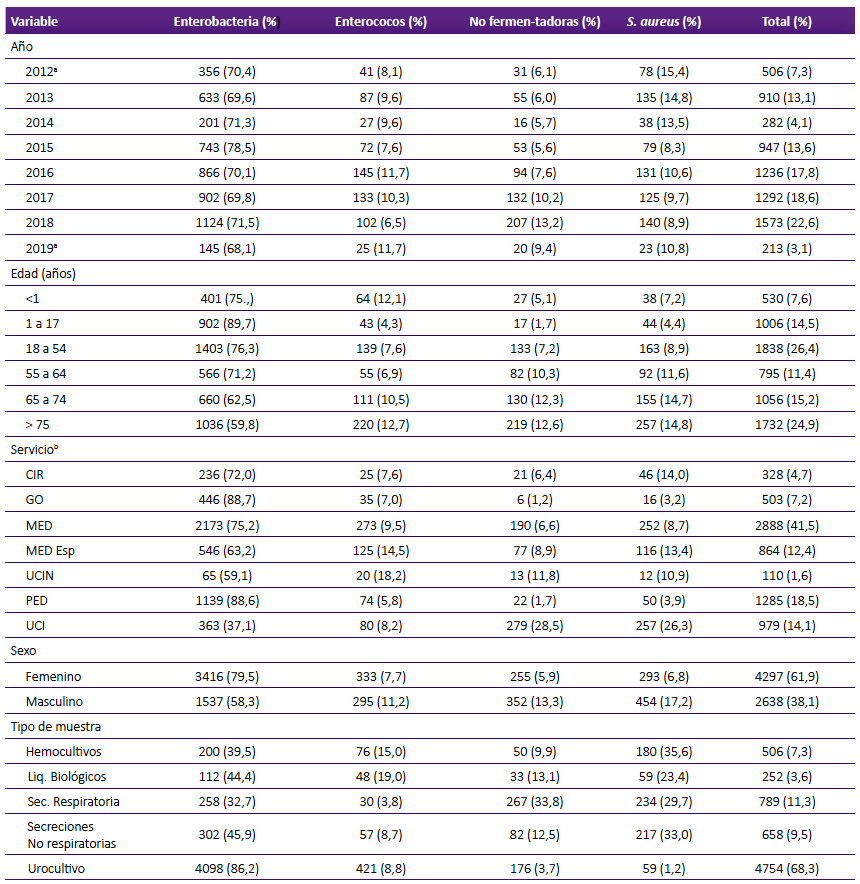
a Se incluyeron solo los meses abril a diciembre 2012 y enero a marzo del 2019.
b dos cepas no tenían información sobre el servicio de origen.
CIR: cirugía, GO: gineco-obstetricia, MED: medicina, MED Esp: medicina especialidades, PED: pediatría, UCI: unidad de cuidados intensivos, UCIN: unidad de cuidados intensivos neonatales
Se identificaron 5162 (74,2%) cepas MDR, evidenciándose una tendencia a la disminución de la prevalencia anual de cepas MDR, sin embargo, no se identificó una variación estadísticamente significativa respecto al año 2012 (Tabla 2).
Tabla 2 Factores asociados presencia de cepas multidrogoresistentes.
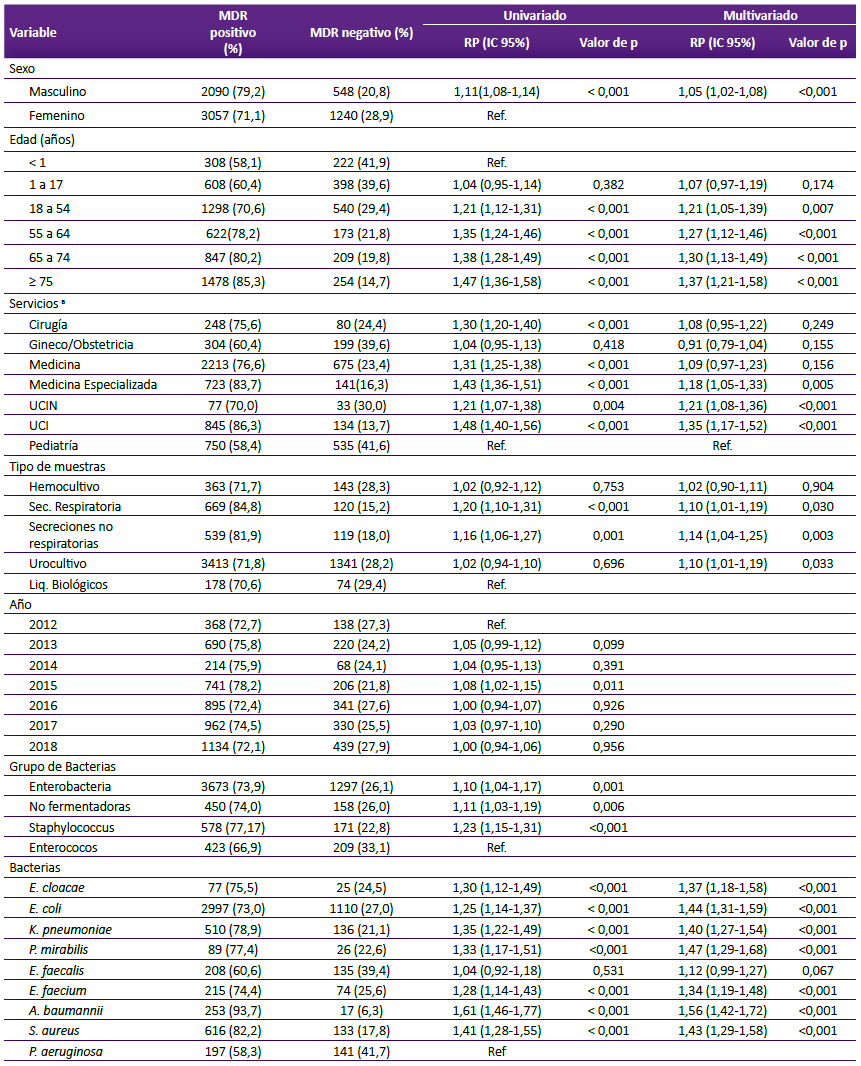
MDR: multidrogoresistente, RP: razón de prevalencia
a Se excluyeron dos cepas que no tenían información asociada sobre el servicio
Para la mayoría de las bacterias evaluadas la prevalencia anual de cepas MDR fue mayor a 70%. En el caso de A. baumannii más del 90% de las cepas evaluadas en los últimos tres años fueron MDR (sin considerar los años 2014 ni 2019). Se identificó una tendencia a la disminución en la prevalencia anual de cepas MDR en K. pneumoniae, E. faecalis, S. aureus, P. mirabilis y P. aeruginosa (no se consideró el año 2019), sin embargo, en el caso de las dos últimas bacterias, se observó un cambio en esta tendencia en los últimos dos años estudiados (Tabla 3).
Tabla 3 Prevalencia anual de cepas multidrogoresistentes según tipo de bacteria.
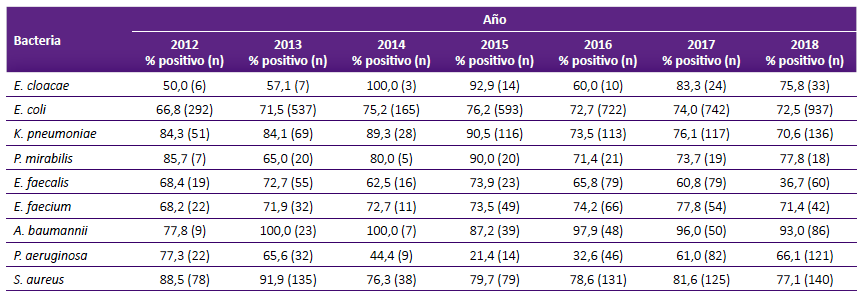
n: número de cepas evaluadas
En la tabla 2 se presentan la razón de proporción RP y RP ajustada para posibles factores asociados al aislamiento de cepas MDR. En el análisis multivariado, los pacientes de sexo masculino tuvieron una probabilidad 5% mayor de tener cepas MDR, por otro lado, los pacientes mayores de 75 años en relación con los menores de 1 año tuvieron 37% mayor probabilidad de tener cepas MDR, mientras que, en los servicios de medicina especializada, UCIN y UCI se observó una probabilidad significativamente mayor de cepas MDR con relación al servicio de pediatría. Las muestras clínicas de secreciones respiratorias, no respiratorias y urocultivos, tenían 10%, 14% y 10% mayor probabilidad, respectivamente, de presentar cepas MDR comparadas con los líquidos biológicos.
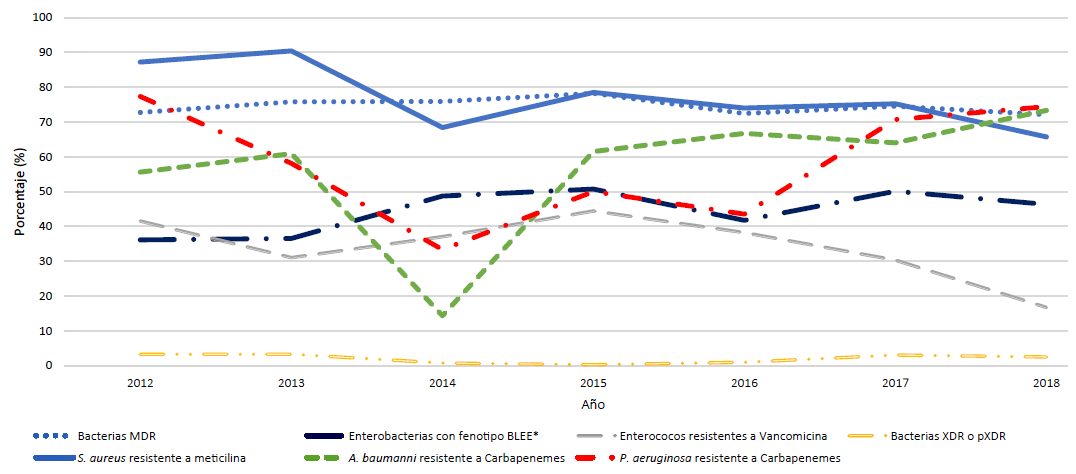
Se identificó 37 (0,5%) cepas XDR y 107 (1,5%) pXDR de 6 771 muestras evaluadas. Las cepas XDR correspondían a A. baumannii (25) y P. aeruginosa (12). Las cepas pXDR correspondían a cepas de P. aeruginosa (91), E. coli (1), E. faecalis (11) y E. faecium (4). En la tabla 4 se presenta la prevalencia de cepas BLEE (en E. coli y K. pneumoniae), Enterococcus spp. resistentes a vancomicina, SARM, cepas XDR o pXDR, y cepas resistentes a carbapenemes (RCARB), según servicio y tipo de muestra. En la figura 2 se muestra la variación anual de fenotipos resistentes. Las cepas RCARB fueron identificadas en A. baumannii (65,9%) y P. aeruginosa (65,6%), y solo se encontró una cepa de K. pneumoniae RCARB (0,2%).
Tabla 4 Prevalencia de cepas aisladas con diferentes mecanismos de resistencia fenotípica según servicio y tipo de muestra.
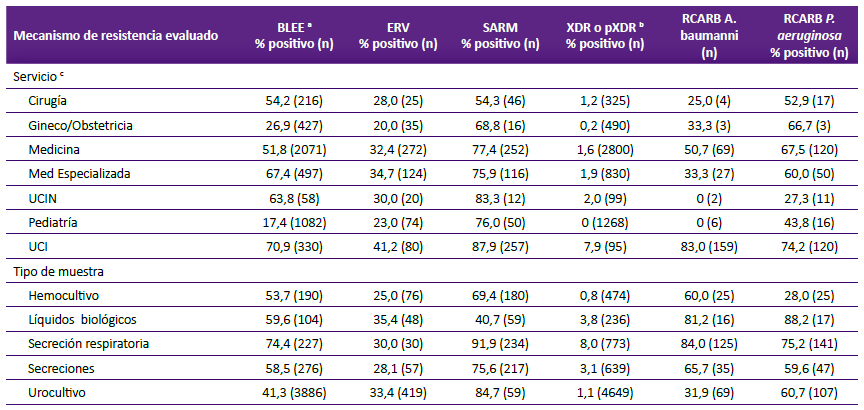
a E. coli y K. pneumoniae; b A.baumanni y P. aeruginosa; c Se excluyeron dos cepas que no tenían información asociada sobre el servicio.
BLEE: Betalactamasas de espectro extendido, ERV: Enterococo resistente a vancomicina, SARM: S. aureus resistente a meticilina, RCARB: resistente a carbapenémicos, UCI: unidad de cuidados intensivos,
UCIN: unidad de cuidados intermedios.
DISCUSIÓN
En nuestro estudio encontramos alta prevalencia de cepas MDR con porcentajes mayores a 70% en todas las bacterias evaluadas, excepto E. faecalis y P. aeruginosa. Estos resultados concuerdan con estudios realizados en el Perú con muestras recolectadas a partir del 2017, en los que la prevalencia de MDR fue 70% o superior 12,13,16. El pico de la prevalencia de bacterias MDR fue en el año 2015 (78,2%), luego hubo una disminución que puede estar relacionada a diversos factores; entre estos, coincidió con la implementación del programa de optimización de antimicrobianos (PROA) en el año 2016 en el hospital evaluado.
A pesar de que se observa una tendencia a la disminución en la prevalencia anual de cepas MDR en cinco de las bacterias evaluadas, en dos de ellas (P. mirabilis y P. aeruginosa) la prevalencia aumentó en los últimos dos años, por lo cual se debe continuar con la vigilancia de la resistencia.
En nuestro estudio A. baumannii presentó la prevalencia más alta de cepas MDR (93,7%) durante el periodo estudiado, lo cual se correlaciona con estudios previos, como el realizado por Agyepong et al que encontró 100% de A. baumannii MDR y el estudio de Góngora et al que encontró 77,1% de A. baumannii MDR 20,21. Sin embargo, a diferencia de estos estudios, donde P. aeruginosa era la primera o segunda bacteria gran negativa con mayor prevalencia de cepas MDR 17,18, en nuestro estudio P. aeruginosa tuvo la menor prevalencia de cepas MDR (58,3%).
En nuestro estudio encontramos que las bacterias con mayor prevalencia de cepas MDR, luego de A. baumannii, fueron S. aureus (82,2%) y K. pneumoniae (78,9%). Existen pocos estudios que describen la prevalencia de S. aureus MDR en muestras hospitalarias; en un estudio en neonatos con sepsis la prevalencia fue 66,6% (18 muestras) 22, mientras que la prevalencia de SARM en hospitales de Brasil fue del 25% 23, sin embargo, esta baja prevalencia pudo deberse a la definición de MDR utilizada en este estudio, pues un SARM debía ser resistente a cuatro o más grupos de antibióticos no β-lactámicos. Respecto a K. pneumoniae, los estudios describen que la prevalencia de cepas MDR varía entre 18% a 89%, Garza-González et al reportó 22% de K. pneumoniae MDR y Shilpakar et al reportó un 80% 24-27.
En general, la mayor proporción de cepas MDR considerando todas las bacterias evaluadas fueron encontradas en el servicio de UCI (86,3%), seguido de los servicios de medicina especializada (83,7%), y se corresponde con reportes previos en otros países 20. En el análisis multivariado se encontró que el aislamiento de cepas MDR fue más probable en muestras clínicas de pacientes varones, así como en los servicios de medicina especializada, UCI y UCIN, también en muestras de secreciones no respiratorias. Estos factores en general concuerdan con estudios previos, aunque varían de acuerdo a la categoría utilizada como referencia, por ejemplo, se ha descrito la estancia en UCI como un factor de riesgo, pero no la estancia en servicios de medicina, ni tampoco en pacientes mayores de 60 años 28-30.
En relación a la prevalencia de cepas con otros fenotipos de resistencia, nosotros encontramos que K. pneumoniae y E. coli BLEE positivas por servicio hospitalario variaron entre 17,4 a 70,9%, que se corresponde con reportes de Latinoamérica donde la proporción de cepas resistentes a cefalosporinas de tercera generación de E. coli varió entre 0-60%7. En nuestro estudio, la proporción de cepas de E. coli BLEE fue menor de 50% todos los años (figura 2), por debajo de los reportado por la Red Latinoamericana de Vigilancia de la Resistencia a los Antimicrobianos para Perú (59%)7, que incluye cepas no hospitalarias, o de lo reportado en un centro de salud privado en el periodo 2014-2016 en muestras de orina (50,5%)31, sin embargo sí se observa una tendencia al incremento de la proporción anual desde el año 2013 (33,3%) hasta el año 2018 (44,0%).
La mayor proporción de cepas RCARB fueron encontradas en el servicio de UCI (83% para A. baumannii y 74,2% para P. aeruginosa), y para ambas bacterias se aprecia una tendencia de incremento anual en la prevalencia de cepas resistentes considerando todos los servicios. Estos resultados coinciden con reportes de Latinoamérica del 2014 al 2016, en los que se observó un incremento en la proporción de cepas RCARB para A. baumannii y P. aeruginosa, con porcentajes de resistencia que alcanzaban el 89% y 69%, respectivamente 7. De la misma forma, en nuestro estudio, la proporción de cepas XDR o posible XDR fue mayor en UCI (7,9%), aunque, la proporción total de cepas XDR o posible XDR no varió anualmente.
Respecto a las cepas de Enterococos, se encontró una proporción de ERV de 31,8%, y en general fueron aisladas con mayor frecuencia en UCI (41,2%). Estos resultados son similares a los reportados en un estudio a nivel de Latinoamérica, realizado entre los años 2004 a 2015, donde se reporta 40,8% de cepas E. faecium resistente a vancomicina, pero solo 1,6% de E. faecalis resistentes a vancomicina 32. En nuestro estudio se observa una disminución en la proporción de ERV hasta 16% en el 2018, que podría estar relacionada con la implementación del programa de optimización de antimicrobianos (PROA) en el hospital desde el 2016, el cual tiene como protocolo el uso controlado de vancomicina.
SARM fue identificado en más del 50% de cepas de S. aureus en todos los servicios, similar a los reportes de resistencia de Latinoamérica 32,33, y fue más frecuente en UCI (87,9%). A pesar de que nuestro estudio presenta resultados de cepas aisladas en el hospital, no necesariamente asociadas a infección, es importante señalar que SARM está asociada a un 95% mayor riesgo mayor de muerte comparado con S. aureus susceptible a meticilina; y mayor estancia hospitalaria. En nuestro estudio no se identificó ninguna cepa de S. aureus resistente a vancomicina.
Entre las limitaciones del estudio: no se pudo determinar las causas en las variaciones de frecuencias de bacterias MDR u otros mecanismos específicos de resistencia, con relación a otros estudios de la región debido a que solo se evaluaron datos microbiológicos, demográficos y relacionados a la muestra. No se pudo diferenciar la importancia clínica de las cepas incluidas en el estudio debido a que no se contó con la información clínica, y muchas cepas pueden haber sido cepas colonizantes o incluso contaminantes. Por otro lado, se evalúo una base de datos que incluyó la interpretación de la CMI, según las normas de CLSI en el año evaluado, y no se pudo obtener los valores de CMI, por lo cual no se pudo homogenizar los criterios de interpretación a lo largo del periodo de estudio.
En general son pocos los estudios en países Latinoamericanos que evalúan la prevalencia de bacterias MDR en hospitales, y están en mayor parte centrados en mecanismos especiales de resistencia o en bacterias específicas. Sin embargo, debido a su importancia como problema de salud pública 1, es necesario publicar resultados de la vigilancia antimicrobiana, así como desarrollar estudios que evalúen el estado de las cepas resistentes a antimicrobianos en la región, de tal forma que los resultados estén disponibles para investigadores y tomadores de decisiones. A pesar de no existir un consenso específico para definir el fenotipo MDR para todas las bacterias, creemos que el utilizado en este estudio, propuesto por Magiorakos et al. 18, brinda detalle suficiente para obtener resultados comparables con estudios que se realicen en diferentes regiones y países. En este sentido nuestro estudio aporta información importante para conocer la epidemiología de la resistencia antibiótica en el Perú.
En conclusión, nuestro estudio muestra una alta prevalencia de cepas MDR en las bacterias más frecuentemente aisladas en pacientes atendidos en un hospital de tercer nivel de atención ubicado en una ciudad de altura, además, se identificó una tendencia a la disminución de la prevalencia anual de cepas MDR, excepto para las bacterias E. coli, E. cloacae, E. faecium y A. baumannii.