INTRODUCCIÓN
La otitis externa maligna (OEM) es una infección severa que afecta principalmente a personas con diabetes mellitus y tiene una importante morbimortalidad 1,2. Su diagnóstico es clínico-radiológico 3) y puede presentar complicaciones como osteomielitis de base de cráneo con parálisis de nervios craneales 1.
Su principal etiología es la bacteria Pseudomonas aeruginosa 2, su tratamiento es con antibióticos anti-pseudomónicos como fluroquinolonas y beta-lactámicos 1,4. Muy pocos casos de resistencia a fluoroquinolonas han sido reportados y ninguno con resistencia a carbapenémicos 5,6. Cuando existe evidencia de complicaciones como osteomielitis puede ser necesario el tratamiento quirúrgico 7.
Se presenta un caso de OEM por Pseudomonas aeruginosa, con evidencia de diseminación hematógena al ser aislada en urocultivo y hemocultivos. A nuestro conocimiento es el primer caso publicado de este patrón de infección y con resistencia a carbapenémicos, por lo que este reporte tiene como objetivo resaltar esta forma inusual de presentación.
Para el presente reporte, se obtuvo el consentimiento informado de parte de un familiar directo del paciente, quien estuvo de acuerdo con lo estudiado y el contenido del reporte. A su vez, se tuvieron los permisos institucionales para la revisión de la historia clínica.
REPORTE DE CASO
Varón de 66 años, natural y procedente de Tarma, región de Junín, Perú. Tiene antecedentes familiares de diabetes mellitus tipo 2, ingresó por emergencia con 14 días de enfermedad caracterizada por poliuria, polidipsia, polifagia, astenia y en las últimas horas somnolencia y dificultad respiratoria.
Al ingreso tenía temperatura de 36,7°C, estuvo hipotenso, taquicárdico, taquipneico y somnoliento. Se le encontró una lesión necrótica en pabellón auricular izquierdo (Figura 1), con otorrea y secreción seropurulenta retroauricular. El conducto auditivo externo (CAE) derecho estuvo ocupado por material costroso sin visualizarse la membrana del tímpano. El paciente no refirió el tiempo de evolución de este cuadro.
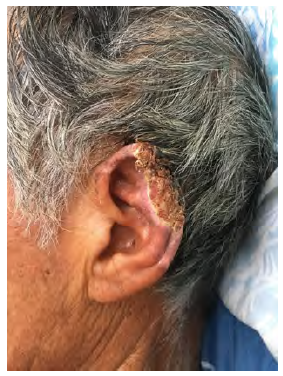
Figura 1 Lesión costrosa necrótica en hélix y anti-hélix de pabellón auricular izquierdo. Se observa también un borde inflamatorio alrededor de la lesión.
Respecto a los resultados de laboratorio, en las primeras 48 horas se observó hiperglicemia y retención nitrogenada. Los gases arteriales y electrólitos séricos revelaron acidosis metabólica anion gap elevado, osmolaridad sérica elevada, hipernatremia y hiperkalemia. El hemograma tuvo leucopenia sin deviación izquierda y plaquetopenia moderada. La proteína C reactiva y la procalcitonina tuvieron concentraciones elevadas. El examen de orina inicial mostró cetonuria, glucosuria y microhematuria (Tabla 1). La tomografía espiral multicorte de tórax mostró consolidaciones lobares en ambas bases con broncograma aéreo. Se tomaron muestras de hemocultivos y urocultivo.
Tabla 1 Evolución de los exámenes de laboratorio durante la hospitalización
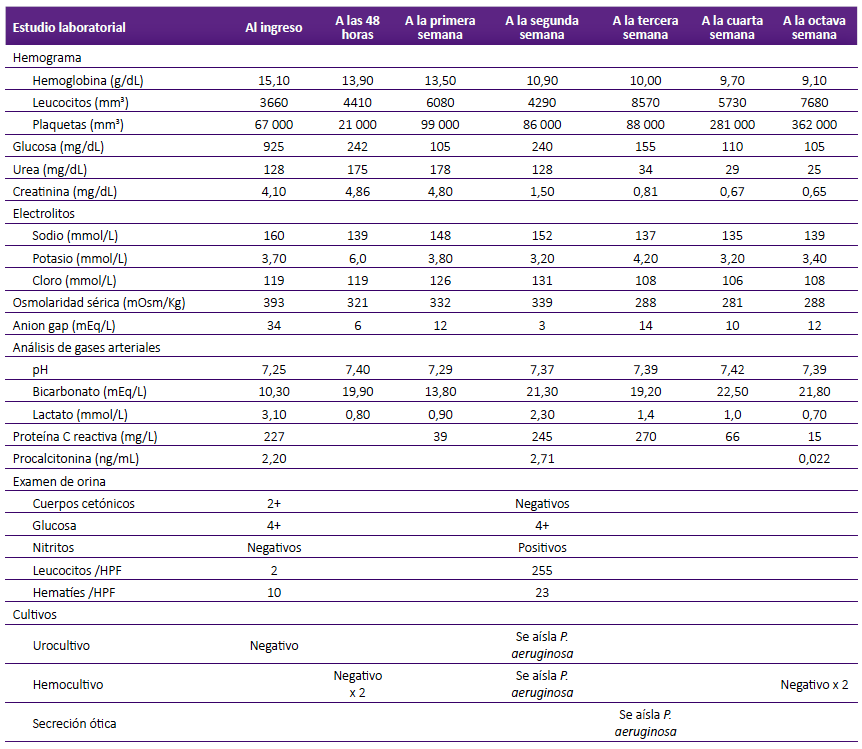
HPF: campo de gran aumento
Se diagnosticó choque séptico por neumonía severa, debut de diabetes mellitus 2 con crisis hiperglucémica mixta (cetoacidosis diabética más estado hiperglucémico hiperosmolar), injuria renal aguda y úlcera infectada en oído izquierdo. Se le trató con fluidoterapia, noradrenalina e insulina rápida en infusión endovenosa, antibioticoterapia empírica con meropenem 500 mg endovenoso (EV) cada 12 horas (h), según mejoría de la función renal se le indicó 1000 mg EV cada 12 h. Se corrigió el medio interno e inició ventilación mecánica invasiva. A las 48 horas los resultados de hemocultivos y urocultivo tomados al ingreso fueron negativos.
Se observó mejoría parcial al final de la primera semana con disminución de marcadores inflamatorios; sin embargo, hacia la segunda semana hubo empeoramiento clínico con aumento de marcadores inflamatorios y glucemia de difícil manejo. En el laboratorio de control se obtuvo examen de orina que revela leucocituria (Tabla 1), y se tomaron nuevas muestras para urocultivo y hemocultivos.
Los hemocultivos se procesaron en frascos BD BACTEC(tm) Plus Aerobic/F incubándose a 37°C en el equipo BD BACTEC(tm), estos fueron positivos a 24 y 27 horas para bacilos Gram negativos, realizándose subcultivo en agar Mac Conkey observándose colonias de bacterias no fermentadoras. La muestra de orina con coloración Gram también identificó bacilos Gram negativos, observándose en el urocultivo sembrado en agar CLED colonias sugerentes de Pseudomonas spp. La identificación de colonias en ambos casos se realizó en el equipo BD Phoenix(tm)100 mediante sustratos cromogénicos, fluorogénicos, y con fuentes de carbono, aislándose Pseudomonas aeruginosa.
Los antibiogramas fueron procesados en el equipo BD Phoenix(tm)100 mediante microdilución en caldo. En el hemocultivo y urocultivo se encontró resistencia a aminoglucósidos, fluoroquinolonas y carbapenémicos, sensibilidad intermedia a piperacilina/tazobactam y sensibilidad a colistina por método de pre-difusión y concentración inhibitoria mínima según el Clinical and Laboratory Standards Institute (Tabla 2). A los 15 días de hospitalización se inició el tratamiento con colistina 300 mg EV en dosis de carga y luego 150 mg EV cada 12 h.
Tabla 2 Patrón de sensibilidad del antibiograma de Pseudomonas aeruginosa aislada en hemocultivos, urocultivo y cultivo de secreción ótica izquierda, en 3 muestras, a la segunda y tercera semana de hospitalización.
| Antibiótico | Concentración inhibitoria mínima | Sensibilidad |
|---|---|---|
| Amikacina | >32 | Resistencia |
| Cefepima | >16 | Resistencia |
| Ceftazidima | >16 | Resistencia |
| Ciprofloxacino | >2 | Resistencia |
| Colistina | ≤1 | Sensible |
| Gentamicina | >8 | Resistencia |
| Imipenem | >8 | Resistencia |
| Levofloxacino | >4 | Resistencia |
| Meropenem | >32 | Resistencia |
| Piperacilina/Tazobactam | 32/4 | Intermedia |
A los 2 días del inicio de colistina, se realizó toma de cultivo de secreción de lesión descrita en oído izquierdo, aislándose Pseudomonas aeruginosa con el mismo perfil de sensibilidad en los hemocultivos y urocultivo (Tabla 2). El paciente fue diagnosticado con OEM por Pseudomonas aeruginosa resistente a carbapenémicos con diseminación hematógena, ampliándose el tratamiento con colistina durante 4 semanas y posteriormente con piperacilina/tazobactam 4,50 g cada 6 h por 2 semanas completando 6 semanas en total.
La tomografía mostró otomastoiditis bilateral, signos de perforación timpánica izquierda y secreción en oído medio derecho, además de sinusitis maxilar derecha y etmoidal bilateral, sin erosión ósea (Figura 2A). La resonancia magnética de oído encontró secreción líquida en ambas celdas mastoideas y en T2 aumento de intensidad en región preauricular y retroauricular izquierda, no encontrándose alteraciones en el trayecto de nervios craneales (Figura 2B).
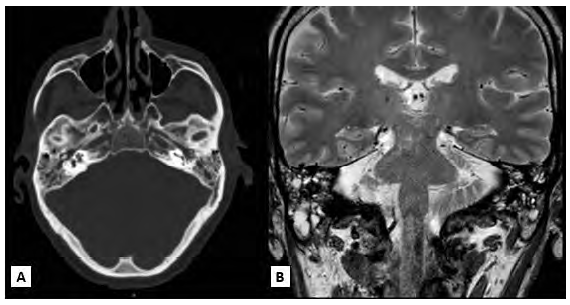
Figura 2 Exámenes radiológicos. A. Tomografía de hueso temporal y B. Resonancia magnética en T2 donde se observa ocupación de ambas celdas mastoideas en relación con otomastoiditis bilateral. No se encontró evidencia de osteomielitis.
Con 6 semanas de tratamiento antibiótico, una debridación local y al observar mejoría clínica, hemocultivos de control negativos, controles de glicemia y marcadores inflamatorios adecuados el paciente fue dado de alta.
DISCUSIÓN
Pseudomonas aeruginosa es un bacilo Gram negativo, no fermentador de glucosa, capaz de causar infecciones comunitarias e intrahospitalarias en huéspedes inmunocompetentes e inmunosuprimidos. Pueden ocasionar infecciones graves que comprometen la vida 8 y por su capacidad de generar resistencia a antibióticos de última línea es considerado un germen prioritario por la Organización Mundial de la Salud 9.
La OEM es una infección progresiva y severa originada entre las porciones ósea y cartilaginosa del CAE. Puede afectar tejidos adyacentes y huesos de la base del cráneo 1, complicándose con parálisis de nervios craneales, meningitis, abscesos cerebrales y trombosis de senos venosos y yugular interna 2,10.
Como en nuestro paciente, afecta principalmente a mayores de 65 años, la diabetes está presente hasta en 90% de los casos y predispondría a esta infección, debido a la alcalinización del pH del cerumen, la disminución de la quimiotaxis y produciendo hipoperfusión por microangiopatía 2,10. Un trauma, la exposición a agua o cirugía local pueden estar presentes como antecedentes 5.
Su etiología principal es Pseudomonas aeruginosa (90%), reportándose también Apergillus spp, Staphylococcus meticilinoresistente y bacilos Gram negativos 2. El diagnóstico etiológico requiere el cultivo más antibiograma de secreción de oído 5, lo cual fue realizado.
El diagnóstico se basa en el antecedente de diabetes y la presentación de otalgia intensa de predominio nocturno (100%), edema de CAE (98%), otorrea (93%), sordera (45%), presencia de tejido de granulación en el CAE (45%) y rara vez fiebre (10%). Se ha descrito un tiempo de enfermedad promedio de 4 semanas 3. Otros signos incluyen trismo y dolor en la articulación temporomandibular 3,5. El compromiso bilateral, como en el caso presentado, es inusual 11.
La parálisis de nervios craneales sugiere OEM severa por la presencia de osteomielitis de base de cráneo 1. La parálisis del VII nervio es la más común (15%), asociándose su presencia a mayor mortalidad y estancia prolongada 2,10. En nuestro caso no se encontraron estas complicaciones.
La tomografía detecta osteomielitis del hueso temporal 1, mientras que la resonancia magnética evalúa tejidos blandos circundantes, expansión intracraneal y edema de médula ósea (que precede a la osteítis), ambos son estudios complementarios 3-5. El compromiso radiológico de senos paranasales o de la articulación temporomandibular debe alerta la posibilidad de etiología fúngica 12, la que fue descartada en nuestro paciente. Otras técnicas como la tomografía por emisión de positrones tienen una sensibilidad de 96% y especificidad de 91% para el descarte de osteomielitis de base del cráneo 2.
Tal como se hizo y a fin de evitar demora en el inicio del tratamiento, el diagnóstico de OEM podría plantearse ante la presencia de al menos 3 de los siguientes 5 hallazgos 4: otitis externa persistente; presencia de tejido de granulación en CAE; radiología con osteomielitis en CAE, base de cráneo o compromiso de celdas mastoideas; compromiso de nervios craneales; y Pseudomonas aeruginosa aislada en cultivo de secreción de oído.
Los hallazgos clínico-radiológicos dividen a la OEM en 3 estadios clínicos de progresión (Tabla 3) 4. El caso reportado corresponde al estadio I. El tratamiento es individualizado y conservador con antibioterapia empírica inicial y luego guiada por cultivo. El ciprofloxacino es la elección, debido a su acción anti-pseudomónica y buena biodisponibilidad ósea, otras alternativas son piperacilina/tazobactam, ceftazidima y carbapenems 1,4. La duración recomendada mínima es de 6 semanas, variando en función a la evolución clínica y de marcadores inflamatorios 3,5. En casos de osteomielitis de base de cráneo, el tratamiento llega a 3-6 meses 2,10. El patrón de sensibilidad de este caso correspondió a Pseudomonas aeruginosa resistente de difícil tratamiento (PA-DTR), término propuesto por la Infectious Diseases Society of America. Nuestro caso fue tratado exitosamente con colistina y piperacilina/tazobactan. Otras opciones recomendadas para el manejo de PA-DTR incluyen ceftolozano/tazobactam, ceftazidima/avibactam e imipenem/cilastatin/relebactam, antibióticos que requieren corrección de dosis según la función renal y que no se encuentran en el petitorio nacional, por lo que no son de fácil disponibilidad 13,14.
Tabla 3 Estadios clínico-radiológicos de la otitis externa maligna
| Estadio | Descripción |
|---|---|
| I | Infección del canal auditivo externo y tejido adyacentes con dolor severo, con o sin compromiso del nervio facial. |
| II | Extensión de la infección con osteítis de huesos temporal y de la base de cráneo, o compromiso de varios nervios craneales. |
| III | Presencia de meningitis, empiema epidural, empiema subdural o absceso cerebral. |
La mayoría de reportes de OEM muestran Pseudomonas sensibles a betalactámicos 15, no han sido descritos casos de OEM con bacteremia e ITU simultáneas por Pseudomonas aeruginosa resistente a carbapenémicos, y con resistencia puntual a ciprofloxacino, gentamicina y cefalosporinas, y con la severidad de nuestro reporte 5,6,16. La mala evolución clínica asociada a farmacoresistencia en Pseudomonas aeruginosa se debería principalmente a una terapia antimicrobiana inicial inadecuada y a las comorbilidades del huésped, sin embargo, se han identificado factores de virulencia que podrían contribuir a un aumento de la mortalidad 14,17. En nuestro país existen estudios que tipifican genéticamente a la Pseudomonas resistente a carbapenémicos, sin embargo, no se especifican casos de OEM 18,19.
Concluimos que el origen de la bacteriemia fue la OEM, ya que esta lesión se presentaba desde el ingreso con un tiempo de enfermedad no definido, con resultados de urocultivo y hemocultivos iniciales negativos, y no fue hasta la segunda semana que por la evolución tórpida se repiten urocultivo, hemocultivos y posteriormente cultivo de secreción ótica izquierda, aislándose en las 3 muestras Pseudomonas aeruginosa resistente a carbapenémicos.
El manejo quirúrgico se considera en parálisis de nervios craneales, osteomielitis y no respuesta a antibióticos por al menos 2 semanas, variando desde debridación local como en nuestro caso, hasta mastoidectomía 2,7. El uso de oxígeno hiperbárico es una opción terapéutica en casos severos y refractarios, su indicación es controversial 1,3. Se reportan recurrencias hasta 15-20% de los casos recomendándose el seguimiento hasta un año después del tratamiento 3. La mortalidad varía entre 5% a 42%, esta es mayor en pacientes con parálisis de nervios craneales 4.
En conclusión, la OEM debe sospecharse en pacientes con diabetes mellitus, otalgia severa persistente y cambios inflamatorios en oído externo, la radiología complementa el diagnóstico y la toma de cultivo de secreción es obligatoria, para luego de iniciado el tratamiento antibiótico empírico este sea guiado por cultivo. En el caso de tratarse de una PA-DTR la demora en el inicio de un antibiótico adecuado sumado a las comorbilidades del paciente pueden hacer que la evolución sea grave. Este es el primer caso reportado de OEM por Pseudomonas resistente a carbapenémicos con diseminación hematógena al tener un probable compromiso bilateral y aislarse el mismo germen en urocultivo y hemocultivos.















