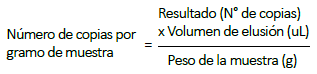INTRODUCCIÓN
El creciente aumento de la población mundial y la necesidad de obtener más y mejores alimentos, son las principales justificaciones para la investigación y aplicación de la tecnología transgénica en el cultivo de plantas alimenticias 1,2. Desde el inicio de su comercialización, el cultivo de plantas transgénicas, el consumo de sus productos por humanos y animales, y el etiquetado de los productos alimenticios industrializados han generado intensas controversias en la comunidad científica, agricultores, autoridades y consumidores 3.
Los que se oponen al cultivo y consumo lo consideran de elevado riesgo para la sostenibilidad del ambiente y la salud humana, agregando el peligro económico que entraña el oligopolio sobre las semillas transgénicas y los herbicidas 4. En relación con la salud humana se sostiene que su consumo puede ocasionar alergenicidad, toxicidad, tumoración, anomalías orgánicas en estómago e intestino, resistencia a los antibióticos, debilitamiento del sistema inmune, y disminución en los niveles de nutrientes del producto alimenticio 5,6,7. Sin embargo, los estudios al respecto se han realizado principalmente en animales y no son lo suficientemente convincentes, y los realizados en humanos son escasos y cuestionables.
Respecto a la alimentación animal, indirectamente humana; lo consumen principalmente aves de corral, y ganado vacuno y porcino 9. Sin embargo, también existen controversias entre los que sostienen que son inocuos y los que argumentan que afectan su salud 4,5. Seralini (7 al evaluar el efecto en ratas del maíz transgénico encontró que el 70% de las hembras y el 50% de los machos presentaron alteraciones hormonales y daños severos en diferentes órganos, muriendo antes de tiempo. Aris y Leblanc 8) reportaron que la toxina Cry I ab podría ingresar al organismo humano mediante la ingesta de leche, huevos y carne de animales alimentados con organismos genéticamente modificados.
Para seleccionar la técnica que permita detectar secuencias transgénicas en alimentos se debe considerar: viabilidad, sensibilidad, exactitud, reproducibilidad, practicidad, rapidez y costo. Actualmente los métodos moleculares son los más aceptados, entre ellos se considera que la técnica de reacción en cadena de la polimerasa en tiempo real (Real time-PCR) es la más adecuada, tanto para detectar secuencias transgénicas, como para cuantificar su concentración 10,11.
En la fabricación de productos alimenticios con ingredientes transgénicos, diversos factores como: cocción, cambios drásticos de pH, actividad de nucleasas y presencia de agentes químicos pueden contribuir a la degradación del ADN transgénico (12. Asimismo, compuestos como proteínas, grasas, polisacáridos, polifenoles, extractos de cacao y azúcar caramelizada pueden inhibir al ADN polimerasa y disminuir la eficacia de la detección de secuencias transgénicas por Real time-PCR 13. Por ello, el método de extracción y purificación de ADN total de los alimentos es un paso crítico para la detección de secuencias de ADN transgénicas. Utilizar el procedimiento establecido en el kit Dneasy Mericon Food y verificar la calidad de la extracción con el kit de detección Mericon Screen 35S, mediante la técnica de Real time-PCR, permite obtener gran cantidad de ADN idéntico al de partida y también detectar trazas de secuencias transgénicas 11.
El P35S es un promotor fuerte que se utiliza para asegurar la expresión del transgene en la mayoría de las plantas cultivadas comercializadas; el ser una secuencia transgénica universal permite lograr un amplio espectro de detección de organismos genéticamente modificados (OGM) y ha demostrado ser útil en la detección de productos alimenticios que tienen componentes transgénicos 14.
La mayor concentración de copias de ADN transgénico en productos alimenticios industrializados podría estar relacionada con riesgo para la salud humana. Por ello y considerando el principio de precaución; además de los análisis cualitativos que indican la presencia o ausencia de organismos transgénicos son necesarios los análisis cuantitativos, que indican su proporción en la muestra, la cual permite determinar si está o no dentro del umbral establecido por la norma de cada país 4,15.
El maíz (Zea mays L.) es una planta angiosperma, herbácea y monoica que fue domesticada en México hace aproximadamente 8700 años, extendiéndose luego hacia el sur de América; en el Perú se han encontrado restos de maíz de 2300 a 7200 años de antigüedad 16. Su cultivo se ha extendido por todo el mundo y es el cereal con mayor volumen de producción a nivel mundial 9.
El genoma del maíz ha sido modificado mediante técnicas de ingeniería genética adicionándole principalmente 2 características: tolerancia a los herbicidas (genes epsps y pat) y resistencia a los insectos (gen cry) 9; estas características han permitido elevar notablemente su productividad. El maíz tiene 218 eventos genéticamente modificados, aprobados y disponibles a nivel comercial para cultivos transgénicos, que son utilizados como alimento para humanos y animales (17. Estudios realizados en diversos países han demostrado la presencia de secuencias transgénicas, en un porcentaje significativo de muestras de granos de maíz y de productos alimenticios industrializados de consumo humano y animal, que tenían como componente principal al maíz 18,19.
Con relación a la necesidad de etiquetar con la información pertinente, los productos alimenticios industrializados que tienen componentes transgénicos, también existen opiniones controversiales, las cuales posiblemente se deben a que existen dudas razonables sobre su peligro potencial para la salud. Los resultados de los estudios sobre el tema no son concluyentes, por lo que se requiere de investigaciones más profundas y de largo plazo 21. Algunos países como Australia, Brasil, China, Ecuador, Indonesia, Rusia y los de la Unión Europea se basan en el principio de precaución para disponer el etiquetado obligatorio de los alimentos transgénicos, cuando tienen un umbral de ADN transgénico entre 0,1% y 0,9%; otros como Argentina, Canadá y Sudáfrica se basan en el concepto de equivalencia con su contraparte convencional para disponer el etiquetado voluntario 4,20. En América del Sur la obligación del etiquetado con la información respectiva varía de acuerdo con la legislación de cada país; pero no existe en Guyana, Surinan, Paraguay y Perú 21. En Perú existe la Ley N°29571-2010, aunque no ha sido reglamentada.
No obstante, el riesgo potencial para la salud humana del consumo de granos de maíz y de alimentos procesados de maíz que contienen secuencias transgénicas; la población, las autoridades, los profesionales de la salud y los investigadores que trabajan en esta área de la biotecnología en el Perú y en numerosos países, no cuentan con la información científica actualizada sobre la presencia y cuantificación de componentes transgénicos en dichos alimentos, ni sobre el etiquetado de los mismos con los datos pertinentes. Asimismo, carecen de información confiable sobre los alimentos de maíz que consumen los animales de abasto, principalmente aves y ganado bovino y porcino, cuyos productos van a ser consumidos por el humano. La carencia de información dificulta que se tomen las medidas necesarias para establecer una política de estado frente a un recurso biotecnológico de importancia nacional y mundial, que puede afectar la salud pública.
El objetivo del estudio fue detectar la transgenicidad, mediante la detección del promotor 35S, en granos y productos alimenticios industrializados de maíz de consumo humano y animal, que se comercializan masivamente en Lima y verificar si en el etiquetado se menciona la presencia o ausencia de componentes transgénicos.
MÉTODOS
La investigación fue aplicada, observacional, descriptiva y transversal.
Recolección de muestras
En mercados y supermercados de diversos sectores de Lima metropolitana se recolectaron 30 muestras de productos alimenticios industrializados de consumo humano masivo, elaborados con maíz, herméticamente envasados y etiquetados. En centros de recepción y distribución de maíz para consumo animal se recolectaron en bolsas ziploc 10 muestras de granos de maíz amarillo de 200 g cada uno. En el etiquetado se verificó si menciona la presencia o ausencia de componentes transgénicos.
Extracción de ADN
Previo a la extracción del ADN se lavó y esterilizó el material y se le trató con solución de Rnasa away para eliminar interferencias. En cada mortero estéril se colocó 10 g de la muestra, se le agregó nitrógeno líquido y se procedió a la pulverización. La extracción de ADN se realizó por duplicado de acuerdo con lo establecido en el kit Dneasy Mericon Food Código 69514. Se trabajó con 50 ng de ADN de cada muestra, previamente verificada con el fago λ. La calidad de la extracción de los ácidos nucleicos se verificó con el kit de detección Mericon Screen 35S.
Detección de la secuencia transgénica P35S
Para la detección de la secuencia transgénica P35S se aplicó la metodología de Real time-PCR, utilizando el rotor Gene Q, según el kit Mericon Screen 35S catálogo N° 291013 de Qiagen. La prueba se realizó por duplicado para cada muestra.
Número de copias de la secuencia transgénica P35S
Para la cuantificación del P35S se elaboró una curva de calibración preparada con 3 valores de referencia conocidas de copias de ADN 2000, 20 000 y 200 000 copias del gen; luego se evaluaron las muestras positivas.
Para la preparación de la curva estándar se empleó un control positivo de cuantificación del kit Mericon Quant MON 810 catálogo N°2911524 y como blanco de corrección de muestras y estándares, agua desionizada libre del analito y de interferencias; luego se realizaron las diluciones correspondientes.
Para calcular el número de copias por gramo de muestra, se empleó la fórmula:
Control y análisis de datos
En todos los procesos se utilizaron controles positivos y negativos; al proceso Real time-PCR se le aplicó la optimización de la ganancia desde la primera adquisición. Para evaluar la consistencia de los resultados se realizaron pruebas de repetibilidad y se midió la desviación estándar; y para garantizar la exactitud, se trabajó con un control positivo que demostró estabilidad, homogeneidad y trazabilidad. Como criterio de la desviación estándar relativa se tomó como límite: 25% 22.
El límite de detección fue determinado por el fabricante del kit y es de 10 copias/ reacción y el límite de cuantificación por definición, es aquel intervalo en el cual se determina la precisión con cierto grado de variabilidad aceptable 23. En el estudio, el límite de cuantificación fue el valor más bajo de cuantificación con el que se obtuvo resultados con exactitud aceptable.
RESULTADOS
Se detectó la presencia de la secuencia transgénica P35S en el 66,66% de las muestras de productos alimenticios para consumo humano (Tabla 1) y en el 90% de las muestras de granos de maíz amarillo para consumo animal (Tabla 2).
Tabla 1. Cuantificación de copias del P35S en muestras de alimentos de maíz para consumo humano.
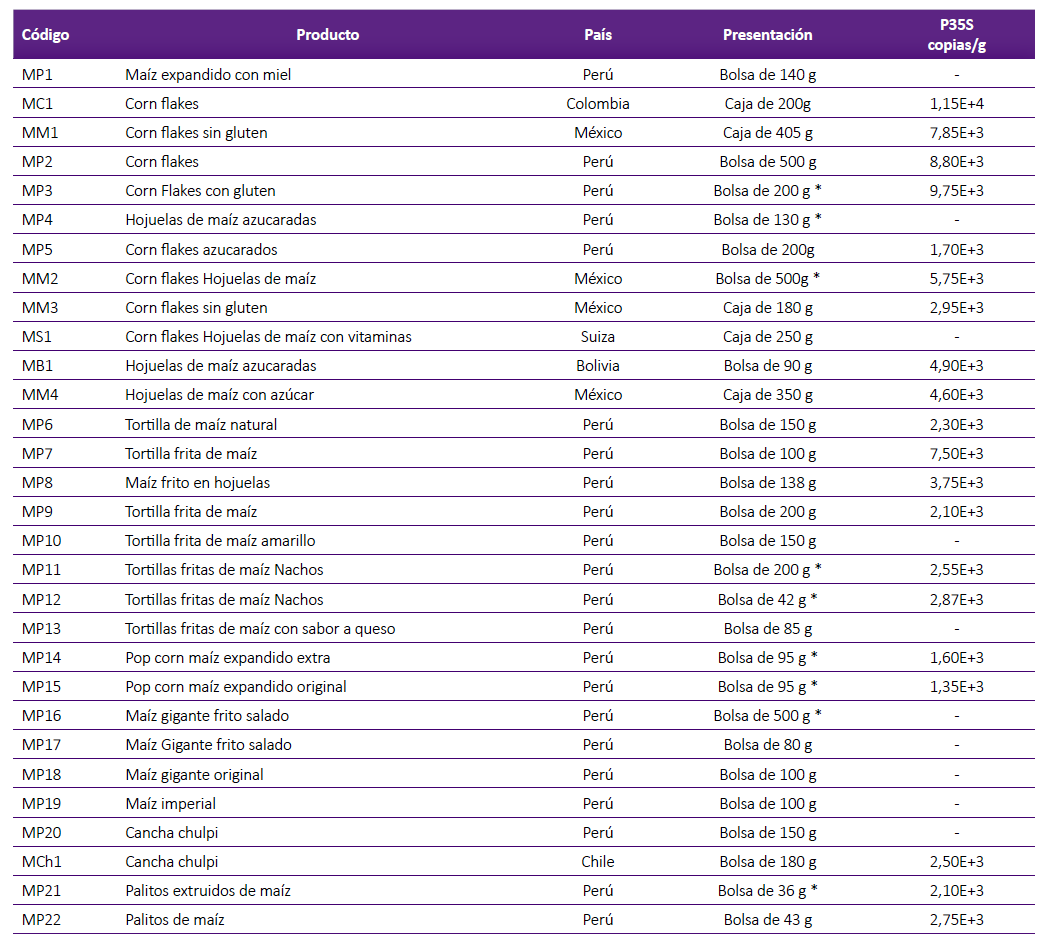
* Procesado con otros productos.
- No se detectó la secuencia transgénica P35S.
Tabla 2. Cuantificación de copias del P35S en muestras de granos de maíz amarillo para consumo animal.
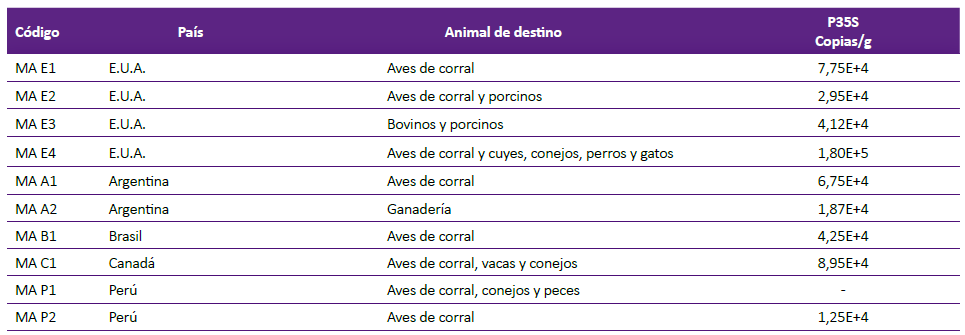
E.U.A: Estados Unidos de Norteamérica.
- No se detectó la secuencia transgénica P35S.
Los productos para consumo humano se expendían en bolsas especiales de plástico y los granos de maíz amarillo entero para consumo animal a granel en sacos de tela. Los productos para humanos fueron cereales para el desayuno y alimentos ligeros conocidos como snacks; las muestras fueron de dos tipos, maíz extruido y granos de maíz. En el caso de alimentos para animales, granos de maíz amarillo entero que se consumen directamente o como componente de piensos.
De las muestras de alimentos para consumo humano, 22 fueron fabricadas en Perú y 8 importadas; del total de muestras, el 30% fue procesada en instalaciones donde se procesaban otros productos alimenticios. Para consumo animal, 2 fueron de procedencia peruana y 8 importadas, el maíz estuvo destinado principalmente para aves, reses y cerdos.
De las muestras positivas de productos alimenticios para consumo humano el 70% fue fabricado en el Perú; de los productos peruanos el 63,6% fue positivo y de los importados el 75%. Del total de muestras positivas para consumo animal el 88,9% fue importado; de los productos peruanos el 50% fue positivo y de los importados el 100%.
El número de copias de la secuencia transgénica P35S en las muestras para consumo humano, osciló entre 1,35E+3 copias/g y 1,15E+4 copias/g; y para consumo animal entre 1,25E+4 copias/g y 1,80E+5 copias/g.
Se observó que en el etiquetado del 100% de los productos alimenticios de maíz para consumo humano y animal, no había información sobre la presencia o ausencia de componentes transgénicos.
DISCUSIÓN
En un elevado porcentaje (66,66%) de las muestras de alimentos de maíz para consumo humano se detectó la secuencia transgénica P35S, lo que demuestra que son alimentos transgénicos; este porcentaje es superior a la mayoría de los obtenidos en otros países como: Costa Rica 41,2% (19, Nigeria 26,7% 14) y Turquía 32,6% (24; e inferior a una minoría como los obtenidos en Jordania 100% (25 y Costa Rica 86,1% (26.
Estos reportes demuestran que, en países de diferentes continentes, se comercializan productos alimenticios de maíz con componentes transgénicos. Datos como el nuestro ponen en evidencia su consumo significativo en todo el mundo. El P35S está presente en alrededor del 95% de las plantas transgénica cultivadas que se comercializan en todo el mundo 18, dicha secuencia transgénica es la más frecuentemente detectada en los análisis de los productos alimenticios transgénicos. Por ejemplo, en Costa Rica 26 en 36 muestras de alimentos detectaron el P35S en el 86,0%, y en Turquía 24 en 43 muestras de maíz detectaron el P35S en el 32,6%; años después también en Turquía 27 en 472 muestras de productos alimenticios diversos detectaron el P35S en el 10,2%, y en Jordania 25 en 11 muestras de semillas de maíz detectaron el P35S en el 100%. Estos resultados sustentan la importancia de detectar el P35S para evidenciar la presencia de componentes transgénicos en productos alimenticios de maíz.
El 70% de los productos alimenticios positivos para P35S fue fabricado en el Perú. En ellos, su presencia en la muestra se debió principalmente a que el maíz era importado, o se estaba cultivando maíz genéticamente modificado contaminado o ilegalmente. En el Perú, por las moratorias del 2011 al 2035 (Leyes: 29811-2011 y 31111-2021) no se pueden cultivar, ni importar organismos vivos modificados genéticamente; pero sí, insumos de origen transgénico para la alimentación. También es posible la contaminación genética adventicia durante el transporte y almacenamiento 11,28, y/o durante el procesamiento, debido a que en las plantas industriales se procesan junto con otros productos que pueden contener insumos transgénicos 20,29; lo cual es mencionado en el 30% de las etiquetas de los envases.
En los países limítrofes Colombia, Brasil, Bolivia y Chile se cultiva maíz transgénico (21, lo cual hace factible que, mediante la dispersión de transgenes se polinicen los cultivos nativos en el Perú. Esta posibilidad se sustenta en los estudios sobre contaminación transgénica reportados por Mazo Castaño y Rodríguez Susa (29) en Colombia, Oviedo-Bolaños et al. 19) en Costa Rica y Trejo-Pastor et al. 30) en México. Los transgenes de los cultivos de maíz RR (Roundup Ready) resistentes al herbicida glifosato, y de los cultivos Bt (Bacillus thurigiensis) que producen la toxina Cry, que es un insecticida, podrían conservar en forma permanente su capacidad de desarrollo y de expresión de proteínas recombinantes 30.
En la cuantificación de la concentración del P35S, el límite que se obtuvo fue de 13 copias/reacción, valor muy cercano al límite de detección establecido por el fabricante; lo que evidencia la precisión del método empleado. La muestra de menor número de copias/g fue pop corn maíz expandido original MP15 (Perú) y la de mayor número corn flakes MC1 (Colombia). Estos datos muestran la diferente concentración de secuencias transgénicas que se puede encontrar en cada producto alimenticio; la cual puede deberse a la diferente concentración de transgenes en el maíz original, o a las variaciones como consecuencia del proceso de industrialización 12,13,20.
La cuantificación de copias de ADN transgénico cobró especial importancia, cuando la Comisión Europea, aplicando el criterio de bioseguridad por riesgos para la salud humana, consideró que la inserción de demasiadas copias de ADN extraño en una posición no deseada o de múltiples segmentos genéticos con reordenaciones puede potenciar o silenciar ciertos procesos de producción de proteínas, y provocar cambios en su composición, con la aparición de componentes potencialmente tóxicos que podrían poner en riesgo la salud humana 14. Debido a la importancia del principio de precaución, la legislación de numerosos países fija un umbral de aceptabilidad para los productos alimenticios transgénicos (4.
En el 90% de las muestras de granos de maíz amarillo para consumo animal se detectó el P35S, porcentaje superior a los reportados en Turquía 9,5% 31) y en Costa Rica 62,5% 26; pero concuerda con el reporte del Departamento de Agricultura de Estados Unidos de América 32, que afirma que más del 95% de los animales de abasto son alimentados con transgénicos. El P35S se detectó en todas las muestras importadas, las cuales provinieron de Argentina, Brasil, Canadá y Estados Unidos de América; los 4 países son los mayores productores de maíz genéticamente modificado del mundo 33. De las 2 muestras de maíz amarillo nacional, en una se detectó el transgén; posiblemente el cultivo era transgénico, lo cual es probable, debido a que se ha detectado cultivo de maíz transgénico en el Perú (34; o que se haya contaminado en el transporte o almacenamiento 11,28, lo que es favorecido por su manejo a granel.
En la cuantificación de la concentración del P35S, la muestra de menor número de copias/g fue MAP2 (Perú) y la de mayor número MAE4 (EUA). La cuantificación de copias/g en promedio fue mayor en las muestras para consumo animal, lo cual posiblemente se debe a que los productos para humanos son procesados y para animales, no.
En el etiquetado, en todos los productos para consumo humano no se menciona presencia o ausencia de secuencias transgénicas, contraviniendo lo que establece el Código de Protección y Defensa del Consumidor (Ley 29571- 2011). Situación similar a la de otros países como Colombia, donde se analizaron 13 muestras de cereal en cuyo etiquetado decía «libre de OGM»; sin embargo, el 84,6 % lo contenía (35. En Brasil, se demostró que menos del 3% de los alimentos transgénicos cumplían con la legislación sobre etiquetado (36. Las principales razones que argumentan los industriales y comerciantes de alimentos transgénicos en el Perú para no mencionar su presencia en el etiquetado son: la ley no se ha reglamentado, no se ha comprobado fehacientemente que los alimentos transgénicos causen enfermedad 5,33) y atemoriza a la población, lo cual disminuye su consumo. Actualmente no existe acuerdo a nivel internacional sobre la legislación respecto al consumo de alimentos transgénicos y a su mención en la etiqueta.
En los sacos de muestras de granos de maíz para consumo animal, no se menciona si contienen o no secuencias transgénicas. Los comerciantes y criadores de aves y de ganado lo consideran intrascendente, y en los centros de recepción y distribución de granos de maíz consideran que el maíz que importan es transgénico y que el maíz de producción nacional, no lo es.
En el Perú se requiere con urgencia que se reglamente la Ley sobre etiquetado de los productos alimenticios transgénicos, y que se incluya el componente transgénico específico que contiene; sugerencia que se sustenta principalmente en que no es concluyente su inocuidad y en el derecho del consumidor de estar informado, además, que posibilita a nuestros investigadores evaluar su patogenicidad potencial.
Entre las limitaciones del estudio consideramos que, en los alimentos para consumo humano, sólo evaluamos productos industrializados envasados y etiquetados, de marcas registradas con autorización sanitaria; pero, en mercados, bodegas de abarrotes y venta ambulatoria se comercializan masivamente productos similares que no cumplen con estos requisitos. En la recopilación de datos sobre maíz amarillo para consumo de animales de abasto hubo respuestas poco precisas de los importadores y comerciantes, y en algunos casos no documentada. Aparte, suelen mezclar los maíces de diferente origen, lo que dificultó el muestreo, por cuanto teníamos que garantizar que las muestras de maíz en cada almacén provenían de un solo país. Aun así, pudo haber contaminación adventicia; aunque todas las muestras de maíz importado mostraron tener secuencias transgénicas. Determinamos que las muestras contenían secuencias transgénicas a través de la detección del promotor 35S; pero no evaluamos otras secuencias transgénicas, que podrían haber proporcionado información más detallada.
En conclusión, haber detectado contenido transgénico en la mayoría de los alimentos industrializados de maíz para consumo humano, y en granos de maíz para consumo de animales de abasto, cuyos productos van a ser ingeridos por humanos; evidencian la necesidad de su mención en el etiquetado, que actualmente no se cumple, y la implementación de una política exigente en bioseguridad alimentaria, para que no afecte la salud de los consumidores y favorezca el desarrollo socioeconómico sostenible del Perú, generado por la biotecnología.