INTRODUCCIÓN
La interferencia analítica es una de las principales causas de la aparición de sesgos clínicamente significativos en la medición de magnitudes biológicas. Se define como el efecto de alguna sustancia endógena o exógena presentes en la muestra que altera el valor correcto del mensurando 1.
La turbidez por lipemia es una de las interferencias preanalíticas más comunes en el laboratorio clínico. Los sueros sanguíneos con altas concentraciones de lipoproteínas ricas en triglicéridos se enturbian y pueden ocasionar interferencia espectral en los métodos que usan espectrofotómetros. La lipemia absorbe y dispersa la luz a diferentes longitudes de onda, además, puede reducir la fracción acuosa del suero sanguíneo y por su naturaleza hidrofóbica pueden retener en su interior analitos, reactivos o productos de la reacción. Este tipo de interferencia produce sesgos en la medición de las magnitudes bioquímicas y puede conducir a diagnósticos equivocados y por consiguiente a suministrar tratamientos innecesarios o potencialmente perjudiciales para los pacientes 2-4.
Las causas de sueros lipémicos en el laboratorio son múltiples, entre ellas, el insuficiente tiempo de duración del ayuno para la toma de muestras sanguíneas, a ciertas condiciones clínicas como la diabetes mellitus, pancreatitis, o cuando se administra nutrición parenteral y ciertos fármacos como el propanolol, glucocorticoides, antivirales, etc. 2,3
En el laboratorio clínico se determina la concentración de gran variedad de constituyentes bioquímicos mediante técnicas espectrofotométricas. Los dos métodos más utilizados son las de química líquida que utiliza la espectrofotometría de absorción con reactivos en estado líquido y la de química seca que utiliza espectrofotometría de reflectancia con reactivos adheridos a superficies sintéticas o slides. El signo y la magnitud de la interferencia, puede ser distinto para un mismo constituyente, cuando se utilizan diferentes métodos o analizadores, lo que origina discordancia entre los resultados de ensayos realizados sobre este tipo de interferencia 5,6.
Existen diferentes criterios para establecer umbrales a partir de la cual se puede considerar una interferencia clínicamente relevante. Los criterios más utilizados son los que utilizan los fabricantes de los reactivos para validar sus métodos, que consideran una variación del resultado verdadero mayor a ±10% como límite de interferencia significativa. Por otra parte, la Organización Mundial de la Salud en base a recomendaciones de la Sociedad Alemana de Química Clínica considera interferencia clínicamente relevante cuando se supera al error sistemático deseable, datos que son extraídos de diversos estudios sobre la variación biológica para cada magnitud en personas sanas 7. Un tercer criterio, es el denominado límite de error máximo admisible, que utiliza datos de variabilidad biológica intraindividual y la variabilidad analítica propia de cada constituyente. La mayoría de las investigaciones sobre interferencias utilizan criterios basados en estudios de variabilidad biológica; sin embargo, no existe actualmente armonización entre los laboratorios sobre los límites que mejor definan los sesgos significativos por interferencia 8,9,10,11.
El presente estudio tiene por objetivo valorar la interferencia por lipemia en la medición de 25 constituyentes bioquímicos, en analizadores con tecnología de química seca y líquida; un objetivo secundario es establecer límites de tolerabilidad de interferencia utilizando los criterios del distribuidor de reactivos, del error sistemático deseable y del error máximo admisible.
MÉTODOS
Diseño experimental
Realizamos un estudio preexperimental, que comparó el valor medido de la magnitud en una muestra sin interferente, con los valores obtenidos cuando se adicionan a la misma muestra concentraciones conocidas y crecientes del interferente. Se utilizó el protocolo de la Comisión de Metrología y Sistemas Analíticos de la Sociedad Española de Química Clínica 12.
Instrumentación y reactivos
Los 25 constituyentes investigados fueron valorados en los analizadores de química líquida Atellica® Solution y química seca Vitros 7600® con reactivos y calibradores de SIEMENS y Ortho Clinical Diagnostics, respectivamente. Los métodos analíticos fueron analizados según las indicaciones del fabricante.
Los analizadores fueron calibrados previamente de acuerdo con las recomendaciones del fabricante. El programa de control de calidad interno incluyó la evaluación de sueros controles BIO-RAD® de 2 niveles de decisión que se procesaron diariamente y una muestra mensual de un control de calidad externo internacional (RIQAS).
En las tablas 1 al 4 presentamos los constituyentes analizados, los métodos en los que se basan sus mediciones, la concentración sérica inicial del constituyente sin el agregado del interferente, los porcentajes de desviación de los resultados cuando se agregó cantidades crecientes del interferente para los dos tipos de analizadores, además de los límites de aceptabilidad de los criterios del error sistemático deseable y el criterio del error máximo admisible.
Solución concentrada del interferente
Utilizamos una emulsión para nutrición parenteral SMOFlipid® 20%. Cada 1000 mL de esta emulsión contiene 60 g de aceite de soya refinada, 60 g de triglicéridos de cadena media, 50 g de aceite de oliva refinado y 30 g de aceite de pescado 13.
Preparación del suero base
Recolectamos 25 mL de un pool de sueros, las muestras seleccionadas estaban libre de hemolisis, ictericia y lipemia.
Preparación de las diluciones de los interferentes
A partir del suero base se preparó ocho diluciones. La primera dilución sin el agregado de interferente, a las siete restantes se les agregó cantidades crecientes de la emulsión para conseguir varios grados de lipemia. Las cantidades resultantes de triglicéridos en las alícuotas se muestran en las tablas del 1 al 4.
Cada una de las diluciones fue analizada por duplicado y de forma independiente, en los analizadores de química seca y líquida, finalmente se determinó el sesgo de la concentración de cada constituyente en función del incremento del grado de lipemia de las muestras.
Evaluación de las interferencias
Los resultados de los constituyentes estudiados en las diferentes alícuotas (Ci) fueron expresados en porcentaje de cambio, con respecto a la concentración del constituyente en la alícuota sin el agregado del interferente (Co), para lo cual se utilizó la siguiente relación: % Cambio o sesgo = 100 x (Ci - Co) / Co
Los fabricantes de los insumos consideran como límite de tolerabilidad una variación con respecto a la muestra sin interferente de ±10% 6.
El segundo criterio se considera interferencia clínicamente relevante cuando la variación de los resultados es mayor a las especificaciones de calidad analítica para el error sistemático. Estos datos son obtenidos de las especificaciones de calidad deseable calculados a partir de la variación biológica de cada constituyente 14.
Para establecer los umbrales de tolerancia por el criterio del error máximo admisible (EMA) consideramos los valores de variación analítica (CVa) de cada constituyente obtenidos de una serie de 30 mediciones repetidas de controles diarios de dos niveles de decisión. Así mismo, consideramos el coeficiente de variación intraindividual (CVi) para cada magnitud, referencia extraída de la base de datos del Estudio Europeo de Variación Biológica (EuBIVAS) 15.
Los límites admisibles para este criterio se establecen mediante la siguiente ecuación: EMA = ± [ Z (CVa2 + CVi2)1/2]; donde, Z representa el valor de 1,96 para un 95% de confianza. Consideramos interferencia clínicamente relevante cuando el sesgo cae por fuera de los límites del error máximo admisible.
Para el análisis estadístico empleamos el programa SPSS versión 21 (SPSS Inc., Chicago, IL, EE. UU).
RESULTADOS
Los resultados muestran que el criterio del error sistemático deseable exhibió límites de tolerabilidad menores al 10% en la mayoría de los constituyentes estudiados a excepción de la lipasa (±11,34%), alanina aminotransferasa (ALT) (±11,48%), gamma glutamiltransferasa (GGT) (±11,06%), creatina cinasa (CK) (±11,50%) y proteína C reactiva (±21,80%). Por el contrario, el criterio del error máximo admisible presentó umbrales superiores al 10% en la mayoría de los constituyentes estudiados y fueron diferentes para las plataformas de química seca y química líquida, esto debido a las características propias de variabilidad analíticas de cada analizador.
Los constituyentes que presentaron un mayor porcentaje de variación para la plataforma de química líquida por efecto del agregado de cantidades crecientes del interferente fueron: fósforo, ALT y aspartato aminotransferasa (AST) que llegaron a tener una variación de hasta -84,72%, -81,25% y -75,76%, respectivamente. En el caso de la plataforma de química seca se observó mayor variación para los constituyentes, ALT, CK y lipasa que arrojaron cambios de hasta -79,41%, -28,92 y +24,85%, respectivamente. A partir de la alícuota 5 con un contenido de 0,4% de solución interferente, el analizador de química seca no arrojo resultados para la enzima lipasa.
La figura 1 representa los interferogramas que indican los límites aceptables de variación de ± 10% establecido por los distribuidores de reactivos y la variación de la concentración de los analitos que presentaron interferencia significativa utilizando el criterio mencionado en ambos sistemas de medida.
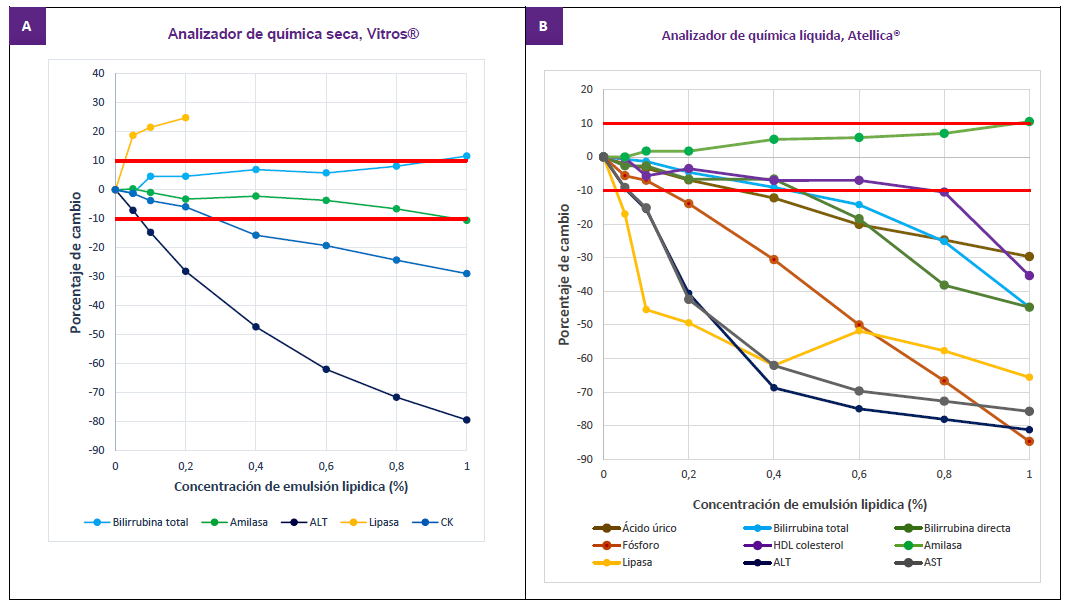
Figura 1. Efecto del agregado de cantidades crecientes del interferente sobre la concentración original (porcentaje de cambio) de los constituyentes que presentaron interferencia significativa en los analizadores de química seca y química líquida según los límites establecidos por el fabricante ±10%
Según el criterio de los fabricantes de reactivos, el analizador de química líquida presentó interferencia en 9 constituyentes, fósforo, lipasa, AST, ALT, amilasa, HDL colesterol (HDLc), ácido úrico, bilirrubina total (BT) y bilirrubina directa (BD). Para el caso de la plataforma de química seca los constituyentes afectados por el interferente fueron 5: lipasa, ALT y CK, BT y amilasa (Figura 1).
Cuando se empleó los límites de aceptación basados en el error sistemático deseable, de los 25 analitos estudiados, se comprueba interferencia significativa en 14 y 13 constituyentes para los analizadores de química liquida y seca, respectivamente. Ambos analiza-dores coincidieron en presentar interferencia en los constituyentes: proteínas totales, BT, sodio, calcio, fosforo, amilasa, lipasa y ALT (Tablas 1 y 2).
Tabla 1. Concentración sérica basal (sin el agregado del interferente) de los constituyentes analizados, metodologías, especificaciones para el límite de error sistemático deseable y porcentaje relativo de desviación de la concentración del constituyente con respecto al resultado inicial por influencia de la turbidez (lipemia) en el analizador de química líquida
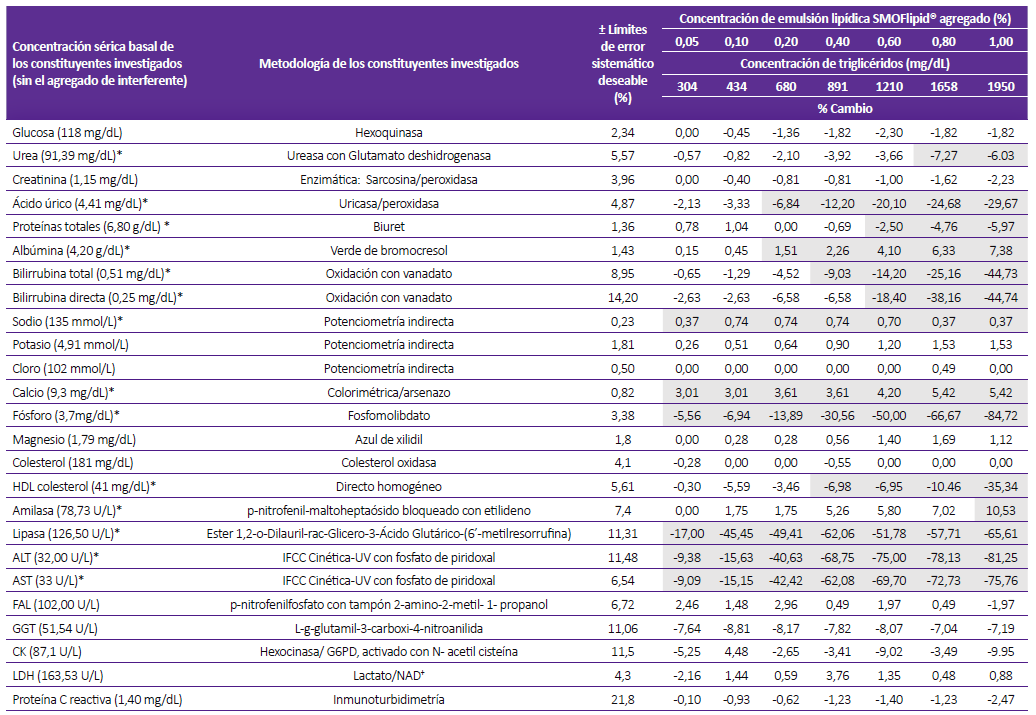
Los resultados son comparados con las especificaciones del error sistemático deseable, los que exceden dichas especificaciones están sombreados y además marcados en negrita y cursiva.
(*) Constituyentes en las que se encuentra interferencia.
Tabla 2. Concentración sérica basal (sin el agregado del interferente) de los constituyentes analizados, metodologías especificaciones para el límite de error sistemático deseable y porcentaje relativo de desviación de la concentración del constituyente con respecto al resultado inicial por influencia de la turbidez (lipemia) en el analizador de química seca
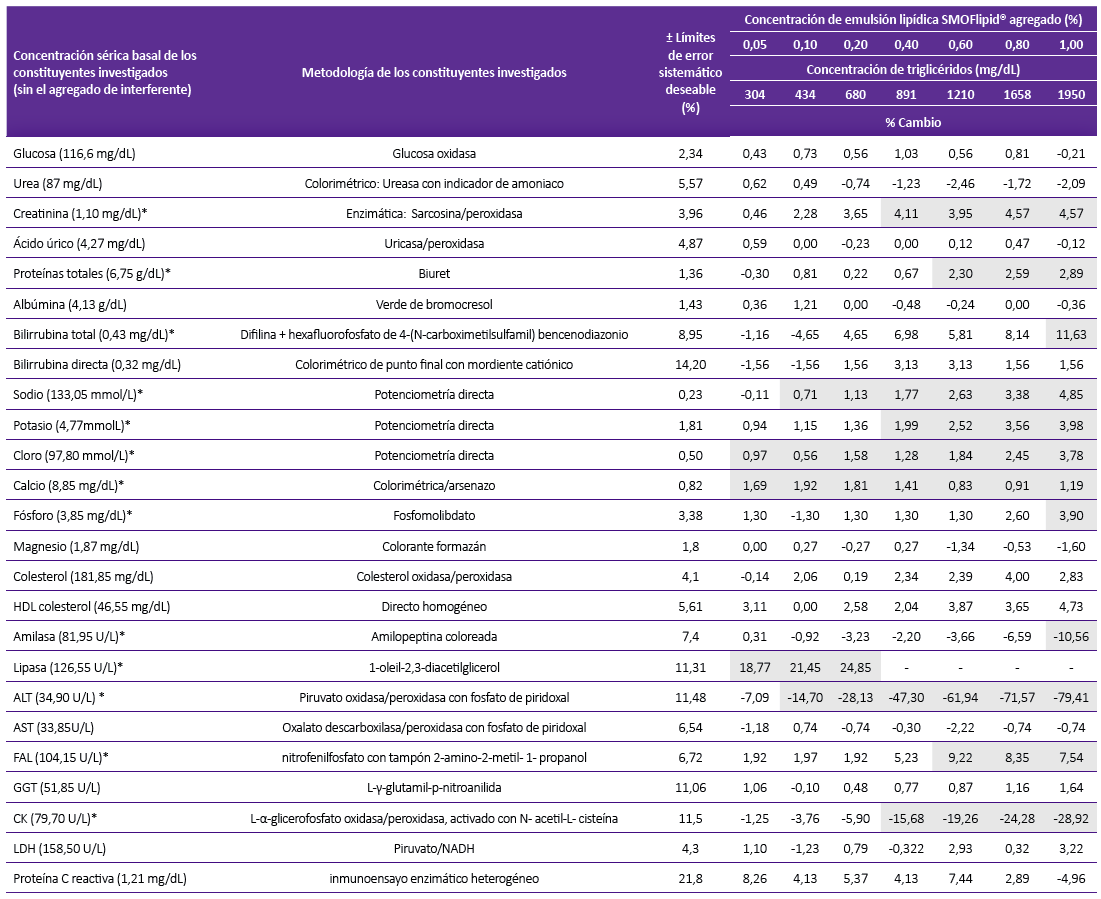
Los resultados son comparados con las especificaciones del error sistemático deseable, los que exceden dichas especificaciones están sombreados y además marcados en negrita y cursiva.
(*) Constituyentes en las que se encuentra interferencia.
Considerando el criterio del error máximo admisible, se demostró interferencia por turbidez en 9 constituyentes: ácido úrico, albúmina, BT, BD, fósforo, HDLc, lipasa, AST y ALT para el analizador de química líquida, mientras que, para el analizador de química seca se observó interferencia en 2 constituyentes: lipasa y ALT (Tablas 3 y 4).
Tabla 3. Concentración sérica basal (sin el agregado del interferente) de los constituyentes analizados, metodologías, especificaciones para el máximo error admisible y porcentaje relativo de desviación de la concentración del constituyente con respecto al resultado inicial por influencia de la turbidez (lipemia) en el analizador de química líquida
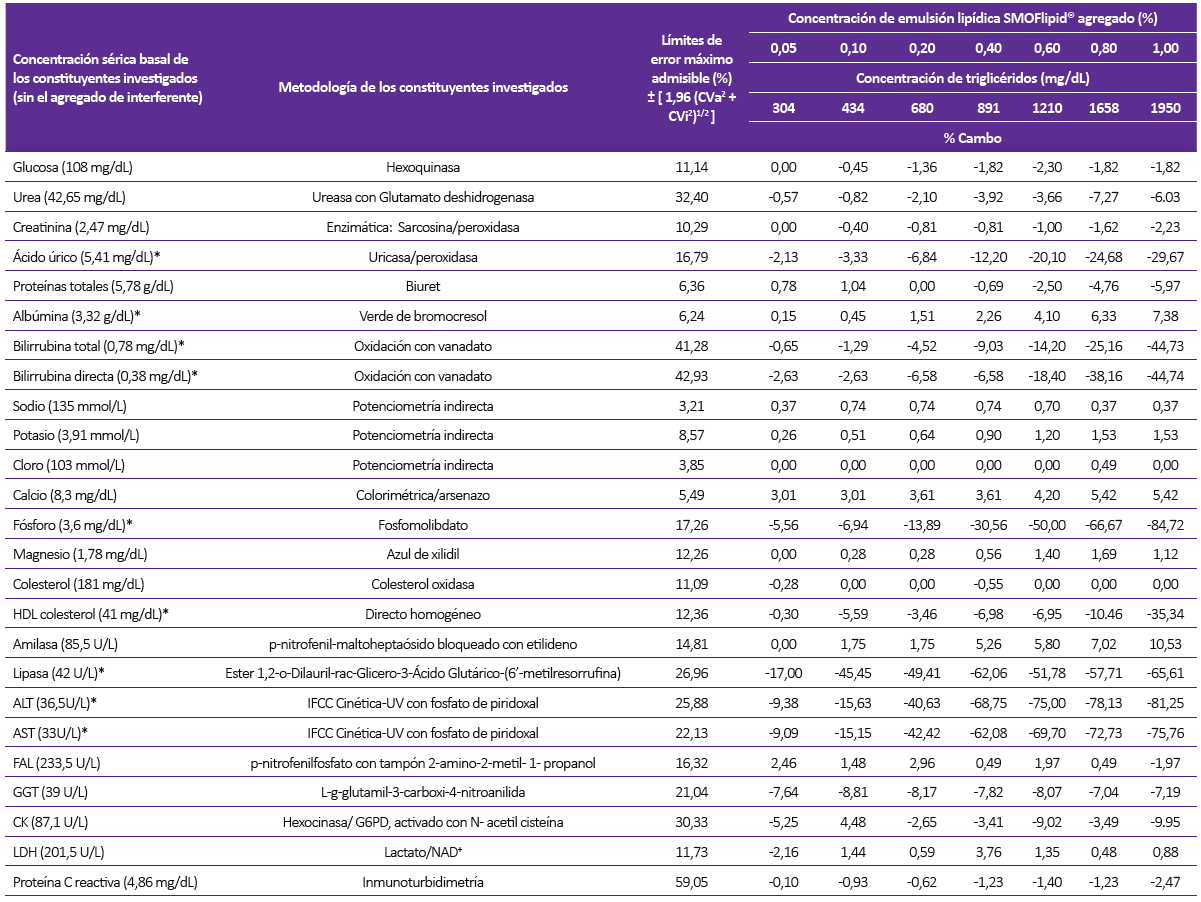
Los resultados son comparados con las especificaciones del máximo error admisible, los que exceden dichas especificaciones están sombreados y además marcados en negrita y cursiva.
(*) Constituyentes en las que se encuentra interferencia.
Tabla 4. Concentración sérica basal (sin el agregado del interferente) de los constituyentes analizados, metodologías, especificaciones para el máximo error admisible y porcentaje relativo de desviación de la concentración del constituyente con respecto al resultado inicial por influencia de la turbidez (lipemia) en el analizador de química seca
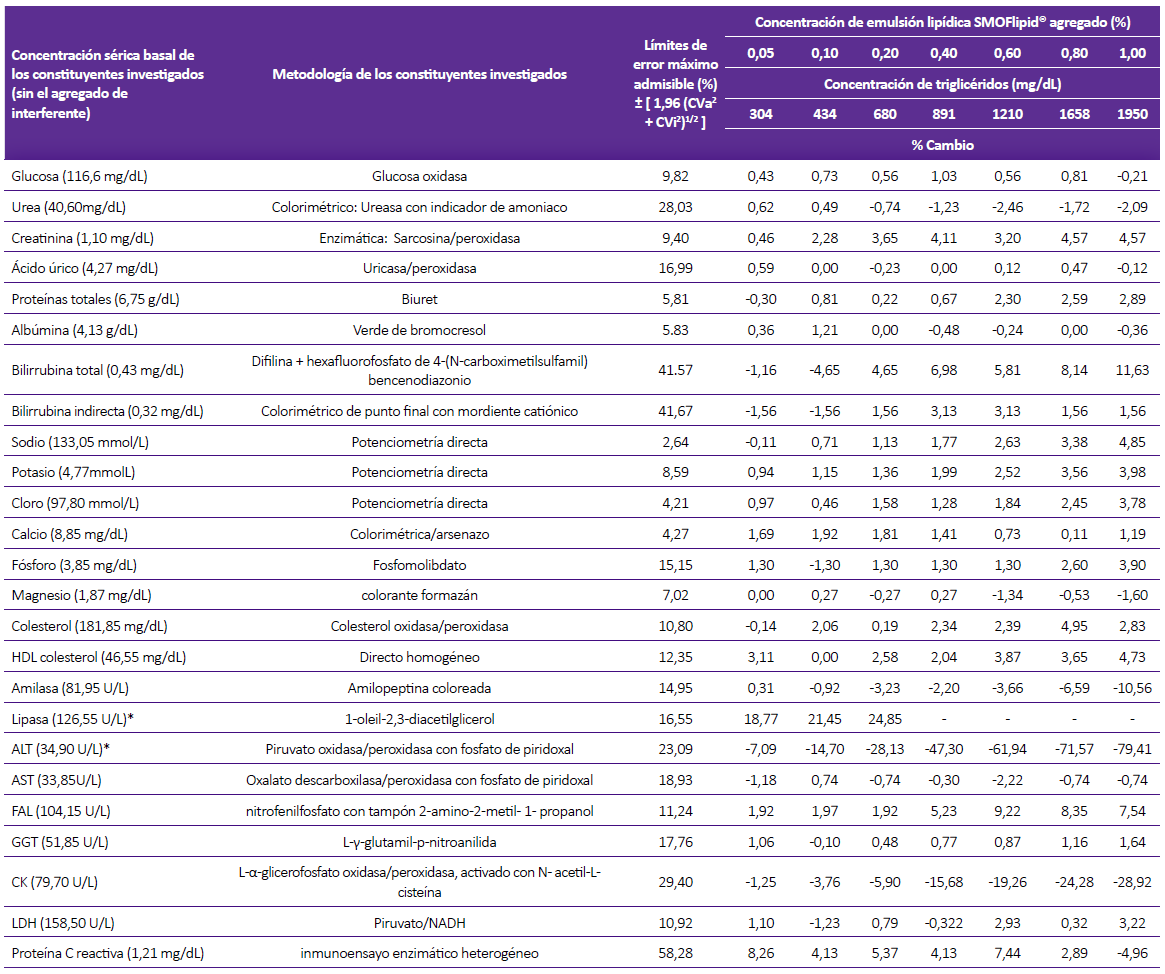
Los resultados son comparados con las especificaciones del máximo error admisible, los que exceden dichas especificaciones están sombreados y además marcados en negrita y cursiva.
(*) Constituyentes en las que se encuentra interferencia.
DISCUSIÓN
Los sesgos determinados en las alícuotas con cantidades crecientes de interferente fueron distintos para los analizadores de química líquida y seca. Esta diferencia se podría explicar por las diferentes tecnologías de ambas plataformas analíticas. La metodología de química seca utiliza reactivos secos impregnados en capas que bloquean el paso de potenciales interferentes, mientras que el análisis de química líquida usa reactivos líquidos para la cuantificación o identificación de diversos analitos.
El emplear distintos límites de interferencia tolerable, ocasionó que el número de constituyentes afectados por la interferencia difiera según el criterio utilizado. Los umbrales establecidos por el criterio del error máximo deseable fue el más permisivo, lo que derivó que menos constituyentes presentaran interferencia por lipemia, la amplitud de dichos límites fue muy semejantes al obtenido por Fernández et al. y Lippi et al.8,16
A pesar de que este último criterio permite la personalización de cada constituyente, los resultados identificaron umbrales más permisivos que el 10% de sesgo, incluso para analitos ampliamente reconocidos como susceptibles a la interferencia por lipemia. Una reciente investigación propone una modificación de este criterio para estimar el sesgo significativo sin considerar la variabilidad analítica del constituyente 17-20.
El valor del umbral preestablecido del ±10%, que los proveedores de reactivos utilizan para considerar una interferencia significativa, presenta ciertas limitaciones, como no considerar las características de variabilidad analítica o biológica de los constituyentes. Los criterios de aceptación de interferencia no serán los mismos para los analitos con diferente variación biológica y rendimiento analítico, siendo el criterio del fabricante más permisible para magnitudes con pequeña variabilidad y menos permisivo en aquellas magnitudes con elevada variabilidad biológica. Por lo tanto, es injustificable que se utilicen valores arbitrarios del 10% como sesgo admisible de interferencia para todos los analitos de manera indistinta 21-23.
Los resultados de la presente investigación evidencian que empleando el umbral del 10%, ciertos constituyentes como: urea, proteínas totales, albúmina, sodio y calcio, no se hubieran detectado como sensibles a la interferencia en el analizador de química líquida, y lo mismo con las magnitudes de creatinina, proteínas totales, sodio, potasio, cloro, calcio, fósforo y fosfatasa alcalina, en el analizador de química seca. Lo que evidencia disparidad en los resultados de los estudios de interferencia 22,23.
La principal causa de interferencia de la lipemia en la medición de diversas magnitudes bioquímicas es la dispersión de luz provocada por la presencia de lipoproteínas en las muestras biológicas. La lipemia dispersa la luz en el espectro de 300 a 700 nm, dicha dispersión aumenta a medida que disminuye la longitud de onda, esto se traduce en que los ensayos con lecturas en longitudes de onda más cortas del espectro sean más susceptibles a la interferencia 21,23.
La medición de la concentración de ciertos analitos en química clínica está basada en la reacción indicadora NAD(P)+↔ NADH (P) + H+, dado que las lecturas del cambio de absorbancia de esta reacción se realizan a una longitud de onda de 340 nm, metodologías que utilicen este indicador se verán muy afectados por la lipemia 22,23.
Esto se evidencia en los resultados que presentó el analizador de química líquida para las enzimas ALT y AST que utilizan la reacción indicadora de conversión del NADH a NAD+. Los sesgos para ambas magnitudes llegaron hasta los valores de -81,25% y -75,76%, respectivamente; sesgos que sobrepasaron los tres límites de aceptabilidad para interferencias. Así mismo para el caso específico de la urea en el mismo analizador (método ureasaglutamato deshidrogenasa) el porcentaje de variabilidad llegó a -7,27%, valor que solo excedió los límites de error sistemático deseable. Para los casos de glucosa (método de hexoquinasa), y CK (método Hexocinasa/ G6PD, activado con N- acetil
cisteína) que utilizan la misma reacción indicadora en el analizador de química líquida se presentó sesgos inferiores a -9,95%, valores que no superaron ninguno de los umbrales para considerar una interferencia significativa.
En el caso de la enzima LDH que utiliza la misma reacción indicadora en los analizadores de química seca (piruvato/ NADH) y química líquida (método Lactato/NAD+), los sesgos obtenidos fueron menores a 3,76%, valores que no excedieron ninguno de los límites de interferencia utilizado en el presente estudio.
Las soluciones parenterales sintéticas utilizadas para inducir turbidez en las muestras en los estudios de interferencia contienen excipientes como el glicerol, que puede interferir en los métodos para determinar triglicéridos cuya reacción está basada en la oxidación del glicerol a fosfato de dihidroxiacetona. Dicha oxidación del glicerol es proporcional a la concentración de triglicéridos; por lo tanto, una mayor cantidad de glicerol en la muestra se traducirá en un aumento falso de la concentración de triglicéridos.
La reacción para medir la actividad de la enzima lipasa en el analizador de química seca está basado en la hidrólisis del sustrato 1-oleil-2,3-diacetilglicerol a 2,3 diacetilglicerol y ácido oleico, posteriormente por acción de la enzima diacetinasa, el 2,3-diacetilglicerol es convertido a glicerol y ácido acético. La cantidad de glicerol producido es proporcional a la actividad de la enzima. Esta premisa podría explicar los resultados hallados para el caso específico de la enzima lipasa para el analizador de química seca, alcanzando sesgos de +24,85%, además de presentarse resultados incongruentes en las últimas alícuotas. Fernández Prendes y Lebeck sugieren el empleo de muestras con lípidos nativos provenientes de pacientes para realizar estudios de interferencia por lipemia cuando los métodos están basados en la producción de glicerol 21-24.
En esta misma línea Zheng et al. compararon el uso de lípidos endógenos extraídos por ultra centrifugación de pacientes con hipertrigliceridemia y una emulsión lipídica comercial Intralipid para valorar el efecto de interferencia por lipemia sobre la medición de las enzimas ALT y AST. Los resultados demuestran que el efecto de la interferencia fue mucho menor cuando se utilizó los lípidos endógenos y que tal efecto era inverso a los niveles de actividad de las enzimas presente en las muestras. Los autores concluyeron que los laboratorios deben de ser conscientes de las diferencias de los resultados cuando se evalúa la interferencia por turbidez utilizando lípidos endógenos o exógenos, además que dicho efecto puede variar según la concentración del constituyente medido 25.
El suero normal tiene aproximadamente 93% de agua y 7% de fase sólida, es decir, lípidos y proteínas. En muestras lipémicas la proporción de la fase acuosa disminuye y la fase lipídica aumenta, por lo tanto, la medición de constituyentes que no se distribuyen en la fase lipídica, como es el caso de los electrolitos, se infraestima. Este efecto conocido como exclusión de electrolitos o de desplazamiento de volumen, ocurre en métodos que realizan prediluciones antes de su medición, asumiendo que la matriz sérica es predominante acuosa, como es el caso de las metodologías potenciométricas de electrodos selectivos (ISE) indirectos.
Una estrategia para eludir dicho efecto es emplear metodologías donde la determinación de la concentración de electrolitos no dependa de la proporción agua/sólido y la medición se realice en muestras sin diluir como en las metodologías de ISE directo. El efecto de exclusión de electrolitos es más marcado para el sodio, debido a su concentración plasmática relativamente alta y su estrecho rango fisiológico 21,23.
En el presente estudio los límites establecidos por el criterio del error sistemático para el caso del electrolito sodio resultaron ser muy estrechos (±0,23%), comparado a los criterios del fabricante y al error máximo admisible que presentaron limites más amplios. Fernández-Prendes et al. recomiendan establecer el límite interferencia de ±1,65 * 2½ * (Cva), donde el CVa es el coeficiente de variación analítica, dato extraído de los estudios de control de calidad de cada laboratorio. Otro criterio recomendado por la Clinical Laboratory Improvement Amendments 1988 (CLIA) es considerar una interferencia significativa cuando la diferencia entre las concentraciones de sodio en la alícuota con interferente y sin interferente es ≥4 mmol/L 20,26.
El presente estudio detectó interferencia significativa para el sodio cuando se utilizó los criterios del error sistemático deseable en ambos tipos de analizadores, a pesar de que el analizador de química seca utiliza la metodología de potenciometría directa. Para los criterios de Prendes et al. y el de CLIA, únicamente el analizador de química seca sobrepaso dichos límites en las últimas alícuotas del ensayo.
Cuando se compara el uso de emulsiones lipídicas y de lípidos nativos para la evaluación de la interferencia por lipemia en el caso del constituyente sodio, se producen discrepancias en los resultados. Al usar emulsiones lipídicas no se encuentra impacto significativo en los niveles de sodio en muestras con altas concentraciones del interferente, sin embargo, cuando la evaluación se realiza utilizando lípidos nativos se presentan sesgos negativos (pseudohiponatremia) 26,27.
Dado que el efecto de la lipemia depende del número, del tamaño y de la composición de las lipoproteínas, los cambios fisicoquímicos en las muestras lipémicas endógenas y enriquecidas con emulsiones lipídicas comerciales serán distintos. Las emulsiones lipídicas están constituidas por liposomas ricas en fosfolípidos y quilomicrones ricos en triglicéridos de tamaño entre 200 a 600 nanómetros, mientras que los lípidos endógenos provenientes de sueros de pacientes contienen una compleja mezcla de compuestos lipoproteicos del tamaño entre 50 a 1000 nanómetros, lo que imitan mejor el proceso fisiopatológico de la lipemia. Sin embargo, el hecho de utilizar la ultra centrifugación para extraer los lípidos endógenos, el cual no está disponible en la mayoría de los laboratorios, además de la heterogeneidad del contenido de lipoproteínas endógenas en las muestras séricas, hace que persista la recomendación del uso de sueros lipémicos inducidos con emulsiones comerciales de nutrición parenteral para la valoración de la interferencia por lipemia.
Dentro de las limitaciones del presente estudio podemos mencionar el no haber incluido dentro del ensayo de interferencia el uso de muestras con lípidos de naturaleza endógena extraída de los propios pacientes, además de sueros con distintas concentraciones de los constituyentes evaluados.
Los laboratorios clínicos y distribuidores de reactivos utilizan diferentes criterios para establecer límites de tolerabilidad para las interferencias, sumado al uso de lípidos endógenos y exógenos para realizar los ensayos y al empleo de distintos analizadores y métodos para valorar los constituyentes bioquímicos, originan que los resultados sean discordantes, incluso evidenciándose efectos de interferencia distintos para un mismo-constituyente.
Los laboratorios clínicos deben ser conscientes que la interferencia por lipemia es una fuente de error en la interpretación de los resultados de diversas magnitudes bioquímicas, por lo que es necesario disponer de procedimientos de actuación ante la presencia de muestras lipémicas. Así mismo, es de suma importancia, ante la falta de replicabilidad de los estudios de interferencia, armonizar los procesos e instaurar límites semejantes tolerables entre los laboratorios y fabricantes de insumos.















