INTRODUCCIÓN
El cáncer es una enfermedad multifactorial con características biológicas particulares, tales como la proliferación anormal que conlleva a la invasividad y metástasis. El uso de quimioterápicos como la doxorubicina puede inducir a metástasis y eventualmente a la falla de la terapia, resultando en el incremento de la malignidad e incluso en multidrogo resistencia. Este evento es frecuente en el cáncer de mama triple negativo (TNBC) caracterizado por la ausencia de receptores específicos para estrógeno, progesterona y producción insuficiente de receptor 2 del factor de crecimiento epidérmico humano. Este tipo de cáncer es de los más agresivos, de difícil tratamiento y peor pronóstico 1. De acuerdo con la International Agency for Research on Cancer, a nivel mundial el porcentaje de mortalidad por adenocarcinoma mamario en mujeres es de 6,9% y la incidencia es 11,7%. En el Perú la mortalidad es de 13,3% y la incidencia se incrementa a 51,2 (por cada 100 000 mujeres) 2. Por lo tanto, es necesario continuar realizando estudios que aporten al hallazgo y diseño de nuevos productos, y protocolos de tratamiento.
Diversos estudios están enfocados en el desarrollo de tratamientos que combinan la quimioterapia o radioterapia con nuevos productos que coadyuven a neutralizar los efectos adversos causados por los antineoplásicos 1,3. Un producto promisorio es el fucoidan, un polisacárido estructural abundante de la matriz extra-celular de las algas marrones. El fucoidan se caracteriza por la presencia significativa de L-fucosa y grupos sulfato a los que se le atribuyen actividades antitrombótica, anticoagulante, antiviral y antitumoral. Además, contiene pequeñas cantidades de Dgalactosa, D-manosa, D-xilosa y residuos de ácido glucurónico 4,5. Se caracteriza por su baja toxicidad. Las investigaciones en modelos preclínicos abarcan aspectos como la administración oral y sistémica, angiogénesis y respuesta inmunitaria. Aunque se consume en algunos países, sus efectos sobre la salud humana requieren ser validados científicamente 6.
En la búsqueda de tratamientos contra el cáncer es fundamental el índice de selectividad, quimioterápicos como doxorubicina (Dox) ocasionan toxicidad aguda y crónica, mielosupresión, inmunosupresión y cardiotoxicidad acumulativa por cada dosis; por lo tanto, es deseable un tratamiento combinado con otro fármaco o agente no tóxico y al mismo tiempo eficaz, o que coadyuve a reducir la dosis y mitigar los efectos secundarios 7.
Los ensayos desarrollados in vitro y en modelos animales imitan parcialmente o por completo la secuencia metastásica y permiten proyectar el efecto en humanos, sobre todo en protocolos de tratamientos combinados principalmente con Dox 8. Los métodos que aportan mejores datos sobre un producto con potencial anticancerígeno se relacionan con la evaluación de la actividad proliferativa. Entre estos métodos se encuentran los ensayos de cierre de herida y la actividad anticlonogénica.
El fucoidan más estudiado y comercializado es el de Fucus vesiculosus, en el caso del género Lessonia la mayoría de las publicaciones se refieren a L. vadosa6. A pesar de que L. trabeculata es una especie nativa del mar peruano, la información acerca de su actividad anti proliferativa sobre células neoplásicas de cáncer mamario no ha sido reportada. Los estudios en nuestro país han demostrado su actividad inmunomoduladora en cultivos de células mononucleares de sangre periférica, estimulando la producción de especies reactivas de oxígeno (superóxido), óxido nítrico (NO) y citoquinas, y su citotoxicidad sobre las líneas HeLa y Hep-2 9. Nuestro objetivo fue evaluar la actividad citotóxica y anti proliferativa de un extracto rico en fucoidan del alga parda Lessonia trabeculata sobre la línea celular 4T1 (adenocarcinoma mamario murino, triple negativo).
MÉTODOS
Diseño del estudio
Realizamos un estudio experimental in vitro. La citotoxicidad fue evaluada midiendo la actividad metabólica con MTT (bromuro de 3-(4,5-dimetiltiazol2-il)-2,5-difeniltetrazolio; Mosmann 1983) (n= 6). La acción antiproliferativa fue medida con los ensayos de cierre de herida (n=3) y ensayos clonogénicos (n=3). Fueron evaluadas distintas concentraciones del extracto rico en fucoidan de Lessonia trabeculata nativa (EFLt), se utilizó doxorubicina como control positivo de citotoxicidad (Dox, Sigma-Aldrich, PM 579,98). Se realizó un ensayo complementario combinando las IC50 de EFLt + Dox.
Elaboración del EFLt
Los especímenes fueron colectados en la Bahía de San Nicolás, distrito de Marcona, provincia de Nazca, departamento de Ica, Perú (15°11’41” S 75°16’27” O). La identificación taxonómica fue realizada en el Herbario Augusto Weberbauer de la Universidad Nacional Agraria La Molina (UNALM). El procesamiento, el cálculo de la pureza y el peso molecular (PM) fueron realizados en el laboratorio de Fitoquímica y Bioquímica Vegetal del Instituto de Investigación de Bioquímica y Biología Molecular de la UNALM (Lima, Perú) siguiendo los protocolos descritos por Apumayta y Loayza 10,11. Las siguientes concentraciones se elaboraron a partir de EFLt liofilizado: 1, 10, 100, 1000, 2000, 4000, 6000, 8000 y 10000 μg/mL. Las concentraciones de Dox fueron: 0,01, 0,1, 1, 5 y 10 μg/mL. Las soluciones base de EFLt (15 mg/mL) y Dox (10 mg/mL) se elaboraron en medio incompleto (MIn, RPMI-1640 sin SBF), se filtraron (0,22 μm) y almacenaron a 4 °C hasta su uso. Las proteínas totales se cuantificaron por fluorometría empleando el Qubit 3.0 (InvitrogenTM).
Líneas celulares y condiciones de cultivo
La línea celular de adenocarcinoma de ratón 4T1 (BCRJ-Código 0022 del Banco do células do Rio de Janeiro, Brasil) se cultivó en RPMI-1640 suplementado con 10% de suero bovino fetal (medio completo o MCo, SBF-Biowest), 2 g/L de bicarbonato de sodio, 2 mM de L-glutamina, 1 mM de piruvato de sodio, 0,01 M de Hepes, 100 U/mL de penicilina, 100 µg/mL de estreptomicina (todos de Sigma-Aldrich), y 250 μg/mL de fungizona (Gibco). Para despegar las monocapas 4T1 empleamos tripsina-EDTA (0,25% y 0,02%, respectivamente) (Sigma-Aldrich). Las células VERO 76 fueron donadas por el Instituto Nacional de Salud. En todos los ensayos, los cultivos celulares se incubaron en condiciones estándares (37 °C, 5% de dióxido de carbono y 95% de humedad relativa).
Determinación de la viabilidad celular mediante el ensayo MTT
Es un ensayo de punto final que permite cuantificar la viabilidad celular mediante la intensidad del color del reactivo; por contraparte, también se puede cuantificar la actividad citotóxica de un producto o fármaco. Para determinar el número de células a sembrar por pocillo, se elaboró el patrón de linealidad, resultando 2 x 103 para 4T1 y 5 x 103 para VERO 76. Las células fueron sembradas en microplacas de 96 pocillos, con fondo plano (CorningTM), y se incubaron toda la noche para obtener monocapas con 80% de confluencia. Se agregaron 200 μL de cada concentración por cada monocapa. Las diluciones se elaboraron en MCo, las microplacas se incubaron por 72 h, en condiciones estándares. Se retiró el medio, se añadió 100 μL de MTT e incubó por 4 h adicionales, se descartó el medio y se agregaron 100 μL de dimetilsulfóxido (Sigma-Aldrich). Se incubó por 30 min a 37 °C, protegiendo de la luz y en agitación a 60 rpm (incubador-shaker ZHWY-2102C, Zhicheng, China). La viabilidad celular se determinó midiendo la densidad óptica (D.O.) en un lector de microplacas (Sinnowa ER500, China), a 492 nm con filtro diferencial de 630 nm. Las concentraciones indicadas de EFLt y Dox también se aplicaron a VERO 76. El efecto se consideró tóxico cuando el % VC fue inferior al 75% 12,13; de acuerdo con la clasificación ISO 10993-52009, si el % VC es de 75% a 100% es no citotóxico, 50% a 74% es mínimamente citotóxico, 25% a 49% es moderadamente citotóxico y 0 a 24% se trata de un producto extremadamente citotóxico (EC).
Cálculo del porcentaje de viabilidad celular (% VC)
Se empleó la siguiente fórmula: % VC = D.O. células tratadas / D.O. células no tratadas x 100
Donde D.O. es la densidad óptica obtenida para 4T1 o VERO 76 en la prueba MTT.
Cálculo de la concentración media inhibitoria (IC50)
Es la concentración de EFLt o Dox que inhibe al 50% de células 4T1 o VERO 76, fue determinada utilizando el modelo de regresión no lineal con el programa GraphPad Prism 5.0 para Windows, con un intervalo de confianza del 95%.
Cálculo del índice de selectividad (IS)
Permite diferenciar la actividad tóxica y la inocuidad de un producto o fármaco. Considerando que los antineoplásicos también afectan a las células normales es importante conocer el IS. Un valor del IS > 1 indicó que el producto es más citotóxico para las células neoplásicas que para las células normales, si dicho valor fue < 1, afectará tanto a las células neoplásicas como a las normales 12. Se empleó la fórmula: Índice de selectividad = IC50 VERO 76 / IC50 4T1
Ensayo de migración de 4T1
La cicatrización por cierre de herida permite medir el grado de invasividad de las células neoplásicas hacia el área libre causada por un rasguño o herida sobre la monocapa. Se cultivaron 2 mL de 3 x 105 células 4T1 en placas de 12 pocillos (CorningTM) en MCo y se incubaron por 24 h, en condiciones estándares, para conseguir 80% de confluencia. Las monocapas se lavaron con 1 mL de buffer fosfato salino (PBS) 1X, se agregó RPMI-1640 2% de SBF, e incubaron por 12 h. Sin retirar el medio, las monocapas se rayaron en línea recta, empleando un tip amarillo de 200 μL, haciendo un ángulo de inclinación de 30° y abarcando todo el diámetro. Las células desprendidas fueron eliminadas mediante lavado, por dos veces, de la monocapa con PBS 1X. Se evitó que la monocapa se seque. Las concentraciones de EFLt (700, 950 IC50 y 1200 µg/mL) se elaboraron en RPMI-1640 2% SBF, y 2 mL se agregaron a cada monocapa. En el caso de Dox se empleó únicamente la IC50. Las placas se incubaron por 12 y 24 h. El estado de las heridas fue verificado con el microscopio invertido (Leica, USA), fotografiando las monocapas a las 0, 12 y 24 h de tratamiento. Los tiempos empleados corresponden al método de barrido discreto. Se hizo un ensayo adicional combinando las IC50 de EFLt y Dox (1:1).
El avance sobre la herida es el crecimiento o migración de las células hacia dicha zona y se cuantificó con el programa ImageJ (NIH, USA). Los resultados fueron presentados como el porcentaje de inhibición de la migración (% IM) calculado respecto al control sin tratamiento ± la desviación estándar. El porcentaje de migración celular (% MC) se determinó mediante la fórmula:
% MC = (área de herida 0 h- área de herida 12 o 24 h) x 100 / área de la herida 0 h
El porcentaje de inhibición de la migración (% IMC) se calculó usando la fórmula: % IMC = 100 - % MC.
Ensayo clonogénico o de formación de colonias
Se basa en la propiedad que tiene una sola célula de proliferar y formar una colonia o clon constituido mínimamente por 50 células después de ser tratadas con un producto con acción citotóxica comprobada o potencial. Se cultivaron 500 células en placas de 6 pocillos (CorningTM) con MCo y se incubaron por 24 h. Las monocapas celulares se trataron con EFLt: 700, 950 (IC50) y 1200 µg/mL o IC50 de Dox (0,5 µg/mL). Se realizó una prueba adicional combinando las IC50 de EFLt y Dox (1:1). Las placas se incubaron durante 7 días, luego se lavaron con PBS 1X, se fijaron con metanol puro durante 15 min y tiñeron por 2 min con azul de metileno al 0,1% en PBS 1X.
La eficiencia de plaqueo (% EP) se calculó mediante la fórmula:
EP = [N° de colonias formadas antes del tratamiento/ N° de células sembradas] x 100
La fracción de sobrevivencia (FS) se calculó mediante la fórmula:
FS = N° de colonias después del tratamiento / [N° de células sembradas x EP]
El conteo de las colonias se realizó capturando las imágenes con el microscopio invertido (x10) y se procesaron con el programa ImageJ (NIH, USA).
Análisis estadístico
Para los datos experimentales de los ensayos de citotoxicidad y clonogénico se empleó ANOVA unidireccional seguido por el post test de comparaciones múltiples de Dunnett y Tukey. Para el ensayo de migración se utilizó ANOVA bidireccional seguido del post test para comparaciones múltiples de Bonferroni. Se empleó el programa GraphPad Prism versión 8.0.1. Las diferencias fueron significativas con un valor de p < 0,05.
RESULTADOS
Análisis químico del EFLt
El EFLt presentó 41,28% de azúcares totales expresados en fucosa, 7,85% de sulfatos y 121 μg/mL de proteínas totales. En base a los porcentajes obtenidos para sus componentes se determinó que la concentración de fucoidan en el EFLt fue de ⁓81,87%, y el PM fue de 10,04 kDa.
Citotoxicidad y viabilidad celular con el tratamiento EFLt
Se evidenció marcado efecto citotóxico sobre las líneas celulares 4T1 y VERO 76 a partir de 1000 μg/mL, con un perfil directamente proporcional a la concentración. A esa concentración, respecto al control no tratado, se produjo 56% y 30% de citotoxicidad para 4T1 y VERO 76 respectivamente (p < 0,01). En ese sentido, EFLt desde 2000 resulto con hasta 10000 resultó con EC para 4T1, y únicamente a la concentración de 10000 para VERO 76 (Figuras 1A, 1B).
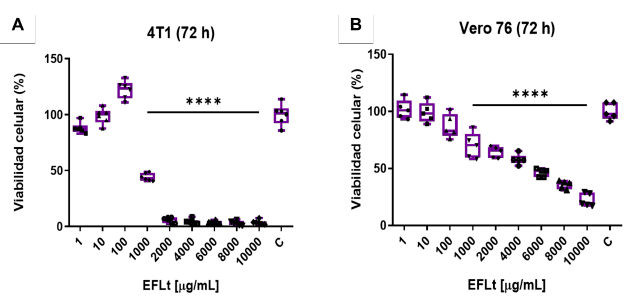
Tiempo de tratamiento: 72 h. (n=6). ****p˂ 0,0001, ANOVA unidireccional.
Las diferencias fueron significativas cuando p < 0,05 respecto al control no tratado. C: Control, células sin tratamiento.
Figura 1 Citotoxicidad ejercida por el EFLt. (A) sobre 4T1 fue dependiente de la concentración a partir de 1000 μg/mL. (B) sobre VERO 76, fue dependiente de la concentración desde 10 μg/mL.
La citotoxicidad de Dox respondió a un perfil dependiente de la concentración, siendo EC con 80% de IVC para 4T1 y 90% para VERO 76, a la concentración de 10 μg/mL (1000 veces más potente que el EFLt a 10 000 μg/mL).
Citotoxicidad y viabilidad celular con IC50 [EFLt + Dox]
Se produjo incremento de la citotoxicidad (73%, p < 0,001) sobre 4T1 y disminución de la VC (27%). Asimismo, la citotoxicidad fue significativa respecto a EFLt y Dox (p < 0,001) (Figura 2A). En el caso de VERO 76, la citotoxicidad fue de 54,8% y la VC de 45,2%; sin embargo, la diferencia entre EFLt, Dox y EFLt + Dox, no fue significativa (Figura 2B).
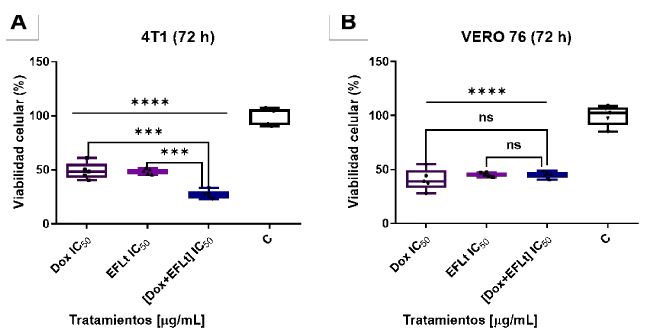
Figura 2. Comparación del efecto citotóxico del EFLt IC50 sobre 4T1 y VERO 76. (A). 4T1, EFLt con citotoxicidad similar a Dox (control positivo). [Dox + EFLt] IC50 causó mayor citotoxicidad respecto a EFLt y Dox. ***p < 0,001, (B) VERO 76, citotoxicidad similar con EFLt, Dox y EFLt + Dox, sin diferencias significativas (n.s.). En todos los tratamientos, tanto para 4T1 como VERO 76 la citotoxicidad fue significativa respecto al control. ****p< 0,0001. Valores de IC50 de EFLt para: 4T1= 950 µg/mL, Dox = 0,5 µg/mL. Valores de IC50 de EFLt para VERO 76: 3000 µg/mL, Dox: 0,2 µg/mL. (n=5). C: control (sin tratamiento). ANOVA bidireccional seguido del post test para comparaciones múltiples de Bonferroni.
Concentración media inhibitoria (IC50) e índice de selectividad (IS)
La IC50 es el valor informativo más utilizado para demostrar la potencia de un fármaco o producto natural comparando los resultados con un control de efecto demostrado. La IC50 para 4T1 con el EFLt fue de 950 µg/mL, mientras que para VERO 76 fue de 3000 µg/mL. La IC50 de Dox fue 0,5 µg/mL y 0,2 µg/mL para 4T1 y VERO 76, respectivamente. Los IS fueron de 3,15 y 0,4 para el EFLt y Dox, respectivamente. Estos valores indican que el EFLt ejerce menor toxicidad (>1) sobre células normales en comparación con Dox 14.
El EFLt redujo la capacidad migratoria
El avance de las células hacia la zona de la herida se produjo en función a la concentración de EFLt y el tiempo. A las 12 h, las tres concentraciones de EFLt produjeron la IMC de 4T1, aunque a las 24 h la zona de la herida disminuyó, superando el 65%. Con la IC50 de EFLt, se produjo 80,3% de IMC, y con Dox IC50 fue de 74% (Figura 3).
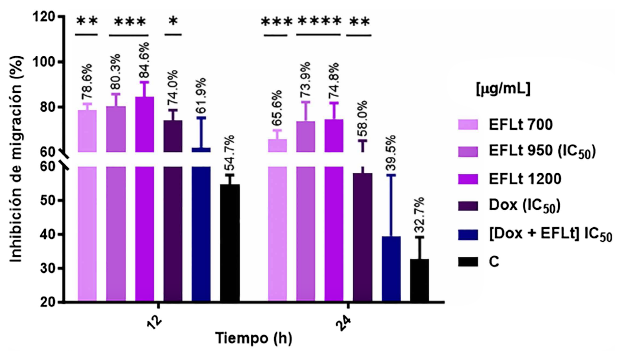
Figura 3. Inhibición de la migración (IMC) de 4T1 en el ensayo de cierre de herida. A las 12 h, el EFLt causó IMC en 78,6%, 80,3% y 84,6% con 700, 950 (IC50) y 1200 μg/mL respectivamente. A las 24 h, la IMC fue superior al 50% para EFLt y Dox, a diferencia de EFLt + Dox, en el que fue similar al control no tratado. C: control no tratado. *p < 0,05, **p < 0,01, ***p < 0,001 y ****p < 0,0001: diferencia estadística significativa respecto al control no tratado; (n=3). Se empleó ANOVA unidireccional seguido por el post test de comparaciones múltiples de Dunnett y Tukey
Para EFLt + Dox, a las 12 h, la IMC fue similar al control no tratado, esta característica continuó a las 24 h; así, en el control no tratado se presentó 67,3% de curación de la herida y en EFLt + Dox 60,5%. Estos datos sugieren que la citotoxidad de Dox puede ser modulada por el EFLt (Figura 3).
A las 12 h y 24 h, mediante el post test de Tukey se determinaron diferencias no significativas entre las concentraciones de EFLt y la IC50 Dox (p > 0,05), indicando que tienen efectos antiproliferativos similares. Sin embargo, es importante considerar que la IC50 de Dox es inferior a la de EFLt. El tiempo que facilitó la discriminación del efecto antiproliferativo entre las concentraciones de EFLt y Dox fue de 12 h.
El EFLt IC50 redujo la capacidad clono-génica de 4T1
La mayor inhibición en la formación de colonias por el EFLt se produjo con 1200 μg/mL (91%, p < 0,01). La EP fue de 62% y la FS proporcional a la concentración del EFLt (Tabla 1). El tratamiento con Dox IC50 produjo la inhibición significativa de la formación de colonias (96%). El tratamiento EFLt + Dox fue similar al obtenido con Dox (98%); el tratamiento con EFLt IC50 produjo 68% de reducción del número de colonias, por lo que se puede atribuir que el efecto anticlonogénico fuera causado por Dox. Los parámetros que se han considerado para el análisis diferenciado entre los tratamientos fueron la reducción del tamaño, forma y número de colonias (Tabla 1, figura 4).
Tabla 1. Inhibición de la formación de colonias 4T1 por el EFLt y [EFLt + Dox] IC50
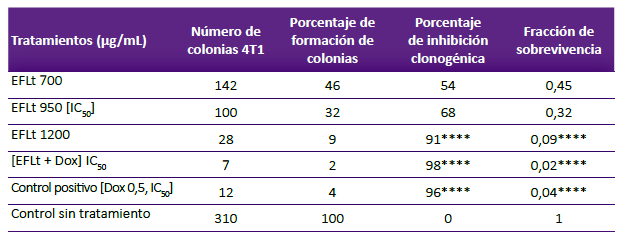
La lectura se realizó después de 7 días de incubación (n=3). El porcentaje de inhibición clonogénica con el tratamiento EFLt fue proporcional a la concentración.
Eficiencia de plaqueo: 62% (aplicado a la fórmula: 0,62). N° de células sembradas: 500. n = 3.
****p< 0,0001 respecto al control no tratado. Tiempo de tratamiento: 7 días
ANOVA unidireccional seguido por el post test de comparaciones múltiples de Dunnett y Tukey
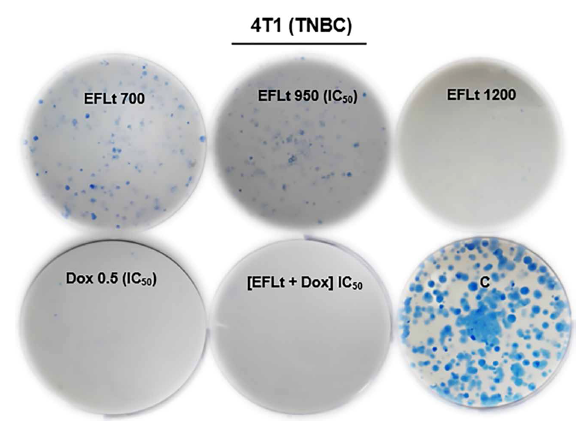
Figura 4. Inhibición de la formación de colonias 4T1 por el EFLt. El efecto anticlonogénico fue dependiente de la concentración, a 1200 μg/mL las colonias fueron escasas, pequeñas y poco compactas a diferencia del control no tratado (C). Tiempo de tratamiento: 7 días. (n=3). Aumento: 4x. El conteo de colonias se hizo con el programa ImageJ (NIH, USA).
DISCUSIÓN
El cáncer sigue siendo uno de los principales problemas de salud con repercusiones socioeconómicas en todo el mundo 15, por lo cual, la prevención y los tratamientos más eficientes, son primordiales y justifican las investigaciones y recursos invertidos. Entre los posibles anticancerígenos con potencial terapéutico se encuentra el fucoidan. Este polisacárido se caracteriza por su contenido de fucosa, que en el presente estudio fue de 41,28%; esta proporción puede variar según la metodología empleada en la extracción e inclusive por la procedencia del alga. Respecto a L. trabeculata, nativa del mar peruano, los porcentajes reportados son de 59% 9, 58% 10 y 21% 16.
Una de las consideraciones más importantes a considerar en un producto natural es su toxicidad, por ello, los estudios in vitro han establecido algunos parámetros como la VC y el IS 13,14. En el presente estudio, la citotoxicidad mostró un perfil dependiente de la concentración. El EFLt posee efecto citotóxico en células 4T1 a partir de 1000 µg/mL. Respecto al IS, los valores indicaron menor efecto tóxico del EFLt sobre células VERO 76 y mayor sobre 4T1, que lo califica como un producto con citotoxicidad selectiva. Este hallazgo es muy importante para continuar los estudios y postular que el fucoidan de L. trabeculata es inocuo, característica necesaria, entre otras, para su utilización como nutracéutico y/o fitofármaco específicamente para el tratamiento del cáncer de mama.
Se ha demostrado el efecto apoptótico e inducción a autofagia de un extracto crudo de Fucus vesiculosus sobre la línea celular de cáncer de mama humano MDA-MB-231 y MCF-7 17. El fucoidan purificado de F. vesiculosus (Sigma) inhibió la proliferación, la capacidad de transformación y la formación de colonias de las líneas celulares MDA-MB-231, MCF-7 y de ratón 4T1, a través de una vía de degradación dependiente de ubiquitina que afecta a los ejes TGFR/Smad/Snail, Slug, Twist y EMT 18. Asimismo, las dosis orales de fucoidan retrasaron el crecimiento del tumor NB4 en ratones y aumentaron la actividad citolítica de las células NK 19. En el caso del extracto crudo es probable el sinergismo entre el fucoidan y los polifenoles presentes en el extracto. En nuestro estudio no se puede excluir la presencia de polifenoles, ya que se ha empleado un extracto que no alcanza el 90% de pureza. El efecto citotóxico también se atribuye a la presencia de sulfato en su estructura y el bajo PM 23, en el estudio realizado el fucoidan tuvo 7,85% de sulfato y bajo PM (10,04 KDa).
En el ensayo de citotoxicidad con EFLt + Dox, se observó que el efecto sobre 4T1 fue mayor que con EFLt y Dox (menor VC). Para VERO 76 la viabilidad fue similar a EFLt y Dox. Estos resultados tienen relación directa con el IS determinado. Respecto a la combinación de un quimioterápico y fucoidan, se han realizado diversos ensayos con resultados prometedores; así, el fucoidan de Cladosiphon novaecaledoniae mejoró su actividad citotóxica sobre monocapas MDA-MB-231 y MCF-7 cuando se aplicó combinado con cisplatino, tamoxifen y paclitaxel (taxol) debido a la inducción de apoptosis 20. En otro experimento se demostró la efectividad del tratamiento combinado de fucoidan de bajo PM con gemcitabina y cisplatino en ratones BALB/c atímicos afectados por cáncer de vejiga 21. Aunque en los ensayos de cierre de herida y clonogénico no se replicaron dichos resultados.
Acerca de la IC50 del EFLt, algunos reportes en Perú dan cuenta de la variación en función a la línea celular y el PM, con valores de 1,7 mg/mL y 2,2 mg/mL sobre monocapas HeLa (adenocarcinoma cervical) y cultivos de U937 (leucemia promonocítica), respectivamente 9. En el presente estudio la IC50 para 4T1 fue menor (950 µg/mL), las diferencias indican que la susceptibilidad no solo se relaciona con la concentración sino también con el tipo de célula neoplásica.
Los modelos para estudiar la migración celular in vitro han aportado un mayor acercamiento a los eventos del microambiente tumoral y permiten monitorear el movimiento de la población celular de manera global o individual. La migración global está relacionada con la capacidad colonizadora per se, que se puede evidenciar empleando un medio de cultivo pobre. En el presente estudio, la mayor curación en el grupo no tratado se produjo a las 24 h; las diferencias en cuanto al tiempo podrían estar relacionadas con el porcentaje de confluencia de la monocapa al inicio del experimento (80%), ya que en algunos ensayos se utilizan monocapas con mayor confluencia que cierran en menor tiempo. En este ensayo, encontramos diferencia entre los resultados obtenidos para la IM con EFLt y Dox respecto a EFLt + Dox. La IM en esta combinación fue similar a la del control no tratado. Esta notoria reducción del efecto antiproliferativo sugiere que el IC50 EFLt, a esa concentración, modula la actividad de Dox 22.
En el ensayo clonogénico la inhibición del crecimiento de colonias para el EFLt se produjo en relación directa a su concentración. En cambio, en EFLt + Dox la inhibición fue similar a Dox, por lo que, el efecto se puede atribuir al quimioterápico. Los resultados encontrados para el EFLt fueron similares a los reportados para el fucoidan de Saccharina japonica y Undaria pinnatifida que redujeron la formación de colonias de manera diferenciada, siendo más potente sobre T-47D, que sobre SK-MEL-28 (líneas celulares de neoplasia de mama y melanoma humanos, respectivamente) 23. La fracción de sobrevivencia para 4T1 con la concentración 1200 μg/mL de EFLt constituye un indicador valioso 24, que refleja la susceptibilidad de estas células al efecto del fucoidan, mientras que la sobrevivencia indica la heterogeneidad genética relacionada con la resistencia de las células tumorales.
Los ensayos que se emplearon para evaluar la actividad antiproliferativa in situ ponen de manifiesto la resistencia y elevada tasa de proliferación de 4T1 (triple negativa), que son capaces de sobrevivir en un medio pobre (cierre de herida) o formar colonias en un tiempo prolongado (ensayo clonogénico), superando o cediendo al efecto del EFLt o Dox.
Como limitaciones del estudio para el caso de EFLt + Dox, podemos considerar que para conocer las proporciones que se van a emplear, es necesario determinar el índice de combinación 25,26; asimismo, probar el uso de nanotransportadores 27. En el caso del ensayo de cierre de herida es conveniente utilizar paneles que posean una zona de exclusión celular diseñada químicamente en lugar de barreras mecánicas (28; además, sería importante incluir un control pro-proliferativo, por ejemplo, incrementando el contenido de glutamina 29) y/o SBF 30) al medio de cultivo.
Concluimos que el EFLt tuvo actividad citotóxica sobre la línea celular 4T1 TNBC y su actividad en las pruebas de VC fue potenciada cuando se combinó con Dox. Los datos obtenidos sobre la citotoxicidad, el índice de selectividad y la fracción de sobrevivencia indican que el fucoidan de L. trabeculata es un producto prometedor que requiere ser investigado con mayor profundidad para determinar los mecanismos de acción tanto in vivo como in vitro.















